整合酶抑制剂临床应用专家共识
2018-01-08


摘 要 整合酶抑制剂(integrase inhibitors, INIs)已成为国际上艾滋病治疗指南中抗反转录病毒治疗方案的首选推荐,是目前抗艾滋病毒治疗的核心药物。越来越多INIs的不断上市为临床医生提供了更多的治疗选择。为规范INIs的临床应用,中华医学会热带病与寄生虫学分会艾滋病学组和中华医学会感染病学分会艾滋病学组共同制定了《整合酶抑制劑临床应用专家共识》。此共识是基于国际上最新的相关指南以及我国的INIs临床应用实践来进行编写的。此共识也将根据国内外INIs的临床研究进展、尤其是在“真实世界”中的研究结果来予以定期更新。
关键词 人免疫缺陷病毒 整合酶抑制剂 治疗 共识
中图分类号:R978.7; R512.91 文献标志码:A 文章编号:1006-1533(2018)23-0019-08
Expert consensus on the clinical application of integrase inhibitors*
AIDS Professional Group, Society of Tropical Diseases and Parasitology of Chinese Medical Association; AIDS Professional Group, Society of Infectious Diseases of Chinese Medical Association(corresponding author: LU Hongzhou**, LI Taisheng**)
ABSTRACT Integrase inhibitors (INIs) have become the preferred recommendation in the international AIDS treatment guidelines, and are the core antiviral drugs. More and more INIs are on the market, providing more choices for clinicians. In order to standardize their clinical application, the AIDS Professional Group, Society of Tropical Diseases and Parasitology of Chinese Medical Association, and AIDS Professional Group, Society of Infectious Diseases of Chinese Medical Association jointly formulated the Expert Consensus on the Clinical Application of Integrase Inhibitors. This consensus is based on the latest international guidelines and the clinical practice of INIs in China and will also be updated regularly on the basis of the clinical research progress of INIs.
KEY WORDS human immunodeficiency virus; integrase inhibitors; treatment; consensus
抗反转录病毒治疗(antiretroviral therapy, ART)的出现和应用使艾滋病从一种致死性疾病转变为一种可以治疗、但目前尚难彻底治愈的慢性疾病。ART是治疗艾滋病的最重要措施,现已有7大类共超过50种的抗反转录病毒药物(antiretroviral drug, ARV)获得美国FDA批准,用于艾滋病的临床治疗[1]。随着ART在临床上的广泛应用,人免疫缺陷病毒(human immunodeficiency virus, HIV)的耐药问题成为影响ART疗效的重要因素。奈韦拉平(nevirapine, NVP)和依非韦伦(efavirenz, EFV)等非核苷类反转录酶抑制剂(non-nucleoside reverse transcriptase inhibitors, NNRTIs)曾是应用广泛的一线ARV,但近年来HIV对NNRTIs的耐药率明显升高,部分地区甚至出现了较高的传播性耐药率,使得基于NNRTIs的一线ART方案受到巨大挑战[2]。此外,不良反应也是影响ART疗效的重要因素。因此,优化ART方案势在必行。
针对新型作用靶点的整合酶抑制剂(integrase inhibitors, INIs)因高效低毒,在临床广泛应用中表现出良好的疗效和安全性,已成为国际上艾滋病治疗指南中ART方案的首选推荐[3-6]。INIs是现抗HIV治疗的核心药物。越来越多的INIs不断上市,为临床医生提供了更多的治疗选择。INIs目前尚未纳入我国《艾滋病免费抗病毒治疗药品名录》,但临床上使用INIs的情况越来越常见。为规范INIs的临床应用,中华医学会热带病与寄生虫学分会艾滋病学组和中华医学会感染病学分会艾滋病学组共同制定了《整合酶抑制剂临床应用专家共识》。此共识旨在为临床应用INIs提供参考,在具体的临床实践中,临床医生应结合艾滋病患者的具体情况合理选用INIs,同时注意与我国的《艾滋病免费抗病毒治疗药品名录》《国家免费艾滋病抗病毒药物治疗手册》[7]、《艾滋病诊疗指南》[8]以及相关政策间的衔接。此共识是基于国际上最新的相关指南和我国的INIs临床应用实践来进行编写的。由于INIs在我国HIV阳性人群中的应用经验相对较少,基于我国的“真实世界”的研究数据还待进一步的积累和总结。此共识也将根据国内外INIs的临床研究进展、尤其是“真实世界”的研究结果来予以定期更新。
1 INIs概述
HIV属反转录病毒科慢病毒属,为单股正链RNA病毒,临床上常见的是HIV-1型感染。HIV-1在人体细胞内的复制过程包括4个环节:附着和进入、反转录和整合、转录及翻译、成熟及出芽。在这些过程中有多种酶的参与,其中整合酶对反转录形成的HIV-1 DNA的3末端进行处理,催化链转移反应,介导HIV-1 DNA永久性地整合到宿主DNA中,這是HIV-1感染人体的关键环节。INIs通过抑制链转移反应而阻断HIV-1的复制过程[9],故又被称为整合酶链转移抑制剂(integrase strand transfer inhibitors)。现已在美国上市的INIs有拉替拉韦(raltegravir, RAL)、艾维雷韦(elvitegravir, EVG)、多替拉韦(dolutegravir, DTG)和bictegravir(BIC。我国尚未批准)[1];在研的则主要有长效INIs cabotegravir[10]。
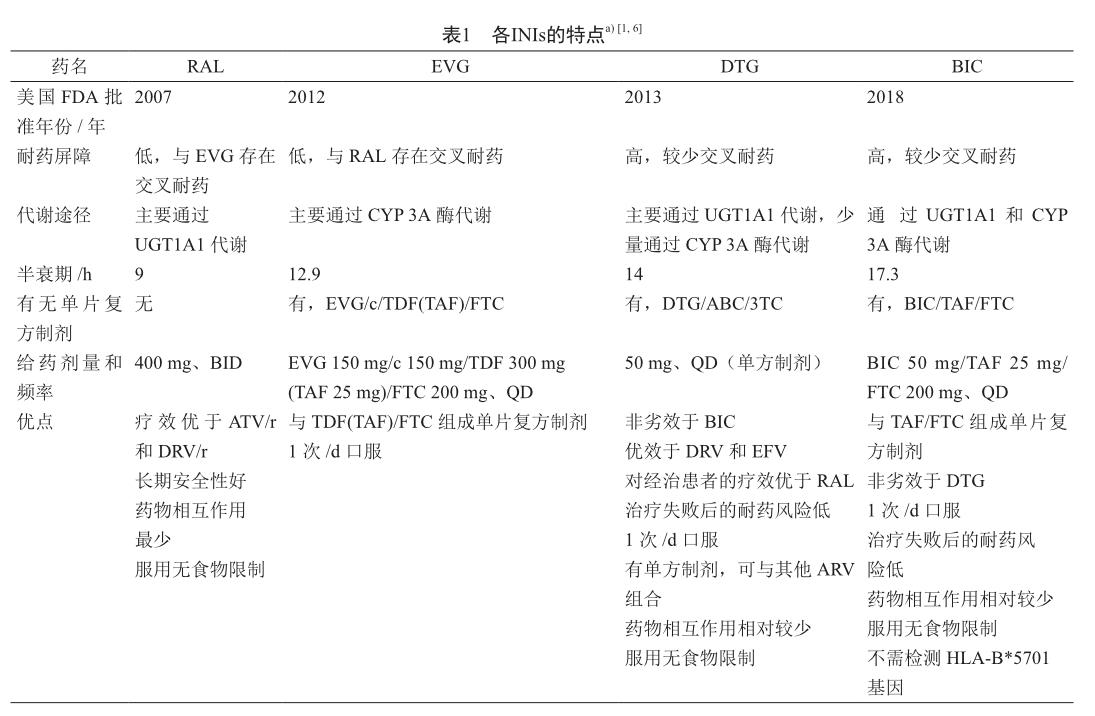
INIs作为目前ART的核心药物,具有疗效高、抑制HIV快(平均4周左右即可将HIV RNA水平降至<50拷贝/ml)、耐受性好等优点[11-14]。目前,HIV对INIs原发性耐药罕见,但经INIs治疗失败的患者可出现治疗后耐药。DTG和BIC具有相对更高的耐药屏障[15-16]。现市场上除RAL外,DTG、BIC和EVG都有单片复方制剂。各INIs的特点归纳见表1。

2 在初治患者中的应用
目前,国际上的相关指南均推荐使用2种核苷类反转录酶抑制剂(nucleoside reverse transcriptase inhibitors, NRTIs)联合1种INIs作为绝大多数初治艾滋病患者的优选ART方案,已上市的几种INIs均可作为初治艾滋病患者的首选治疗药物。表2列举了现国际上各大治疗指南推荐的优选初治ART方案及注意事项。通常情况下,方案中的FTC可换为3TC;如没有肾或骨骼方面的禁忌证,TAF可换为TDF。BIC的上市时间较短,且现仅在美国获得批准,但国际抗病毒学会美国分会2018年发布的指南已将其纳入初治ART方案。临床实践中应根据患者的病情、有无合并感染和肿瘤、基础疾病状况、依从性、药物相互作用、病毒耐药特点(尤其是当地的HIV耐药状况)以及药物的可及性、耐药屏障和不良反应等情况综合考虑,然后确定ART方案。
3 在经治患者中的应用
3.1 治疗失败后患者的管理
治疗失败时应首先评估患者治疗的依从性、耐受性和药物-药物或药物-食物间的相互作用等情况,其中依从性是治疗成败的决定性因素。如排除上述各因素后治疗仍未达到HIV RNA抑制,则需对患者进行HIV耐药检测,并根据检测结果调整ART方案。二线ART方案的选择原则是使用至少2种、最好3种具有完全抗HIV活性的药物,这些药物可是之前使用的ARV类别中的较新的药物如NNRTIs中的依曲韦林(etravirine, ETR)、蛋白酶抑制剂(protease inhibitors, PIs)中的DRV、INIs中的DTG和BIC等,也可是具有新型作用机制的ARV如融合酶抑制剂、辅助受体拮抗剂等。如HIV存在某些耐药突变,某些药物如DTG、DRV/r和洛匹那韦(lopinavir, LPV)/r需2次/d给药以提高血药浓度。由于增效的蛋白酶抑制剂(boosted proteases inhibitors, bPIs)联合其他活性药物可降低大多数患者(包括初治和经治患者)的HIV RNA水平且具有较高的耐药屏障,推荐的二线ART方案中常包含1种具有完全活性的bPIs和1种之前未曾使用过的ARV类别药物(如INIs、融合酶抑制剂或辅助受体拮抗剂)或NNRTIs(如ETR)[4]。
INIs为治疗失败患者提供了新的治疗选择,其在经治患者中有良好的抗HIV作用。研究显示,对治疗失败患者,1种bPIs联合RAL治疗非劣效于1种bPIs联合2种NRTIs[4]。“DAWNING”研究首次前瞻性研究和比较了含DTG与含1种bPIs的二线ART方案的疗效和安全性。48周后的结果显示,对经1种NNRTIs联合2种NRTIs一线治疗失败的患者,DTG联合2种(至少1种具有完全活性)NRTIs治疗的病毒学疗效显著优于LPV/r联合2种(至少1种具有完全活性)NRTIs,且安全性表现也更好[17]。该研究证实,DTG联合2种NRTIs可用作HIV感染患者二线治疗的新选择[3-4]。WHO 2018年发布的指南[3]推荐,DTG联合2种NRTIs是经EFV(或NVP)联合2种NRTIs治疗失败后患者的首选二线ART方案。
临床上应根据患者的既往治疗情况和HIV耐药检测结果来选用药物。通常而言,不推荐在已失败的原治疗方案中加用单个具有完全活性的ARV的做法。临床实践中如耐药检测不可及,则可考虑经验性换药,选用至少1种新的NRTIs,如TDF(或ABC)联合3TC转换为齐多夫定(zidovudine, AZT)联合3TC。对HIV合并乙型肝炎病毒(hepatitis B virus, HBV)感染的患者,如原治疗方案中含TDF和(或)3TC,新治疗方案中应保留TDF和(或)3TC,同时使用其他有活性的ARV。目前,HIV对INIs的原发性耐药罕见,故现并不推荐对初治患者常规进行基线耐药检测。INIs治疗失败后出现对INIs的耐药少见,但临床实践中应注意观察HIV对INIs产生耐药突变的可能。表3列举了不同方案治疗失败后可考虑选用的二线ART方案。
3.2 病毒抑制状态下的方案转换
一般而言,如患者在当前ART方案下达到了病毒学抑制,则不建议随意调整治疗方案。在某些特定情况下可考虑进行方案调整[4],如:①减少药片数量和给药频率,简化治疗方案;②改善耐受性,减少短期或长期毒性;③预防或减轻药物相互作用;④妊娠期或可能发生妊娠的女性患者;⑤降低治疗费用。方案转换应以维持病毒学抑制状态为基础,且不影响未来的药物选用。
多项研究证实,将以NNRTIs或PIs为基础的ART方案转换至以INIs如DTG、RAL或EVG为基础的治疗方案后可继续维持病毒学疗效[4]。此外,同类别药物如INIs之间的相互转换在理论上也是可行的。对两药简化治疗方案,已有的临床数据尚不充分,故不推荐常规采用,国际上的相关治疗指南目前仍推荐三药治疗方案为标准ART方案。在一些较特殊的临床情况下,如在已达病毒学抑制、但无法耐受药物毒副作用的情况下,对出现TDF的肝、肾毒性和ABC的超敏反应或心血管风险等的患者,可考虑选用含有INIs的两药简化方案,但应予以密切监测。已有一定的研究数据或临床经验支持的含有INIs的两药简化方案包括[4]:①DTG+RPV;②DTG+3TC;③DRV/r+RAL;④EVG/c/FTC/TAF+DRV。不推荐INIs单药治疗。
在国内,许多HIV感染患者在首次就诊时就已处于艾滋病期,合并诸如结核病、深部真菌感染等机会性感染或存在肿瘤等并发症[18]。由于免费抗病毒治疗药品与这些并发症的治疗用药之间可能存在药物相互作用,此时可能需要临时使用INIs,待机会性感染治疗结束后再转换为免费ART方案,这在理论上可行,但目前尚无临床试验证实由INIs向bPIs或NNRTIs转换的有效性和安全性。对这种情况,最好在使用INIs达到病毒学成功后再进行药物转换以减少病毒学失败及HIV耐药的风险,药物转换后应加强病毒学及免疫学的检测,及早发现可能出现的失败以便于进行及时的干预。
3.3 因不良反应而转换为INIs
在多项比较RAL、EVG或DTG与NNRTIs和PIs的临床对照试验[11-14]中,INIs都表现出了相对更好的安全性,患者因不良事件而退出治疗的情况更为少见。建议如患者在治疗过程中不能耐受药物的不良反应(如EFV的中枢神经系统不良反应、皮疹、肝损害和PIs的消化系统不良反应、代谢异常等)时可考虑换用INIs,以提高患者的生活质量。
4 在特殊人群中的应用
4.1 女性、妊娠期和哺乳期患者
对女性HIV感染患者,需考虑到其对性激素类药物的特殊需求,如月经不调需要建立人工周期、长期使用口服避孕药和围绝经期的激素替代治疗等。由于含有增效剂考比司他,EVG/c会致雌二醇血药浓度降低而影响雌激素的疗效,在对女性患者长期治疗中需予以注意。DTG和RAL与性激素类药物间都无药物相互作用,是更好的治疗选择[4]。
对HIV感染的孕妇,基于良好的有效性和安全性数据,推荐RAL用于孕妇患者的治疗[4]。迄今尚无在孕妇中使用其他INIs的临床数据,INIs对人类妊娠的影响也不清楚。对在妊娠中晚期被诊出HIV感染的患者,可优先选用INIs,快速降低HIV RNA水平,以保证其分娩时HIV RNA水平被维持在可检出限以下[3-4]。基于已有的研究数据,不推荐EVG/c和BIC用于孕妇患者。
一项研究的初步结果显示,受孕期(卵子受精阶段)暴露于DTG的孕妇其胎儿有神经管缺陷风险提高的可能[19],但队列中确认妊娠(无论妊娠阶段)后才开始使用DTG的孕妇并无新生儿出现神经管缺陷的报告。目前尚无法确定DTG与胎儿神经管畸形发生之间的相关性,相关研究正在进行中。当前建议,对在备孕阶段或无法进行有效避孕的女性患者,应避免使用DTG;对第一孕期暴露于DTG的患者,可考虑换用其他治疗方案;对自第二孕期暴露于DTG的患者,可不换用治疗方案[3, 19]。临床实践中应做好风险告知,做到知情同意。建議DTG避免用于希望怀孕或正在备孕、或性活跃且避孕方法不可靠的育龄女性患者。建议对所有育龄女性患者在使用DTG之前都进行妊娠试验检测并记录在案。目前尚不清楚其他INIs是否也可引起新生儿神经管缺陷,相关信息仍待临床观察和研究的确认。
对HIV感染的哺乳期患者,如配方奶粉可及,绝大多数情况下应人工喂养,杜绝母乳喂养和混合喂养[4]。大鼠试验发现,DTG、RAL和EVG都可在乳汁中分泌,且乳汁中的药物浓度高于血浆中的药物浓度[11-13],但母乳中的药物摄入剂量及药物累积对新生儿的影响尚不清楚。
4.2 儿童、青少年和老年患者
INIs在此类人群中的研究数据整体上说还不充分,临床上需加强监测。RAL可用于青少年、儿童、幼儿和新生儿(体重>2 kg)患者。EVG/c/TAF/FTC可用于≥12岁的青少年患者。DTG可用于青少年和≥6岁的儿童患者。含BIC的单片复方制剂BIC/TAF/FTC尚未被批准用于<18岁的患者。各药的具体用法、用量请参照各国批准的药品说明书[11-14]。
INIs用于≥65岁的老年患者的研究数据有限。考虑到老年患者并发症多、合并用药情况复杂,必要时可考虑选用含有INIs的ART方案以优化治疗。
4.3 肝、肾功能损害患者
INIs对肝、肾功能的影响小,用于肝、肾功能损害患者时的注意事项见表4。
4.4 HIV感染合并其他感染患者
4.4.1 HIV感染合并结核病
应注意INIs与利福霉素类药物之间的相互作用。对正在使用DTG或RAL治疗的HIV感染合并结核病患者,如合并使用利福平,则需增加DTG剂量(至50 mg、BID)[13],而RAL的剂量可考虑增加(至800 mg、BID)或维持不变(400 mg、BID)[5]。利福布汀的肝酶诱导作用较弱,故对使用DTG或RAL治疗的HIV感染合并结核病患者,可考虑以利福布汀替代利福平,此时DTG或RAL的剂量都无需调整。鉴于存在显著的药物相互作用,不推荐EVG/c和BIC用于HIV感染合并结核病患者的治疗[4-5]。
4.4.2 HIV感染合并病毒性肝炎
对于此类患者,ART方案宜选用肝毒性小的药物,INIs具有优势[4]。但因INIs没有抗HBV活性,故对HIV/HBV合并感染的患者,需注意同时使用具有抗HBV活性的药物。对合并丙型肝炎病毒(hepatitis C virus, HCV)感染的患者,如临床情况许可,可先进行抗HCV治疗,然后再进行HIV感染治疗,以避免药物相互作用,减少毒性累积。如考虑同时进行抗HIV/HCV治疗,则需注意表5列举的直接作用抗病毒药物(directacting antiviral agents, DAAs)与INIs间的相互作用,推荐使用DTG或RAL。抗HCV治疗应参照相应治疗指南。
4.5 HIV-2感染患者
HIV-2对NNRTIs天然耐药。不过,体外研究显示HIV-2对PIs、INIs和NRTIs敏感,理论上HIV-2感染的ART方案为2NRTIs+PIs或2NRTIs+INIs。INIs在体外具有很强的抗HIV-2活性,理论上可用于HIV-2感染患者的治疗[4]。但现还无INIs治疗HIV-2感染的大型临床试验数据,亟需积累更多的临床实践经验。
4.6 吸毒人群
如何优化吸毒人群的ART方案目前还面临许多挑战,包括选用的药物应有更小的肝和神经毒性以及更少的药物相互作用。INIs的毒副作用小,可用于正接受美沙酮替代治疗的吸毒人群[4-5],但需注意EVG/c与阿片类药物间的相互作用。
4.7 精神系统疾病患者
INIs的中枢神经系统不良反应较EFV明显减少,同时与精神系统疾病治疗药物间的相互作用也较少[4],可考虑用于合并精神系统疾病的患者,但选用INIs时亦需考虑INIs的神经精神系统不良反应。
5 不良反应及监测
总体而言,INIs的安全性较NNRTIs和PIs都有较明显的改善,中枢神经系统不良反应较EFV明显减少,血脂和消化系统方面的不良反应也较PIs明显减少[4-5]。但INIs在“真实世界”的应用中仍有一些不良反应报告,尽管不同国家的数据有所不同。其中,需注意DTG和RAL引发超敏反应的可能。DTG的超敏反应发生率在临床试验中<1%[13]。上市后监测报告显示,RAL可引发罕见、但严重的皮肤反应和系统超敏反应。RAL还与血肌酸激酶水平升高相关,亦有导致肌炎和横纹肌溶解的报告[4]。
临床上因不良反应而导致患者停用INIs的情况相对少见。临床研究显示,INIs也可导致神经精神系统不良事件如睡眠障碍、抑郁、焦虑等[4]。有研究提示,DTG导致的失眠和头痛发生率较EVG和RAL都高[20-21]。这些神经精神系统不良事件的发生机制都尚未明确,需进行更多的研究予以阐释[4]。HIV感染的管理必须重视患者的生活质量,并在随访中加以记录,如出现较严重的不良反应,应对某些不能耐受的患者及早调整ART方案,以防依从性下降而导致治疗失败。
6 INIs与暴露后预防(post-exposure prophylaxis, PEP)
PEP方案的制定主要基于临床专家的共识[22],原则上应选用疗效好、耐受性佳、用药便利的方案。INIs是PEP方案的合适组分。PEP方案应在高危暴露(包括职业和非职业暴露)后的24 h内(不得>72 h)使用。国际上最新的相关指南推荐的PEP方案見表6,其中推荐的NRTIs主要是TDF+3TC(FTC)。尽管相关指南都未推荐TAF+3TC(FTC),但理论上TAF+3TC(FTC)也可用作PEP方案的NRTIs组分。当然,这方面还需积累更多的临床数据。
中华医学会热带病和寄生虫学分会艾滋病学组和中华医学会感染病学分会艾滋病学组参加本共识讨论及编写的成员名单(按姓氏笔画为序):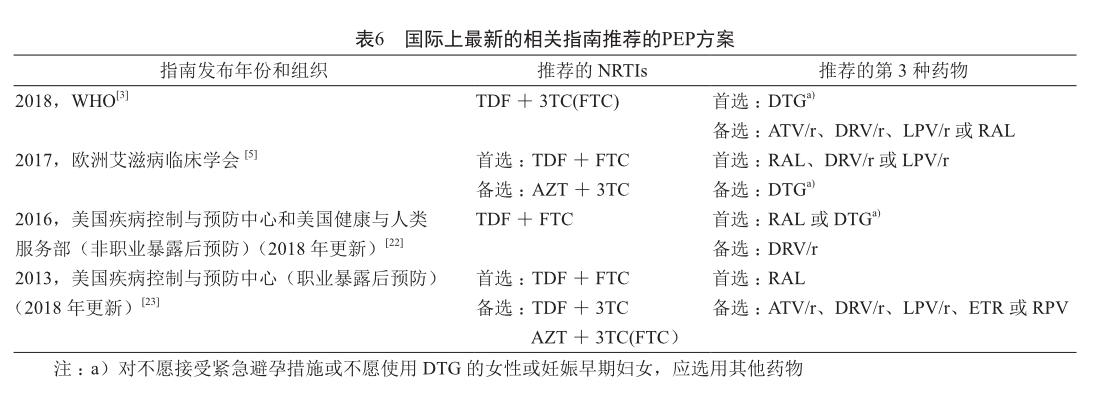
马萍、王敏、王焕玲、王辉、王福祥、邓爱花、卢洪洲、卢祥婵、卢瑞朝、叶珺、叶寒辉、石荔、白浪、成骢、吕玮、朱彪、伦文辉、庄鸣华、刘水青、刘燕芬、刘意心、江建宁、许利军、孙永涛、孙丽君、孙燕、李太生、李在村、李勇、李惠琴、李鑫、吴昊、吴南屏、何云、何艳、何浩岚、何盛华、邹美银、汪习成、沈银忠、宋玉霞、张凤池、张彤、陈耀凯、陈仁芳、陈国春、陈晓红、陈谐捷、陈雅红、周锐峰、林锋、赵红心、赵清霞、徐小元、徐哲、郭威、唐小平、黄成瑜、黄金龙、康文臻、蒋亦明、蒋卫民、董兴齐、喻剑华、谢敬东、韩扬、蒙志好、魏洪霞
起草人:卢洪洲、沈银忠
参考文献
[1] U.S. Department of Health and Human Services. FDAapproved HIV medicines [EB/OL]. [2018-09-10]. https:// aidsinfo.nih.gov/understanding-hiv-aids/fact-sheets/21/58/ fda-approved-hiv-medicines.
[2] WHO. Guidelines for managing advanced HIV disease and rapid initiation of antiretroviral therapy [EB/OL]. [2017-08-20]. http://www.who.int/hiv/pub/guidelines/advanced-HIVdisease/en/.
[3] WHO. Updated recommendations on first-line and secondline antiretroviral regimens and post-exposure prophylaxis and recommendations on early infant diagnosis of HIV: interim guidance [EB/OL]. [2018-08-20]. http://www.who.int/ hiv/pub/guidelines/ARV2018update/en/.
[4] U.S. Department of Health and Human Services. Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents Living with HIV [EB/OL]. [2018-06-30]. https://aidsinfo.nih.gov/guidelines/html/1/adult-andadolescent-arv/0.
[5] EACS. Guidelines, version 9.0 [EB/OL]. [2017-11-15]. http:// www.eacsociety.org/files/guidelines_9.0-english.pdf.
[6] Saag MS, Benson CA, Gandhi RT, et al. Antiretroviral drugs for treatment and prevention of HIV infection in adults: 2018 recommendations of the International Antiviral Society-USA panel [J]. JAMA, 2018, 320(4): 379-396.
[7] 中國疾病预防控制中心性病艾滋病预防控制中心. 国家免费艾滋病抗病毒药物治疗手册[M]. 4版. 北京: 人民卫生出版社, 2016.
[8] 中华医学会感染病学分会艾滋病学组. 艾滋病诊疗指南第三版(2015版)[J]. 中华临床感染病杂志, 2015, 8(5) : 385-401.
[9] McColl DJ, Chen X. Strand transfer inhibitors of HIV-1 integrase: bringing IN a new era of antiretroviral therapy [J]. Antiviral Res, 2010, 85(1): 101-118.
[10] McPherson TD, Sobieszczyk ME, Markowitz M. Cabotegravir in the treatment and prevention of human immunodeficiency virus-1 [J]. Expert Opin Investig Drugs, 2018, 27(4): 413-420.
[11] Merck Sharp & Dohme Corp. Isentress — raltegravir tablet, film coated; Isentress — raltegravir tablet, chewable; Isentress— raltegravir granule, for suspension [EB/OL]. [2018-06-05]. https://dailymed.nlm.nih.gov/dailymed/drugInfo. cfm?setid=89a5ec53-d956-4329-8004-0f40f51c88a3.
[12] Gilead Sciences, Inc. Genvoya — elvitegravir, cobicistat, emtricitabine, and tenofovir alafenamide tablet [EB/OL].[2018-08-27]. https://dailymed.nlm.nih.gov/dailymed/drugInfo. cfm?setid=34784acf-15ed-4715-b504-eb30430518e9.
[13] ViiV Healthcare Company. Tivicay — dolutegravir sodium tablet, film coated [EB/OL]. [2018-09-13]. https://dailymed. nlm.nih.gov/dailymed/drugInfo.cfm?setid=63df5af3-b8ac-4e76-9830-2dbb340af922.
[14] Gilead Sciences, Inc. Biktarvy — bictegravir sodium,emtricitabine, and tenofovir alafenamide fumarate tablets[EB/OL]. [2018-09-21]. https://dailymed.nlm.nih.gov/ dailymed/drugInfo.cfm?setid=664cb8f0-1f65-441b-b0d9-ba3d798be309.
[15] Castagna A, Maggiolo F, Penco G, et al. Dolutegravir in antiretroviral-experienced patients with raltegravir- and/or elvitegravir-resistant HIV-1: 24-week results of the phase III VIKING-3 study [J]. J Infect Dis, 2014, 210(3): 354-362.
[16] Tsiang M, Jones GS, Goldsmith J, et al. Antiviral activity of bictegravir (GS-9883), a novel potent HIV-1 integrase strand transfer inhibitor with an improved resistance profile [J]. Antimicrob Agents Chemother, 2016, 60(12): 7086-7097.
[17] Aboud M, Kaplan R, Lombaard J, et al. THPEB040. Superior efficacy of dolutegravir (DTG) plus 2 nucleoside reverse transcriptase inhibitors (NRTIs) compared with lopinavir/ ritonavir (LPV/r ) plus 2 NRTIs in second-line treatment —48-week data from the DAWNING study [EB/OL]. [2018-08-20]. http://www.aids2018.org/Portals/4/File/AIDS2018_ Abstract_book.pdf?ver=2018-08-06-160624-427.
[18] 中國疾病预防控制中心性病艾滋病预防控制中心性病控制中心. 2018年5月全国艾滋病性病疫情[J]. 中国艾滋病性病, 2018, 24(7): 645.
[19] WHO. Potential safety issue affecting women living with HIV using dolutegravir at the time of conception [EB/OL].[2018-05-23]. http://www.who.int/medicines/publications/ drugalerts/Statement_on_DTG_18May_2018final.pdf?ua=1.
[20] Pe?afiel J, de Lazzari E, Padilla M, et al. Tolerability of integrase inhibitors in a real-life setting [J]. J Antimicrob Chemother, 2017, 72(6): 1752-1759.
[21] Hoffmann C, Welz T, Sabranski M, et al. Higher rates of neuropsychiatric adverse events leading to dolutegravir discontinuation in women and older patients [J]. HIV Med, 2017, 18(1): 56-63.
[22] Centers for Disease Control and Prevention, U.S. Department of Health and Human Services. Updated guidelines for antiretroviral postexposure prophylaxis after sexual, injection drug use, or other nonoccupational exposure to HIV — United States, 2016 [EB/OL]. [2018-06-23]. https://www.cdc.gov/ hiv/pdf/programresources/cdc-hiv-npep-guidelines.pdf.
[23] U.S. Public Health Service Working Group. Updated U.S. Public Health Service guidelines for the management of occupational exposures to HIV and recommendations for post exposure prophylaxis [EB/OL]. [2018-06-23]. https://stacks. cdc.gov/view/cdc/20711.
