桑葚浓缩汁对D-半乳糖诱导氧化损伤大鼠脾脏的保护作用
2018-01-08刘亚飞彭新颜贺红军金成武苏树飞杨晓帅
刘亚飞,彭新颜,*,贺红军,金成武,苏树飞,杨晓帅
(1.鲁东大学食品工程学院,山东 烟台 264025;2.烟台大学生命科学学院,山东 烟台 264005)
桑葚浓缩汁对D-半乳糖诱导氧化损伤大鼠脾脏的保护作用
刘亚飞1,彭新颜1,*,贺红军2,金成武1,苏树飞1,杨晓帅1
(1.鲁东大学食品工程学院,山东 烟台 264025;2.烟台大学生命科学学院,山东 烟台 264005)
研究桑葚浓缩汁对D-半乳糖(D-galactose,D-Gal)诱导氧化损伤大鼠脾脏的保护作用。采用D-Gal建立衰老模型,将Wistar大鼠随机分为正常对照组、D-Gal模型阴性对照组、D-Gal+VE阳性对照组、D-Gal+桑葚浓缩汁(低、中、高)剂量组6组。检测脾脏总超氧化物歧化酶(total superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)的活力及丙二醛(malondialdehyde,MDA)含量,血清中肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)的质量浓度,并对脾脏指数、半胱氨酸天冬氨酸蛋白酶(Caspase-9、Caspase-3)的表达水平进行测定,结合组织形态学评价桑葚浓缩汁对氧化损伤大鼠脾脏的影响。结果显示,与阴性对照组相比,桑葚浓缩汁中、高剂量组均可提高脾脏组织T-SOD、GSH-Px、CAT的活力(P<0.05),各剂量处理组均可降低MDA含量(P<0.05)及TNF-α、IL-6的表达,提高脾脏指数。其中高剂量处理组的T-SOD、GSH-Px、CAT活力分别达到了113.22、90.17、7.67 U/mg pro,作用效果明显;MDA含量降至13.59 nmol/mg,脾脏指数升至4.12 mg/g,均达到了正常对照组和阳性对照组水平(P>0.05);TNF-α、IL-6水平下降至56.95、76.83 pg/mL。免疫组化结果显示,桑葚浓缩汁处理组Caspase-9、Caspase-3的表达均有减轻,其中高剂量组效果最好。苏木素-伊红染色结果也证实,桑甚浓缩汁可保护脾脏结构,有效增加淋巴细胞数量,改善充血现象。可见,桑葚浓缩汁对氧化损伤大鼠脾脏有一定的保护作用,并呈一定的量效关系。
桑葚浓缩汁;D-半乳糖;氧化损伤;脾脏
近年来,心脑血管疾病、恶性肿瘤、糖尿病、阻塞性肺部疾病、精神病等慢性疾病的发病率居高不下,严重威胁着人们的健康[1]。研究表明,自由基过量是造成这些疾病的重要原因之一,过量的自由基会引起细胞结构与功能损伤,使机体组织细胞的新陈代谢功能紊乱,破坏机体的正常秩序,造成多种器官组织病变或功能异常[2]。因此,为减少过量自由基对机体的损伤及造成的衰老等病变,抗氧化物质的研究越来越受到重视,天然抗氧化物的开发已成为研究热点[3]。
桑葚作为一种“药食同源”的植物果实,含有人体必需的各种营养物质。国内外研究表明,桑葚含有黄酮、多糖、花色苷、多酚等多种抗氧化成分,具有清除自由基、抗氧化、防衰老、增强机体免疫力等保健功效[4]。范金波等[5]研究发现,桑葚中总酚、黄酮含量最多,并测得其1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazylradical,DPPH)自由基清除能力和铁离子还原能力较高。Lin等[6]分析桑叶、桑枝和果实主要抗氧化成分及含量差异,发现桑葚中东莨菪素含量最高,桑叶中芦丁含量最高,黑果中槲皮素含量较高,桑枝中山奈酚的浓度较高。邓秀婷等[7]用不同剂量的桑葚提取液灌胃大鼠40 d,发现其血清及肝脏中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力升高,丙二醛(malondialdehyde,MDA)含量下降。Liu Huan等[8]也证实,桑葚提取物可提高肝抗氧化蛋白的表达,加快硝基苯酚(nitrophenol,NP)的代谢和排泄,对NP诱导的大鼠毒性起解毒作用。Li Yuxian等[9]利用腹腔注射CCl4建立大鼠模型,对比各组谷丙转氨酶、谷草转氨酶、透明质酸、羟脯氨酸等含量,发现桑葚花青素对CCl4诱导的大鼠肝纤维化有很强的保护作用。Jiang Yan等[10]通过研究发现黑桑葚提取物可抑制大鼠动脉粥样硬化的发展,增强抗氧化活性,减少动脉粥样硬化病变。可见,桑葚中存在多种抗氧化功效成分。
2000年,Eberhardt等[11]在Nature上发表“营养——新鲜苹果的抗氧化剂活性”一文,受到国内外广泛关注,这些学者提出果蔬中所有成分的协同作用是其发挥抗氧化和防癌功效的重要原因。但目前有关桑葚抗氧化、防衰老及解毒的报道多集中在某种成分的研究[5]。因此,本实验以建立D-半乳糖(D-galactose,D-Gal)衰老模型为切入点,研究桑葚浓缩全汁对氧化应激大鼠脾脏生化指标和炎症因子的影响,为桑葚浓缩汁在体内抗氧化作用模式及其机制研究提供理论依据,对实际生产、生活和开发天然食物具有指导意义。
1 材料与方法
1.1 动物、材料与试剂
健康Wistar雄性大鼠由北京维通利华实验动物中心提供,合格证号SCXK(京)2011-0011,使用许可证号SYXK(鲁)20160022。
无籽大十黑桑葚(Fructusmori)购自烟台惠安市场。
D-Gal 北京索莱宝科技有限公司;总SOD(total superoxide dismutase,T-SOD)、过氧化氢酶(catalase,CAT)、GSH-Px、MDA试剂盒 上海通蔚生物科技有限公司;大鼠肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)定量检测试剂盒 上海生物技术有限公司;大鼠白细胞介素6(interleukin-6,IL-6)试剂盒 上海恪敏生物科技有限公司;Caspase活力检测试剂盒 海德创业(北京)生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FA504B精密电子分析天平 浙江赛德仪器设备有限公司;HHS-21-4电热恒温水浴锅 浙江托普仪器有限公司;MB16-414酶标仪 上海胜卫电子科技有限公司;PHS-3C型酸度计 上海仪田精密仪器有限公司;JK21710电动搅拌器 北京精凯达仪器有限公司;GTR16-2型高速台式冷冻离心机 北京时代北利离心机有限公司;UV-1800紫外分光光度计 上海美谱达仪器有限公司;XHF-D高速分散器 宁波新芝生物科技股份有限公司;XH-C微型混合器 江苏省金坛区白塔安瑞实验仪器厂。
1.3 方法
1.3.1 桑葚浓缩汁的制备流程及主要营养成分含量测定
新鲜桑葚→洗净晾干→榨汁(出汁率约70%)→4 层和8 层纱布分别过滤3 次→0.45 μm膜过滤→桑葚原汁→浓缩2 倍→4 ℃冷藏保存备用
分别测定浓缩汁的花青素(pH值示差法)、VC(碘量滴定法)、总酚(福林-酚试剂法)、黄酮(亚硝酸钠-硝酸铝比色法)及总糖(斐林试剂法)含量[12]。
1.3.2 D-Gal致衰老模型大鼠的建立
参考彭新颜等[13]的方法,选择健康雄性Wistar大鼠72只(体质量260~340 g),将大鼠分笼、给予标准饮食,饲养1周后,随机分成6 组:正常对照组、D-Gal模型阴性对照组、D-Gal+VE阳性对照组、D-Gal+桑葚浓缩汁(低、中、高)剂量组,期间有淘汰,最终每组10只。正常对照组大鼠颈背部皮下注射生理盐水并于第2周给予50 mg/kg双蒸水作为正常对照组。其他5 组于第2周颈背部注射D-Gal(120 mg/kg),每日注射一次,连续注射8周建立衰老模型;同时,于第2周每日分别灌胃等量双蒸水、VE 50 mg/kg,低、中、高剂量组灌胃桑葚浓缩汁2.5、5.0、10.0 mL/kg。
1.3.3 血清的制备
实验结束后,摘取大鼠眼球取血,血样于4 ℃冰箱放置12 h,然后4 ℃、3 000 r/min离心10~15 min,收集上清液,即为血清。
1.3.4 脾脏指数测定和组织匀浆的制备
参考范桢亮等[14]的方法并稍作修改,8 周实验结束后,称量大鼠体质量,断颈处死,摘取脾脏并用滤纸吸干表面血液,电子天平精确称其质量,根据下式计算其脾脏指数。
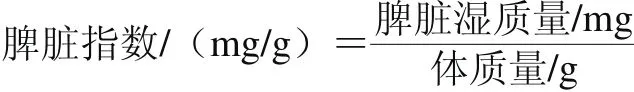
测定脾脏指数后,除去脾脏周围的脂肪及结缔组织,置于生理盐水中洗净脏器表面黏附的血污,用洁净的滤纸吸干表面水分,取1 g置于小烧杯中,并加入10 mL生理盐水,在4 ℃水浴中用眼科小剪迅速剪碎组织块,冰浴匀浆,低温3 000 r/min离心15 min,取上清液,制成10%组织浆液。
1.3.5 生化指标测定
抗氧化酶系中T-SOD、CAT、GSH-Px活力及MDA含量的检测,炎症因子TNF-α、IL-6水平的测定,都按照试剂盒说明书进行操作。
1.3.6 脾组织形态学观察
采用石蜡切片观察病理变化,取大鼠脾组织,厚度大约为4~5 mm。在4 ℃环境下以4%多聚甲醛固定24 h,经各梯度体积分数酒精脱水(75%、80%、85%、90%、95%、100%)、石蜡包埋、切片机切片(厚度约4 μm)、苏木素-伊红法(hematoxylin and eosin,HE)染色、封片等步骤制成切片,在显微镜下观察病理变化。
1.3.7 对大鼠脾组织蛋白Caspase-9、Caspase-3表达的测定
经常规脱蜡、水化后,滴加Caspase-9、Caspase-3一抗、二抗,按试剂盒说明对切片标本进行染色,3,3-四盐酸二氨基联苯胺显色,蒸馏水洗、脱水、封片,显微镜观察,免疫组化阳性产物定位于细胞质,表现为棕黄色颗粒。
1.4 数据分析
以上每个实验重复3 次,结果均以 ±s表示。采用Statistix 8.1软件包中Linear Models程序对数据进行统计,通过SigmaPlot 12.0和Excel 6.0软件作图,差异显著性分析使用Tukey HSD程序,P<0.05表示差异显著。
2 结果与分析
2.1 桑葚浓缩汁主要成分含量
实验测得桑葚浓缩汁中主要营养成分及其含量为:花青素0.98 g/L、VC 44 mg/L、总酚534 mg/L、黄酮1.17 g/L、总糖6.7%。
2.2 桑葚浓缩汁对大鼠脾脏T-SOD活力的影响
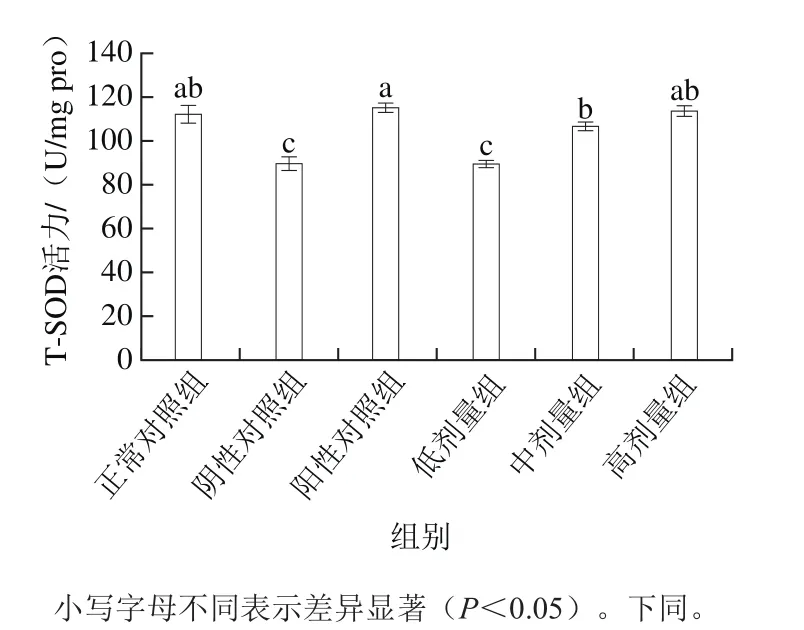
图1 桑葚浓缩汁对D-Gal诱导大鼠脾脏T-SOD活力的影响Fig. 1 Effect of mulberry juice concentrate on T-SOD activity in spleen of rats with D-Gal-induced injury
从图1可看出,造模后,阴性对照组大鼠脾脏T-SOD活力显著低于其他各组(P<0.05),说明造模成功,阳性对照组、正常对照组和桑葚浓缩汁高剂量组的T-SOD活力分别为(114.86±1.93)、(111.89±3.84)、(113.22±2.85)U/mg pro,三者间差异不明显(P>0.05),桑葚浓缩汁高剂量组比阴性对照组、低剂量组分别提高了26.4%、26.6%(P<0.05),并达到了正常对照组和阳性对照组的水平,而且桑葚浓缩汁中剂量与高剂量组效果相当(P>0.05)。
2.3 桑葚浓缩汁对大鼠脾脏GSH-Px活力的影响
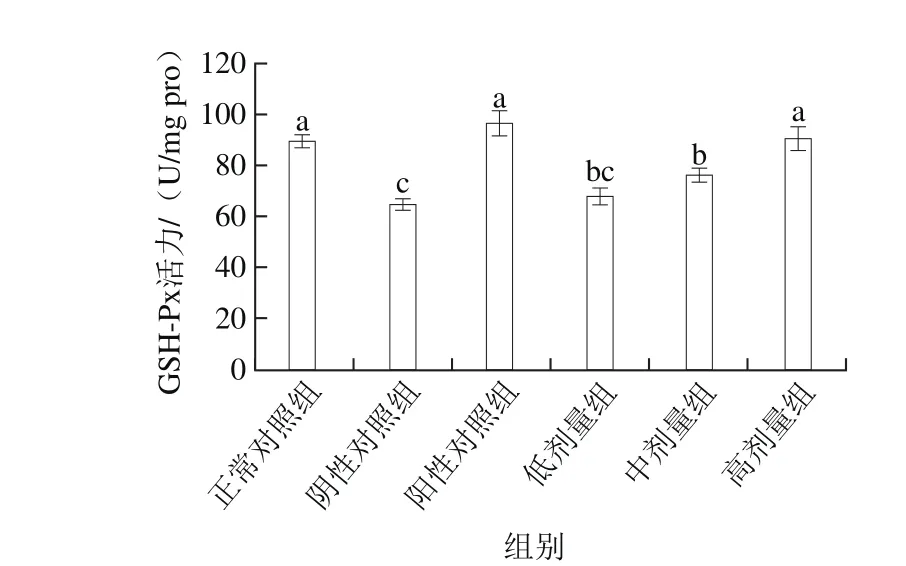
图2 桑葚浓缩汁对D-Gal诱导大鼠脾脏GSH-Px活力的影响Fig. 2 Effect of mulberry juice concentrate on GSH-Px activityin spleen of rats with D-Gal-induced injury
如图2所示,桑葚浓缩汁低、中、高剂量组GSH-Px活力分别为(68.01±3.40)、(76.36±2.45)、(90.17±4.69)U/mg pro,其中低剂量组与阴性对照组无显著差异(P>0.05),中剂量组与阴性对照组差异显著(P<0.05)。桑葚浓缩汁高剂量组效果最好,比低、中剂量组和阴性对照组分别提高了32.6%、18.1%、39.3%(P<0.05),并与正常对照组和阳性对照组无显著差异(P>0.05)。
2.4 桑葚浓缩汁对大鼠脾脏CAT活力的影响
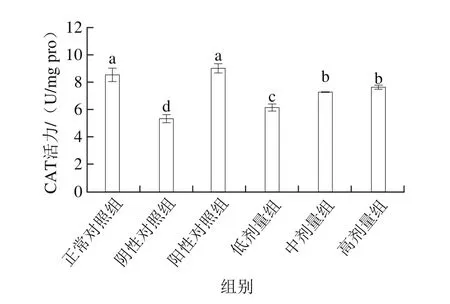
图3 桑葚浓缩汁对D-Gal诱导大鼠脾脏CAT活力的影响Fig. 3 Effect of mulberry juice concentrate on CAT activity in spleen of rats with D-Gal-induced injury
从图3可以看出,桑葚浓缩汁低、中、高剂量组的CAT活力分别为(6.18±0.25)、(7.27±0.07)、(7.67±0.10)U/mg pro,与阴性对照组相比分别增加了15.1%、35.4%、42.8%(P<0.05),其中,桑葚浓缩汁中、高剂量组与低剂量组差异显著(P<0.05),但3种桑葚浓缩汁处理组均未达到正常对照组和阳性对照组水平(P<0.05)。
2.5 桑葚浓缩汁对大鼠脾脏MDA含量的影响
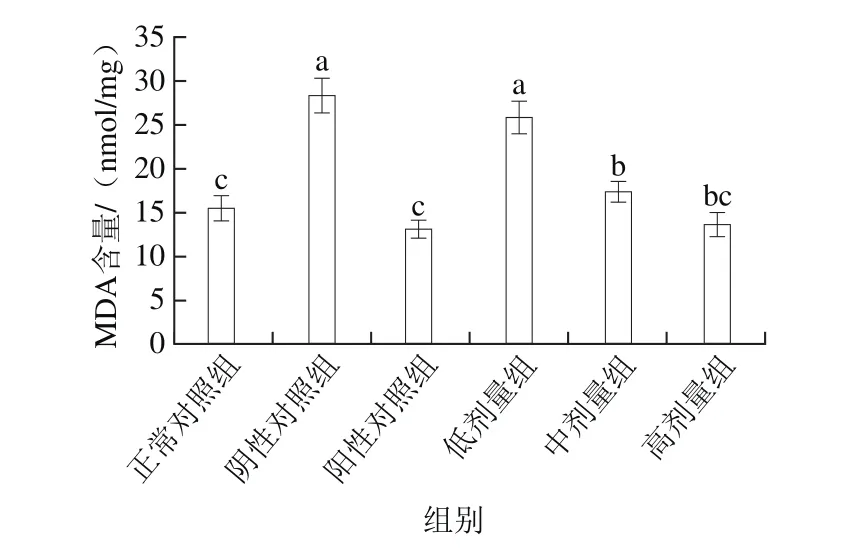
图4 桑葚浓缩汁对D-Gal诱导大鼠脾脏MDA含量的影响Fig.4 Effect of mulberry juice concentrate on MDA level in spleen of rats with D-Gal-induced injury
由图4可知,MDA含量在阳性对照组中最低,其次为桑葚浓缩汁高剂量组和正常对照组,三者分别达到(13.07±0.99)、(13.59±1.39)、(15.40±1.38)nmol/mg,三者之间无显著差异(P>0.05),中、高剂量组显著低于低剂量组和阴性对照组(P<0.05),桑葚浓缩汁高剂量组达到了正常对照组的效果,说明桑葚浓缩汁对减轻脂质过氧化有较好的效果。
2.6 桑葚浓缩汁对大鼠脾脏指数的影响
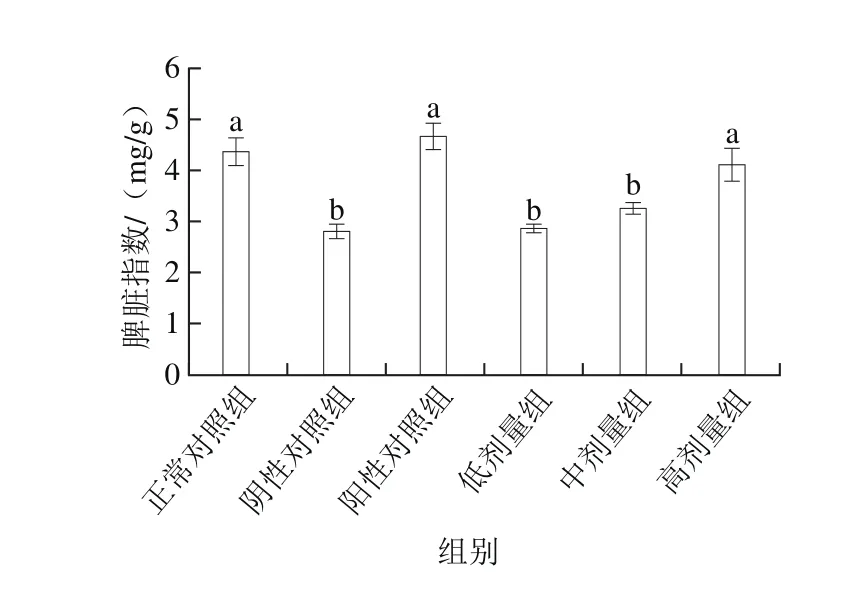
图5 桑葚浓缩汁对D-Gal诱导大鼠脾脏指数的影响Fig. 5 Effect of mulberry juice concentrate on spleen index in rats with D-Gal-induced injury
如图5所示,与正常对照组和阳性对照组相比,阴性对照组的脾脏指数明显下降,表明D-Gal诱导大鼠脾脏指数降低,影响了机体免疫力。经桑葚浓缩汁低、中、高剂量处理后,大鼠脾脏指数均有增加,其中高剂量组的效果最为明显,含量为(4.12±0.29)mg/g,与低、中剂量组和阴性对照组相比分别增加了43.6%、26.0%、46.6%(P<0.05),并达到正常对照组和阳性对照组的水平(P>0.05),说明桑葚浓缩汁对维持氧化损伤的大鼠脾脏指数和调节机体免疫力起到重要作用。
2.7 桑葚浓缩汁对大鼠脾脏TNF-α、IL-6的影响
如图6所示,桑葚浓缩汁各处理组均可降低TNF-α水平。桑葚浓缩汁低剂量组的TNF-α质量浓度为(74.22±2.29)pg/mL,与阴性对照组无显著差异(P>0.05),中、高剂量组质量浓度分别为(68.19±3.56)、(56.95±6.14)pg/mL,相比于阴性对照组分别降低了16.5%、30.3%(P<0.05),但均未达到正常对照组与阳性对照组的水平。
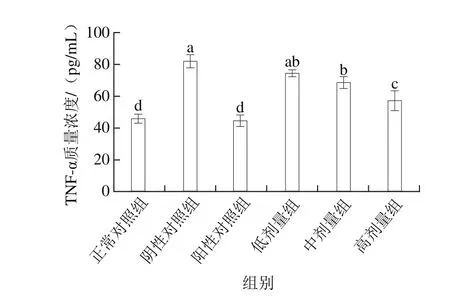
图6 桑葚浓缩汁对D-Gal诱导大鼠TNF-α的影响Fig. 6 Effect of mulberry juice concentrate on TNF-α expression in spleen of rats with D-gal-induced injury
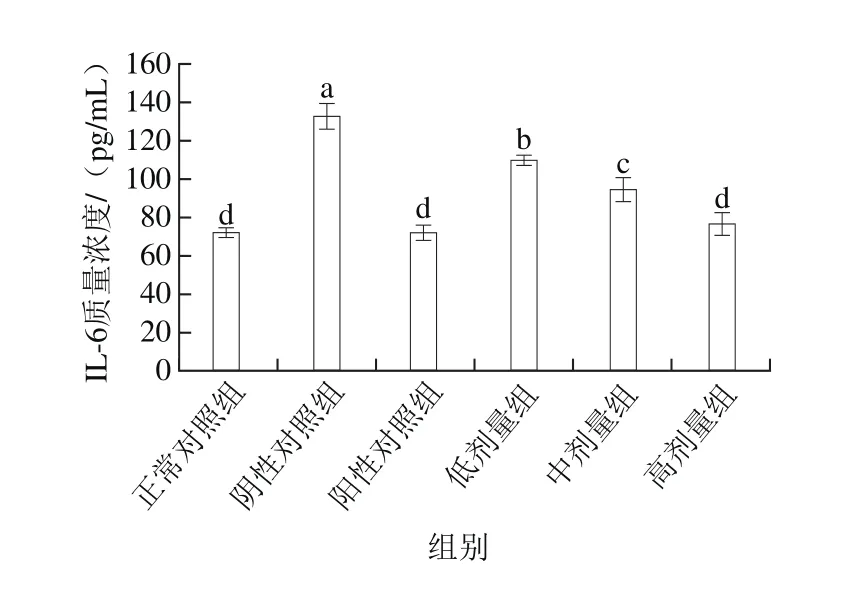
图7 桑葚浓缩汁对D-Gal诱导大鼠IL-6的影响Fig. 7 Effect of mulberry juice concentrate on IL-6 expression in spleen of rats with D-Gal-induced injury
由图7可知,在I L-6方面,桑葚浓缩汁低、中、高剂量组质量浓度分别为(109.66±2.60)、(94.21±6.36)、(76.83±5.87)pg/mL,与阴性对照组相比分别降低了17.3%、29.0%、42.1%(P<0.05),三者存在明显的量效关系,其中高剂量组效果最佳,达到了正常对照组和阳性对照组的水平。
2.8 桑葚浓缩汁对大鼠脾脏Caspase-9、Caspase-3的影响
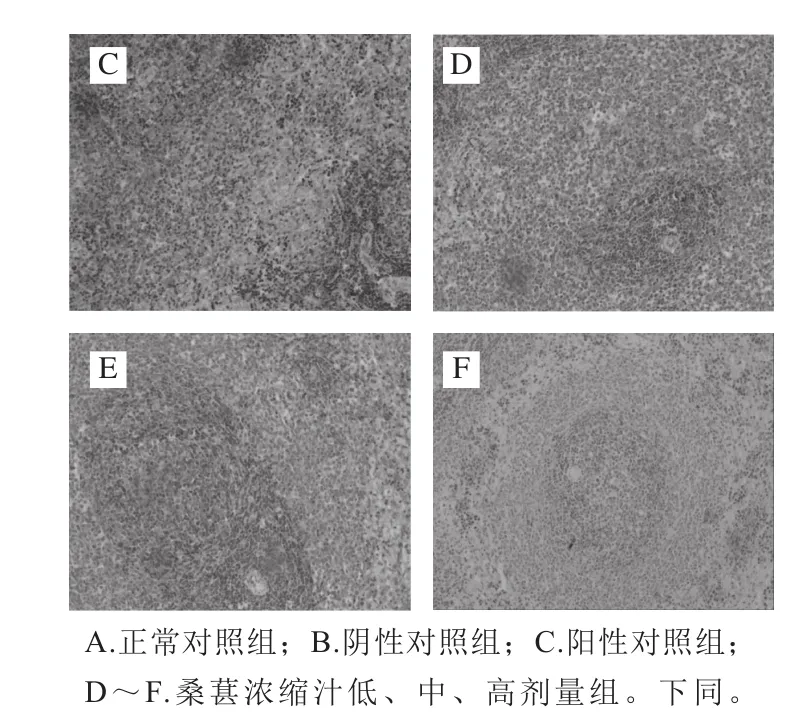
图8 各处理组大鼠脾脏组织Caspase-9表达Fig. 8 Expression of caspase-9 in spleen tissues

图9 各处理组大鼠脾脏组织Caspase-3表达Fig. 9 Expression of caspase-3 in spleen tissues
Caspase-9、Caspase-3的阳性表达部位均是在细胞的胞浆、胞质中,经免疫组化染色后出现棕黄色颗粒。由图8、9可知,在正常组中,Caspase-9、Caspase-3的表达率低。而阴性对照组与正常组比较,具有明显差别,Caspase-9、Caspase-3的阳性表达明显增高,出现深棕黄色颗粒。桑葚浓缩汁处理组与模型阴性对照组相比,中、高剂量组中Caspase-9、Caspase-3的表达均明显降低,低剂量组与阴性对照组比较,差异不明显。
2.9 大鼠脾脏组织HE染色结果


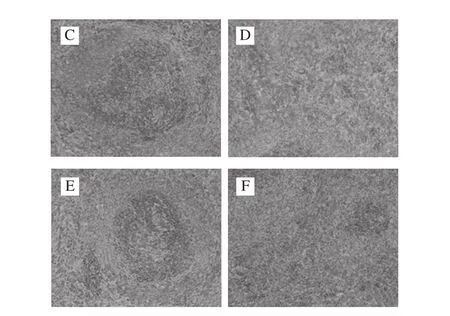
图10 各处理组大鼠脾脏病理学切片Fig. 10 Histopathological observation of spleen tissues
如图10所示,正常组脾脏在低倍镜下观,形态结构较完整、清晰,表面被膜伸入实质内形成小梁,可见白髓及红髓区,白髓由脾小体及动脉周围淋巴鞘组成,脾小体结构清晰,可见中央动脉。阴性对照组与正常对照组相比,脾脏结构消失、欠清,红髓髓窦扩张、充有大量的红细胞,白髓淋巴细胞减少,脾小结体积变小,红髓髓索变窄,脾窦扩张淤血。桑葚浓缩汁处理组病变与阴性对照组比较,脾脏形态结构有明显改善,红髓、白髓分界较清晰,红髓区可见少量淤血,白髓淋巴小结数量均有不同程度增多,生发中心较明显,细胞分布均匀。其中以中、高剂量组较好,阳性对照组治疗效果最佳,低剂量组疗效欠佳。
3 讨 论
实验动物注射外源性的D-Gal造模后,机体会产生大量活性氧自由基,造成组织器官的氧化性应激损伤,是目前公认的建立动物衰老模型的方法[15]。T-SOD、GSH-Px、CAT是生物抗氧化防御体系中重要的抗氧化酶类[16],分别通过清除超氧阴离子自由基、脂类自由基、过量的H2O2来维持细胞正常功能,从而减少脂质过氧化物的形成,增强机体抗氧化损伤的能力,提高机体免疫功能[17-18]。MDA是生物膜中内源性脂质过氧化的主要指标,它反映了脂质过氧化所产生的自由基含量,通常用于分析脂质过氧化程度[19]。本实验中,阴性对照组与正常组相比,大鼠脾脏T-SOD、GSH-Px和CAT活力均显著下降(P<0.05),MDA含量显著升高(P<0.05),表明D-Gal能诱导机体产生大量的活性自由基,使抗氧化体系紊乱,说明造模成功。经桑葚浓缩汁处理可明显提高氧化损伤大鼠脾脏的3种抗氧化酶活力,显著降低MDA含量,结果与邓秀婷等[7]用不同剂量的桑葚提取液灌胃大鼠40 d后一致。其中以高剂量组作用效果最明显,表明桑葚浓缩汁可以增强抗氧化酶活力,降低脂质过氧化水平,抑制D-Gal所致的氧化损伤,从而起到延缓大鼠衰老的作用。Liu Huan[8]、Li Yuxian[9]和Jiang Yan[10]等也证实,桑葚提取物对氧化应激大鼠损伤有较好的改善作用。
脾脏是机体最大的免疫器官,含有大量的淋巴细胞和巨噬细胞,能清除衰老血细胞、细菌和异物,还可分泌多种免疫因子,在免疫调节中起重要作用[20]。脾指数是代表脾脏形态大小的重要指标,其值大小与功能之间有着密切联系,多种疾病均可引起脾脏大小的变化,如感染性疾病、血液系统疾病及免疫性疾病等[21]。因此,脾脏指数的测定对于氧化损伤和抗氧化的评估有重要意义。本实验中,衰老阴性对照组大鼠的脾脏指数显著下降,桑葚浓缩汁低、中、高剂量组大鼠的脾脏指数均有不同程度的增加,其中以高剂量组效果最好,已达到正常对照组和阳性对照组的水平,提示桑葚浓缩汁可缓解脾细胞衰老,保护脾脏的组织结构和功能,增强机体抗病能力。
炎症细胞因子主要包括促炎细胞因子TNF-α、IL-6和抗炎细胞因子IL-4、IL-10等,这些细胞因子的内分泌调节功能在脾脏免疫功能中发挥着重要的作用[22]。促炎与抗炎网络失衡可影响机体内环境稳定,使免疫功能紊乱甚至低下,导致炎性衰老,从而引发多种衰老相关性疾病[23],如动脉粥样硬化、帕金森病、心脏病等[24]。研究表明,促炎细胞因子如TNF-α、IL-6等水平升高会使机体维持高促炎症反应状态,当组织器官长时间处于这种炎性环境中时,就会导致衰老及与衰老相关的并发症的发生[25-26]。本实验中,阴性对照组D-Gal大鼠的促炎因子TNF-α、IL-6水平较正常对照组明显升高,桑葚浓缩汁处理后的大鼠,两者表达水平都有所下降,提示桑葚浓缩汁可抑制促炎因子表达,减轻炎症反应。
Caspase是一组存在于细胞质中含有半胱氨酸的天冬氨酸蛋白水解酶[27],包含两大家族:起始Caspase和执行Caspase,两大蛋白家族通过内外多种因子的复杂作用被激活,经过级联反应使细胞解体,最终导致细胞凋亡[28]。Caspase-9是细胞凋亡的启动性蛋白酶,位于Caspase级联反应的上游,可在外来蛋白辅助因子的作用下被切割激活,通过自我活化再激活其下游的Caspase-3,它可通过裂解特异性底物使细胞凋亡得以完成[29]。本实验中,阴性对照组Caspase-9、Caspase-3的表达均有明显增高,说明D-Gal诱导大鼠氧化损伤后存在细胞凋亡,桑葚浓缩汁处理后,两者的表达均有降低,特别是中、高剂量组2种蛋白的表达都明显降低,这表明桑葚浓缩汁可通过抑制凋亡级联通路中Caspase-9、Caspase-3活性的表达,减少脾细胞凋亡,从而减轻D-Gal所致大鼠脾脏的氧化损伤。脾脏HE染色实验也证实,桑甚浓缩汁处理组大鼠脾脏病变有明显改善,白髓淋巴小结均有不同程度的增加,生发中心明显,脾窦和脾索结构无明显异常,提示桑葚浓缩汁可提高大鼠脾脏的免疫功能。李海杰[30]和Gorąca[31]等也发现具有抗氧化功效的物质可改善大鼠脾脏组织形态及其衰老的变化。
桑葚具有广泛的生理功能,如清除自由基、抗癌作用、抗动脉粥样硬化、抗高脂血症[32-33]。江岩等[34]通过测定药桑葚花青素烷基自由基、羟自由基、超氧阴离子自由基和DPPH自由基的清除能力,分析了其体外抗氧化作用,并与白桑葚、黑桑葚花青素的体外抗氧化作用进行比较,结果发现,桑葚清除自由基能力与花青素含量呈正相关。Bao Tao等[35]用高效液相色谱法和质谱分析了桑葚中多酚成分主要有矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷、芦丁和槲皮素,而且桑葚的抗氧化活性与其含有的酚类物质密切相关。可见,桑葚含有总酚、黄酮、东莨菪素、花青素多种抗氧化成分,本研究中桑葚浓缩汁之所以能够对D-Gal所致衰老大鼠脾脏有保护作用,可能是由于桑葚各种不同的抗氧化成分之间存在相互补充、互相协调的关系,在体内通过作用于抗氧化和氧化酶系统,降低促炎细胞因子的表达,影响Caspase家族基因表达等多种途径联合发挥抗氧化、防衰老作用。
综上所述,桑葚浓缩汁可以减轻大鼠脾脏的氧化损伤,具体表现为增加抗氧化酶T-SOD、GSH-Px、CAT的活力,降低MDA含量及TNF-α、IL-6水平,减少Caspase-9、Caspase-3的表达,明显提高脾脏指数。此外,组织病理学切片也证实桑葚浓缩汁可以改善D-Gal诱导的大鼠脾脏损伤,对增强免疫力、缓解机体衰老有良好的促进作用。
[1] 张翠利, 付丽娜, 杨小云, 等. 活性氧自由基与细胞衰老关系的研究进展[J]. 广州化工, 2015, 43(19): 5-7.
[2] 殷晓煌. 活性氧自由基与老年疾病代谢的关系[J]. 药物生物技术,2013, 20(2): 183-185.
[3] 彭新颜, 孟婉静, 周夕冉, 等. 蓝点马鲛鱼皮抗氧化肽段对熟肉糜脂肪和蛋白氧化抑制作用的研究[J]. 水产学报, 2015, 39(11):1730-1741. DOI:10.11964/jfc.20150409830.
[4] CHEN Chun, YOU Lijun, ARSHADMA, et al. Optimization for ultrasound extraction of polysaccharides frommulberryfruits with antioxidant and hyperglycemic activity in vitro[J]. Carbohydrate Polymers, 2015, 130: 122-132.DOI:10.1016/j.carbpol.2015.05.003.
[5] 范金波, 蔡茜彤, 冯叙桥, 等. 桑葚、蓝莓、黑加仑中多酚类物质的抗氧化活性[J]. 食品与发酵工业, 2015, 41(2): 157-162.DOI:10.13995/j.cnki.11-1802/ts.201502027.
[6] LIN C Y, HORNG L L. Characteristics of fruit growth, component analysis and antioxidant activity of mulberry (Morus spp.)[J]. Scientia Horticulturae, 2013, 162: 285-292. DOI:10.1016/j.scienta.2013.08.009.
[7] 邓秀婷, 罗姮, 李彦彬, 等. 桑葚提取液对D-半乳糖致衰老小鼠抗氧化能力的影响[J]. 中国老年学杂志, 2016, 36(1): 36-37.
[8] LIU Huan, YANG Jie, HUANG Shaowen, et al. Mulberry crude extracts induce Nrf2 activation and expression of detoxifying enzymes in rat liver: implication for its protection against NP-induced toxic effects[J]. Journal of Functional Foods, 2017, 32: 367-374.DOI:10.1016/j.jff.2017.03.024.
[9] LI Yuxian, YANG Zhonghan, JIA Shanshan, et al. Protective effect and mechanism of action of mulberry marc anthocyanins on carbon tetrachloride-induced liver fibrosis in rats[J]. Journal of Functional Foods, 2016, 24: 595-601. DOI:10.1016/j.jff.2016.05.001.
[10] JIANG Yan, DAI Min, NIE Wenjing, et al. Effects of the ethanol extract of black mulberry (Morusnigra L.) fruit on experimental atherosclerosis in rats[J]. Journal of Ethnopharmacology, 2017, 200:228-235. DOI:10.1016/j.jep.2017.02.037.
[11] EBERHARDT M V, LEECY, LIU R H. Nutrition: antioxidant activity of fresh apples[J]. Nature, 2000, 405: 903-904. DOI:10.1038/35016151.
[12] 吕春玲, 姜绍通, 沈鸿, 等. 浓缩对桑葚汁营养品质的影响[J]. 饮料工业, 2015, 18(5): 8-13; 19. DOI:10.3969/j.issn.1007-7871.2015.05.002.
[13] 彭新颜, 孔保华, 熊幼翎. 乳清多肽对D-半乳糖衰老模型大鼠血清和脏器组织抗氧化效果的影响[J]. 食品科学, 2010, 31(9): 238-242.
[14] 范桢亮, 朱凯浩, 李标, 等. 不同浓度仙鹤草水煎液对免疫抑制小鼠脾指数、白细胞计数影响的实验研究[J]. 慢性病学杂志, 2016,17(1): 41-43; 47. DOI:10.16440/j.cnki.1674-8166.2016.01.013.
[15] DU Z D, YANG Q, LIU L, et al. NADPH oxidase 2-dependent oxidative stress, mitochondrial damage and apoptosis in the ventral cochlear nucleus of D-galactoseinduced aging rats[J]. Neuroscience,2015, 286: 281-292. DOI:10.1016/j.neuroscience.2014.11.061.
[16] ZHANG Zhengqing, GUO Ruijian, LI Menglou. Identification,characterization and expression analysis of superoxide dismutase genes in Dastarcus helophoroides (Coleoptera: Bothrideridae)[J].Gene, 2017, 606: 25-34. DOI:10.1016/j.gene.2017.01.003.
[17] ORHAN A, MUSTAFA N, HATICE A. Different doses of dexmedetomidine reduce plasma cytokineproduction, brain oxidative injury, PARP and caspase expression levelsbut increase liver oxidative toxicity in cerebral ischemia-induced rats[J]. Brain Research Bulletin,2017, 130: 1-9. DOI:10.1016/j.brainresbull.2016.12.005.
[18] SHEN Yingbin, ZHANG Hui, CHENG Liling, et al. In vitro and in vivo antioxidant activity of polyphenols extractedfrom black highland barley[J]. Food Chemistry, 2016, 194: 1003-1012. DOI:10.1016/j.foodchem.2015.08.083.
[19] LIN Lin, CUI Fangyuan, ZHANG Jianjun, et al. Antioxidative and renoprotective effects of residue polysaccharides from Flammulina velutipes[J]. Carbohydrate Polymers, 2016, 146: 388-395.DOI:10.1016/j.carbpol.2016.03.071.
[20] KATARZYNAB, JACEKW, JOANNA H, et al. Impact of low and high molecular weight oat beta-glucan on oxidative stress and antioxidant defense in spleen of rats with LPS induced enteritis[J]. Food Hydrocolloids, 2015, 51: 272-280. DOI:10.1016/j.foodhyd.2015.05.025.
[21] 杨伟力, 李军宅. 肋单元法与脾指数法评估脾脏大小的比较[J]. 中国当代医药, 2014, 21(2): 129-131.
[22] KEDAR N P, WU M X, STEPHEN C B. Telomere shortening during aging: attenuation by antioxidants and anti-inflammatory agents[J].Mechanisms of Ageing and Development, 2017, 164: 61-66.DOI:10.1016/j.mad.2017.04.004
[23] 夏世金, 孙涛, 郑松柏, 等. 炎性衰老的研究[J]. 成都医学院学报,2012, 7(3): 336-343.
[24] GAO Q, CAMOUS X, LU Y X, et al. Novelinflammatory markers associated with cognitive performance: Singapore longitudinal ageing studies[J]. Neurobiology of Aging, 2016, 39: 140-146. DOI:10.1016/j.neurobiolaging.2015.12.002.
[25] XIA W L, GENG K Y. A sirtuin activator and an anti-inflammatory moleculemultifaceted roles of adjudin and its potential applications foraging-related diseases[J]. Seminars in Cell & Developmental Biology, 2016, 59: 71-78. DOI:10.1016/j.semcdb.2016.07.020.
[26] TUSHAR S, ANNE B N. Inflammatory markers in population studies of aging[J]. Ageing Research Reviews, 2011, 10(3): 319-329.DOI:10.1016/j.arr.2010.11.002.
[27] JEREMY W D, ZHANG X, WANG N P, et al. Binge ethanol exposure increases the Krüppel-like factor 11-monoamine oxidase (MAO)pathway in rats: examining the use of MAO inhibitors to prevent ethanol-induced brain injury[J]. Neuropharmacology, 2016, 105: 329-340. DOI:10.1016/j.neuropharm.2016.01.024.
[28] ZHU Y F, ZHAO Q P, GAO H, et al. Lycium barbarum polysaccharides attenuates N-methy-N-nitrosoureainduced photoreceptor cell apoptosis in rats through regulation of poly (ADP-ribose) polymerase and caspaseexpression[J]. Journal of Ethnopharmacology, 2016, 191: 125-134. DOI:10.1016/j.jep.2016.05.037.
[29] ALEXEY V Z, GELINA S K, EVGENIIA A P, et al. Post-translational modification of caspases: the other side of apoptosis regulation[J].Trends in Cell Biology, 2017, 27: 322-339. DOI:10.1016/j.tcb.2017.01.003.
[30] 李海杰, 冯翠萍, 常明昌, 等. 姬松茸多糖对染铅大鼠脾脏组织形态及细胞因子mRNA表达的影[J]. 营养学报, 2013, 35(2): 176-180.
[31] GORĄCA A, HUK-KOLEGA H, KLENIEWSKA P, et al. Effects of lipoic acid on spleen oxidative stress after LPS administration[J].Pharmacological Reports, 2013, 65(1): 179-186. DOI:10.1016/S1734-1140(13)70976-9.
[32] 李冬香, 陈清西. 桑葚功能成份及其开发利用研究进展[J]. 中国农学通报, 2009, 25(24): 293-297.
[33] JIN Y L, CHING Y T. Strawberry, loquat, mulberry, and bitter melon juices exhibit prophylactic effectson LPS induced inflammation usingmurine peritoneal macrophages[J]. Food Chemistry, 2008,107(4): 1587-1596. DOI:10.1016/j.foodchem.2007.10.025.
[34] 江岩, 郑力, 克热木·江吐尔逊江. 药桑葚花青素的体外抗氧化作用[J].食品科学, 2011, 32(13): 45-48.
[35] BAO Tao, XU Yang, VEMANA G, et al. Systematic study on phytochemicals andantioxidant activity of some new and common mulberry cultivars in China[J]. Journal of Functional Foods, 2016, 25:537-547. DOI:10.1016/j.jff.2016.07.001.
Protective Effect of Mulberry Juice Concentrate on D-Galactose-Induced Oxidative Damage in Spleen of Rats
LIU Yafei1, PENG Xinyan1,*, HE Hongjun2, JIN Chengwu1, SU Shufei1, YANG Xiaoshuai1
(1. College of Food Engineering, Ludong University, Yantai 264025, China;2. College of Life Sciences, Yantai University, Yantai 264005, China)
The intention of this study was to explore the protective effect of mulberry juice concentrate (MJC) on D-galactose-induced damage in the rat spleen. A rat model of aging was induced by D-galactose. Wistar rats were randomly divided into 6 groups: normal control, model, positive control (VE), and low-, medium- and high-dose MJC treatment groups. The activities of total superoxide dismutase (T-SOD), glutathione peroxidase (GSH-Px) and catalase (CAT), and malondialdehyde (MDA) level of spleen homogenate were measured by using test kit. The levels of tumour necrosis factor-α(TNF-α) and interleukin-6 (IL-6) in serum were determined; the spleen index and the expression levels of caspase-9 and caspase-3 were measured as well. Moreover, histomorphological examination was performed to evaluate the effect of MJC on oxidative damage in the rat spleen. The results showed that compared to the model group, the medium- and high-dose MJC groups could improve the activity of T-SOD, GSH-Px and CAT in spleen tissue (P < 0.05). MJC at all three doses decreased MDA level (P < 0.05) and TNF-α and IL-6 expression levels, and increased spleen index. High-dose MJC could signif i cantly increased T-SOD, GSH-Px and CAT activity to 113.22, 90.17 and 7.67 U/mg protein, decreased MDA level to 13.59 nmol/mg, and enhanced spleen index to 4.12 mg/g compared to the model group, all of which reached the levels of the normal control group and positive control group (P > 0.05). In addition, the expression levels of TNF-α and IL-6 in thehigh-dose group were decreased to 56.95 and 76.83 pg/mL. The results of immunohistochemistry showed that the expression of caspase-9 and caspase-3 was attenuated by MJC at all doses, and the best effect was found at high dose. Hematoxylin and eosin staining also indicated that MJC could protect spleen structure, increase the number of lymphocytes and improve hyperemia. These results showed that mulberry juice concentrate has a signif i cant protective effect on oxidative damage in the spleen of rats.
mulberry juice concentrate; D-galactose; oxidative damage; spleen
10.7506/spkx1002-6630-201801029
TS201.4
A
1002-6630(2018)01-0192-08
刘亚飞, 彭新颜, 贺红军, 等. 桑葚浓缩汁对D-半乳糖诱导氧化损伤大鼠脾脏的保护作用[J]. 食品科学, 2018, 39(1):192-199.
10.7506/spkx1002-6630-201801029. http://www.spkx.net.cn
LIU Yafei, PENG Xinyan, HE Hongjun, et al. Protective effect of mulberry juice concentrate on D-galactose-induced oxidative damage in spleen of rats[J]. Food Science, 2018, 39(1): 192-199. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801029. http://www.spkx.net.cn
2017-06-01
国家自然科学基金青年科学基金项目(31401491);城新创新奖学金项目;大学生创新创业训练计划项目
刘亚飞(1994—),女,本科生,研究方向为天然产物功能因子。E-mail:1633212456@qq.com
*通信作者简介:彭新颜(1976—),女,副教授,博士,研究方向为天然产物功能因子。E-mail:pengxinyan2006@163.com
