副干酪乳杆菌N1115发酵乳对小鼠便秘的改善作用
2018-01-08曹永强梅雪洋王世杰杨贞耐
曹永强,张 健,郑 喆,梅雪洋,王世杰,朱 宏,杨贞耐,*
(1.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048;2.食品质量与安全北京实验室,北京工商大学,北京 100048;3.石家庄君乐宝乳业有限公司,河北 石家庄 050221)
副干酪乳杆菌N1115发酵乳对小鼠便秘的改善作用
曹永强1,2,张 健1,2,郑 喆1,2,梅雪洋1,2,王世杰3,朱 宏3,杨贞耐1,2,*
(1.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048;2.食品质量与安全北京实验室,北京工商大学,北京 100048;3.石家庄君乐宝乳业有限公司,河北 石家庄 050221)
本研究基于盐酸咯哌丁胺建模制造小鼠便秘模型,考察副干酪乳杆菌 N1115发酵乳对治疗小鼠便秘的作用。低、中、高剂量副干酪乳杆菌N1115发酵乳(活菌含量分别为1×107、1×108、1×109CFU/mL)连续灌胃15 d后,与对照组相比小鼠的排便量及粪便含水量均显著升高(P<0.05);肠道推进率分别为57.3%、67.3%和71.3%,显著高于对照组(P<0.05)。气相色谱仪分析小鼠粪便中的短链脂肪酸发现,灌胃副干酪乳杆菌N1115发酵乳后,小鼠粪便中的乙酸、丙酸、丁酸、戊酸含量显著升高(P<0.05),且短链脂肪酸种类较模型组更为丰富。对小鼠远端结肠的组织形态观察发现,灌胃副干酪乳杆菌N1115发酵乳的小鼠结肠黏膜完整,细胞排列整齐,而对照组的肠黏膜厚度降低,凹窝变浅。通过c-kit抗体对小鼠结肠中的肠间质细胞(interstitial cells of Cajal,ICC)进行免疫组化分析,结果显示,灌胃副干酪乳杆菌N1115发酵乳后小鼠的ICC含量显著增加,表明副干酪乳杆菌N1115发酵乳通过提高ICC活性,促进肠道蠕动。综上,副干酪乳杆菌N1115发酵乳能够有效缓解小鼠的便秘症状。
副干酪乳杆菌;发酵乳;便秘;短链脂肪酸
便秘是临床的常见疾病,其发病机理及症状存在个体差异,常见的治疗方法多以调养为主,其中益生菌在治疗便秘方面具有突出的疗效,是近年来临床上常用的治疗便秘的调节剂[1]。益生菌能够定殖在人体肠道中,可以通过直接或者间接的方式调整肠道的菌群结构,同时还可避免药物治疗带来的副作用。益生菌主要包括乳杆菌[2]、双歧杆菌[3]、革兰氏阳性球菌[4]等,其中乳杆菌中的副干酪乳杆菌(Lactobacillus paracasei)广泛存在于奶酪、泡菜等发酵食品,具有悠久的食用历史,为食源安全性菌株[5]。副干酪乳杆菌可黏附于肠黏膜而阻止病原微生物的黏附,在肠道内具有较好的生存能力,具有润肠、抑制有害菌生长、维持肠道菌群平衡、降低胆固醇、增强机体免疫力等多种保健功能[6-7]。Picard等[8]研究表明,副干酪乳杆菌在发酵过程中能够提高肠道内短链脂肪酸(shortchain fatty acid,SCFA)的浓度、降低肠道整体pH值、缩短肠道转运时间,从而起到缓解便秘的作用。
对于副干酪乳杆菌缓解便秘的研究,大部分是基于菌株自身的理化特性,而关于该菌株发酵乳对便秘改善效果的研究还鲜见报道[9]。通过发酵乳研究菌株的特性能够更加真实地反映菌株在乳制品中的作用,具有一定的应用价值。本研究基于一株分离自传统发酵乳制品的副干酪乳杆菌N1115,前期研究表明,该菌株具有耐酸、耐胆盐、促进肠道细胞生长等益生作用[10-11]。通过该菌株发酵脱脂乳,采用发酵乳灌胃便秘小鼠模型,研究其对小鼠便秘的改善作用,以期为益生菌发酵乳改善人体便秘的应用提供参考依据,并为该菌株发酵乳的开发提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性昆明小鼠60 只,6 周龄,平均体质量为30 g左右,由斯贝福(北京)生物技术有限公司提供。
乙醚、盐酸咯哌丁胺、苏木红染料、活性炭、甲醛、伊红、盐酸、苏木精、冰醋酸、氯化钠(均为分析纯) 国药集团化学试剂有限公司;L. paracasei N1115菌粉(NCBI 参考序列:NZ_CP007123.1,食品级) 石家庄君乐宝乳业有限公司;脱脂乳粉(食品级) 新西兰恒天然乳品有限公司;MABF360 c-kit抗体 德国达姆施塔特默克集团。
1.2 仪器与设备
MLS-3750高压蒸汽灭菌器 日本三洋公司;FE20 pH计 梅特勒-托利多(上海)仪器有限公司;7890B气相色谱(gas chromatograph,GC)仪 美国安捷伦科技有限公司;CR21Ⅲ离心机 日本Hitachi公司;BX53显微镜 日本Olympus公司。
1.3 方法
1.3.1 溶液的配制
脱脂乳培养基:去离子水1 L、葡萄糖20.0 g、脱脂乳粉12 g,搅拌均匀后置于95 ℃灭菌15 min。
活性炭溶液:阿拉伯胶100 g,去离子水800 mL,混匀,煮沸至溶液透明,再准确加入50 g粉状活性炭,连续煮沸3 次,冷却后,加水定容至1 000 mL,4 ℃冷藏,使用前需摇匀。
1.3.2 副干酪乳杆菌N1115发酵乳的制备
向100 mL巴氏杀菌脱脂乳培养基中接种副干酪乳杆菌N1115直投式发酵剂,42 ℃发酵至终pH值降至4.5,活菌含量为1×109CFU/mL,发酵液用相同浓度的脱脂乳培养基稀释至1×107、1×108CFU/mL,同时用平板菌落计数法确定具体的副干酪乳杆菌N1115活菌含量。4 ℃贮藏,使用前37 ℃预热5 min。
1.3.3 动物实验分组及模型的建立
实验前稳定饲养小鼠1 周,控制动物房温度25℃、相对湿度50%,昼夜时间分明,不禁食不禁水。将小鼠分成3 组,分别为空白组、对照组、实验组各30 只,实验组又分为副干酪乳杆菌N1115发酵乳低(1×107CFU/mL)、中(1×108CFU/mL)、高(1×109CFU/mL)剂量组各10只。灌胃对照组和实验组小鼠盐酸洛哌丁胺5 mg/kg(以体质量计,下同),早09∶00、晚18∶00各一次,连续灌胃7 d,构造便秘模型。以排便量减少、粪便干硬、毛发粗糙、精神不振为小鼠便秘的判断指标。空白组灌胃等量的生理盐水。造模成功后,空白组、对照组分别给予灭菌的质量分数12%的脱脂乳,实验组分别给予低、中、高3 个剂量组的副干酪乳杆菌N1115发酵乳,灌胃量10 mg/(kg·d),连续灌胃15 d。
1.3.4 粪便指标的测定
实验过程中记录小鼠灌胃1、5、10、15 d的体质量变化,同时记录末次灌胃后小鼠的进食和饮水量,收集6 h内所有的新鲜粪便,置于带盖离心管中,记录总质量和粪便数量。将每组小鼠的粪便样品均匀的分成3 份,1 份用来测定粪便含水率,另2 份用来测定SCFA含量和pH值。
1.3.4.1 粪便含水量的测定
准确称量新鲜小鼠粪便质量(m1),置于105 ℃烘箱中烘干至恒质量(m2),按公式(1)计算粪便含水量。
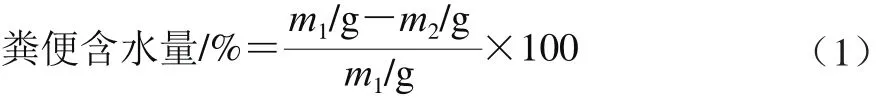
1.3.4.2 粪便SCFA含量的测定
准确称取100 mg粪便样品,加入0.9 mL 0.01 mol/L磷酸盐缓冲液(phosphata buffered saline,PBS)充分溶解,加入1/6体积的质量分数为50%硫酸混匀后,再加入1 mL乙醚,振荡10 min,3 000 r/min离心5 min,取乙醚层,加入无水氯化钙除去水分,取2 μL样品用于GC测定[16]。
1.3.4.3 粪便pH值的测定
将一定质量的小鼠新鲜粪便制成质量分数为10%的悬浊液,溶剂为去离子水,使用pH计测定悬浊液pH值。
1.3.5 肠道推进率的测定
在动物实验期最后一天(第15天),小鼠禁食不禁水12 h后,分别对空白组、对照组、实验组小鼠灌胃1 mL墨汁,准确计时30 min后脱颈椎处死小鼠,解剖腹腔剪取上端自幽门、下端至回盲肠部的肠管,置于白板上,喷洒无菌水以防止小肠黏结,轻轻将小肠拉成直线,测量肠管总长度(L1),从幽门至墨汁前沿为墨汁推进长度(L2),按公式(2)计算肠道推进率。

1.3.6 远端结肠组织微观结构观察
脱颈处死小鼠并解剖,取远端结肠1 cm,放入10%中性甲醛溶液浸泡保存,做常规切片,光学显微镜下观察并拍照。
1.3.7 免疫组化实验
组织切片依次用二甲苯、乙醇溶液和去离子水冲洗脱蜡,复水并静置一段时间后加入3% H2O2浸泡10 min以除去内源性的过氧化氢酶,去离子水清洗后再加入柠檬酸盐缓冲液,微波炉95 ℃加热10 min使抗体复性,水洗2 次后浸入PBS冲洗,擦干载玻片周围PBS后立即滴加血清,置于37 ℃恒温箱中0.5 h进行血清封闭。取出载玻片擦干组织周围血清,滴加一抗c-kit(1∶200),37 ℃孵化2 h,PBS洗涤2 次,擦干组织周围缓冲液,滴加生物素共轭二次抗体,37 ℃孵化30 min,取出后PBS洗涤3 次,擦干周围PBS,滴加链霉亲和素-生物素复合物,37 ℃恒温箱中孵化30 min,取出后PBS清洗3 次,擦干周围PBS,加DAB染色,显色后将染片用清水冲洗,浸泡于苏木精中复染,复染后的染片依次用去离水、乙醇、二甲苯脱水,最后用中性树胶封片,通过显微镜拍照,图像通过Image Pro Plus软件处理。
1.4 数据统计分析
实验样品3 组平行,结果取平均值,以 ±s表示,SPSS 20.0软件进行数据统计及方差分析。
2 结果与分析
2.1 小鼠体质量、进食量和饮水量变化
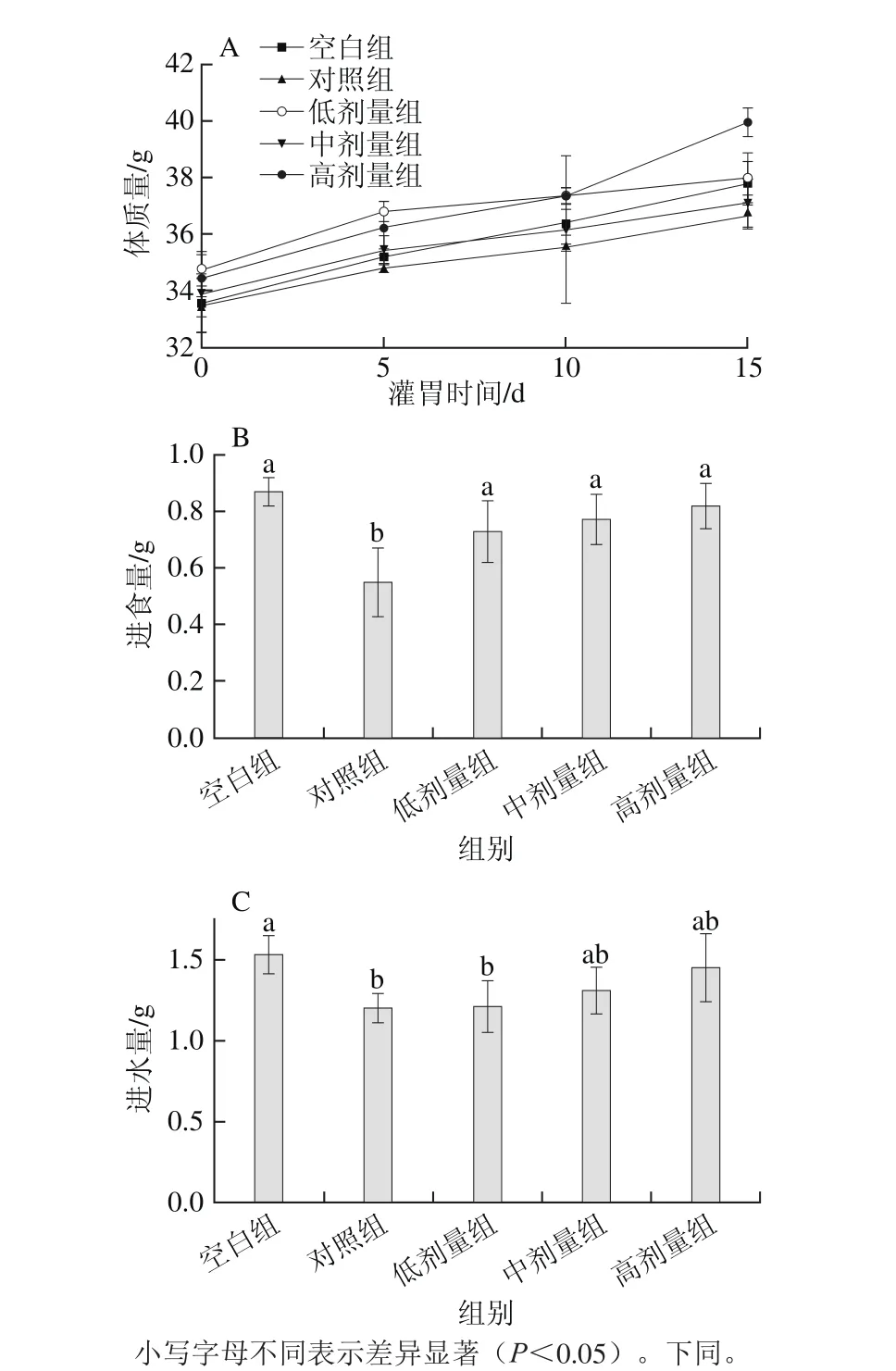
图1 副干酪乳杆菌N1115发酵乳对小鼠体质量(A),末次灌胃后小鼠进食量(B)、进水量(C)的影响Fig. 1 Effect of L. paracasei N1115 fermented milk on body weight (A),food intake (B), and water intake (C) in mice after the last administration
由图1A可知,总体上所有组别小鼠在实验过程中的体质量均呈现上升的趋势。此外,虽然对照组小鼠的体质量略低于其他组,但是各组小鼠的体质量均无显著差异(P>0.05)。从图1B可以看出,末次灌胃后各组小鼠进食量之间存在差异,其中,对照组在实验中的进食量最低(P<0.05),此外,各实验组小鼠之间的进食量之间无显著差异(P>0.05)。从图1C还可看出,各组小鼠饮水量之间差异不显著(P>0.05)。
2.2 小鼠肠道推进率变化
从图2可以看出,空白组和实验组皆与对照组之间存在显著差异(P<0.05),其中空白组的肠道推进率最高为73.6%,对照组的肠道推进率最低为49.3%,而实验组中的肠道推进率皆显著高于对照组(P<0.05),分别为57.3%、67.3%和71.3%,并且随着副干酪乳杆菌N1115发酵乳菌数的提高,肠道推进率也逐渐提高。
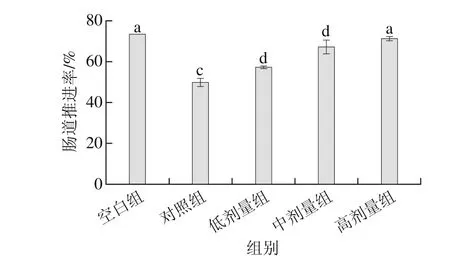
图2 副干酪乳杆菌N1115发酵乳对小鼠肠道推进率的影响Fig. 2 Effect of L. paracasei N1115 fermented milk on intestinal propulsion in mice
2.3 末次灌胃后小鼠粪便指标分析结果
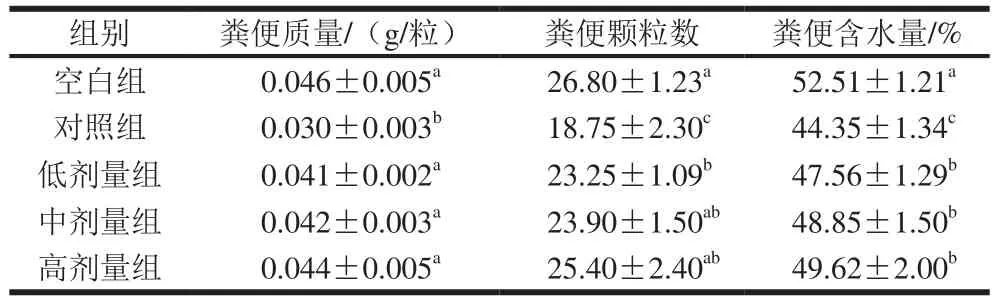
表1 副干酪乳杆菌N1115发酵乳对末次灌胃后小鼠排便量及粪便含水量的影响Table 1 Effect of L. paracasei N1115 fermented milk on fecal parameters in mice after the last intragastric administration
收集小鼠在灌胃后6 h内的粪便,对空白组、对照组、实验组小鼠的粪便分别计数、称质量,测定粪便含水量,结果由表1可知,对照组与空白组之间各指标均存在显著差异(P<0.05),其小鼠粪便质量最低,为0.030 g/粒。实验组小鼠粪便质量之间无显著性差异(P>0.05),但是均显著高于对照组(P<0.05)。小鼠粪便颗粒数中对照组最小,为18.75 粒,空白组和实验组均显著高于对照组(P<0.05)。空白组、对照组、实验组之间粪便含水量存在显著性差异,其中对照组的粪便含水量较少,粪便比较干燥,而空白组粪便含水量最高,为52.51%。实验组之间不存在显著差异(P>0.05),但是均显著高于对照组(P<0.05)。
2.4 小鼠粪便pH值变化
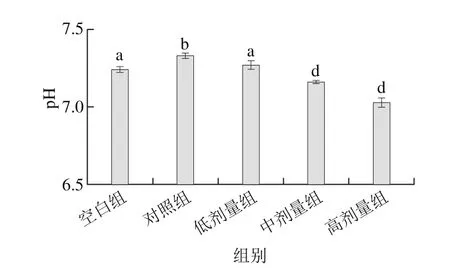
图3 副干酪乳杆菌N1115发酵乳对小鼠粪便pH值的影响Fig. 3 Effect of L. paracasei N1115 fermented milk on pH in mice feces
从图3中可以看出,空白组和实验组皆与对照组之间存在显著差异(P<0.05),其中对照组的小鼠粪便pH值最高,为7.33,高于所有实验组。随着副干酪乳杆菌N1115发酵乳活菌含量的增加,实验组小鼠粪便pH值从低剂量组到高剂量组呈现逐渐降低的趋势,且均显著低于对照组的pH值(P<0.05)。
2.5 小鼠粪便SCFA种类及含量
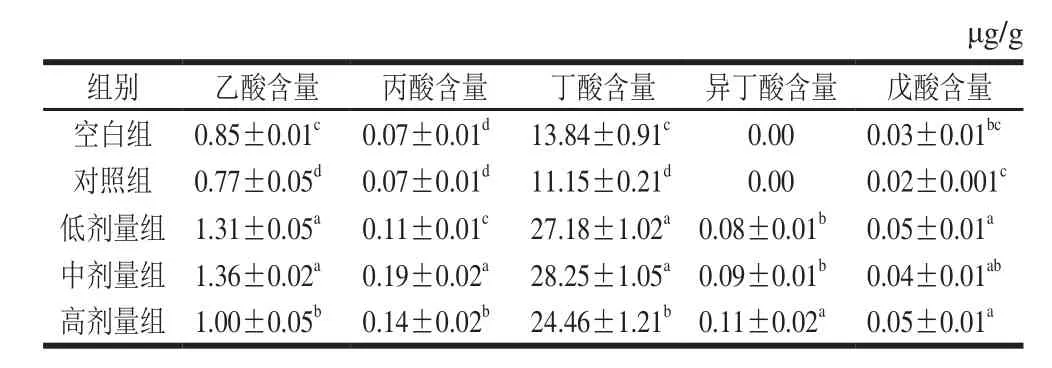
表2 副干酪乳杆菌N1115发酵乳小鼠粪便中SCFA含量的影响Table 2 Effect of L. paracasei N1115 fermented milk on SCFA contents in mice feces
小鼠粪便中的SCFA种类及含量的变化由表2可知,对照组小鼠粪便中的主要SCFA为乙酸、丙酸、丁酸和戊酸,其含量均显著低于其他组别(P<0.05)。此外,实验组中乙酸、丁酸、丙酸和戊酸的含量均显著高于空白组和对照组(P<0.05)。另外,实验组的小鼠粪便中还含有异丁酸,该酸在对照组和空白组中均不存在。
2.6 小鼠远端结肠组织微观结构观察
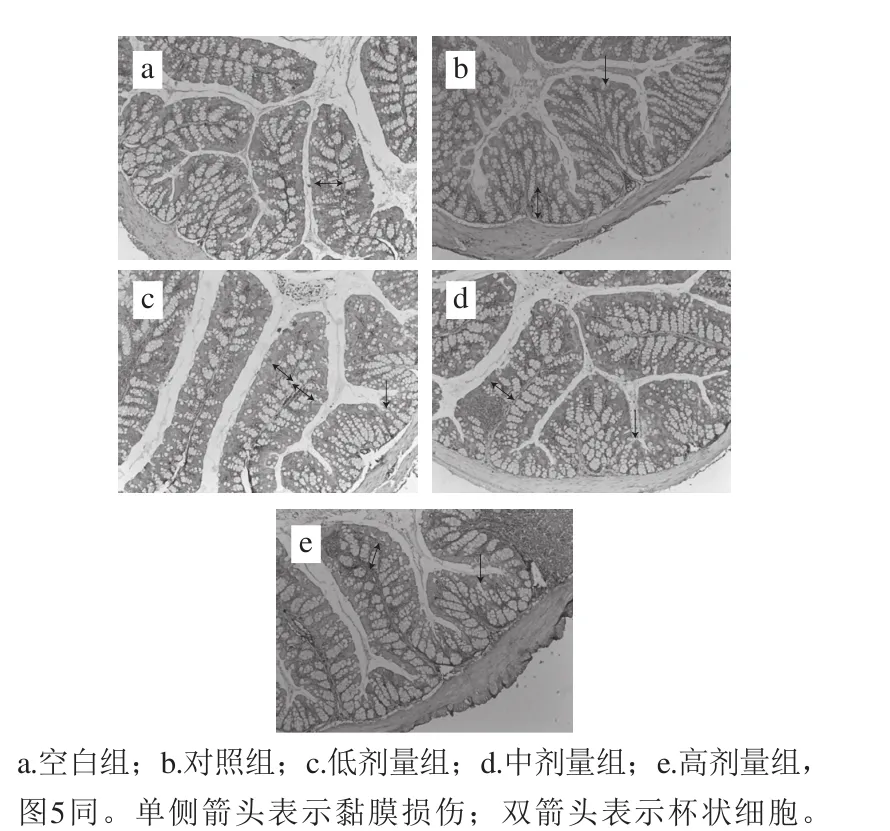
图4 副干酪乳杆菌N1115发酵乳对小鼠远端结肠组织微观结构的影响(×100)Fig. 4 Effect of L. paracasei N1115 fermented milk on microstructure of distal colon tissue in mice (× 100)
通过组织切片可更好地观察不同组小鼠的肠道微观结构,小鼠的远端结肠组织经过石蜡包埋后切片,染色后的结肠组织横截面的显微图如图4所示。空白组的结肠黏膜的上皮完整,未见萎缩、糜烂、坏死,细胞排列整齐,其间散落分布杯状细胞,绒毛丰富,符合健康状态下小鼠肠道黏膜的形态特征。然而,盐酸咯哌丁胺导致小鼠便秘后,其结肠组织会受到相应的影响。从图4b可以看出,黏膜上皮细胞发生脱落,造成黏膜表面形成凹型缺陷,小肠黏膜细胞排列不均一,杯状细胞的数量有所下降。进一步研究发现,当灌胃副干酪乳杆菌N1115发酵乳后,便秘组的小鼠的肠道黏膜形态学特征会有一定程度的恢复。从图4c~e可以看出,随着发酵乳中干酪乳杆菌N1115发酵乳菌数的增加,小鼠结肠组织的细胞排列越来越均匀,褶皱深度逐渐加深,高剂量组的结肠特征与空白组的结肠特征接近。
2.7 免疫组化分析
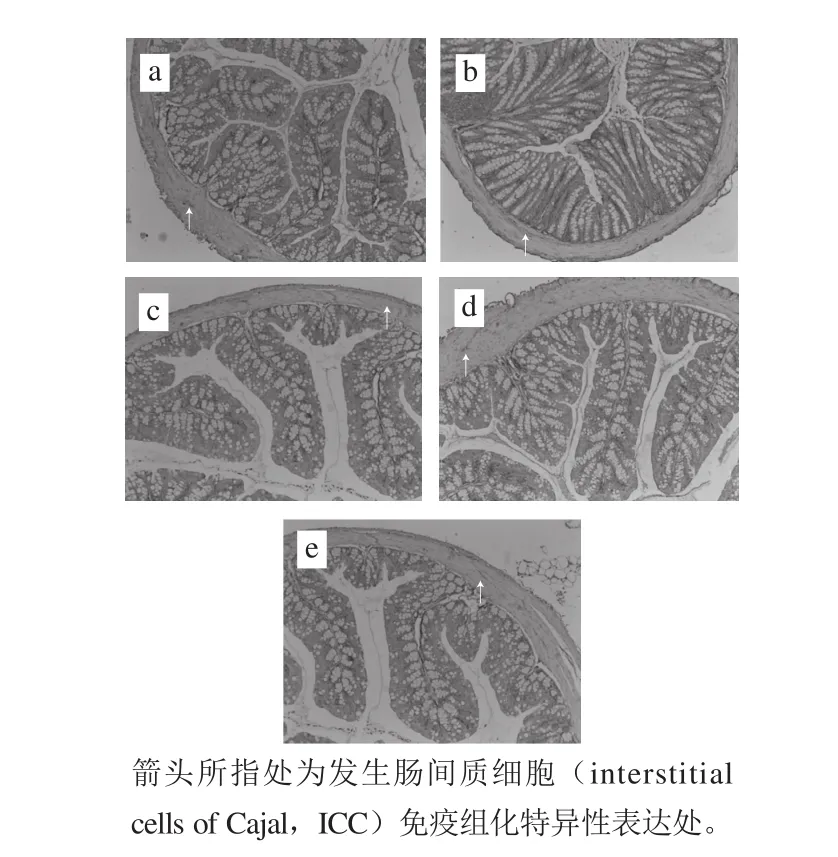
图5 副干酪乳杆菌N1115发酵乳对小鼠远端结肠免疫组化的影响(×100)Fig. 5 Effect of L. paracasei N1115 fermented milk on immunohistochemical characteristics of ICC in the mouse distal colon (×100)
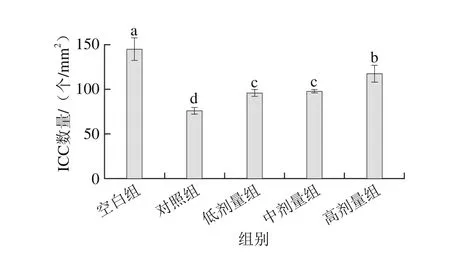
图6 副干酪乳杆菌N1115发酵乳对小鼠ICC数量的影响Fig. 6 Effect of L. paracasei N1115 fermented milk on the quantity of colonic ICC in mice
不同组小鼠结肠组织ICC含量可以通过与c-kit抗体特异性结合表达来量化,通过免疫组化染色得到各组ICC特异性表达的图片如图5所示,c-kit抗体结合ICC后会显棕黄色,各组ICC数量和活性存在一定的差异。为了更好地研究组间的差异,通过Image Pro Plus软件对经免疫组化处理后的ICC进行计数,结果如图6所示,空白组、对照阻和实验组单位面积内ICC数量存在显著差异(P<0.05)。其中,空白组单位面积内ICC数量最多,表明该组肠道平滑肌中的ICC数量较高,从图5a中也能看出其色泽较深,对照组的ICC数量显著低于空白组(P<0.05)。然而灌胃副干酪乳杆菌N1115发酵乳后,各实验组中各剂量组的ICC数量均显著高于对照组。此外,从图6可以看出,随着副干酪乳杆菌N1115发酵乳中菌含量增加,c-kit抗体特异性表达更显著。
3 结 论
采用灌胃盐酸咯哌丁胺建造小鼠便秘模型[12]。盐酸咯哌丁胺造模后导致小鼠便秘、食欲降低,表明盐酸咯哌丁胺造模成功[13]。本实验中,与空白组相比较,副干酪乳杆菌N1115发酵乳对小鼠的体质量及进食量、饮水量无显著影响。
小鼠肠道推进率是指消化物在单位时间内在肠道内推进的速率,是研究小鼠便秘情况的重要指标之一。小肠运动主要是通过蠕动力推动肠内容物运动。实验结果表明,发酵乳能够提高便秘小鼠的肠道推进率,能够有效地改善便秘问题。这可能存在两方面的原因:一是副干酪乳杆菌N1115可改善肠道菌群环境,刺激肠道蠕动,治疗便秘;另一原因可能是干酪乳杆菌N1115发酵乳中含有益生元,可促进肠道内菌群的生长与活动,改善便秘,这与周晓丹等[14]研究干酪乳杆菌LC-01促进肠道蠕动的实验结果一致。
粪便含水量表征粪便的干燥程度,粪便越干燥,表明小鼠便秘情况越严重。通过灌胃不同菌含量的副干酪乳杆菌N1115发酵乳,小鼠粪便数量和质量提高,表明干酪乳杆菌N1115发酵乳起到了一定的缓解便秘的作用。实验中,对照组便秘小鼠的粪便pH值偏高,通过灌胃副干酪乳杆菌N1115发酵乳后,肠道pH值降低,表明副干酪乳杆菌N1115发酵乳对小鼠便秘起到了一定的缓解作用,且随着菌含量的增高,其预防便秘的效果愈加显著。
研究表明,肠道SCFA是结肠杆菌的发酵杂多糖的终产物[15-16]。实验结果表明灌胃副干酪乳杆菌N1115发酵乳会影响小鼠粪便中SCFA的含量[17],其中,乙酸含量增加原因可能是由于乙酸积累。丁酸、丙酸、戊酸含量增加的原因可能有两方面,一方面,副干酪乳杆菌N1115会影响肠道菌群结构,影响肠道菌群产酸。副干酪乳杆菌N1115发酵乳中的益生元可促进肠道中结肠杆菌的生长代谢,促进其分解杂多糖产酸。另一方面,丁酸为肠道细胞的运动提供能量,促进肠道细胞的增殖,提高肠道动力,加快肠道蠕动速率[18]。实验结果表明通过灌胃副干酪乳杆菌N1115发酵乳,小鼠粪便中的SCFA种类发生变化,异丁酸对于促进小鼠肠道蠕动具有潜在的作用[19-20]。综上结果发现,通过灌胃副干酪乳杆菌N1115发酵乳导致小鼠粪便中SCFA含量和种类的变化会促进小鼠的肠道蠕动,从而缓解便秘状况。
Shimotoyodome等[21]研究发现,盐酸咯哌丁胺会损伤小鼠的结肠黏膜,一方面可能是由于副干酪乳杆菌N1115与肠道中有益菌的协同作用,促进其产生丁酸,丁酸可为小鼠的肠道细胞提供能量,促进肠道蠕动,同时,益生菌利用丁酸产生的丁酸钠还具有修复肠道黏膜,增加肠道绒毛长度的作用[22-23],这与上面研究小鼠粪便中的SCFA的结果相一致;另一方面,副干酪乳杆菌N1115发酵乳中的有机酸可能可以调节肠道菌群环境[24],曹山川等[25]在仔猪饲料中添加有机酸,仔猪的肠道绒毛会增加。高增兵等[26]研究发现,某些有机酸(如苯甲酸等)会修复肠道黏膜,调节肠道菌群环境,具有潜在的提高肠道菌群中双歧杆菌活性的能力。综上结果表明,副干酪乳杆菌N1115发酵乳能够有效抑制盐酸咯哌丁胺造成的小鼠结肠黏膜的持续恶化,修复小鼠肠道黏膜,提高肠道黏膜细胞的活性,对改善小鼠便秘起一定的作用。
研究发现,若ICC之间或其与平滑肌细胞之间的信号转导受到损伤,肠道的运动功能就会受到抑制[26]。灌胃盐酸咯哌丁胺后,小鼠产生便秘症状,肠道平滑肌中的ICC受到抑制,小鼠肠道蠕动速率降低。而灌胃副干酪乳杆菌N1115发酵乳后,ICC数量提高,肠道蠕动速率升高,表明副干酪乳杆菌N1115发酵乳对小鼠肠道ICC具有促进作用,这一方面可能是由于副干酪乳杆菌N1115的产酸特性导致的[27-28]。另一方面是肠道细胞的信号转导得到修复,活性提高导致的[29-30]。故推测副干酪乳杆菌N1115发酵乳对小鼠的肠间质细胞具有促进作用。
对于副干酪乳杆菌N1115发酵乳的功能特性研究表明,一方面其可提高便秘小鼠的肠道推进率,提高便秘小鼠的粪便质量、排便量及粪便中的含水量;另一方面,其影响粪便中SCFA的含量及种类,粪便中测到的异丁酸有利于促进肠道蠕动。另外,副干酪乳杆菌N1115会使小鼠粪便的pH值显著降低,实验结果显示,当活菌含量达到1×109CFU/mL时,这种改善效果更加显著。
对小鼠肠道远端结肠组织进一步的生理分析发现,随着发酵乳中副干酪乳杆菌N1115活菌含量的增加,小鼠结肠组织的细胞排列越来越均匀,褶皱深度逐渐加深,高剂量组的结肠特征与实验组的结肠特征接近。此外,实验组肠间质细胞ICC数量显著高于对照组。本研究结果表明,副干酪乳杆菌N1115发酵乳对小鼠便秘具有一定的改善作用。
[1] 赵先平, 肖新云, 蔡锐, 等. 便秘相关肠道微生物研究进展[J]. 中国微生态学杂志, 2014, 26(10): 1236-1240. DOI:10.13381/j.cnki.cjm.201410034.
[2] BU L N, CHANG M H, NI Y H, et al. Lactobacillus casei rhamnosus Lcr35 in children with chronic constipation[J]. Pediatrics International Off i cial Journal of the Japan Pediatric Society, 2007, 49(4): 485-490.DOI:10.1111/j.1442-200X.2007.02397.x.
[3] KATO K, MIZUNO S, UMESAKI Y, et al. Randomized placebocontrolled trial assessing the effect of bif i dobacteria-fermented milk on active ulcerative colitis[J]. Alimentary Pharmacology and Therapeutics,2004, 20(10): 1133-1141. DOI:10.1111/j.1365-2036.2004.02268.x.
[4] SACCHIDANAND S, PENN R L, EMBIL J M, et al. Efficacy and safety of tigecycline monotherapy compared with vancomycin plus aztreonam in patients with complicated skin and skin structure infections: results from a phase 3, randomized, double-blind trial[J].International Journal of Infectious Diseases, 2005, 9(5): 251-261.DOI:10.1016/j.jmii.2010.04.002.
[5] ZAGATO E, MILETI E, MASSIMILIANO L, et al. Lactobacillus paracasei CBA L74 metabolic products and fermented milk for infant formula have anti-inf l ammatory activity on dendritic cells in vitro and protective effects against colitis and an enteric pathogen in vivo[J].PLoS ONE, 2014, 9(2): 1-14. DOI:10.1371/journal.pone.0087615.
[6] CHIANG S S, PAN T M. Benef i cial effects of Lactobacillus paracasei subsp. paracasei NTU 101 and its fermented products[J]. Applied Microbiology and Biotechnology, 2012, 93(3): 903-916. DOI:10.1007/s00253-011-3753-x.
[7] ZHANG H, SUN J, LIU X T, et al. Lactobacillus paracasei subsp.paracasei LC-01 positively modulates intestinal microf l ora in healthy young adultes[J]. Journal of Microbiology, 2013, 51(6): 777-782.DOI:10.1007/212275-013-3279-2.
[8] PICARD C, FIORAMONTI J, FRANCOIS A, et al. Review article:bifidobacteria as probiotic agents-physiological effects and clinical benefits[J]. Alimentary Pharmacology & Therapeutics, 2005, 22(6):495-512. DOI:10.1111/j.1365-2036.2005.02615.x.
[9] REALE A, RENZO T D, ROSSI F, et al. Tolerance of Lactobacillus casei, Lactobacillus paracasei, and Lactobacillus rhamnosus, strains to stress factors encountered in food processing and in the gastrointestinal tract[J]. LWT-Food Science and Technology, 2014, 60(2):721-728.
[10] 王世杰, 鄢芳, 何方, 等. 副干酪乳杆菌N1115对乳鼠肠道发育影响研究[J]. 营养学报, 2016, 38(1): 71-74. DOI:10.13325/j.cnki.acta.nutr.sin.2016.01.015.
[11] 王世杰. 中国传统发酵乳中具有益生菌潜质菌株筛选及 N1115功能性研究[D]. 北京: 中国农业大学, 2013: 3-15.
[12] 唐尧, 张萍萍, 王明琴, 等. 盐酸咯哌丁胺治疗糖尿病腹泻和肛门失禁的疗效观察[J]. 东南大学学报(医学版), 1991, 10(1): 58-59.
[13] TAN-NO K, NIIJIMA F, NAKAGAWASAI O, et al. Development of tolerance to the inhibitory effect of loperamide on gastrointestinal transit in mice[J]. European Journal of Pharmaceutical Sciences, 2003,20(3): 357-363.
[14] 周晓丹, 刘爱萍, 张明, 等. 副干酪乳杆菌LC-01对便秘小鼠的通便作用[J]. 乳业科学与技术, 2012, 35(5): 7-11. DOI:10.15922/j.cnki.jdst.2012.05.013.
[15] LI C, NIE S P, ZHU K X, et al. Effect of Lactobacillus plantarum NCU116 on loperamide-induced constipation in mouse[J].International Journal of Food Sciences and Nutrition, 2015, 66(5):533-538. DOI:10.3109/09637486.2015.1024204.
[16] HU J L, NIE S P, XIE M Y. High pressure homogenization increases antioxidant capacity and short-chain fatty acid yield of polysaccharide from seeds of Plantago asiatica L.[J]. Food Chemistry, 2013, 138(4):2338-2345. DOI:10.1016/j.foodchem.2012.12.016.
[17] ZHANG X, ZHAO Y, ZHANG M, et al. Structural changes of gut microbiota during berberine-mediated prevention of obesity and insulin resistance in high-fat diet-fed rats[J]. PLoS ONE, 2012, 7(8):1-12. DOI:10.1371/journal.pone.0042529.
[18] WANG L F, ZHANG J C, GUO Z, et al. Effect of oral consumption of probiotic Lactobacillus planatarum P-8 on fecal microbiota, SIgA,SCFAs, and TBAs of adults of different ages[J]. Nutrition, 2014,30(7/8): 776-783.
[19] 王少光, 张晓峰, 韩萍, 等. 低聚异麦芽糖对小鼠肠道菌群及其代谢产物的影响[J]. 河南工业大学学报(自然科学版), 2012, 33(5): 75-78. DOI:10.16433/j.cnki.issn1673-2383.2012.05.003.
[20] QUIGLEY E M M. The enteric microbiota in the pathogenesis and management of constipation[J]. Best Practice & Research Clinical Gastroenterology, 2011, 25(1): 119-126.
[21] SHIMOTOYODOME A, MEGURO S, HASE T, et al. Decreased colonic mucus in rats with loperamide-induced constipation[J].Comparative Biochemistry and Physiology. Part A: Molecular &Integrative Physiology, 2000, 126(2): 203-212. DOI:10.1016/S1095-6433(00)00194-X.
[22] FAN Y, WU S D, FU B B, et al. Decreased number of interstitial cells of Cajal play an important role in the declined intestinal transit during cholesterol gallstone formation in guinea pigs fed on high cholesterol diet[J]. International Journal of Clinical and Experimental Medicine,2014, 7(5): 1262-1268.
[23] KANG D W, DIBAISE J K, ILHAN Z E, et al. Gut microbial and short-chain fatty acid profiles in adults with chronic constipation before and after treatment with lubiprostone[J]. Anaerobe, 2015, 33:33-41.
[24] 李转羽, 刘松玲, 任发政, 等. 副干酪乳杆菌L9的发酵性能驯化及其机理研究[J]. 中国食品学报, 2016, 16(7): 90-96.
[25] 曹山川, 杨跃奎, 刘静波. 有机酸对断奶仔猪生长性能和肠道健康的影响[J]. 饲料工业, 2015, 36(2): 47-51. DOI:10.13302/j.cnki.fi.2015.02.010.
[26] 高增兵, 余冰, 郑萍, 等. 苯甲酸对仔猪肠道微生物及代谢产物的影响[J]. 动物营养学报, 2014, 26(4): 1044-1054.
[27] HOU M L, CHANG L W, LIN C H, et al. Comparative pharmacokinetics of rhein in normal and loperamide-induced constipated rats and microarray analysis of drug-metabolizing genes[J]. Journal of Ethnopharmacology, 2014, 155(2): 1291-1299.DOI:10.1016/j.jep.2014.07.022.
[28] KIM N, JO H J, NAM R H, et al. Sa1437 Decrease of proper muscle, interstitial cells of Cajal (ICC) and neuronal nitric oxide synthase (nNOS) positive neuronal cells in the aged rat colon[J].Gastroenterology, 2012, 142(5): 305-306.
[29] 丁圣, 蒋菁莉, 刘松玲, 等. 长双歧杆菌BBMN68对便秘模型小鼠的通便作用[J]. 食品科学, 2011, 32(3): 195-198.
[30] 卢晓莉, 王世杰, 陆淳, 等. 副干酪乳杆菌N1115的耐酸耐胆盐特性研究[J]. 农业工程技术(农产品加工业), 2011(5): 32-35.
Therapeutic Effect of Lactobacillus paracasei N1115 Fermented Milk in Constipated Mice
CAO Yongqiang1,2, ZHANG Jian1,2, ZHENG Zhe1,2, MEI Xueyang1,2, WANG Shijie3, ZHU Hong3, YANG Zhennai1,2,*
(1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Technology and Business University,Beijing 100048, China; 2. Beijing Laboratory for Food Quality and Safety, Beijing Technology and Business University,Beijing 100048, China; 3. Shijiazhuang Junlebao Dairy Co. Ltd., Shijiazhuang 050211, China)
In this study, the therapeutic effect of Lactobacillus paracasei N1115 fermented milk on constipation was examined by using a mouse model of constipation induced by loperamide hydrochloride. After 15 days of feeding with the fermented milk at low (1 × 107CFU/mL), middle (1 × 108CFU/mL) and high (1 × 109CFU/mL) dosages, the constipated mice had a signif i cant increase in defecation and fecal moisture content (P < 0.05) as well as increased intestinal propulsion rates of 57.3%, 67.3% and 71.3%, respectively, when compared with the control group (P < 0.05). Analysis of short chain fatty acids in feces by gas chromatography-mass spectrometry showed significantly increased contents of acetic acid,propionic acid, butyric acid and valeric acid in the treated mice (P < 0.05) along with more diverse short chain fatty acids than compared with the control mice. Histological analysis of distal colon tissue showed that the colon mucosa of the treated mice remained intact with orderly cell arrangement, while that of the model control mice was reduced in thickness with shallower pits. Furthermore, immunohistochemical analysis of interstitial cells of Cajal (ICC) in colon tissue using c-kit antibody showed that feeding constipated mice with the fermented milk significantly increased colonic ICC, indicating increased ICC activity and intestinal movement. These results showed that L. paracasei N1115 fermented milk had a positive therapeutic effect on constipation.
Lactobacillus paracasei; fermented milk; constipation; short chain fatty acids
10.7506/spkx1002-6630-201801028
TS218
A
1002-6630(2018)01-0185-07
曹永强, 张健, 郑喆, 等. 副干酪乳杆菌N1115发酵乳对小鼠便秘的改善作用[J]. 食品科学, 2018, 39(1): 185-191.
DOI:10.7506/spkx1002-6630-201801028. http://www.spkx.net.cn
2016-10-17
国家自然科学基金面上项目(31371804);副干酪乳杆菌N1115抗后酸化菌株的选育及应用研究横向项目
曹永强(1991—),男,硕士研究生,研究方向为乳品生物技术。E-mail:caoyongqiang91@163.com
*通信作者简介:杨贞耐(1965—),男,教授,博士,研究方向为乳品科学及加工技术。E-mail:yangzhennai@th.btbu.edu.cn
CAO Yongqiang, ZHANG Jian, ZHENG Zhe, et al. Therapeutic effect of Lactobacillus paracasei N1115 fermented milk in constipated mice[J]. Food Science, 2018, 39(1): 185-191. (in Chinese with English abstract)
10.7506/spkx1002-6630-201801028. http://www.spkx.net.cn
