沟槽区胰腺炎多层螺旋CT征象分析
2018-01-05杨国雄王金花刘于宝
杨国雄, 王金花, 刘于宝
沟槽区胰腺炎多层螺旋CT征象分析
杨国雄, 王金花, 刘于宝
目的探讨沟槽区胰腺炎的MSCT征象,提高对该病的影像学诊断水平。方法回顾性分析53例GP患者的临床及CT影像学资料,所有病例经手术病理或ERCP活检病理证实。观察沟槽区肿块或囊状病变的强化特点和分型,以及邻近结构的影像学改变。结果53例的主要CT表现:①均可见沟槽区软组织增厚改变,CT平扫呈等或混杂稍低密度,动脉期呈轻度强化或无强化,实质期呈渐进性不均匀延迟强化;②57%(30/53)伴有副胰管开口邻近十二指肠降部肠壁或胰头实质的囊性变(长径10~48 mm);③十二指肠降部肠壁增厚45例(85%),其中40例为弥漫性水肿,5例为局部性水肿;④胰管扩张占19%(10/53),胆总管扩张占15%(8/53);⑤其它:沟槽区积液占89%(47/53),淋巴结炎(短径8~17 mm)占23%(12/53)。结论沟槽区胰腺炎的MSCT征象具有一定特征性,双期增强扫描对本病的诊断具有重要价值。
慢性胰腺炎; 沟槽区胰腺炎; 体层摄影术,X线计算机; 鉴别诊断
沟槽区胰腺炎(groove pancreatitis,GP)是一种临床少见特殊类型的局限性慢性胰腺炎,以发生于十二指肠降部、胆总管下段和胰头背部之间的沟槽区而命名[1],该潜在解剖间隙内有淋巴组织和血管走行,炎性或肿瘤性病变均可以发生于该区域,可累及大乳头括约肌、小乳头括约肌、胆总管下段、主胰管、副胰管等重要解剖结构[2],其临床症状和体征与胰头癌有很多相似之处,极易误诊为胰腺癌。本文对GP的CT征象进行归纳总结,旨在提高临床医师对该疾病的诊断水平,为临床治疗采取正确有效的方案提供依据。
材料与方法
本研究经本院伦理委员会同意,患者均签署知情同意书。搜集2008年1月-2014年2月本院经手术病理或ERCP内镜活检确诊的53例GP患者的病例资料,主要分析指标包括临床病史、实验室检查(血/尿淀粉酶、总胆红素、谷丙转氨酶、γ谷氨酰转肽酶、肿瘤指标CA19-9及CEA等)、CT平扫和双期增强扫描图像、手术或ERCP内镜检查和组织病理学记录。

图1 男,64岁,沟槽区慢性胰腺炎(单纯型)。a) CT平扫示胰头与十二指肠降部的间隙内有软组织密度灶(箭),边界欠清,周围脂肪间隙模糊、渗出; b) 增强扫描动脉期显示沟槽区病灶内有囊变区,周围实性病灶呈不均匀强化; c) 增强扫描实质期,显示沟槽区病灶呈渐进性延迟强化,中心相对低密度区缩小。胰头实质呈均匀强化(箭),边缘清; d) 增强实质期冠状面重组图像,显示十二指肠降部副胰管区肠壁不均匀增厚(白箭),其内可见低密度囊变区,十二指肠降部呈偏心性狭窄,胰周多发肿大淋巴结(黑箭)。
本组53例中男31例,女22例,年龄25~91岁,中位年龄60岁。病程2周~9年。主要临床表现:反复上腹部疼痛35例,恶心、呕吐9例,腹泻3例,黄疸、发热和血便各1例,消瘦、体重下降42例。病史:包括长期饮酒嗜好39例,胆结石病史25例,急性或慢性胰腺炎病史14例,胃肠道或阑尾切除术病史8例,十二指肠憩室病9例,诱因不明12例。实验室检查:血清或尿淀粉酶升高7例,胆红素升高2例,所有病例中血清癌胚抗原和糖类抗原CA19-9未见升高。
使用GE Discovery CT750 HD 64排CT扫描仪,常规行上腹部CT平扫及双期增强扫描。患者扫描前空腹4~6 h,饮水500 mL。扫描时采取仰卧位,扫描方向为头足向。扫描参数:120 kV,200~220 mA,层厚0.75~2.00 mm,层间距2~5 mm,螺距1.0~1.5。扫描范围自膈顶至肾下极。增强扫描采用上肢静脉团注对比剂碘帕醇(370 mg I/mL),剂量1.5~2.0 mL/kg,注射流率2.5~4.0 mL/s,经高压注射器注入后延迟24和55 s分别行动脉期和实质期增强扫描。
CT图像分析由2位高年资放射科医师采用双盲法分别阅片,主要观察分析沟槽区病灶的形态、分型(单纯性/节段性)、平扫和双期增强的特点,以及邻近的十二指肠降部、胰管、胆总管、胰腺实质、血管和淋巴结等相关结构的影像学改变。当诊断结果存在分歧时,经协商达成一致意见。
结 果
1.GP的CT影像特点
本组53例GP在CT图像上均可见到胰十二指肠沟槽区异常改变,表现为胰头与十二指肠之间有不规则片状混杂稍低密度软组织团块,57%(30/53)的病灶内有多发小囊状稍低密度区,囊变区直径10~48 mm;病灶与十二指肠降部与胰头之间的间隙增大,与邻近的十二指肠降部肠壁或胰头分界不清(图1a)。增强动脉期(图1b):病变呈不均匀斑片样轻度强化(41例)或无强化(12例),囊变区无强化。实质期(图1c~d):44例病灶实性部分呈渐进性延迟强化,呈相对稍高密度,边界显示较清晰。
十二指肠降部改变:45例(45/53,85%)可见肠壁水肿。40例(40/53,75%)为弥漫性,表现为肠壁呈环状增厚、分层,增强后呈环形强化(图2~7),其近端的胃肠道无明显扩张或狭窄。5例(5/53,10%)为局部性,表现为十二指肠降部内侧肠壁不均匀增厚,增强后呈延迟强化,以小乳头区域肠黏膜水肿较明显,局部管腔可呈偏心性狭窄,肠壁僵硬或肠壁间有多发小囊性改变(图1d),7例可见有小分隔或钙化灶(图6),1例继发梗阻性胃肠道潴留。
本组中有10例(10/53,19%)可见副胰管扩张(直径3~7 mm),系小乳头区肠壁水肿引起副胰管出口端狭窄所致(图4)。8例(8/53,15%)可见大乳头区肠壁水肿,胆总管下段呈渐进性狭窄,内壁尚光滑,近端胆总管扩张(最大径6~18 mm),其中有3例可见“双管”征、胰管扩张呈串珠样改变(图7)。合并胆囊结石7例、胆囊炎9例,胆囊形态呈香蕉状(图3)。
46例(89%)可见沟槽区有少量渗出性积液(图3)。12例(23%)的胰头周边、肠系膜根部或腹膜后可见散在淋巴结增大(图1d、图6),短径8~17 mm。胃十二指肠动脉形态基本正常,5例可见有轻度受压、移位(图2)。
34例(34/53)为节段型,胰头部可见不规则片状延迟强化(图3),其中8例(15%)胰腺实质萎缩、可见钙化灶(图5);19例为(36%)为单纯型,胰腺实质均匀强化,形态正常。
2.手术或ERCP检查
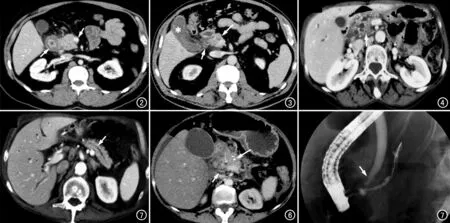
图2 男,66岁,弥漫型GP。CT增强扫描实质期示十二指肠降部管壁环形增厚(长箭),胃十二指肠动脉受推移(短箭)。图3 男,73岁,节段型GP。CT增强扫描实质期示胰头部囊性病灶(长箭),伴有沟槽区积液(短箭),胆囊炎、胆囊呈香蕉状形态(*)。 图4 女,60岁,节段型GP。CT增强扫描实质期示副胰管扩张(箭),肝内外胆管扩张。 图5 男,76岁,GP。CT增强扫描实质期示胰腺实质钙化并主胰管扩张(箭),肝内外胆管扩张。 图6 女,57岁,GP。增强扫描实质期示胰管钙化(箭),胰头区渗出性改变,胰周多发淋巴结炎(短箭)。 图7 男,60岁,GP。 ERCP示十二指肠降部管壁水肿,胆总管下段呈逐渐变细的狭窄(箭),胰管呈串珠状改变。
本组中23例行Whipple式切除手术并进行病理检查。术中可见胰头与十二指肠之间的沟槽区有灰白色瘢痕组织,十二指肠副乳头附近的肠壁黏膜有结节状溃疡,周边纤维结缔组织增生,肠周可见软组织增厚、纤维化,呈慢性炎症改变。呈慢性炎症表现。显微镜下可见肠壁黏膜层内有大量Brunner腺体增生,黏膜下层和肌层组织内可见纤维化和囊变,囊变区内包含有扩张的导管样结构,囊壁由柱状上皮覆盖,内含蛋白质成份和吞噬粘蛋白的异物巨噬细胞和成纤维细胞等。
有30例行ERCP检查,内镜下表现:10例可见十二指肠降部小乳头区肠壁充血、水肿(图7);8例可见大乳头区肠壁水肿,胆总管下段狭窄及近端胆管扩张,最大径6~18 mm;胰管扩张7例,直径3~7 mm,其内有结石及蛋白栓形成,副胰管常不能探及。
讨 论
1.GP的基本病理和临床特点
沟槽区指胰头、十二指肠降部、胆总管下端、胰管及副胰管等结构共同组成的特殊解剖区域,又称为胆胰十二指肠区域,该区域发生局限性胰腺炎可导致十二指肠降部肠壁增厚、囊变甚至肿块形成。有学者根据好发部位的特点,提出用“十二指肠旁胰腺炎”来描述发生于该区域的局限性胰腺炎,而文献多以沟槽区胰腺炎命名。以往的文献中以不同的名称对GP进行过报道和描述,如十二指肠旁胰腺炎、十二指肠壁囊肿、异位胰腺囊性营养不良、肌腺瘤及十二指肠壁胰腺错构瘤等[3-4]。
GP的确切发病机制尚不明确,大部分学者认为各种因素所致十二指肠小乳头功能性障碍或解剖学变异和Brunner腺体增生使得胰液经副胰管排出不畅是主要的发病机制[2]。长期酗酒、吸烟、十二指肠壁异位胰腺、胆管或胰管系统疾病、胃溃疡病、十二指肠壁或胰腺囊肿、胃切除术病史以及十二指肠乳头括约肌的解剖或功能障碍等因素均与GP的发生发展相关[5-6]。本病多好发于40~50岁男性,常有长期饮酒史,病程可持续数周或数年。实验室检查:血浆胰酶(淀粉酶、脂肪酶、蛋白酶)或尿淀粉酶可有轻度升高,肝功能和血清肿瘤指标(如CEA、CA19-9、CA50)等通常无明显异常,亦有个别文献报道患者的CA19-9增高[7],这提示本病亦存在恶变的可能。
2.CT影像特点
总结本组53例GP的MDCT表现,有以下常见特点。①囊性病变:本研究中可见沟槽区囊性病变者占57%,囊性病变实际为胰管的异常囊状扩张。有研究结果显示GP累及十二指肠降部,引起副胰管区肠壁间囊变或肠壁增厚的概率可高达92%,而胰头实质的囊性变发生率为75%[8]。此征象是GP在CT 图像上相对特征性的表现。增扫扫描动脉期可见病变周边呈轻度强化,囊内无强化,实质期实性部分呈渐进性不均匀延迟强化,其强化的程度与病灶内所含纤维成分的多少以及病情分期有关。②十二指肠降部增厚:本组病例中肠壁呈弥漫性环状水肿者占75%,而表现为局部管壁增厚者约占10%,其病理机制一般是由于沟槽区发生慢性炎症引起十二指肠壁瘢痕组织增生、囊变所致,严重时肠腔不均匀狭窄,可继发梗阻性肠管扩张、胃肠道潴留等。虽然胰头癌亦可导致十二指肠降部肠壁增厚、肠腔狭窄,但是胰头癌导致十二指肠壁内出现囊性病变的概率相对较低,而且两种病变导致肠壁增厚的形成机制不同,胰头癌所致的肠壁增厚一般是由于肿瘤组织的侵犯和压迫所致。③胆总管和胰管扩张:在多数情况下被瘢痕组织包绕受压则表现为渐进性狭窄,胆总管下段的狭窄可导致肝内外胆管扩张、胆囊增大(形态类似香蕉状)。主胰管扩张多见于单纯性GP,副胰管扩张则多见于节段性GP,在扩张的副胰管内可见蛋白质栓、钙化斑和脓肿形成[9]。同时,可伴有胰腺实质内腺泡退化、血管内膜纤维化,使胰腺形态不规则,体尾部实质萎缩,部分胰管呈串珠样扩张,并可见钙化或囊变等。④淋巴结炎和血管受推移:GP常有周边淋巴结肿大,呈慢性炎性改变,无特异性。邻近胃十二指肠动脉一般受压推移,但血管较完整,没有血栓形成及管壁浸润等改变,不同于胰头癌对血管的浸润、破坏或癌栓形成。⑤分型:1991年Becker 和Mischke[9]根据GP是否累及胰腺背侧实质将本病分为单纯型和节段型两种类型。单纯型GP是指病变只局限在沟槽区域,胰头部实质未受影响,而节段型GP则是沟槽区和胰头部同时有受累及。本研究中节段型GP约占64%,单纯型GP占36%。1982年Stolte等[10]观察了123例经手术治疗的慢性胰腺炎患者,节段型占15.5%,单纯型占8.9%,这一研究结果与本研究结果中的数据相差较大,笔者认为Stolte等的研究时间比较早,可能受限于当时的诊断及检测的技术水平。
3.鉴别诊断
GP主要应与以胰十二指肠间肿块为主要表现的胰头癌、胆总管下段肿瘤和局灶性自身免疫性胰腺炎等疾病进行鉴别,鉴别要点如下。①GP好发于40~50岁男性患者,胰腺癌发病年龄相对较高。GP患者多有长期饮酒、胆道疾病、急性胰腺炎和糖尿病等的病史,肿瘤标记物一般在正常范围内,而胰头癌患者多有CEA、CAl9-9等肿瘤标记物的升高。GP与胰头癌最大不同的表现在于十二指肠副胰管区肠壁的增厚、囊性变,MSCT增强上呈延迟、渐进性、不均匀纤维瘢痕样的强化特点[11-12],该表现在胰头癌中相对少见。GP是引起局部肠壁的炎性渗出,而胰头癌是侵犯十二指肠壁,可以行十二指肠镜活检病理检查进行证实。②GP患者虽然胆总管也可有狭窄的表现,但一般为较长一段胆总管呈渐进性良性狭窄表现,主胰管可不受损害,继发性的黄疸呈波动性。而胆总管下段肿瘤一般表现为胆管不规则狭窄或者突然中断,患者的黄疸呈进行性加重。③局灶性自身免疫性胰腺炎:患者的血清IgG4/IgG比值升高,具有一定的特异性和敏感性,可资与GP相鉴别。
综上所述,笔者认为GP一般好发于长期过量饮酒的人群,MSCT上表现为沟槽区十二指肠降部肠壁增厚,副胰管开口区囊性变、纤维化,可伴有胆总管渐进性狭窄或胰管串珠样扩张,双期增强特点呈延迟、渐进性、不均匀纤维瘢痕样强化,结合排除其它疾病的临床相关检查,则有助于该病的诊断和鉴别。由于GP与胰头癌相似性,且慢性胰腺炎又是胰腺癌前病变的重要因素,临床工作中对GP患者建立定期随访是有必要的。
[1] DeSouza K,Nodit L.Groove pancreatitis:a brief review of a diagnostic challenge[J].Arch Pathol Lab Med,2015,139(3):417-421.
[2] Raman SP,Salaria SN,Hruban RH,et al.Groove pancreatitis:spectrum of imaging findings and radiology-pathology correlation[J].AJR,2013,201(1):29-39.
[3] Adsay NV,Zamboni G.Paraduodenal pancreatitis:a clinico-pathologically distinct entity unifying "cystic dystrophy of heterotopic pancreas","para-duodenal wall cyst",and "groove pancreatitis"[J].Semin Diagn Pathol,2004,21(4):247-254.
[4] Shin LK,Jeffrey RB,Pai RK,et al.Multidetector CT imaging of the pancreatic groove:differentiating carcinomas from paraduodenal pancreatitis[J].Clin Imaging,2016,40(6):1246-1252.
[5] Jani B,Rzouq F,Saligram S,et al.Groove pancreatitis:a rare form of chronic pancreatitis[J].N Am J Med Sci,2015,7(11):529-532.
[6] Shanbhogue AK,Fasih N,Surabhi VR,et al.A clinical and radiologic review of uncommon types and causes of pancreatitis[J].Radiographics,2009,29(4):1003-1026.
[7] Goldaracena N and McCormack L.A typical feature of groove pancreatitis[J].HPB (Oxford),2012,14(7):487-488.
[8] Zaheer A,Haider M,Kawamoto S,et al.Dual-phase CT findings of groove pancreatitis[J].Eur J Radiol,2014,83(8):1337-1343.
[9] Becker V,Mischke U.Groove pancreatitis[J].Int J Pancreatol,1991,10(3-4):173-182.
[10] Stolte M,Weiss W,Volkholz H,et al.A special form of segmental pancreatitis:"groove pancreatitis"[J].Hepato-gastroenterology,1982,29(5):198-208.
[11] 田笑.多层螺旋CT在胰头部肿块型慢性胰腺炎诊断中的价值[J].放射学实践,2010,25(3):328-331.
[12] Kalb B,Martin DR,Sarmiento JM,et al.Paraduodenal pancreatitis:clinical performance of MR imaging in distinguishing from carcinoma[J].Radiology,2013,269(2):475-481.
Analysisofmulti-sliceCTfeaturesofgroovepancreatitis
YANG Guo-xiong,WANG Jin-hua,LIU Yu-bao.
Radiology Medical Center,Shenzhen Hospital,Southern Medical University,Guangdong 518101,China
Objective:To study the MSCT features of groove pancreatitis (GP),thus to improve diagnostic accuracy of imaging examination in this disease.MethodsRetrospective review of preoperative CT findings and clinical data in 53 patients with pathologically proven GP after pancreaticoduodenectomy or endoscopic retrograde cholangiopancreatography (ERCP).Category and attenuation of groove lesion,associated with the CT imaging performance of the second part of duodenal,bile common duct,pancreatic duct,lymph node and vessels were evaluated and collected.ResultsThe main CT features of GP were as follows:①soft tissue thickening in the groove was seen in all 53 patients,the lesions was isodense or blended hypodense on pre-contrast images,It showed slight or no enhancement in arterial phases and continuous patchy delayed enhancement during the parenchymal phases.②57% (30/53) cystic dystrophy at the adjacent region of the Santorini duct in the second part of duodenum or in the pancreatic parenchyma (diameter of 10~48mm).③Wall thickness in the descending duodenum was seen in 85% (45/53) patients,with a general or local edema by 75% (40/53) and 10% (5/53) respectively.④Abnormality of the bile duct dilatation in pancreas was identified by 19% (10/53) and common bile duct was observed by 15% (8/53).⑤Other:Fluid collection of the groove area was identified in 89% (47/53) patients.Lymphadenopathy was observed in 23% (12/53) patients (ranging from 8~17mm in short dimension).ConclusionThe MSCT features of groove pancreatitis are relatively specific,dual-phase study can be a valuable reference for the clinical diagnose.
Chronic pancreatitis; Groove pancreatitis; Tomography,X-ray computed; Differential diagnosis
518101 广东,南方医科大学深圳医院医学影像中心
杨国雄(1988-),男,广东湛江人,住院医师,硕士研究生,主要从事胰腺影像学研究工作。
刘于宝,E-mail:ybliu28@163.com
国家自然科学基金面上项目(81671660);深圳市知识创新计划基础研究自由探索项目(201740428);广东省科技计划公益研究与能力建设专项(2014A020212730);深圳市卫生计生系统临床技术研究及转化项目(201601042);南方医科大学临床研究培育项目(LC2016PY061)。
RR814.42;R576
A
1000-0313(2017)12-1282-04
10.13609/j.cnki.1000-0313.2017.12.016
2017-07-09
2017-10-28)