药用植物与微生物互利共生关系的研究进展*
2018-01-05张连娟沙本才龙光强张广辉杨生超陈军文
张连娟,沙本才,龙光强,张广辉,杨生超,陈军文**
(1.云南农业大学农学与生物技术学院 昆明 650201;2.云南农业大学西南中药材种质创新与利用国家地方联合工程研究中心 昆明 650201)
药用植物体内或其周围环境中的微生物是植物微生态系统的重要组成部分,它与植物的生长发育密切相关,并对植物群落结构的演替具有重要作用。药用植物与微生物在长期的侵染和抗侵染过程中逐渐形成了复杂的互作关系,两者能相互利用、协同进化。根际微生物可直接作用于植物,促进或抑制其生长,影响药用植物产量、质量及有效成分的变化[1,2];而药用植物则可通过根系分泌物作用于根围环境、产生根际效应来影响微生物的区系等[3]。因此,药用植物与微生物间共生互作机理的研究,将有利于调控药用植物自身内或周围环境中的微生物区系,以促进药用植物优质高产目标的实现。
菌根真菌是最为古老的一类共生真菌,出现最早约为4亿年前的泥盆纪,几乎与陆生植物同时出现在地球上[4]。据报道,大多数陆生植物均能与其形成共生关系。并且,菌根真菌在生态系统营养循环和物质循环过程中扮演着重要的角色,可改善植物根际微环境,提高植物群落和生态系统的多样性[5]。与菌根相比,根瘤菌共生起源稍晚,约为距今0.65亿年前的白垩纪[6]。根瘤菌是一类广泛分布于土壤中的革兰氏阴性细菌,与豆科植物的共生固氮作为生物固氮的主要方式,与其它固氮体系共同参与全球的氮循环[7],在生态系统平衡的维持中发挥重要的功能。
鉴于菌根真菌和根瘤菌作为植物与微生物共生关系研究中起源最早、分布最广泛且研究最为深入、应用也较为成功的两类共生微生物,本文就以这两类典型的模式共生体为例,对近年来关于药用植物与微生物互利共生关系的研究进展进行综述,并对当前存在的问题和以后的研究方向作了分析与展望,以期为药用植物-微生物互作提供重要依据。
1 药用植物与微生物的互利共生
共生关系是指一个以上的有机体,双方建立互利共存关系,或是一方有利且对另一方无害地生活在一起的一种关系[8]。依据对共生关系中生物体利弊关系来分析,共生可分为以下几种形式:寄生、互利共生、偏利共生、偏害共生等。生物之间的共生关系在亲疏程度上差异很大,且相对其他几种形式而言,互利共生关系更为直接和稳定,也更有利于共生体对外界自然环境的生存适应[9]。
共生作为生物适应环境的一种必然现象,在自然界中有多种互惠共生体的存在,而最常见,分布最广的共生体主要包括以下两种:一是豆科植物-根瘤菌互惠共生体,根瘤菌是一类广泛分布于土壤中的革兰阴性细菌,它能与豆科植物(包括其中的药用植物)形成共生关系,将空气中分子态氮转化为植物可利用的化合态氮供给植物,同时根瘤菌也能从植物根中获得其生活所需的营养物质[10]。二是植物-菌根(包括药用植物)互惠共生体,菌根是一些土壤真菌与植物根系形成的互利共生体。如丛枝菌根能将菌丝体伸展到土壤中吸收矿质营养和水分,并将它们输送到植物根部供其吸收利用,同时自身也能通过根内菌丝从植物体内获得糖类[11]。
除以上两种形式的互惠共生体外,在菌根和药用植物互惠共生体中还存在一种特殊的兰科共生菌根。如兰科天麻属的天麻(Gastrodia elataBl.)因其种子细小、无胚乳及储存营养有限不足以供种子萌发所需,不同生育时期需与不同真菌共生以获得外源营养的供给。天麻种子在萌发阶段依赖与紫萁小菇(Mycena osmundicola)等萌发菌建立共生关系,以获得营养而发芽;发芽后,原球茎分化出的营养繁殖茎,又必须被蜜环菌(Armillariella mellea(Vahk ex Fr.)karst.)侵染,建立共生营养关系,才能正常生长[12]。名贵药用植物天麻无根、也不能进行光合作用合成碳水化合物,其生长发育所需的营养物质全来自共生菌。在一些特殊条件下,蜜环菌也会分解天麻块茎以供自身营养所需。微生物普遍存在于各种药用植物中,并与药用植物建立了互利共生关系(表1)。
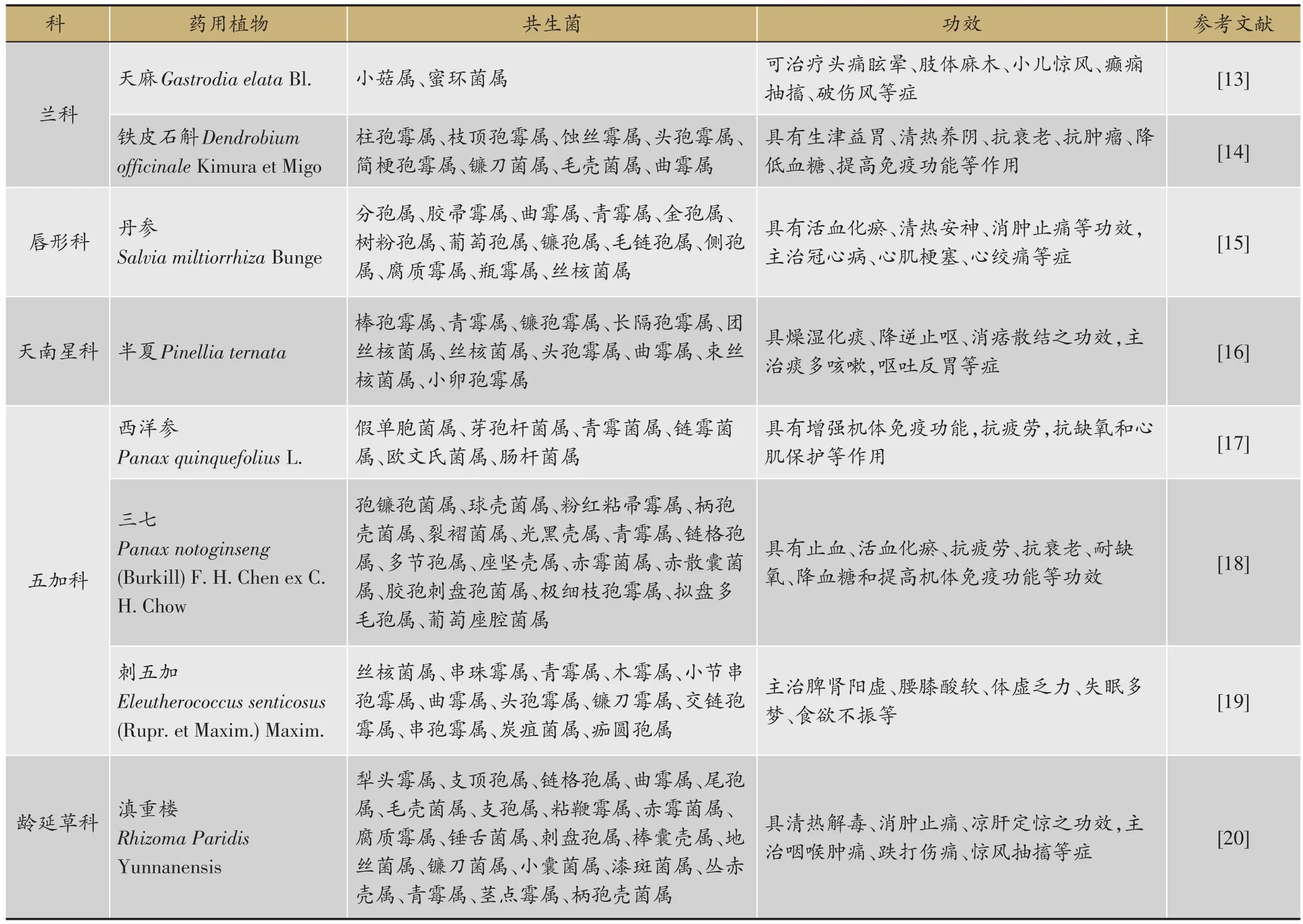
表1 部分与微生物共生的药用植物种类
2 药用植物与微生物共生的互作影响
德国微生物学家Lorenz Hiltner在1904年首次提出根际(Rhizospher)的概念,他将根际定义为根系周围受根系生长影响的土体[21]。根际作为植物和土壤生态系统物质和能量交换较为频繁的一个界面,其区域内微生物多样性丰富,具有强烈的根际效应。同时它能与植物根系土区内微生物群落共同形成复杂的生态区系,是确保植物根系正常生长发育的生境场所,也是确保植物与外界环境正常进行物质与能量交换的主要场所[22]。因此,植物对根际微生物作用是人们关注的重点。
2.1 植物类型对根际微生物群落结构的影响
植物类型是决定微生物群落结构的主要因子,根际微生物群落变化通过根际微生物数量和结构的变化来体现[23],不同类型的植物或同种植物不同品种、同种植物不同生育时期,其根际土壤中的微生物种类、数量、结构和功能也不同。康业斌等对凤丹和洛阳红两个品种的牡丹(Paeonia suffruticosaAndr.)根际微生物进行研究,结果表明同一产地、同一年限、同一栽培条件下,两个牡丹品种的根际微生物数量明显不同[24]。苍术(Atractylodes lancea(Thunb)DC.)根际土壤微生物的研究结果表明两年生苍术根际土壤中的细菌、真菌、放线菌的数量普遍低于一年生苍术,且不同种植年限的苍术根际土壤中三者的比例也发生了改变[25]。此外,植物种类多样性与土壤微生物群落之间关系的研究也表明,植物种类多样性与土壤微生物的磷脂脂肪酸(PLFA)含量相关,随着植物种类数量的增加,土壤中细菌与放线菌PLFAs数量下降,而真菌PLFAs数量上升[26]。这些研究案例均说明植物种类的多样性会影响根际微生物群落的多样性。
2.2 植物根系分泌物对根际微生物的影响
根系分泌物(root exudates)是指植物生长过程中,其根系通过各种方式向周围环境释放的各种有机物和无机物[26]。在土壤生态系统中,根系分泌物是植物与根际微生物相互作用的中间媒介,它既能吸引某些具有趋化性的微生物在根际聚集和繁殖进而生长成为根际微生物;同时又能为微生物生长发育提供重要能量和营养来源,其种类和数量直接影响着根际微生物的代谢和生长发育,进而对根际微生物的种类、数量和分布产生影响,根系分泌物对根际微生物群落结构有一定的选择塑造作用[27]。特别是药用植物,其次生代谢产物更为丰富(如黄酮、生物碱、萜类、酚酸等),这些物质在药用植物生长过程中很容易被释放到土壤中,从而改变根际土壤理化性质,进而影响根际微生物的群落结构[28]。
根系分泌物对根际微生物的影响具有空间和浓度依赖性。根尖是根系分泌最旺盛的部位,在根尖处微生物密度较低,而离根尖越远,分泌作用就越弱,微生物密度也越高[3]。Darrah(1991)模拟了可溶性碳同根际微生物量及死亡量的水平和垂直分布,结果表明,根际微生物的分布与沿根的可溶性碳分布距离有关,微生物生物量的积累依赖于根系分泌物的释放[29],根系释放的分泌物越多,根际微生物的生长也就越旺盛,且根系分泌物的种类决定了根际微生物的种类。地黄根系分泌物和残体中的主要成分水苏糖是一些土壤细菌的碳源,因此它能促进这些细菌在地黄根际的繁殖,对土壤细菌具有显著的筛选作用,从而导致土壤微生态失衡[30]。凤眼莲(Eichhornia crassipes(Mart.)Solms)的根系分泌物不仅对细菌的生长动态有影响,对细菌降酚酶活性也有影响,并表现为低浓度促进,高浓度抑制的趋势[31]。
2.3 微生物对药用植物的影响
微生物对药用植物的影响是多方面的。在根际微生物区系中,主要表现为根际微生物分泌的一些植物激素对植物地上部分及根系的促生作用;根际微生物对根围土壤或根系分泌的一些有机物的分解作用;根际微生物对空气中分子态氮和土壤中难溶性磷酸盐的转化作用;植物根际微生物通过拮抗作用和诱发植物抗逆性对植物病害的生防作用等[23]。鉴于菌根真菌和根瘤菌作为植物与微生物共生关系研究中起源最早、研究最为深入、应用也较为成功的两类共生微生物,本文主要概述根瘤菌、菌根两类互惠共生体对植物的影响。
2.3.1 根瘤菌对药用植物的影响
根瘤菌是一类广泛分布于土壤中的革兰氏阴性细菌,它与相应的豆科植物和少数的非豆科植物根系共生,从而将空气中的分子态氮还原为植物可利用的氨[6]。
在共生阶段,根瘤菌在豆科植物的根或茎上诱发其皮层细胞增生形成瘤,大量的根瘤菌在瘤中转化为具有固氮作用的类菌体,然后再将大气中的氮还原为氨并供给宿主植物[32]。此外,根瘤菌还能通过分泌一些有机酸、氨基酸、酶等促进难溶矿物质的溶解,增加植物对磷及其他营养物质的吸收;分泌一些植物激素类物质(如IAA、GA3等)促进植物的生长发育;向贫瘠土壤中补充土壤氮素以改良土壤结构、降低细胞外层屏障对重金属离子的通透性从而修复重金属污染土壤,维持土地持久生产力等[33]。此外,豆科植物根瘤中还含有大量的抗氧化酶及代谢物能阻止活性氧的形成,因此在短期的干旱胁迫下根瘤菌能提高植物的抗旱性。如紫花苜蓿(Medicago sativaL.)接种根瘤菌后在短期干旱胁迫下能通过渗透调节降低豆血红蛋白素以增强自身抗旱性[34]。
2.3.2 菌根对药用植物的影响
菌根是自然界中一种普遍的植物共生现象,是一些土壤真菌与植物根系形成的互惠共生体。德国植物病理学家Frank于1885年首次发现了菌根,且根据寄主植物的种类、入侵方式及菌根的形态特征,将菌根主要分为三种类型:外生菌根、内生菌根和内外生菌根[35]。其中,内生菌根是分布最为广泛的菌根类型,而丛枝菌根是内生菌根中分布最广、功能最重要的一类。
丛枝菌根真菌在侵染植物根系形成共生体过程中,能促进寄主植物对土壤水分、养分的吸收,能增强植物对干旱、水涝、高温、高盐、土传病害、重金属胁迫等的抗逆性[36]。如黄京华等研究发现菌根真菌能促进药用植物黄花蒿根系对养分的吸收,增加了各器官中N、P、K含量[37];在干旱条件下,随着菌根侵染率的提高,药用植物连翘(Forsythia suspensa(Thunb.)Vahl)幼苗的叶绿素和脯氨酸含量增加,SOD活性增强,而丙二醛含量和膜透性降低,苗木枯死率下降[38];当土壤中水分含量过高时,菌根真菌能增加药用植物细叶百脉根(Lotus tenuis)的泡囊结构数量,且在一定水涝逆境下泡囊结构仍可保存一定活力,当洪水退去后,存活下来的泡囊便又可形成新的菌根结构,促进养分吸收,补偿植物涝灾时受到的损害[39];在盐胁迫条件下,接种丛枝菌根真菌能增加牡丹植株氧自由基清除系统活性,降低其盐害程度,进而促进牡丹正常生长[40];丛枝菌根真菌可以不同程度地抑制土传病原细菌、真菌和线虫的生长、繁殖和危害,从而提高植物抗病性[41-43];牡丹幼苗在接种AM真菌后根系活力明显增强,脯氨酸和可溶性糖含量明显增加,植物细胞的保水能力明显增强,幼苗植株对高温逆境的忍耐力和适应性也明显提高,从而使其免受高温伤害[44];在高浓度的铬、铅胁迫下,接种AM真菌有利于药用植物罗勒(Ocimum basilicumL.)挥发油化学成分的增加,从而保证重金属胁迫下罗勒的产量和品质[45],因为AM真菌能通过菌丝对重金属的过滤、菌丝固持等来降低重金属对植物组织造成的伤害,从而改善植物耐重金属毒害[46,47]。
除丛枝菌根外,还有一些特殊的菌根类型,如兰科菌根(Orchid Mycorrhiza)。兰科植物是典型的内生菌根植物,几乎所有的兰科植物在其生长发育过程中都要与相应的菌根真菌建立共生关系来为自身提供营养,尤其以兰科植物天麻和石斛为典型代表。天麻是一种高度退化的兰科植物,种子无法自己萌发,营养体无法制造养料以满足自身生长。因此,天麻要完成生活史所需的物质和能量主要来自于共生真菌。
石斛属(Dendrobium)是兰科的第二大属,其种子极其微小且无胚乳,在自然条件下,其萌发必须依靠真菌。如铁皮石斛(Dendrobium officinaleKimura et Migo)种子在接种真菌后,菌丝破坏根被进入外皮层细胞,随后部分菌丝细胞壁被溶酶体降解,细胞内含物被释放,而部分细胞中菌丝被消化吸收,最终形成衰败的菌丝残骸,溶酶体也随之消失,但含有菌丝残骸的皮层细胞可被新侵染的菌丝重新定殖[48],并且在铁皮石斛整个生长发育进程中这一菌丝侵染然后被消化最后再侵染的过程可重复发生,从而持续为铁皮石斛提供营养。
3 药用植物与微生物互利共生的分子识别机制
在药用植物与微生物共生关系的形成过程中,需要宿主植物与微生物之间进行一系列的信号分子的识别、交换以及转导作用,最终激活宿主植物和微生物一些基因的表达。菌根真菌和根瘤菌是两类重要的共生微生物,分别能够与宿主植物形成丛枝菌根和根瘤。两类微生物与宿主植物共生关系建立的关键均是二者之间的相互识别以及随后的侵染,其识别过程就是它们相互交换信号分子、相互作用的过程[49]。研究发现这两类微生物与宿主植物的识别过程具有许多相似之处。鉴于此,本文就根瘤菌、AM真菌在分子水平上的识别机制进行了综述,进而对药用植物与微生物互利共生体的形成过程进行了分析。
3.1 根瘤菌对药用植物的识别机制
豆科植物与根瘤菌共生关系的建立过程就是其相互识别、交换信号分子、相互作用的过程[49]。首先,植物根际不断释放类黄酮等分泌物,诱导根瘤菌结瘤基因的表达并合成结瘤因子[50]。结瘤因子是一些脂壳寡糖,是共生体系形成必不可少的信号物质。它们被植物特异性识别后,植物根部迅速作出一系列反应,如根部细胞内钙离子浓度的变化(钙峰及离子流的形成)、根毛的变形(根毛先端卷曲和膨胀)[51-53]。随后,在变形的根毛内,附着的根瘤菌进入细胞壁间并开始形成侵入线。同时,某些细胞进行有丝分裂,根瘤原基开始形成[54]。最后,侵入线以类似顶端生长的方式,在根毛内向前推移穿过幼根皮层细胞,并在根瘤原基细胞中释放根瘤菌,后者进一步分化为有固氮功能的拟菌体,从而形成宿主植物与根瘤菌共生体[55-57]。Peters等发现,在缺氮条件下,豆科植物根系会通过分泌黄酮类或异黄酮类物质来诱导启动根瘤菌结瘤基因的表达,最终致使根瘤菌侵染根系并形成根瘤[58]。豆科植物根上的凝集素也能够识别根瘤菌的结瘤因子,凝集素特异性地识别根瘤菌表面的酸性胞外多糖和脂多糖,形成交联桥,从而形成分子界面结构,保证根瘤菌特异性吸附到豆科植物根系表面[59]。
3.2 菌根对药用植物的识别机制
菌根的形成过程可分为AM真菌接触植物根之前的共生阶段和接触后的共生阶段[60]。首先,AM真菌在未找到宿主植物之前,以休眠孢子形态存在于土壤中,直到其感受到宿主植物释放于土壤中的信号物质后,真菌孢子开始分枝,并向宿主植物延伸,同时释放相应的信号分子[61]。AM真菌的识别信号就是植物根系分泌物(如无机离子、有机化合物、次生代谢物等)[62]。同样,在AM真菌与宿主植物的附着孢出现之前,AM真菌孢子能够分泌一种衍信号物质—菌根形成因子(Myc因子)而被根系所识别[63]。Kosuta等利用一张玻璃纸膜将AM真菌和宿主植物隔开进行培养,允许它们之间有信号分子的交换,但没有物理接触,结果发现AM真菌的确能够释放Myc因子而被植物根系识别,且这种Myc因子还能诱导具有药用价值的植物藜蒺苜蓿(Medicago truncatila)早期结瘤基因MtENOD11的表达,而且只在邻近分枝菌根的根组织中表达[64]。最后,菌丝接触宿主根部,在根表形成附着胞,继而穿刺进入根系组织,并在根细胞内增殖蔓延,实现AM菌根与宿主植物的共生。此外,共生受体样蛋白激酶(SYMRK)、钙/钙调依赖性蛋白激酶(CCaMK)和离子通道(MtDMI 1)也均与AM真菌侵染有关,它们能在菌根定殖的早期阶段对真菌进入宿主细胞的过程进行调控,是菌根形成早期信号转导途径中必不可少的信号元件[65]。
4 展望
共生微生物与药用植物的生长、繁殖和次生代谢活动息息相关,药用植物与微生物互利共生关系是近年来药用植物研究的热点。了解药用植物与微生物相互作用的机制及菌体所产生的多种生物学效应,对有效利用微生物促生机制来提高药用植物抗逆性、增加药材产量和改善质量具有重要意义。基于近年来对根瘤菌、菌根两类互惠共生体的最新研究进展,我们认为有许多工作还需深入研究,主要有以下几个方面:
4.1 加强内生真菌鉴定。
植物内生菌因具繁殖快,培养方便等特点而在农业和医药领域中有较大的应用潜力,并受到了人们的广泛关注。而其中,对分离出来的内生菌进行鉴定是人们研究和利用它们过程中的一个重要环节。目前内生真菌的分类鉴定主要以真菌的形态学特征为依据,但不产孢的真菌则无法用形态观察来判断。近年来一些分子技术手段(如DNA测序鉴定法、核酸杂交、DNA指纹图谱技术)已被用于这些真菌的分类研究,但多数研究也只能将真菌鉴定到属的水平而无法准确鉴定到种的水平[66]。因此,我们还需将这些形态学及分子生物学技术有机结合来综合分析植物组织中内生菌的系统分类,并以此为基础来进一步研究内生菌与宿主间的互作机制,弄清内生真菌产生活性成分的内在机理,并筛选出具有与寄主相同或相似活性成分的内生真菌并加以利用。
4.2 强化药用植物菌根共生机制的研究。
就目前而言,菌根与药用植物共生体的研究仍存在一些悬而未决的问题,首先,如AM菌根真菌菌丝多核、无法纯培养等特性,给AM真菌与宿主共生双方间信号转导的研究带来了一定困难;其次,兰科植物如天麻、石斛等,种子极其微小,不易进行实验操作等限制,兰科菌根共生机制的研究至今仍较薄弱[67];最后,菌根真菌与药用植物共生体建立过程中宿主根系分泌的信号物质除类黄酮外是否还存在其他化合物,若存在,那它们之间是否存在协同作用。因此,我们今后还需应用基因组学、蛋白组学、代谢组学等多方面的技术手段逐步强化药用植物菌根共生机制的研究。
4.3 加大根瘤菌在药用植物生产上的应用。
豆科植物-根瘤菌共生体系在生态修复中的应用是目前的研究热点,但还存在一些问题有待加强。首先是需进一步筛选高抗且具促生作用的菌株,实现共生体的最佳搭配,以提高修复效率;再者,还需深入研究不良环境条件下这些根瘤菌的抗性机制和功能基因的表达调控,以期从功能上阐明根瘤菌-豆科植物共生修复的分子机理[68]。上述问题的解决,不仅能促进药用植物生长发育,而且能提高植物在不良环境中的适应能力,有利于在恶劣生态环境系统中进行药材生 产及珍稀药用植物资源保护。
1 Katrhikeyan B,Jaleel C A,Gopi R,et al.Science Letters:Alterations in seedling vigour and Antioxidant enzyme activities in Catharanthus roseus under seed priming with native diazotrophs.J Zhejiang Univ,2007,8(7):453-457.
2 Jaleel C,Manivannan P,Sankar B,et al.Pseudomonas fluorescens enhances biomass yield and Ajmalicine production in Catharanthus roseus under water deficit stress.Colloid Surface B,2007,60(1):7-11.
3 王茹华,张启发,周宝利,等.浅析植物根分泌物与根际微生物的相互作用关系.土壤通报,2007,38(1):167-172.
4 Remy W,Taylor T N,Hass H,Kerp H.Four hundred-million-year-old vesicular arbuscular mycorrhizae.Proc Natl Acad Sci USA,1994,91(25):11841-11843
5 盛江梅,吴小芹.菌根真菌与植物根际微生物互作关系研究.西北林学院学报,2007,22(5):104-108.
6 Lum M R,Hirsch A M.Roots and their symbiotic microbes:strategies to obtain nitrogen and phosphorus in a nutrient-limiting environment.J Plant Growth Regul,2003,21(4):368-382.
7 Zahran H H.Rhizobium-legume symbiosis and nitrogen fi xation under severe condition and in an arid climate.Microbiol Mol Biol Rev,1999,63(4):968-989.
8 裘维番.菌物学大全.北京:科学出版社,1998.
9 王元贞,潘廷国,柯玉琴.微生物与植物共生关系的研究及其利用.中国生态农业学报,2003,11(3):101-104.
10李合生.现代植物生理学.北京:高等教育出版社,2002.
11赵之伟.菌根真菌在陆地生态系统中的作用.生物多样性,1999,7(3):81-85.
12徐锦堂,郭顺星,范黎,等.天麻种子与小菇属真菌共生萌发的研究.菌物系统,2001,20(1):137-141.
13谢果珍,申爱荣,谭著明,等.天麻共生菌研究进展.湖南中医杂志,2015,31(4):206-208.
14谢吉容,陈媛.铁皮石斛菌根研究进展.重庆文理学院学报,2015,34(5):99-102.
15王萌,戴国君,马云桐,等.丹参内生真菌与其有效成分的相关性分析.中国实验方剂学杂志,2013,19(23):66-73.
16刘建玲,陈宝宝,刘永红,等.半夏内生菌的分离与初步鉴定.中国中药杂志,2009,34(18):2305-2307.
17刘学周,赵智灵,李绍宾,等.西洋参内生菌群落结构与多样性.微生物学报,2015,55(3):330-340.
18张玉洁,和泽高,唐龙山,等.三七内生真菌分离与分子鉴定.文山学院学报,2011,24(6):1-3.
19熊亚南,邢朝斌,吴鹏,等.刺五加内生真菌分离及分布研究.安徽农业科学,2009,37(24):11347-11348.
20王茜,申仕康,张爱丽,等.滇重楼内生真菌分离与多样性研究.中国中药杂志,2013,38(22):3838-3844.
21肖艳红,李菁,刘祝祥,等.药用植物根际微生物研究进展.中草药,2013,44(4):497-504.
22刘占良,翟红,刘大群.植物根际的微生物互作及其在植物病害生物防治中的应用.河北农业大学学报,2003,26(S1):182-189.
23国辉,毛志泉,刘训理.植物与微生物互作的研究进展.中国农学通报,2011,27(9):28-33.
24康业斌,商鸿生,董苗菊.凤丹与洛阳红根际微生物及其与根皮中丹皮酚含量的关系.西北农林科技大学学报,2006,34(12):159-162.
25郭兰萍,蒋有绪,陈美兰,等.栽培苍术根际土壤微生物变化.中国中药杂志,2007,32(12):1131-1133.
26 Zak D R,Holmes W E,White D C,et al.Plant diversity,soil microbial communities and ecosystem function:Are there any links.Ecology,2003,84(8):2042-2050.
27 Nihorimbere V,Ongena M,Smargiassi M,et al.Beneficial effect of the rhizosphere microbialcommunity forplantgrowth and health.Biotechnol Agron Soc,2011,15(2):327-337.
28乔卿梅,程茂高,王新民.根际微生物在克服药用植物连作障碍中的潜力.土壤通报,2009,40(4):957-961.
29 Darrah P R.Model of the rhizosphere.Plant and Soil,1991,133(2):187-199.
30刘峰.地黄连作障碍机理研究(I)-水苏糖和梓醇对土壤细菌的影响研究.济南:山东大学硕士学位论文,2007.
31赵大君,郑师章.凤眼莲根分泌物氨基酸对根际肠杆菌属F2细菌降酚的影响.应用生态学报,1996,7(4):435-438.
32史小霞,师尚礼,杨晶,等.豆科植物根瘤菌分类研究进展.草原与草坪,2006,(1):12-17.
33赵叶舟,王浩铭,汪自强.豆科植物和根瘤菌在生态环境中的地位和作用.农业环境与发展,2013,30(4):7-12.
34张攀,杨培志,王卫栋,等.干旱胁迫下根瘤菌共生紫花苜蓿抗旱生理变化研究.草地学报,2013,21(5):938-944.
35田蜜,陈应龙,李敏,等.丛枝菌根结构与功能研究进展.应用生态学报,2013,24(8):2369-2376.
36黄京华,谭钜发,揭红科,等.丛枝菌根真菌对黄花蒿生长及药效成分的影响.应用生态学报,2011,22(6):1443-1449.
37赵平娟,安锋,唐明.丛枝菌根真菌对连翘幼苗抗旱性的影响.西北植物学报,2007,27(2):396-399.
38 Birhane E,Frank J,Sterck F M,et al.Arbuscular mycorrhizal fungi enhance photosynthesis, water use efficiency, and growth of frankincense seedlings under pulsed water availability conditions.Oecologia,2012,169(4):895-904.
39 García I,Mendoza R,Pomar M C.Deficit and excess of soil water impact on plant growth of Lotus tenuis by affecting nutrient uptake and arbuscular mycorrhizal symbiosis.Plant and Soil,2008,304(1-2):117-131.
40郭绍霞,陈丹明,刘润进.盐水胁迫下接种AM真菌对牡丹幼苗抗氧化酶活性的影响.园艺学报,2010,37(11):1796-1802.
41 Affokpon A,Coyne D L,Lawouin L,et al.Effectiveness of native West African arbuscular mycorrhizal fungi in protecting vegetable crops against root-knot nematodes.Biol Fertil Soils,2011,47(2):207-217.
42 Chandanie W A,Kubota M,Hyakumachi M.Interactions between plant growth promoting fungi and arbuscular mycorrhizal fungus Glomus mossese and induction of systemic resistance to anthracnose disease in cucumber.Plant and Soil,2006,286(1-2):209-217.
43李海燕,刘润进,束怀瑞,等.Chib1和PAL5基因在AM真菌Glomus fasciculatus诱导大豆抗线虫病害防御反应中的作用.菌物学报,2005,24(3):385-393.
44李思龙,张玉刚,陈丹明,等.丛枝菌根对高温胁迫下牡丹生理生化的影响.中国农学通报,2009,25(7):154-157.
45 Prasad A,Kumar S,Khaliq A,Pandey A.Heavy metals and arbuscular mycorrhizal(AM)fungi can alter the yield and chemical composition of volatile oil of sweet basi(lOcimum basilicum L.).Biol Fertil Soils,2011,47(8):853~861.
46 Christie P,Li X,Chen B.Arbuscular mycorrhiza can depress translocation of zinc to shoots of host plants in soils moderately polluted with zinc.Plant and Soil,2004,261(1/2):209-217.
47 Janouskova M,Vosatka M.Response to cadmium of Daucus carota hairy roots dual cultures with Glomus intraradices or Gigaspora margarita.Mycorrhiza,2005,15(3):217-224.
48金辉,许忠祥,陈金花,等.铁皮石斛组培苗与菌根真菌共培养过程中的相互作用.植物生态学报,2009,33(3):433-441.
49王树和,王昶,王晓娟,等.根瘤菌、丛枝菌根(AM)真菌与宿主植物共生的分子机理.应用与环境生物学报,2008,14(5):721-725.
50丑敏霞,魏新元.豆科植物共生结瘤的分子基础和调控研究进展.植物生态学报,2010,34(7):876-888.
51 Dénarié J,Debellé F,Promé J C.Rhizobium lipochitooligosaccharide nodulation factors,signaling molecules mediating recognition and morphogenesis.Ann Rev Biochem,1996,65(0):503-535.
52 Cárdenas L,Holdaway-Clarke T L,Sanchez F,et al.Ion changes in legume root hairs responding to Nod factors.Plant Physiol,2000,123(2):443-452.
53 Shaw S L,Long S R.Nod factor elicits two separable calcium responses in Medicago truncatula root hair cells.Plant Physiol,2003,131(3):976-984.
54 Timmers A C J,Auriac M C,Truchet G.Refined analysis of early symbiotic steps of The Rhizobium-Medicago interaction in relationship with microtubular cytoskeleton rearrangements.Development,1999,126(16):3617-3628.
55 Brussel A A,Bakhuizen R,van Spronsen P C,et al.Induction of preinfection thread structures in the leguminous host plant by mitogenic Lipooligosaccharides of Rhizobium.Science,1992,257(5066):70-72.
56 van Spronsen P C,Bakhuizen R,van Brussel A,et al.Cell wall degradation during infection thread formation by the root nodule bacterium Rhizobium leguminosarum is a two-step process.Eur J Cell Biol,1994,64:88-94.
57 Brewin N J.Tissue and cell invasion by Rhizobium,the structure and development of infection threads and symbiosomes.In:Spaink HP,Kondorosi A,Hooykaas PJJ eds.The Rhizobiaceae:Molecular Biology of Model Plant-Associated Bacteria.Kluwer Academic Publishers,Dordretch,The Netherlands,1998:417-429.
58 Peters N K,Frost J W,Long S R..A plant flavone,luteolin,induces expression ofRhizobium meliloti nodulation genes.Science,1986(4767):233:977-980.
59 Hirsch A M,Brill L M,Lim P O,et al.Steps toward de fi ning the role of Lectins in nodule development in legumes sybiosis.Symbiosis,1995,19:155-173.
60朱先灿,宋凤斌.丛枝菌根共生的信号转导及其相关基因.生命科学研究,2008,12(2):95-99.
61胡江,孙淑斌,徐国华.植物中丛枝菌根形成的信号途径研究进展.植物学通报,2007,24(6):703-713.
62 Bais H P,Weir T L,Perryl G,et al.The role of root exudates in rhizosphere innteractons with plants and other organisms.Ann Rev Plant Biol,2006,57:233-266.
63 Vierheilig H,Piché Y.Signalling in arbuscular mycorrhiza:factors and hypotheses.Adv Exp Med Biol,2002,21:23-39.
64 Kosuta S,Chabaud M,Lougnon G,et al.A diffusible factor from arbuscular mycorrhizal fungi induces symbiosis-specific MtENOD11 expression in roots of Medicago truncatila.Plant Physiol,2003,131(3):952-962.
65 Bonfante P,Genre A.Mechanisms underlying beneficial plant-fungus interactions in mycorrhizal symbiosis.Nat Commun,2010,1(4):48.
66谭小明,周雅琴,陈娟,等.药用植物内生真菌多样性研究进展.中国药学杂志,2015,50(18):1563-1580.
67陈娟,张丽春,刑咏梅,等.兰科石斛属植物菌根共生研究进展.中国药学杂志,2013,48(19):1644-1648.
68韦革宏,马占强.根瘤菌-豆科植物共生体系在重金属污染环境修复中的地位、应用及潜力.微生物学报,2010,50(11):1421-1430.
