慢性肾脏病患者血清Klotho蛋白水平与血管钙化的相关性研究*
2018-01-05李海涛危志强
丁 浩,曹 娟,章 旭,李海涛,印 荻,危志强
(江苏省泰兴市人民医院肾脏内科 225400)
论著·临床研究
慢性肾脏病患者血清Klotho蛋白水平与血管钙化的相关性研究*
丁 浩,曹 娟△,章 旭,李海涛,印 荻,危志强
(江苏省泰兴市人民医院肾脏内科 225400)
目的探讨慢性肾脏病(CKD)患者血清Klotho蛋白水平与血管钙化的相关性。方法选取2014年1-12月在该院肾内科住院的CKD患者107例,另外选取年龄、性别匹配的20例健康体检者为对照组。采用ELISA法测定血清Klotho蛋白水平,采用腹部侧位X线片评估患者的腹主动脉钙化(AAC),同时采用彩色多普勒超声检测患者肱动脉依赖性血管舒张功能(FMD)和颈动脉中膜厚度(cIMT)。比较CKD患者与健康人群血清Klotho蛋白水平的差别;探讨血清Klotho蛋白水平与慢性肾脏病-矿物质和骨异常(CKD-MBD)、血管功能紊乱如血管钙化、内皮功能紊乱、cIMT的相关性并分析其临床意义。结果CKD组患者血清Klotho蛋白水平和FMD显著低于对照组,而cIMT和AAC评分显著高于对照组。随着CKD进展,血清Klotho蛋白水平也显著降低。CKD患者血清Klotho蛋白水平与年龄(r=-0.348,P<0.01)、甲状旁腺激素(iPTH)的对数(log iPTH,r=-0.366,P<0.01)、cIMT(r=-0.192,P<0.05)及AAC评分(r=-0.251,P<0.01)呈负相关,与肾小球滤过率(eGFR,r=0.387,P<0.01)、1,25-二羟维生素D3(1,25-(OH)2-D3,r=0.311,P<0.01)及FMD(r=0.190,P=0.048)呈正相关。FMD≥6.0%、cIMT<1.0 mm及AAC评分等于0分的患者血清Klotho蛋白水平均显著高于FMD<6.0%、cIMT≥1.0 mm及AAC评分大于0分的患者。多因素Logistic回归分析显示年龄(OR=3.63,95%CI:1.75~8.89,P=0.002)、平均动脉压(MBP)(OR=2.98,95%CI:1.45~7.69,P=0.09)、蛋白尿(OR=1.97,95%CI:1.16~3.73,P=0.022)、血清Klotho蛋白水平(OR=0.60,95%CI:0.39~0.98,P=0.007)是血管钙化的独立预测因子。结论随着CKD进展,血清Klotho蛋白水平显著降低;血清Klotho蛋白水平下降是血管钙化的独立预测因子。
Klotho蛋白;肾疾病;慢性病;钙质沉着症
慢性肾脏病(chronic kidney disease,CKD)是严重威胁人类健康的常见病,随着生活水平提高、人口老龄化及其他各种因素,CKD及其导致的终末期肾病(end stage renal disease,ESRD)的发生率也逐年提高[1]。心血管疾病(cardiovascular disease,CVD)是CKD及ESRD患者最常见的并发症,也是导致ESRD患者死亡的首要原因[2-3],因此对CVD的早期诊治具有重要意义。血管功能紊乱在CKD早期阶段就十分常见,是CVD的早期表现。血管功能紊乱包括血管钙化、内皮功能紊乱及颈动脉中膜厚度(cIMI)增厚等方面,目前已证实血管功能紊乱是CKD患者心血管死亡的主要原因之一,是CVD的独立预测因子[4]。CVD的传统危险因素已广为人知,CKD患者同时还存在非传统危险因素,在CVD的进展过程中也起重要作用。近年的研究发现,Klotho-FGF23调节轴功能水平异常也是CVD的非传统危险因素[5]。既往对Klotho蛋白的研究主要集中于其抗衰老、钙磷调节的作用,但是对血清Klotho蛋白水平及血管功能紊乱的相关性研究较少。因此,本研究通过检测CKD患者血清Klotho蛋白水平,探讨血清Klotho蛋白水平与血管功能紊乱的相关性,为预防和治疗CKD患者心血管事件提供新的治疗策略。
1 资料与方法
1.1一般资料 选取2014年1-12月在本院肾内科住院,并诊断为CKD的患者,共107例。其中,男63例,女44例,中位年龄56.0岁(46.0~63.5)岁。原发病方面:52例(48.6%)为慢性肾小球肾炎,25例(23.4%)为糖尿病肾病,17例(15.9%)为高血压肾病,其他病因共13例(12.2%)。CKD分期:1期11例(10.3%),2期31例(29.0%),3期28例(26.2%),4期19例(17.8%),5期18例(16.8%)。另选取本院体检中心年龄、性别匹配的健康体检者20例为对照组。排除标准:(1)患有动脉粥样硬化并发症(冠心病、充血性心衰或外周血管疾病);(2)服用维生素D或磷结合剂;(3)近1个月内有感染;(4)其他严重疾病:如恶性肿瘤、严重营养不良、精神疾病等。本研究经本院伦理委员会批准。
1.2方法
1.2.1资料收集 收集入组病例的临床资料包括年龄、性别、身高、体质量、收缩压(SBP)、舒张压(DBP)等一般资料及原发疾病、伴随疾病、吸烟史、饮酒史、用药情况等相关病史。
1.2.2实验室检查 所有入组患者及健康对照组均于清晨空腹抽取静脉血、收集中段晨尿标本, 检测血红蛋白(Hb)、血钙(Ca2+)、血磷(P3+)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、总胆固醇(TC)、三酰甘油(TG)、血清清蛋白(Alb)、血尿素氮(BUN)、血肌酐(Scr)、甲状旁腺激素(iPTH)、 C反应蛋白(CRP)、尿蛋白及1,25-二羟维生素D3(21,25-(OH)2-D3);ELISA法测定血清Klotho蛋白及成纤维细胞生长因子23(FGF23)水平。
1.2.3血管功能评估
1.2.3.1评估血管内皮功能 检测肱动脉内皮依赖性血管舒张功能(FMD)。采用彩色多普勒超声诊断仪,取仰卧位,右上肢外展15°,将超声探头置于肘上5~10 cm处探测肱动脉,取其纵切面,记录静息状态下肱动脉舒张末期内径(D0),后将血压计袖带置于肘下,充气加压至高于收缩压50 mm Hg,完全阻断血流5 min后迅速将袖带放气减压,并在1 min内测量肱动脉的内径(D1),FMD=[(D1-D0)/D0]×100%。FMD<6%表示存在血管内皮功能异常[6]。
1.2.3.2检测cIMT 采用彩色多普勒超声诊断仪,取去枕仰卧位,充分暴露颈部,从锁骨上窝开始向上逐段连续探查颈总动脉、颈内动脉和颈外动脉,取颈总动脉分叉处近心端1 cm处后壁的两条线的垂直距离为cIMT,左右两侧均测定3次,取平均值。cIMT≥1.0 mm表示存在颈动脉中膜增厚[7]。
1.2.3.3评估血管钙化 腹部侧位X线片检查评估腹主动脉钙化(AAC),采用的半定量积分系统,根据L1~L4对应的腹主动脉前壁和后壁钙化斑块的长度,分别给予0~3分的评分:无钙化为0分,少量钙化(钙化范围小于动脉壁长度的1/3)为1分,中等钙化(钙化范围累及动脉壁长度的1/3~2/3)为2分,重度钙化(钙化范围大于动脉壁长度的2/3)为3分。AAC 积分0~24分。正常为0分,>0分提示存在AAC[8]。
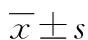
2 结 果
2.1CKD患者临床资料与实验室检查 CKD组患者SBP、DBP、MAP、Scr、尿蛋白、CRP、iPTH、FGF23、cIMT及AAC评分均显著高于对照组,而Alb、eGFR、1,25-(OH)2-D3、血清Klotho蛋白水平及FMD均低于对照组,见表1。

续表1 两组临床资料及实验室数据的比较
MAP:平均动脉压;eGFR:肾小球滤过率;HbA1c:糖化血红蛋白
2.2CKD患者血清Klotho蛋白水平与CKD分期的关系 随着CKD进展,血清Klotho蛋白水平也显著降低,见图1。

图1 CKD患者血清Klotho蛋白水平与CKD分期的关系
2.3CKD患者血清Klotho蛋白与相关因素的相关性 CKD患者血清Klotho蛋白水平与年龄(r=-0.348,P<0.01)、log iPTH(r=-0.366,P<0.01)、cIMT(r=-0.192,P<0.05)及AAC评分(r=-0.251,P<0.01)呈负相关,与eGFR(r=0.387,P<0.01)、1,25-(OH)2-D3(r=0.311,P<0.01)及FMD(r=0.190,P<0.05)呈正相关。
2.4不同FMD、CIMF ACC评分分组CKD患者血清Klotho蛋白水平的比较 所有患者中,FMD≥6.0%的患者占37.4%(40/107),其血清Klotho蛋白水平显著高于FMD<6.0%的患者(P<0.01); cIMT<1.0 mm患者占64.5%(69/107),其血清Klotho蛋白水平显著高于cIMT≥1.0 mm的患者(P<0.01);AAC=0分的患者占32.7%(35/107),其血清Klotho蛋白水平显著高于AAC>0分的患者(P<0.01)。
2.5血管钙化的多因素分析 以是否发生血管钙化作为因变量,将非HDL-C、HbA1c、eGFR、尿蛋白、Hb、血Ca2+、血P3+、iPTH、1,25-(OH)2-D3、FGF23、血清Klotho蛋白水平作为协变量进行多因素分析,结果显示,血清Klotho蛋白水平是血管钙化的影响因素,但不是FMD及cIMT的影响因素,见表2。多因素Logistic回归分析显示年龄(OR=3.63,95%CI:1.75~8.89,P=0.002)、MBP(OR=2.98,95%CI:1.45~7.69,P=0.009)、蛋白尿(OR=1.97,95%CI:1.16~3.73,P=0.022)、血清Klotho蛋白水平(OR=0.60,95%CI:0.39~0.98,P=0.007)是血管钙化的独立预测因子,见表3。

表2 血管钙化(AAC>0分)的多因素分析
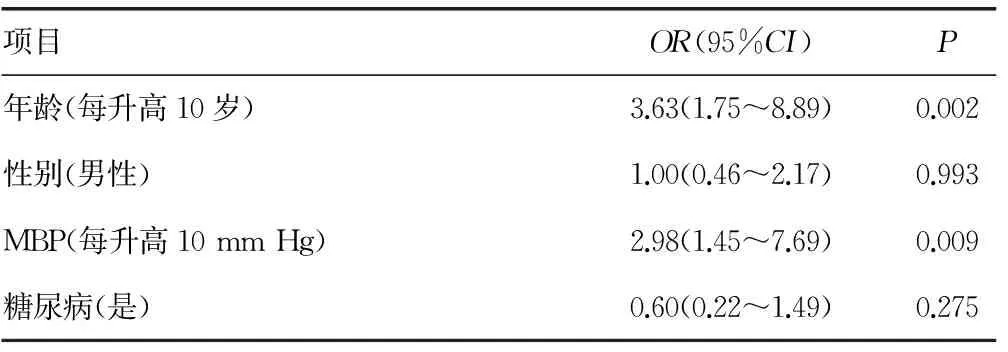
表3 血管钙化影响因素的多元Logistic回归分析
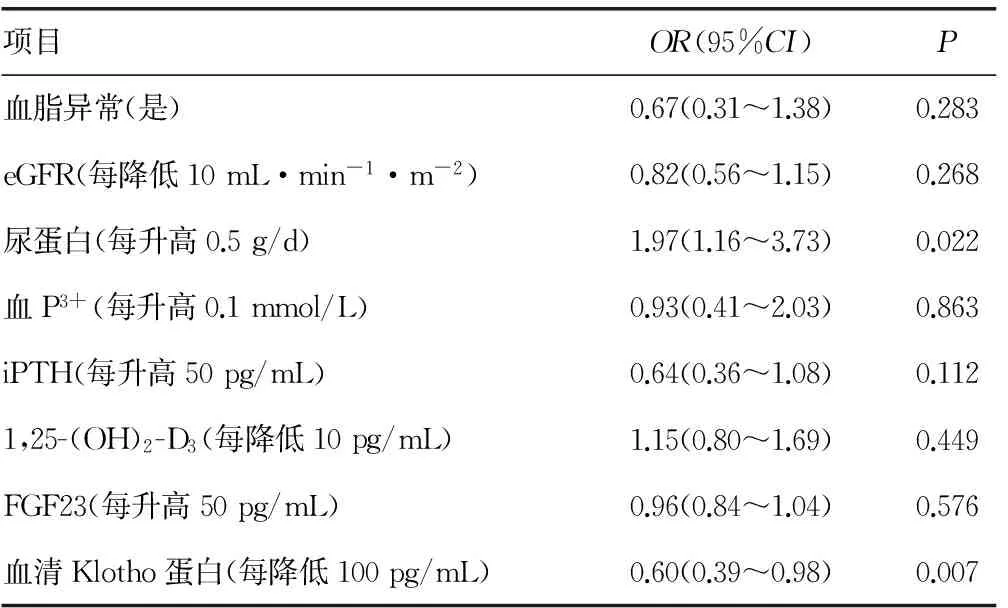
续表3 血管钙化影响因素的多元Logistic回归分析
3 讨 论
CKD在人群中的发病率逐步增加,成为严重威胁人类健康的又一个重要疾病。我国CKD患病率为10.8%,全国成人人群中约有1.2亿CKD患者[1]。CKD患者是CVD发生的高危人群,心血管疾病也是CKD患者最常见的并发症和首位致死病因,其发生率比同龄普通人群高出3~30倍[2-3]。对CVD的早期诊断及防治可显著改善患者的生活质量,具有重要意义。
血管功能紊乱主要包括血管内皮细胞功能紊乱、血管钙化、动脉中膜增厚等,在CKD早期阶段就已出现,是心血管疾病的早期重要指标,也是CKD患者CVP病死率升高的主要原因,是CVD的独立预测因子[4]。血管钙化是动脉粥样硬化、CKD等普遍存在的共同病理表现,是心脑血管疾病高发病率和高病死率的重要因素之一[9]。血管钙化是个主动的、可调控的过程。在正常条件下,身体可调控钙化的各种诱导和抑制因子,因此血管钙化可得到避免,而上述诱导和抑制因子的调控失衡可导致血管钙化的发生[10]。对CKD 5期透析的患者、早期CKD患者及正常人群的研究显示,血P3+是血管钙化的重要诱导因子。研究发现高血P3+水平的维持性透析患者冠状动脉钙化更为明显,CKD患者血P3+每升高1 mg/dL,冠状动脉钙化的发生率升高21%(P=0.002),血P3+高于3.9 mg/mL的人群,15年后冠状动脉钙化发生率增加52%[11]。近年来的临床研究表明,CKD患者血管钙化的主要因素包括以下两方面[12]:(1)高P3+血症:可增加细胞的P3+内流,促进血管平滑肌细胞(VSMCs)转分化和凋亡;(2)钙化抑制因子表达减少。
Klotho基因是1997年Kuro-o等在研究自发型高血压小鼠时发现。进一步研究表明,Klotho蛋白可与FGF受体结合,调节1,25(OH)2-D3、PTH合成;也具有葡萄糖苷酶活性,可修饰细胞膜上离子通道和转运体的糖链,调节其活性;而且作为一种内分泌因子,也具有抗氧化、抗凋亡、抗衰老、保护干细胞等作用[13]。既往对Klotho蛋白的研究主要集中于其Ca2+、P3+调节,抗衰老等作用,对血清Klotho蛋白水平与CVD风险的相关性研究较少。
本研究检测CKD患者及健康人群血清Klotho蛋白水平,结果与之前的研究[14]相同,与健康人群相比CKD患者血清Klotho蛋白水平显著降低,与eGFR密切相关,并且随着CKD进展,血清Klotho蛋白水平也显著降低。Klotho蛋白在肾脏高表达,因此任何因素导致肾脏损伤后Klotho蛋白水平都会降低。CKD患者肾脏Klotho mRNA及Klotho蛋白表达水平均显著下降,而Klotho蛋白缺乏,对Wnt信号通路的抑制作用减弱,可延缓肾脏修复、加重肾脏损伤,形成恶性循环。血清Klotho蛋白水平在CKD 1期就已降低,因此检测血清Klotho蛋白水平也是评估肾功能的重要方法之一。
血清Klotho蛋白水平与PTH及1,25-(OH)2-D3也密切相关。在甲状旁腺中,Klotho蛋白和FGFR结合成复合体,通过Klotho-Na/K-ATP酶信号通路调节甲状旁腺合成、分泌PTH;在CKD患者中,甲状旁腺Klotho和FGFR表达减少,导致对FGF23信号通路抑制作用减弱,促进甲状旁腺Klotho-Na/K-ATP酶复合物形成并促进PTH合成[15]。Klotho蛋白也是1,25-(OH)2-D3代谢的必要条件;Klotho基因启动子附近有维生素D反应元件,1,25-(OH)2-D3可诱导肾脏细胞表达Klotho蛋白[16]。因此Klotho蛋白与1,25-(OH)2-D3之间存在相互促进的作用。
FMD、cIMT及AAC评分是评估CKD患者血管功能紊乱的常用指标。本研究发现,血清Klotho蛋白水平与FMD、cIMT及AAC评分均密切相关,但血清Klotho蛋白水平下降只是血管钙化的独立预测因子,不是内皮功能紊乱、动脉中膜增厚的预测因子。目前,血清Klotho蛋白在CKD患者血管钙化过程中的作用主要包括以下几方面:(1)增加尿P3+排泄,降低血P3+,抑制P3+内流[17]:Klotho蛋白能抑制NaPi-2a和NaPi-2c,有效促进肾脏排磷;直接减少P3+诱导的NaPi-2b和Pit-1的表达,抑制肠道P3+吸收;直接抑制NaPi-3活性,抑制P3+内流。(2)减少血管平滑肌细胞(VSMCs)的转分化[18]:Klotho蛋白抑制CBFA1/RunX2的过表达,调控VSMCs转分化和去转分化的平衡,通过抑制VSMCs转分化抑制血管钙化。(3)抗氧化应激,保护肾功能[19]:Klotho蛋白通过激活FoxO叉头转录因子,诱导锰超氧化物歧化酶(Mn-SOD)表达,增加机体对氧化应激的抵抗力。(4)抗微炎症和抗凋亡[20]:Klotho蛋白可抑制血管平滑肌细胞(VSMCs)对细胞黏附分子如ICAM-1和VCAM-1的表达,抑制RIG-1诱导的IL-6和IL-8表达,抑制NF-κB激活,阻止TNF诱导的单核细胞附着。
综上所述,CKD是一种Klotho蛋白缺乏的状态,Klotho蛋白水平的下降不仅仅是肾脏受损的早期标志物,同时在CKD及其并发症(如血管钙化)的进展中也起关键作用。本研究为改善CKD患者血管功能、减少CVD发生及提高心血管预后提供了新的治疗策略。
[1]Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China:a cross-sectional survey[J].Lancet,2012,379(9818):815-822.
[2]Said S,Hernandez GT.The link between chronic kidney disease and cardiovascular disease[J].J Nephropathol,2014,3(3):99-104.
[3]Collins AJ,Foley RN,Gilbertson DT,et al.United States renal data system public health surveillance of chronic kidney disease and end-stage renal disease[J].Kidney Int Suppl,2015,5(1):2-7.
[4]Chan DT,Watts GF,Irish AB,et al.Insulin resistance and vascular dysfunction in chronic kidney disease:mechanisms and therapeutic interventions[J].Nephrol Dial Transplant,2017,3(8):1274-1281.
[5]Ding HY,Ma HX.Significant roles of anti-aging protein klotho and fibroblast growth factor23 in cardiovascular disease[J].J Geriatr Cardiol,2015,12(4):439-447.
[6]Flammer AJ,Anderson T,Celermajer DS,et al.The assessment of endothelial function from research into clinical practice[J].Circulation,2012,126(6):753-767.
[7]Abdallah E,Mosbah O,Khalifa G,et al.Assessment of the relationship between serum soluble Klotho and carotid intima-media thickness and left ventricular dysfunction in hemodialysis patients[J].Kidney Res Clin Pract,2016,35(1):42-49.
[8]Tatami Y,Yasuda Y,Suzuki S,et al.Impact of abdominal aortic calcification on long-term cardiovascular outcomes in patients with chronic kidney disease[J].Atherosclerosis,2015,243(2):349-355.
[9]Yevzlin AS,Gimelli G.Diagnosis and treatment of peripheral arterial disease in CKD patients[J].Semin Dial,2013,26(2):240-251.
[10]Shioi A.Vascular Calcification-pathological mechanism and clinical application-mechanisms of vascular calcification.[J].Clin Cal,2015,25(5):635.
[11]Mcgovern AP,De LS,Van VJ,et al.Serum phosphate as a risk factor for cardiovascular events in people with and without chronic kidney disease:a large community based cohort study[J].PLoS One,2013,8(9):e74996.
[12]Kurabayashi M.Vascular calcification-pathological mechanism and clinical application-role of vascular smooth muscle cells in vascular calcification[J].Clin Cal,2015,25(5):661-669.
[13]Chen CD,Tung TY,Liang J,et al.Identification of cleavage sites leading to the shed form of the anti-aging protein klotho[J].Biochemistry,2014,53(34):5579-5587.
[14]Zhou LL,Li YJ,Zhou D,et al.Loss of klotho contributes to kidney injury by derepression of Wnt/beta-Catenin signaling[J].J Am Soc Nephrol,2013,24(5):771-785.
[15]Kimura T,Shiizaki K,Kuro-OM.Role of parathyroid hormone in Klotho-FGF23 system[J].Clin Calcium,2016,26(6):859-866.
[16]Latus J,Lehmann R,Roesel M,et al.Involvement of α-klotho,fibroblast growth factor-,vitamin-D- and calcium-sensing receptor in 53 patients with primary hyperparathyroidism[J].Endocrine,2013,44(1):255-263.
[17]Sopjani M,Rinnerthaler M,Almilaji A,et al.Regulation of cellular transport by klotho protein[J].Curr Protein Pept Sci,2014,15(8):828-835.
[18]Chen T,Mao H,Chen C,et al.The role and mechanism of α-Klotho in the calcification of rat aortic vascular smooth muscle cells[J].Biomed Res In,2015,2015:194362.
[19]Jin J,Jin L,Lim SW,et al.Klotho deficiency aggravates Tacrolimus-Induced renal injury via the phosphatidylinositol 3-Kinase-Akt-Forkhead box protein O pathway[J].Am J Nephrol,2016,43(5):357-365.
[20]Maekawa Y,Ishikawa K,Yasuda O,et al.Klotho suppresses TNF-alpha-induced expression of adhesion molecules in the endothelium and attenuates NF-kappaB activation[J].Endocrine,2009,35(3):341-346.
StudyoncorrelationbetweenserumKlothoproteinlevelwithvascularcalcificationinpatientswithchronickidneydisease*
DingHao,CaoJuan△,ZhangXu,LiHaitao,YinDi,WeiZhiqiang
(DepartmentofNephrology,TaixingPeople′sHospital,Taixing,Jiangsu225400,China)
ObjectiveTo investigate the correlation between serum Klotho protein level with vascular calcification in the patients with chronic kidney disease (CKD).MethodsOne hundred and seven inpatients with CKD in the nephrology department of the hospital from January 2014 to December 2014 were selected and 20 age- and sex-matched persons undergoing healthy physical examination served as the control group.Serum Klotho ptotein level was measured by ELISA.Abdominal aortic calcification(AAC) was assessed by abdominal lateral X-rays.Meanwhile the brachial arterial flow-mediated dilatation (FMD) and carotid intima-media thickness (cIMT) were determined by the color Doppler ultrasound.The difference of serum Klotho protein levels were compared between the CKD patients and healthy people.The relationship between the serum Klotho protein level with CKD-mineral and bone disorder (CKD-MBD) and vascular dysfunction such as vascular calcification,.endothelial dysfunction and cIMT was investigated and its clinical significance was analyzed.ResultsSerum Klotho protein level and FMD in the CKD group were significantly lower than those in the control group,while the cIMT and AAC scores were significantly higher than those in the control group.Serum Klotho level was significantly decreased along with the progression of CKD.Serum Klotho protein level were negatively correlated with the age(r=-0.348,P<0.01),log iPTH(r=-0.366,P<0.01),cIMT(r=-0.192,P<0.05) and AAC score(r=-0.251,P<0.01),and positively correlated with eGFR(r=0.387,P<0.01),1,25-dihydroxyvitamin D3level (r=0.311,P<0.01) and FMD (r=0.190,P<0.05) in the CKD patients.The Klotho protein level in the patients with FMD≥6.0,cIMT<1.0 mm and AAC score=0 were significantly higher than those in the patients with FMD<6.0,cIMT≥1.0 mm and AAC score >0.The multivariate Logistic regression analysis showed that age (OR=3.63,95%CI:1.75-8.89,P=0.002),MBP (OR=2.98,95%CI:1.45-7.69,P=0.009),albuminuria (OR=1.97,95%CI:1.16-3.73,P=0.022),serum Klotho protein level (OR=0.60,95%CI:0.39-0.98,P=0.007) were the independent predictive factors of vascular calcification.ConclusionSerum Klotho protein level in the CKD patients is significantly decreased along with CKD progression;serum Klotho protein level decrease is an independent predictive factor of vascular calcification.
] Klotho;kidney disease;chronic disease;calcinosis
10.3969/j.issn.1671-8348.2017.36.018
江苏省卫生计生委面上科研课题(z201525)。
丁浩(1986-),主治医师,本科,主要从事肾脏内科研究。△
,E-mail:13852677171@139.com。
R692
A
1671-8348(2017)36-5094-05
2017-08-14
2017-09-16)
