黄连对羟苯基丙酮酸双加氧酶的原核表达和酶学性质
2018-01-05梁玉玲佐藤文彦
梁玉玲,佐藤文彦
(1.河北大学 生命科学学院,河北 保定 071002;2.河北省生物工程技术研究中心,河北 保定 071002; 3. 京都大学 大学院,日本 京都 606-8502)
黄连对羟苯基丙酮酸双加氧酶的原核表达和酶学性质
梁玉玲1,2,佐藤文彦3
(1.河北大学 生命科学学院,河北 保定 071002;2.河北省生物工程技术研究中心,河北 保定 071002; 3. 京都大学 大学院,日本 京都 606-8502)
为了研究黄连对羟苯基丙酮酸双加氧酶(CjHPPD)的功能和性质,在E.coli中异源表达其编码cDNA得到了重组的CjHPPD. 经HPLC和LC-MS检测确定重组CjHPPD具有催化对羟苯基丙酮酸形成尿黑酸的酶活性.酶学特性分析表明,CjHPPD催化尿黑酸形成的最适pH值为6.5,产物尿黑酸的积累至少在反应开始10 min内随时间呈线形增长,最适反应温度为30 ℃.以ρ-HPP为底物进行底物亲和性分析表明,CjHPPD符合Michaelis-Menten动力学曲线,Km值为43.2 μmol/L.结果表明,CjHPPD的Km值明显高于其他已报道的植物HPPD的Km值,高Km使得CjHPPD具有较强除草剂抗性.
黄连;对羟苯基丙酮酸双加氧酶;原核表达;酶学性质;Km值
对羟苯基丙酮酸双加氧酶(ρ-hydroxyphenylpyruvate dioxygenase,HPPD;EC.1.13.11.27)是生物体中酪氨酸分解代谢的重要酶[1].催化对羟苯基丙酮酸(ρ-hydrotyphenylpyruvate,HPP)与O2形成尿黑酸(homogentisate),包括了氧化脱羧、羟基化和分子内重排等反应过程[2-3].HPPD广泛存在于除少数革兰氏阴性细菌之外的几乎所有需氧生物中[4],是一种含非血红素Fe2+、依靠α-酮酸的双加氧酶,铁原子以非血红素Fe2+作为酶的活性辅助因子参与了该复杂的反应过程.在植物和光合细菌中,尿黑酸还参与质体醌和生育酚生物合成途径.HPPD是质体中这两类重要异戊二烯醌类物质生物合成的关键酶,HPPD酶活性丧失或者受到抑制时,对植物细胞的直接影响是抑制质体醌和生育酚的合成,间接影响是抑制类胡萝卜素的合成.后者引起类胡萝卜素生物合成途径的中间产物八氢蕃红素的积累和质体的光氧化发生[5],导致植物生长缓慢、叶片白化、枯死,直至整株植物死亡.HPPD成为新型除草剂靶标酶和生育酚代谢途径工程的重要酶类.
尽管HPPD在植物体中具有重要的作用,到目前为止,只从少数几种植物中克隆了HPPD的编码基因或cDNA,包括紫苏(Coleusblumei)、大麦(Hordeumvulgare)、胡萝卜(Daucuscarota)、拟南芥(Arabidopsisthaliana)、玉米(Zeamays)、丹参(Salviamiltiorrhiza)毛状根、水麻(Amaranthustuberculatus)等[6-11].在植物组织中HPPD酶活性是低水平的,直接从植物体中分离HPPD酶蛋白困难较大.Garcia等[12]利用Southern杂交技术检测拟南芥基因组中HPPD的拷贝数时发现,编码HPPD的基因在整个基因组中只存在1个拷贝.在大麦中也只是检测到HPPD的1个拷贝[6].HPPD为新型除草剂靶标酶,目前发现玉米和水麻对HPPD抑制剂型除草剂表现出抗性,但是其抗性产生原因是植物对抑制剂的代谢,而不是其HPPD对抑制剂具有抗性[9,11].前期研究发现黄连(Coptisjaponica)培养细胞对HPPD抑制型除草剂DTP(destosyl pyrazolate)具有抗性并克隆了HPPD cDNA[13],本文通过在E.coli中异源表达具有活性的重组蛋白,研究其酶学特性,对进一步研究其抗性产生机理具有重要意义.
1 材料与方法
1.1 材料
携带有黄连hppd开放阅读框架(ORF)的克隆载体pGEM-T easy/Cjhppd由本实验室保存;原核表达载体pET-21 d购自Novagen公司;大肠杆菌表达菌株BL21(DE3) 购自Promerga公司.
1.2 方法
1.2.1 Cjhppd原核表达载体构建
用PCR方法从pGEM-T easy/Cjhppd扩增Cjhppd片段.上游引物 Fw:5′-TACTAACCATGGTTCCCAGCACAGCCTCCA-3′,该引物引入1个包含翻译起始密码子ATG的限制性酶NcoI酶切位点(划线部分);下游引物 Rv:5′-TATGAATTCTCAAATGCAACTATGCAGCAACA-3′与cDNA的3'-末端序列互补,在终止密码子TGA后面加上1个EcoRI 限制性酶切位点(划线部分).PCR反应条件为:预变性 94 ℃ 2 min;30个循环反应,包括94 ℃变性15 s,56 ℃退火30 s,68 ℃延伸2 min;最后68 ℃延伸5 min.PCR产物回收纯化后,用限制性内切酶NcoI/EcoRI消化,与经同样限制酶消化的表达载体pET-21 d连接得到pET-21 d/Cjhppd.转化大肠杆菌DH5α菌株,涂布LB+100 μg/mL Amp平板,37 ℃过夜培养.经菌落PCR和限制性酶切鉴定的阳性质粒pET-21 d/Cjhppd,以pET载体特异性引物T7 promoter primer 和T7 terminator primer对重组质粒的插入DNA片段进行双向测序确保PCR扩增中没有引入错误碱基后,再将重组质粒转入大肠杆菌表达菌株BL21(DE3)感受态细胞,氨苄青霉素筛选阳性菌落,经菌落PCR和限制性酶切提取质粒鉴定阳性转化子.
1.2.2 Cjhppd在大肠杆菌中的异源表达与重组蛋白提取
挑取重组菌株单菌落,接种于5 mL LB+100 μg/mL Amp液体培养基中(50 mL三角瓶中),37 ℃,150 r/min过夜预培养,取1 mL预培养菌液接种于100 mL LB+100 μg/mL Amp液体培养基中(500 mL三角瓶中)振荡培养,当OD600达到0.6 时加入IPTG至终浓度为1 mmol/L,30 ℃继续培养8 h诱导重组蛋白表达后,8 000 r/min 4 ℃离心5 min收集菌体.用蛋白质提取缓冲液(50 mmol/L Tris-HCl pH 7.5,10%(体积分数)甘油,10 mmol/L巯基乙醇)重悬菌体,超声波破碎菌体,离心收集蛋白质粗提液,按照GE Healthcare PD-10 column操作手册脱盐处理后得到重组CjHPPD酶液,每管200 μL分装,-80 ℃保存,同时以空载体转化菌pET-21d(BL21(DE3))做同样处理作为对照.
1.2.3 重组蛋白CjHPPD的酶活性测定
1.2.3.1 酶促反应体系和对照反应体系 标准酶促反应体系为100 μL反应体系中含100 mmol/L磷酸钾缓冲溶液(pH 6.5),50 mmol/L抗坏血酸,10 μL(37.18 μg脱盐蛋白)酶液,200 μmol/L对羟苯基丙酮酸(pH 7.7,购自Aldrich公司).反应以加入底物ρ-HPP开始,反应体系在30 ℃保温5 min.反应体系中加入终质量浓度为20 g/L的TCA停止反应,涡旋混匀后-80 ℃保存.测定反应产物时取出冻存样品冰浴融化后,14 000 r/min 4 ℃ 离心5 min沉淀反应液中的蛋白质成分(按照实验具体情况,此离心步骤也可在停止反应后立即完成),收集上清液用于HPLC和LC-MS测定反应产物尿黑酸.酶学特性分析时对酶促反应时间、温度、pH值、底物浓度等作相应调整.米氏常数Km值计算利用Kaleida Graph(Synergy Software,Reading,PA)软件.
在确定酶催化活性实验中除标准反应体系外,还设立了对照反应体系,分别为: 标准反应体系中不加入反应底物对羟苯基丙酮酸; 标准反应体系中不加入酶溶液;标准反应体系中加入经100 ℃加热处理10 min的变性酶液取代酶溶液.
1.2.3.2 HPLC 测定酶促反应产物 通过测定酶促反应体系中产物尿黑酸的形成及产量来确定酶的活性.HPLC检测使用Shimadzu LC-10A型高效液相色谱仪,Shimadzu SPD-10A紫外检测器,Shimadzu C-R7A色谱处理机,C18反向柱(Inertsil ODS-3 (4.6 mm×250 mm; GL Sciences Inc.);流动相为10 mmol/L乙酸∶甲醇=85∶15(体积比),现用现配,超声波处理10 min去除气泡后使用;流速0.8 mL/min;柱温40 ℃;样品注入量50 μL;检测波长280 nm,尿黑酸标准品(购自Sigma公司)作为对照.
1.2.3.3 LC-MS 检测酶促反应产物 采用液相色谱-质谱联用仪(LC-MS-2010A; Shimadzu,Kyoto,Japan)鉴定反应产物尿黑酸.LC-MS 条件:流动相为 20 mmol/L 醋酸铵(Ammonium acetate) pH 5.5,选择SIM模式(扫描模式为负离子模式),流速为0.5 mL/min,柱温40 ℃,检测280 nm UV吸收,尿黑酸标准品作为对照.
1.2.4 重组蛋白质CjHPPD酶学性质分析
1.2.4.1 酶促反应时间 先在小离心管中分别加入上述反应体系的缓冲液、抗坏血酸和底物,30 ℃恒温水浴预保温3 min,再加入酶溶液,开始计时.反应时间分别为0、1、2、3、4、5、10、20 min,加入TCA终止反应,HPLC法测定酶活性.
1.2.4.2 酶促反应最适温度 采用标准反应体系,反应温度分别设定为10、15、20、25、30、37、40、45、50 ℃,反应时间为5 min,加入TCA终止反应,HPLC法测定酶活性.
1.2.4.3 酶促反应最适pH值 使用不同的缓冲液调节反应体系的pH值,醋酸-醋酸钾缓冲液(KA Buffer,pH值分别为 4.5、5.0、5.5);磷酸钾缓冲液(KP Buffer,pH值分别为 5.5、6.0、7.0、7.5、8.0);Tris-HCl缓冲液(Tris-HCl Buffer,pH值分别为 7.5、8.0、8.5、9.0).反应条件为30 ℃,5 min.加入TCA终止反应,HPLC法测定酶活性.
1.2.4.4Km值测定 100 μL标准酶促反应体系中改变底物的浓度,使底物终浓度分别达到2 、10、20、50、100 μmol/L,加入酶溶液开始反应.反应条件为30 ℃,5 min.加入TCA终止反应,HPLC法测定酶活性.实验数据利用Kaleida Graph(synergy software,reading,PA)软件计算米氏常数Km值.
1.2.5 其他方法
采用质量浓度100 g/L 的聚丙烯酰胺 SDS-PAGE分离重组蛋白,考马斯亮蓝(R250)染色,以确定重组酶蛋白分子质量.采用Bradford方法测定蛋白质浓度[14],以牛血清白蛋白(BSA)为标准品.
2 结果
2.1 Cjhppd基因原核表达载体的构建
以克隆载体pGEM-T easy/Cjhppd为模板,在DNA聚合酶KOD Plus DNA polymease 催化下进行PCR扩增,产物经琼脂糖凝胶电泳检测,得1.3 kb特异DNA片段,与预期片段大小一致(图1),胶回收特异产物后,用NcoⅠ/EcoRⅠ双酶切.同时双酶切载体pET-21d,凝胶电泳检测回收的酶切插入片段和载体(图2).用DNA Ligation Kit进行连接反应,连接产物转化E.Coli感受态细胞DH5α,涂布LB+100 μg/mL Amp平板,37 ℃过夜培养.

1.1 kb plus DNA 标记;2-4.ORF PCR产物.图1 琼脂糖凝胶电泳分析PCR扩增产物Cjhppd ORF DNA片段Fig.1 Analysis of PCR product Cjhppd ORF by electrophroesis through agarose gel

1.1 kb Plus DNA 标记;2.pET-21d 的 NcoⅠ+Eco RⅠ双酶切;3,4.ORF DNA 的 NcoⅠ+Eco RⅠ双酶切. 图2 琼脂糖凝胶电泳检测载体和目的片段酶切产物Fig.2 Analysis of degisted pET-21d and inster byelectrophroesis through agarose gel
2.2 原核表达载体的鉴定及转化表达菌株
挑取生长的菌落进行菌落PCR,使用目的片段的正向引物Fw作为上游引物,载体的T7 terminator primer作为下游引物,扩增插入片段,以检测插入片段的长度和插入片段的连接方向,筛选出了1个插入片段长度和方向都正确的阳性克隆(图3).提取重组菌质粒DNA,分别用NcoⅠ和EcoRⅠ单酶切得到了线形DNA;用NcoⅠ/EcoRⅠ双酶切质粒DNA得到了预期长度的酶切片段(图4).说明Cjhppd的 ORF成功地构建到了表达载体pET-21d中,使Cjhppd处于T7转录元件的控制之下.
用鉴定好的重组质粒DNA 转化BL21(DE3)感受态细胞,挑取生长的单菌落,培养后提取重组质粒DNA,对质粒DNA 进行NcoⅠ/EcoRⅠ限制性酶双酶切,琼脂糖凝胶电泳鉴定酶切片段,得到了预期长度1.3 kb的片段.对重组质粒DNA进行双向测序,测序引物为位于载体多克隆位点上下游的T7 promoterprimer 和T7 terminator primer,测序结果表明,插入片段核苷酸序列与CjhppdORF核苷酸序列完全相同.至此,将Cjhppd的开放阅读框克隆到了大肠杆菌表达载体pET-21d中,并且转化到大肠杆菌表达菌株BL21(DE3)中,获得了Cjhppd的重组菌.

1.1 kb plus DNA 标记;2.阳性对照;3-8.菌落PCR.图3 琼脂糖凝胶电泳检测重组质粒菌落PCR产物 Fig.3 Analysis of colony PCR product by electrophroesis through agarose gel
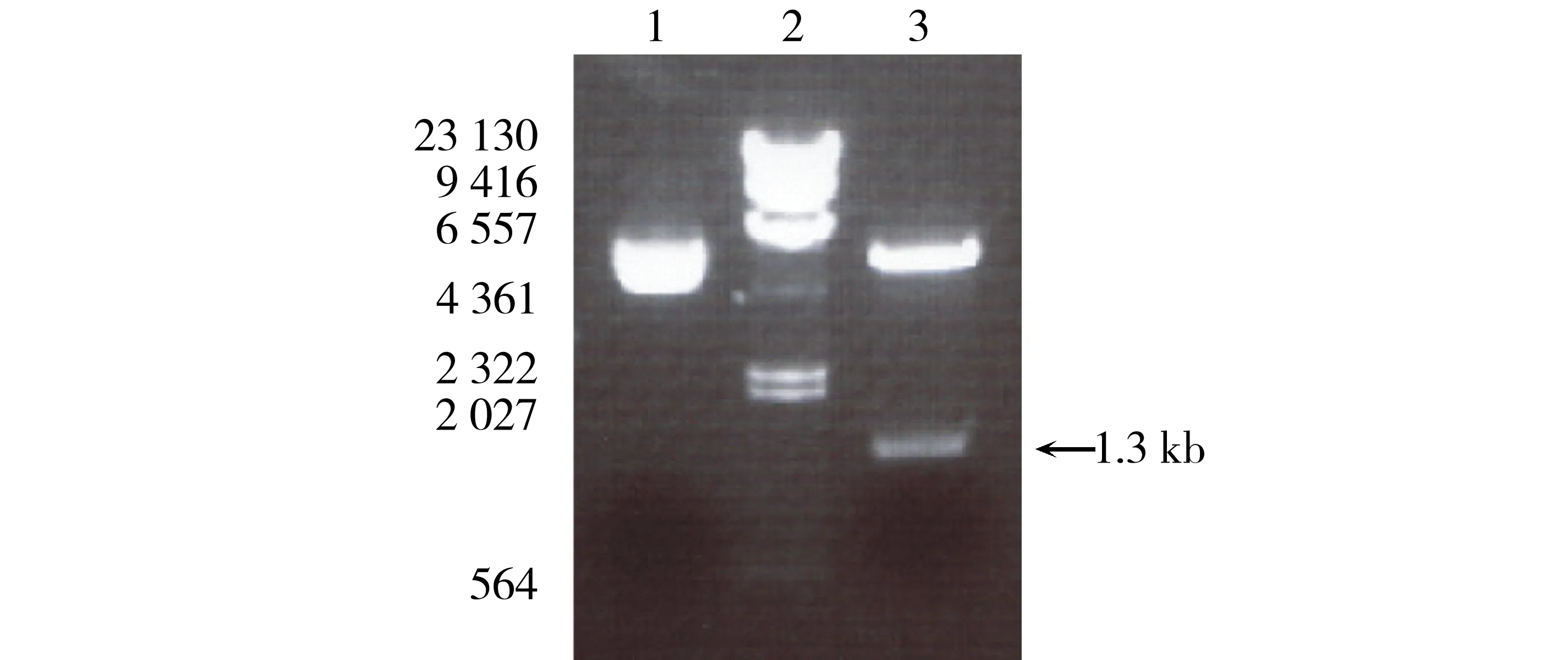
1.质粒 DNA;2.λDNA/Hin d Ⅲ marker;3.Nco Ⅰ+Eco RⅠ双酶切.图4 HPPD-pET-21d 质粒DNA限制性酶切产物琼脂糖凝胶电泳Fig.4 Analysis the products of restriction enzyme digested HPPD-pET-21d plasmid DNA by electrophroesis through agarose gel
2.3 Cjhppd 基因在大肠杆菌中的表达
挑取含有重组质粒pET-21d/Cjhppd的重组大肠杆菌菌株BL21(DE3)单菌落,用终浓度为1 mmol/L的IPTG诱导重组蛋白表达.30 ℃、诱导时间为8 h时获得了目的蛋白的高表达,其表达蛋白质的分子质量与CjHPPD蛋白质的推测分子质量47.3 ku基本吻合,而在转入空载体对照中没有此蛋白质条带,图5为SDS-PAGE电泳图谱.
2.4 重组CjHPPD的酶活性测定
HPPD作为酪氨酸分解代谢中的重要酶类以及植物质体醌和生育酚合成途径的关键酶,催化对羟苯基丙酮酸(HPP)合成尿黑酸(HMG)的反应.提取重组CjHPPD制备酶液加入标准反应体系进行酶促反应,反应产物作HPLC分析.结果显示,标准酶促反应体系反应产物的HPLC检测图谱含有与产物尿黑酸标准品保留时间相同的色谱峰(图6a,b),即检测到了产物尿黑酸的形成.而在空载体对照菌蛋白提取液的反应体系中没有尿黑酸产物形成,只检测到了底物对羟苯基丙酮酸的色谱峰(图6c).同时在其他几种对照体系中也没有检测出尿黑酸(图略).

1.蛋白质分子质量标记;2.空载体对照 (pET-21 d); 3.pET-21d/CjHPPD.箭头所指为预期的重组蛋白.图5 Coptis japonica HPPD 在E.coli中表达的SDS-PAGE图谱Fig.5 SDS-PAGE analysis of overproduction of CjHPPD in recombinant E.coli
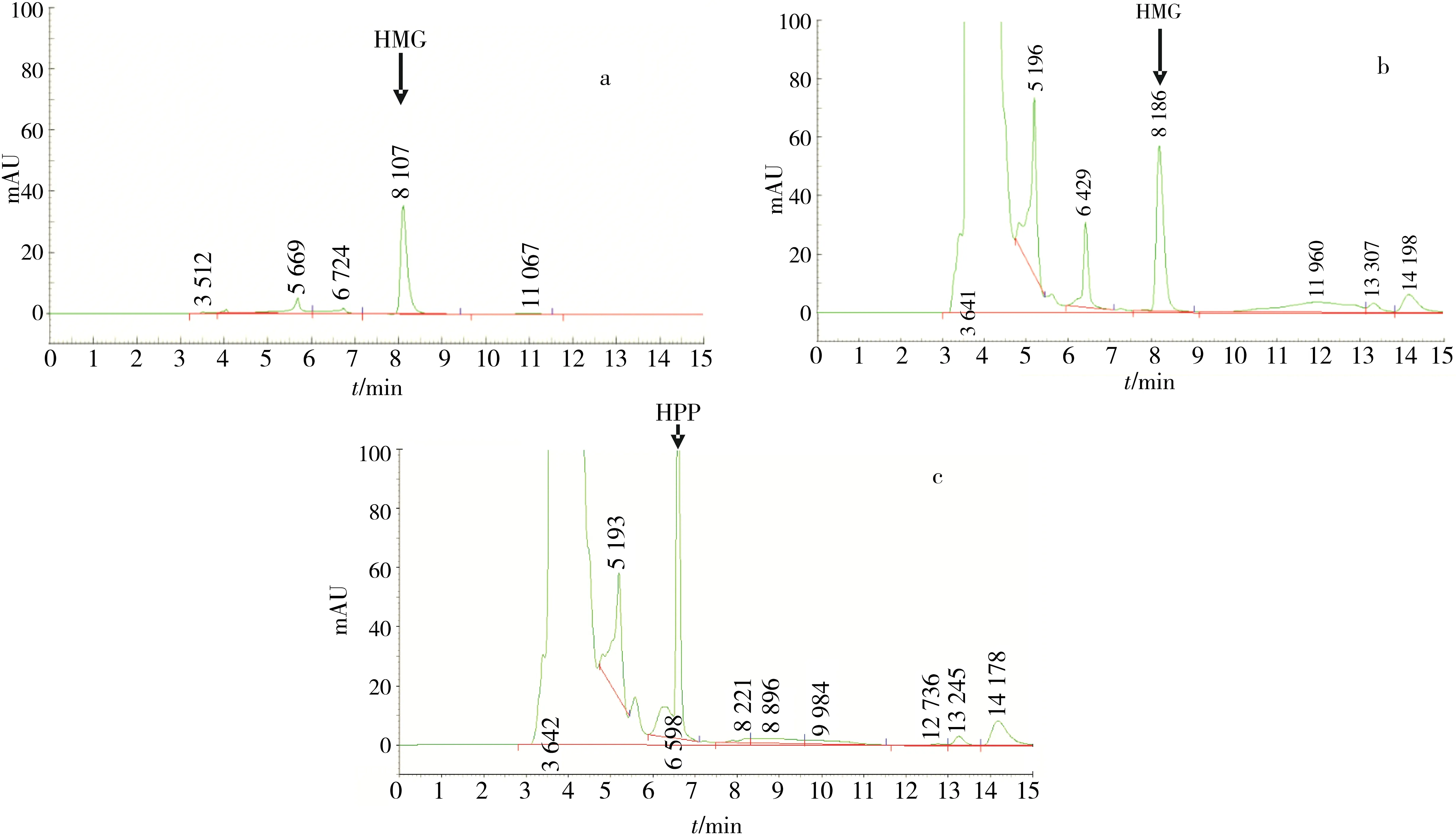
a.反应产物标准品尿黑酸(HMG),标准品浓度100 μmol/L,样品用量为25 μL;b.CjHPPD酶促反应体系,10 μL酶液 (37.18 μg脱盐蛋白);c.空载体对照菌反应体系.HMG为反应产物尿黑酸;HPP为酶作用底物对羟苯基丙酮酸.图6 CjHPPD酶促反应体系反应产物的HPLC图谱Fig.6 HPLC chromatogram of CjHPPD reaction production
2.5 LC-MS鉴定反应产物
为了进一步确定产物是尿黑酸,对酶促反应产物又进行了LC-MS检测,检测图谱如图7.实验结果说明,表达的CjHPPD重组酶蛋白能够催化由对羟苯基丙酮酸形成尿黑酸的生化反应,是有活性的酶蛋白.
2.6 重组CjHPPD的酶学性质分析
2.6.1 产物标准品HMG的HPLC标准曲线测定
精确配制产物标准品尿黑酸溶液,浓度分别为25、50 、75 、100 、200 μmol/L,混匀后加入TCA,涡旋,14 000 r/min离心5 min,使其与酶促反应产物的处理方式一致.分别取上清液在相同色谱条件下进样50 μL,以HPLC峰面积为纵坐标、标准品浓度为横坐标用Microsoft Excel 2003做出曲线如图8,色谱产物吸收峰面积与标准品浓度之间呈现出正线性关系,所以,酶促反应产物的色谱吸收峰面积可以表示出酶促反应产物的生成量,即酶的活性.

HPP为底物对羟苯基丙酮酸;HMG为反应产物尿黑酸.图7 CjHPPD酶促反应体系反应产物的LC-MS分析图谱Fig.7 LC-MS analysis of CjHPPD reaction product HMG

图8 反应产物尿黑酸HPLC标准曲线Fig.8 HPLC standard curve of reactionproduct homogentisate
2.6.2 酶促反应的时间曲线
选择标准酶促反应体系,反应温度37 ℃,以加入底物开始反应,反应时间分别为0、5、10、15、20、30、60、120 min,加入TCA停止反应后,离心取上清液,HPLC检测不同反应时间内的产物形成量,图9a显示,CjHPPD 催化对羟苯基丙酮酸转化成产物尿黑酸的生成量至少在10 min以内与反应时间呈线性关系,即随着时间的延长产物的积累成正比增加,但是当反应时间超过10 min以后反应产物的积累有所下降.所以选择反应时间5 min作为酶学性质分析时的反应时间.
2.6.3 CjHPPD的最适作用温度
选择标准酶促反应体系,先在选定温度下预热3 min,加入酶液开始反应,保温5 min,加入TCA终止反应,涡旋混匀后离心,取上清液用于HPLC测定反应产物.所用反应温度为10、25、30、37、40、45、50 ℃.图9b显示CjHPPD催化反应的最适温度为30 ℃,当高于或低于这一温度时,在相同的反应体系中产物的生成量都会降低,即酶的活性降低.
2.6.4 CjHPPD 的最适pH值
选择标准反应体系,改变pH值缓冲液的使用,使反应体系处于不同的pH值.使用醋酸钾缓冲液(KA buffer):pH值分别调整为 4.5、5.5、6.0;磷酸钾缓冲液(KP buffer):pH值分别调整为5.5、6.0、6.5、7.0、7.5、8.0.反应条件为30 ℃,5 min.反应产物经HPLC测定.图9c显示在底物HPP浓度为200 μmol/L,酶量为10 μL(37.2 μg蛋白质),反应温度为30 ℃条件下,CjHPPD催化对羟苯基丙酮酸转变为尿黑酸的最适pH值为6.5.

a.酶促反应的时间曲线;b.温度对酶促反应的影响;c.pH值对酶活性的影响;d.底物HPP浓度对酶活性的影响.图9 CjHPPD酶学特性分析Fig.9 Analysis of characteristics of CjHPPD
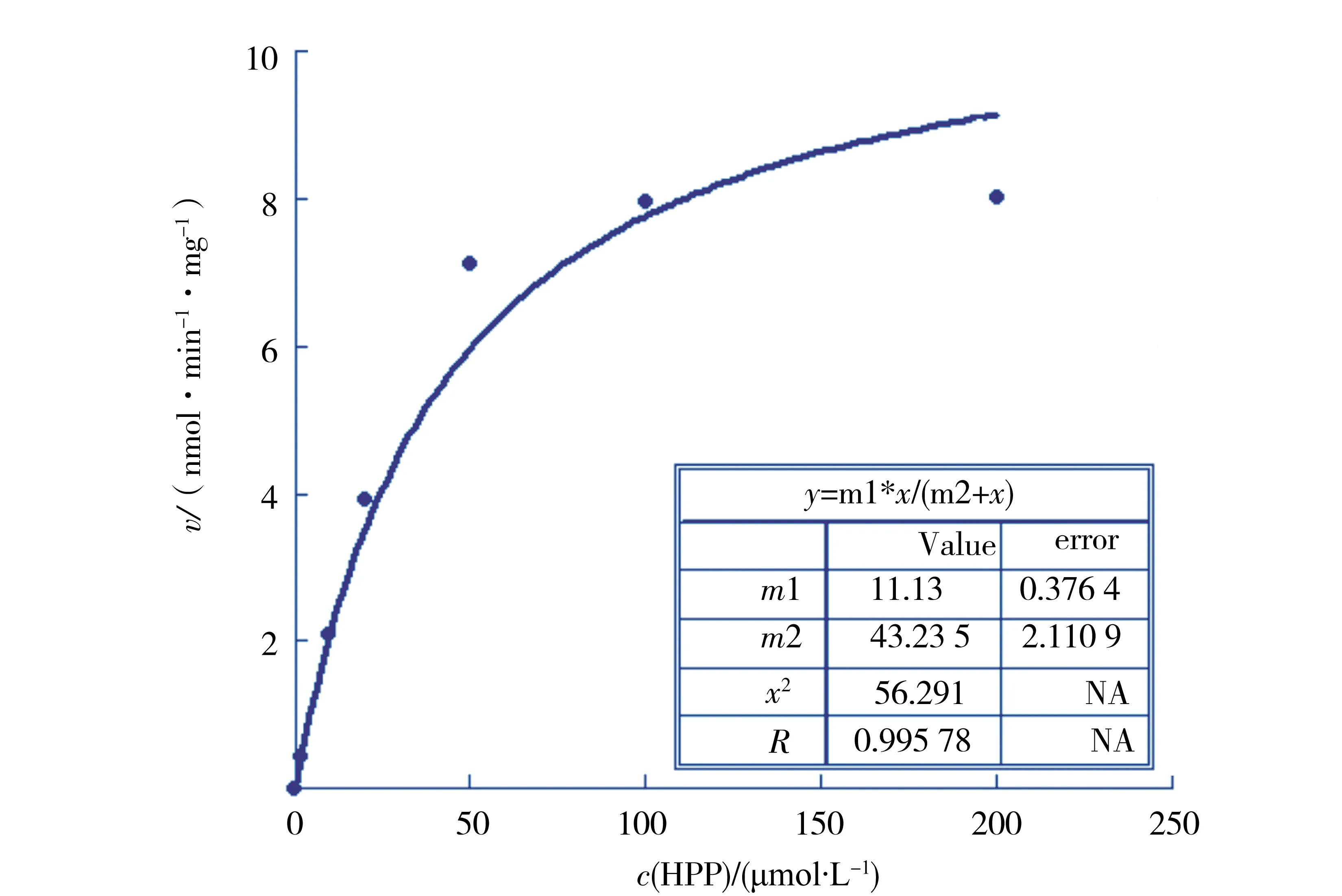
图10 CjHPPD 催化底物HPP 形成HMG反应的Km值计算Fig.10 Caculation of Km of CjHPPD for substrate HPP formation to HMG
2.6.5 底物浓度对CjHPPD活性的影响——Km值计算
为了研究CjHPPD与底物HPP的亲和性,在不同浓度的底物条件下进行酶促反应并测定酶的活性.底物浓度分别为2、10、20、50、100、200 μmol/L,酶的用量为10 μL (37.2 μg蛋白质),反应温度设为30 ℃,pH值为6.5,反应时间为5 min.以加入底物开始反应,加入TCA终止反应,反应产物经HPLC测定.以100 μmol/L尿黑酸标准品进样量50 μL的吸收峰面积换算出生成产物的物质的量(nmol),以其代表酶的活力,制作出曲线如图9d.以每mg酶蛋白每min催化酶促产应产生HMG的物质的量(nmol)作为酶促反应速度(nmol/min/mg),将实验数据利用Kaleida Graph(synergy software,reading,PA) 软件处理并计算米氏常数Km值(图10),数据符合Michaelis-Menten酶促动力学公式,结果显示当底物浓度低于20 μmol/L时,酶促反应速度随着底物浓度的增长呈直线增长;在底物浓度大于20 μmol/L低于100 μmol/L时,酶促反应速度随底物浓度的增加而增加,但是增加速度减慢;当底物浓度达到100 μmol/L时,酶促反应速度达到最大值,再增加底物浓度酶促反应速度不再增加.vmax为11.13 nmol/min/mg,CjHPPD的酶促动力学常数Km值为43.2 μmol/L.
3 讨论
对羟苯基丙酮酸双加氧酶(ρ-hydroxyphenylpyruvate dioxygenase,HPPD;EC.1.13.11.27)是生物体中芳香族氨基酸(苯丙氨酸、酪氨酸)分解代谢过程中的重要酶类.在植物体和光合细菌中,对羟苯基丙酮酸双加氧酶除了参与酪氨酸等的分解代谢,它还是质体醌和生育酚生物合成的关键酶.HPPD成为新型除草剂靶标酶和生育酚代谢途径工程的重要酶类.随着HPPD抑制型除草剂的使用,研究者们利用转基因技术培育转基因植物以扩大该类除草剂的除草谱和用于敏感作物[15-16].Garcia等[17]1997年从胡萝卜培养细胞中分离出了胡萝卜HPPD的cDNA,这是第1次从植物中分离克隆HPPD的cDNA.胡萝卜培养细胞的天然HPPD和重组的胡萝卜HPPD均受到其抑制剂的强烈抑制作用,即天然HPPD和重组HPPD均对除草剂高度敏感.已经研究的动物、植物和细菌等的HPPD均被其抑制剂强烈地抑制[18].
本研究从对HPPD抑制剂具有抗性的黄连培养细胞中获得的黄连HPPDcDNA进行原核表达得到重组CjHPPD,以对羟苯基丙酮酸(ρ-HPP)为底物进行体外酶促反应,经HPLC检测酶促反应的产物为尿黑酸(HMG),产物经LC-MS检测确定.结果表明重组蛋白具有HPPD酶活性.
酶学特性分析实验结果表明,CjHPPD催化反应的最适温度为30 ℃,最适pH值为6.5;在最适条件下,底物ρ-HPP浓度对酶活性的影响符合米氏公式,Km值为43.2 μmol/L.关于植物HPPD的酶学特性前人有一些研究报道,例如玉米HPPD最适温度为30 ℃,最适pH值为7.3,Km值为5 μmol/L[19];胡萝卜重组HPPD在反应温度30 ℃,pH值6.0的反应条件下,Km值为(7.5 ± 2.5)μmol/L[18];Garcia等[12]在研究拟南芥重组HPPD酶学特性时发现,其最适pH值为一个较宽的范围(6.5~7.5),Km值为5~8 μmol/L;稗草barnyardgrass (Fchinochloacrus-galli) HPPD的Km值为4.3 μmol/L[20].与其他植物HPPD相比较,CjHPPD的Km值明显高于其他植物种类,但是低于经过定点突变修饰的细菌HPPD G336W(Km值138 μmol/L)[3].CjHPPD对于底物ρ-HPP的高Km值表明CjHPPD催化大量的底物HPP以增加质体醌代谢流量,从而提高了黄连培养细胞对其竞争性抑制剂DTP的抗性.然而在研究中发现,CjHPPD的氨基酸序列同源性与其他植物HPPD表现出较高的同源性,尤其是与铁结合相关氨基酸残基等活性位点的氨基酸序列相似性很高,CjHPPD的高Km值的分子机理需要进一步的研究.HPPD抑制剂型除草剂作为HPPD的竞争性抑制剂影响敏感植物的生长,同时由于HPPD是质体醌和生育酚生物合成途径的限制因子[21],笔者发现的对除草剂具有抗性的CjHPPD为植物生育酚生物合成代谢途径工程以及抗除草剂基因工程提供了一个很好的途径.
致谢:感谢日本京都大学大学院生命科学研究科Minami Hiromichi博士对本文LC-MS检测的帮助;感谢国家留学基金委的资助.
[1] CROUCH N P,ADLINGTON R M,BALDWIN J E,et al.A mechanistic rationalization for the substrate specificity of recombinant mammalian 4-hydroxyphenylpyruvate dioxygenase (4-HPPD) [J]. Tetrahedron,1997,53:6993-7010.PII:S0040-4020(97)00398-0.
[2] SERRE L,SAILLAND A,SY D,et al.Crystal structure ofPseudomonasfluorescens4-hydroxyphenylpyruvate dioxygenase: an enzyme involved in the tyrosine degradation pathway[J].Structure,1999,7(8):977-988.DOI:http://dx.doi.org/10.1016/S0969-2126(99)80124-5.
[3] MATRINGE M,SLILLAND A,PELISSIER B,et al.ρ-hydroxyphenylpyruvate dioxygenase inhibitor-resistant plants[J].Pes Manag Sci,2005,61:269-276.DOI:10.1002/ps.997.
[4] GUNSIOR M,RAVEL J,CHALLIS G L,et al.Engineeringρ-hydroxyphenylpyruvate dioxygenase to aρ-hydroxymandelate synthase and evidence for the proposed benzene oxide intermediate in homogentisate formation[J].Biochemistry,2004,43 (3):663 -674.DOI:10.1021/bi035762w.
[5] NORRIS S R,SHEN X,DELLAPENNA D.Complementation of theArabidopsispds1 mutation with the gene encodingρ-hydroxyphenylpyruvate dioxygenase[J].Plant Physiol,1998,117:1317-1323.DOI: https://doi.org/10.1104/pp.117.4.1317.
[6] FALK J,ANDERSEN G,KERNEBECK B,et al. Constitutive overexpression of barley 4- hydroxyphenylpyruvate dioxygenase in tobacco results in elevation of the vitaminEcontentin seeds but not in leaves[J].FEBS Letters,2003,540:35-40.DOI:10.1016/S0014-5793(03)00166-2.
[7] BARTLEY G E,MAXWELL C A,HANNA W S,et al.Cloning and biochemical characterization of recombinant 4-hydroxyphenylpyruvate dioxygenase fromArabidopsisthaliana[J].Plant Physiol,1997,114:1587-1593.DOI: https://doi.org/10.1104/pp.119.4.1507.
[8] GARCIA I,RODGERS M,LENNE C,et al.Subcellular localization and purification of aρ-hydroxyphenylpyruvate dioxygenase from cultured carrot cells and characterization of the corresponding cDNA[J].Biochem J,1997,325:761-769.PMCID:PMC1218621.
[9] KIM K H,PETERSEN M.cDNA-cloning and functional expression of hydroxyphenylpyruvate dioxygenase from cell suspension cultures ofColeusblumei[J].Plant Sci,2002,163:1001-1009.
[10] XIAO Y,DI P,CHEN J F,et al. Characterization and expression profiling of 4-hydroxyphenylpyruvate dioxygenase gene (Smhppd)fromSalviamiltiorrhizahairy root cultures[J]. Mol Biol Rep,2009,36:2019-2029.DOI:10.1007/s11033-008-9413-2.
[11] MA R,KAUNDUN S S,TARANEL P J,et al.Distinct detoxification mechanisms confer resistance to mesotrione and atrazine in a population of waterhemp[J].Plant Physiol,2013,163:363-377.DOI: 10.1104/pp.113.223156.
[12] GARCIA I,RODGERS M,PEPIN R,et al.Characterization and subcellular compartmentation of recombinant 4-hydroxyphenylpyruvate dioxygenase fromArabidopsisin transgenic tobacco[J].Plant Physiol,1999,119:1507-1516.DOI: https://doi.org/10.1104/pp.119.4.1507.
[13] LIANG Y L,MINAMI H,SATO F.Isolation of herbicide-resistant 4-hydroxyphenylpyruvate dioxygenase from culturedCoptisjaponicacells[J].Biosci Biotechnol Biochem,2008,72(11):3059-3062.DOI:10.1271/bbb.80466.
[14] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem,1976,72:248-254.
[15] 梁玉玲,于静娟. 新型白化型除草剂靶标酶对羟苯基丙酮酸双加氧酶及其耐性转基因植物研究进展[J].中国生物工程杂志,2009,29(12):100-107.DOI:10.13523/j.cb.20091219.
LIANG Y L,YU J J.Advancs in a new target for bleaching-herbicide ρ-hydroxyphenylpruvate dioxygenase and herbicide-resistant transgenic plants [J].China Biotechnology,2009,29(12):100-107.
[16] SIEHL D L,TAO Y,ALBERT H,et al. Broad 4-Hydroxyphenylpyruvate dioxygenase inhibitor herbicide tolerance in soybean with an optimized enzyme and expression cassette[J]. Plant Physiol,2014,166:1162-1176.DOI:10.1104/pp.114.247205.
[17] GARCIA I,RODGERS M,LENNE C,et al. Subcellular localization and purification of a ρ-hydroxyphenylpyruvate dioxygenase from cultured carrot cells and characterization of the corresponding cDNA[J].Biochem J,1997,325:761-769.PMCID:PMC1218621.
[18] GARCIA I,JOB D,MATRINGE M.Inhibition ofρ-hydroxyphenylpyruvate dioxygenase by the diketonitrile ofIsoxaflutole: a case of half-site reactivity[J].Biochemistry,2000,39: 7501-7507.DOI:10.1021/bi000135h.
[19] BARTA I S,BOEGER P. Purification and characterizatin of 4-hydroxyphenylpyruvate dioxygenenase from maize[J].Pestic Sci,1996,48:109-116.
[20] SECOR J.Inhibition of barnyardgrass 4-hydroxyphenylpyruvate dioxygenase by Suicotrione[J].Plant Physiol,1994,106:1429-1433.PMCID:PMC159682
[21] TSEGAYE Y,SHINTANI D K,DELLA P D.Over-expression of the enzyme ρ-hydroxyphenylpyruvate dioxygenase inArabidopsisand its relation to tocopherol biosynthesis[J].Plant Physiol Biochem,2002,40:913-920.
Prokaryoticexpressionandcharacterizationofρ-hydroxyphenylpyruvatedioxygenasefromculturedCoptisjaponicacells
LIANGYuling1,2,SATOFumihiko3
(1.College of Life Sciences,Hebei University,Baoding 071002,China; 2.Biological Engineering Technology Research Center in Hebei Province,Baoding 071002,China; 3.Graduate School of Biostudies,Kyoto University,Kyoto 606-8502,Japan)
To characterize theρ-hydroxyphenylpyruvate dioxygenase from culturedCoptisjaponicacells (CjHPPD),recombinant protein was produced inE.coli. When the enzyme activity of recombinant CjHPPD was measured in vitro,the formation of homogentisate was determined by HPLC and confirmed by LC-MS analysis. Enzyme assays indicated that the optimum pH for the reaction of HPP transfer to homogentiaste was approximately 6.5. A time course study showed that the accumulation of homogentisate was linear with time for at least 10 min in the presence of 10 μL(37.18 μg) of desalted enzyme and 200 μmol/L hydroxyphenlpyruvate. The optimum temperature was 30 ℃. Characterization of the substrate affinity of recombinant CjHPPD using HPP as the substrate indicated that CjHPPD also followed Michaelis-Menten-type kinetics andKmwas estimated to be 43.2 μmol/L. TheKmof CjHPPD was much higher than the reported values for the HPPD enzyme from other plants. Since HPPD inhibitors are known to compete for the substrate for binding,the higherKmvalue of HPP might affect herbicide tolerance.
Coptisjaponica;ρ-hydroxyphenylpyruvate dioxygenase; prokaryotic expression; characterization;Kmvalue
10.3969/j.issn.1000-1565.2017.06.008
2017-05-26
河北省自然科学基金资助项目(C2013201126)
梁玉玲(1965—),女,河北定州人,河北大学教授,主要从事植物分子生物学与基因工程研究.
E-mail: yuling_liang@163.com
Q786
A
1000-1565(2017)06-0605-09
赵藏赏)
