安吉白茶愈伤组织增殖培养及茶多酚的积累
2018-01-05林昱星肖泽丰田璧瑞郝娜王俊丽
林昱星,肖泽丰,田璧瑞,郝娜,王俊丽
(中央民族大学 生命与环境科学学院,北京 100081)
安吉白茶愈伤组织增殖培养及茶多酚的积累
林昱星,肖泽丰,田璧瑞,郝娜,王俊丽
(中央民族大学 生命与环境科学学院,北京 100081)
为了有效利用安吉白茶资源,以安吉白茶幼叶作为外植体,探讨了不同植物生长调节剂对愈伤组织诱导、增殖及茶多酚积累的影响.研究结果表明,TDZ有利于愈伤组织的诱导、增殖及茶多酚的积累,当TDZ的质量浓度为 1.0 mg/L时,愈伤组织的诱导率为92.1%,茶多酚的质量分数为20.6%,表儿茶素的相对含量为5.3%.
安吉白茶;愈伤组织;茶多酚;GC-MS分析
安吉白茶原产于浙江省安吉县,是茶(Camelliasinensis(L.) O.Ktze.)的一种白化突变类型,春季幼叶呈白色.目前中国南方多地引种安吉白茶[1-3].
茶多酚是茶树中重要的次生代谢产物,其具有多种药理作用和保健功效.于淑池等[4]研究发现,安吉白茶所含的茶多酚是一种潜在天然抗氧化剂,可在食品和医药中广泛应用.吕娜等[5]研究表明,安吉白茶含有黄酮类化合物,具有较强的抗氧化活性和清除自由基的作用.夏道宗等[6]研究发现,安吉白茶中的茶多糖可显著抑制瘤株S180细胞和H22腹水型肝癌移植瘤的生长,可使荷S180实体瘤小鼠巨噬细胞的吞噬能力显著提升.Hajiaghaalipour等[7]研究发现,白茶提取物能有效保护细胞系(3T3-L1)DNA免受损伤,并能抑制肿瘤细胞(HT-29)的增殖.此外,安吉白茶提取液对黄杆菌的生长有明显的抑制作用,这种抑制作用是通过对菌体细胞膜的破坏和对磷代谢的干扰而实现的[8].
安吉白茶对高温、干旱、低温冻害、强光照射的耐受能力弱,加之采摘时间受限、产量较低,在市场中常出现供不应求的局面.因此本研究通过对安吉白茶的组织培养,探索细胞生物量快速增长的适宜条件,促进茶多酚的合成与积累,为茶多酚工业化生产奠定基础.
1 材料与方法
1.1 实验材料与消毒处理
安吉白茶幼叶采自贵州省德江县平原乡.幼叶先用自来水冲洗1 h,之后用体积分数为70%的乙醇消毒30 s,再用质量分数为0.1%的氯化汞溶液消毒8 min,最后用无菌水漂洗3~5次,备用.
1.2 接种与培养
在洁净工作台中,将无菌叶片切成0.5 cm×0.5 cm的小块,进行接种培养.所用培养基为MS培养基,并添加蔗糖(30 g/L)和琼脂(7 g/L),pH值调至5.8左右,在121 ℃条件下灭菌20 min.培养温度为(25±2)℃,光照强度为2 500~3 000 lx,光照时间为12 h/d.
1.3 愈伤组织的诱导
将消毒后的叶片外植体分别接种于含有不同质量浓度植物生长调节剂的MS培养基中进行诱导培养,2,4-D、NAA、6-BA、KT、TDZ的质量浓度均为0、0.5、1.0、2.0、4.0 mg/L.每个处理包含10瓶,每瓶接种5个叶片外植体,设置3次重复,于30 d后统计愈伤组织的诱导率.
1.4 愈伤组织增殖培养
选取生长状态良好的愈伤组织切成小块,接种到不同培养基中,每瓶接种0.8 g(鲜质量),每个处理包含10瓶,设置3次重复,培养45 d后收获愈伤组织并称量鲜质量和干质量.
1.5 茶多酚含量测定
茶多酚含量测定方法参照GB/T 8313—2008,采用分光光度计进行测定.
1.6 愈伤组织醇提物的制备
准确称取10 g磨碎的干愈伤组织或安吉白茶干叶片,加入250 mL体积分数为70%的甲醇,于70 ℃水浴中浸提10 min,重复浸提1次,合并上清液,抽滤,采用旋转蒸发仪减压浓缩,浸膏自然晾干.
1.7 醇提物GC-MS分析
准确称取浸膏样品0.12 g,取200 mL吡啶和100 mL的TMS在75 ℃水浴条件下硅烷化反应60 min,离心(8 000 r/min,10 min),取上层液进样,采用气质联用仪(AGILENT 5975/19091Z-433型)进行测定.所用毛细管柱为HP-35ms(30.0 m×0.25 mm×0.25 μm),以He气为载气,液体流速为 1 mL/min,进样量为1 μL,进样口温度为280 ℃.电子轰击(El)源,电压 70 eV,扫描 20~800 amu,借助质谱数据库NISTOS进行成分分析.
1.8 统计方法
数据分析采用SPSS 18.0软件中的ANOVA (one-way anova statistics)程序,采用Duncan比较法进行分析.
2 结果与分析
2.1 愈伤组织的诱导
研究发现,培养基分别添加不同质量浓度的单一植物生长调节剂(2,4-D、NAA、6-BA、KT、TDZ)时,愈伤组织的诱导效应明显不同(表1).
培养基中附加不同质量浓度(0.5、1.0、2.0、4.0 mg/L)的2,4-D时,30 d后仅能诱导出少量乳白色愈伤组织.当2,4-D质量浓度为1.0 mg/L时,叶片愈伤组织的诱导率为75.7%,但随着2,4-D质量浓度的升高,诱导率明显降低.

表1 2,4-D、NAA、6-BA和TDZ对安吉白茶愈伤组织诱导的影响

培养基附加不同质量浓度的NAA时所诱导出的愈伤组织也为乳白色,且质地较硬.当NAA的质量浓度为1.0~4.0 mg/L时,愈伤组织的诱导率为86.0%~87.0%.将外植体接种于含有不同质量浓度6-BA的培养基中,30 d后能诱导出黄绿色的愈伤组织,但诱导率不高,最高值仅为60.6%.
培养基中分别附加不同质量浓度(0.5、1.0、2.0、4.0 mg/L)的TDZ时,15 d左右就可诱导出疏松的红色愈伤组织.当TDZ质量浓度为1.0 mg/L时,诱导率最高,达92.1%.
然而,当MS培养基中附加KT时,无论其质量浓度高低,均不能诱导出愈伤组织.
2.2 愈伤组织的生长动态
将愈伤组织切成小块,接种在MS+TDZ 1.0 mg/L培养基上,每瓶接种0.8 g(鲜质量),每隔5 d取3瓶称量其鲜质量和干质量(于50 ℃烘箱中烘干),重复3次.细胞生长动态如图1.

a.鲜质量,b.干质量.图1 愈伤组织生长动态曲线Fig.1 Growth curve of callus
从图1可以看出,安吉白茶愈伤组织的鲜质量和干质量在第11~45 d处于快速增长期,至第45 d时生长量达到最大值.因此,第45 d是采收愈伤组织的最佳时间.
2.3 愈伤组织的增殖
将愈伤组织接种到添加不同质量浓度的IAA、6-BA和TDZ的MS培养基中进行增殖培养,其增殖效应如表2所示.

表2 IAA、6-BA和TDZ对愈伤组织增殖的影响

从表2中可以看出,IAA和TDZ有利于愈伤组织的增殖.当IAA质量浓度为1.0 mg/L时,愈伤组织的鲜质量和干质量到达最大值,分别为10.7 g和0.83 g,分别增长了13倍和20倍.当培养基中添加不同质量浓度的TDZ时,所增殖的愈伤组织大部分呈红色,质地较疏松.当TDZ质量浓度为1.0 mg/L时,愈伤组织的鲜质量和干质量达到最大值,分别为13.3 g和0.81 g,分别增长了16倍和20倍.
2.4 不同愈伤组织中茶多酚的含量
选取不同愈伤组织测定茶多酚的含量,以栽培植株叶片为对照组,其结果见表3.

表3 不同愈伤组织中茶多酚含量

从表3可知,MS培养基中附加TDZ 1.0 mg/L时,愈伤组织中茶多酚的质量分数高达20.6%,是栽培植株的叶片茶多酚含量的1.6倍,因此MS+TDZ 1.0 mg/L是茶多酚积累的最佳培养基.
2.5 不同愈伤组织中化学成分的比较
不同愈伤组织的醇提物的GC-MS分析结果如表4所示.从6个样品中共检出氨基酸类、多酚类、酯类、羧酸类、醇类、胺类、生物碱等48种成分.6个样品中均检测出表儿茶素,其相对含量分别为2.09%、2.08%、5.08%、2.14%、5.30%、2.90%,表儿茶素相对含量最高的是样品5;此外,只在样品2、3、5中检测到了芥子酸.
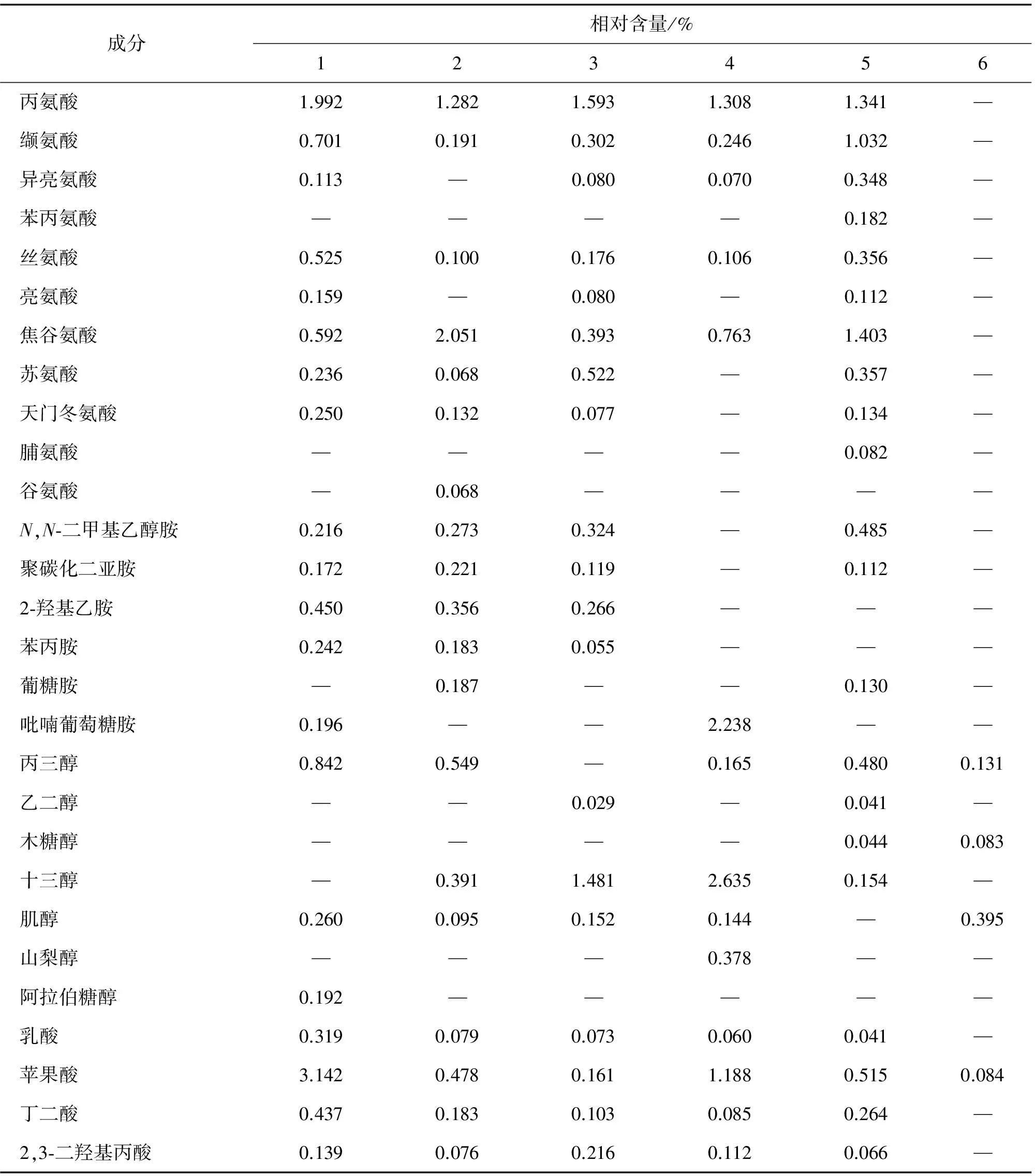
表4 不同样品的GC-MS分析

续表4
3 讨论
3.1 愈伤组织的诱导与增殖
植物生长调节剂的种类和浓度是愈伤组织诱导成功的关键.本研究发现,KT不能诱导愈伤组织的产生.2,4-D、NAA、6-BA虽能诱导出愈伤组织,但愈伤组织均生长缓慢,且褐化严重,不利于增殖培养.TDZ有利于愈伤组织的诱导和增殖,尤其是当TDZ质量浓度为1.0 mg/L时愈伤组织的诱导效果最好,诱导率可达到92.1%,且愈伤组织生长旺盛,增殖最快.薛寒青等[9]研究发现,TDZ有利于大蒜愈伤组织的诱导.康大力等[10]研究发现,质量浓度为1.0 mg/L 的TDZ有利于喜树愈伤组织的生长.Wang等[11]研究也发现,单独使用TDZ时,狼毒愈伤组织的增殖效应明显.
3.2 愈伤组织中茶多酚的积累
本研究发现,在培养基中添加IAA、TDZ有利于茶多酚的积累,而培养基中添加2,4-D、NAA则不利于茶多酚的积累.MS+IAA 1.0 mg/L和MS+TDZ 1.0 mg/L培养的愈伤组织茶多酚含量分别为17.0%和20.6%,远高于栽培植株的叶片茶多酚质量分数(12.94%).而杜鸿标等[12]研究发现,在培养基中附加KT、2,4-D时,有利于金牡丹茶愈伤组织茶多酚的合成,与本研究结果不一致,这可能是由于品种间的差异所致.
[1] 郭雅敏.安吉白茶的性状与发展前景[J].茶叶,1997(4):23-24.
GUO Y M.Characteristics and development prospects of Anji Baicha [J].Journal of Tea,1997(4):23-24.
[2] LI Q,HUANG J A,LIU S Q,et al.Proteomic analysis of young leaves at three developmental stages in albino tea cultivar [J].Proteome Science,2011,9(1):44.DOI: 10.1186/1477-5956-9-44.
[3] 陆文渊,钱文春,赖建红,等.安吉白茶产业的现状及发展对策[J].茶叶科学技术,2012(1):25-27.
LU W Y,QIAN W C,LAI J H,et al.Development status and its countermeasures of Anji Baicha[J].Tea Science and Technology,2012(1):25-27.
[4] 于淑池,刘畅,王乘慧,等.安吉白茶茶多酚的抗氧化活性研究[J].时珍国医国药,2012,23(5):1184-1187.DOI:10.3696/j.issn.1008.0805.2012.05.062.
YU S C,LIU C,WANG C H,et al.Antioxidant activity of tea polyphenols of Anji Baicha[J].Lishizhen Medicine and Materia Medica Research,2012,23(5):1184-1187.DOI:10.3696/j.issn.1008.0805.2012.05.062.
[5] 吕娜,张伟臻,陈林龙,等.安吉白茶黄酮抗氧化活性的体外实验研究[J].毒理学杂志,2014,28(5):389-392.DOI: 10.16421/j.cnki.1002-3127.2014.05.008.
LÜ N,ZHANG W Z,CHEN L L,et al.Invitroexperimental study on antioxidant activity of flavonoids of Anji Baicha [J].Journal of Toxicology,2014,28(5):389-392. DOI: 10.16421/j.cnki.1002-3127.2014.05.008.
[6] 夏道宗,张元君,倪达美,等.安吉白茶多糖抗肿瘤及免疫调节研究[J].茶叶科学,2013,33(1):40-44.DOI:10.13305/j.cnki.jts.2013.01.008.
XIA D Z,ZHANG Y J,NI D M,et al.Studies on antitumor and immune regulation of polysaccharide of Anji Baicha[J].Tea Science and Technology,2013,33(1):40-44.DOI:10.13305/j.cnki.jts.2013.01.008.
[7] HAJIAGHAALIPOUR F,KANTHIMATHI M S,SANUSI J,et al.White tea (Camelliasinensis) inhibits proliferation of the colon cancer cell line,HT-29,activates caspases and protects DNA of normal cells against oxidatiive damage[J].Food Chemistry,2015,169: 401-410. DOI: 10.1016/j.foodchem.2014.07.005.
[8] 吕娜,韦薇,顾帅,等.安吉白茶对柱状黄杆菌抑菌机理的研究[J].中国畜牧兽医,2015,42(1):136-139.DOI:10.16431/j.cnki.1671-7236.2015.01.021.
LÜ N,WEI W,GU S,et al.Study on bacteriostatic mechanism of flavobacterium columnare of Anji Baicha[J].China Animal Husbandry & Veterinary Medicine,2015,42(1):136-139. DOI:10.16431/j.cnki.1671-7236.2015.01.021.
[9] 薛寒青,王舰,周淑兰.TDZ对诱导大蒜愈伤组织形成的影响[J].长江蔬菜,2009(14):19-20.DOI:10.3865/j.issn.1001-3547.2009.14.006.
XUE H Q,WANG J,ZHOU S L.Effect of TDZ on callus induction of garlic [J].Journal of Changjiang Vegetables,2009(14):19-20.DOI:10.3865/j.issn.1001-3547.2009.14.006.
[10] 康大力,张洪利,莫小路,等.TDZ对喜树愈伤组织生长及色素积累的影响[J].生物技术,2012,22(1):83-85. DOI: 10.3696/j.issn.1004-311x.2012.01.023.
KANG D L,ZHANG H L,MO X L,et al.Effect of TDZ on callus of growth and pigment accumulation ofCamptothecaacuminata[J].Biotechnology,2012,22(1):83-85. DOI:10.3696/j.issn.1004-311x.2012.01.023.
[11] WANG J L,XIAO X,WANG Q,et al.Accumulation of flavonoids and antioxidant activity ofStellerachamaejasmeby an efficient callus culture[J].Hort Environ Biotechhnol,2013,54(5):441-449.DOI 10.1007/s13580-013-0171-2.
[12] 杜鸿标,王坤波,陈勤操,等.茶树愈伤组织诱导培养及儿茶素合成的研究[J].茶叶通讯,2014,41(1):11-14.
DU H B,WANG K B,CHEN Q C,et al.Study on callus induction and catechin synthesis of tea [J]. Tea Communication,2014,41(1):11-14.
CallusproliferationandaccumulationofteapolyphenolsofAnjiBaicha
LINYuxing,XIAOZefeng,TIANBirui,HAONa,WANGJunli
(College of Life and Environmental Sciences,Minzu University of China,Beijing 100081,China)
For utilization of Anji Baicha,the effects of different plant growth regulators on callus,proliferation and accumulation of tea polyphenols of Anji Baicha were investigated using leaf as explants.The results showed that TDZ was more effective for callus induction,proliferation and accumulation of tea polyphenols.The callus induction frequency reached 92.1 % when the concentration of TDZ was as high as 1.0 mg/L.The mass fraction of tea polyphenols was 20.6%,and the relative abundance of epicatechin increased to 5.3%.
Anji Baicha; callus proliferation; tea polyphenols; GC-MS analyses
10.3969/j.issn.1000-1565.2017.06.009
2016-09-20
国家重大科学仪器设备开发专项(2012YQ03026108);高等学校学科创新引智计划资助项目(B08044);一流大学一流学科建设项目(ydzxxk201619)
林昱星(1992—),女,新疆乌鲁木齐人,中央民族大学在读硕士研究生,主要从事生物资源保护和利用方面的研究.E-mail:1011421595 @qq.com
王俊丽(1964—),女,河北新乐人,中央民族大学教授,博士生导师,主要从事植物细胞工程及资源利用研究.
E-mail:wangjunli1698@163.com
Q945
A
1000-1565(2017)06-0614-07
赵藏赏)
