槲皮素对高糖培养海马神经元凋亡及Akt、p-Akt、Bcl-2、Bax蛋白表达的影响①
2018-01-05闫斌王靖博张宏田国庆刘玉琴
闫斌,王靖博,张宏,田国庆,刘玉琴
槲皮素对高糖培养海马神经元凋亡及Akt、p-Akt、Bcl-2、Bax蛋白表达的影响①
闫斌1,王靖博1,张宏2,田国庆1,刘玉琴2
目的探讨槲皮素对高糖培养海马神经元凋亡影响的可能作用机制。方法新生24 h Sprague-Dawley大鼠,取海马神经元原代培养,分为正常对照组、高糖组、槲皮素组、槲皮素+Akt抑制剂组和Akt激动剂组。各组在不同条件培养基中培养72 h后流式细胞仪检测细胞凋亡率,Western blotting检测各组神经元p-Akt、Akt、Bcl-2和Bax蛋白表达。结果与正常对照组相比,高糖组细胞凋亡率明显升高(P<0.01),p-Akt/Akt和Bcl-2/Bax均明显减少(P<0.01);与高糖组比较,槲皮素组、Akt激动剂组细胞凋亡率明显下降(P<0.01),p-Akt/Akt和Bcl-2/Bax均明显升高(P<0.01)。与槲皮素+Akt抑制剂组比较,槲皮素组细胞凋亡率明显下降(P<0.01),p-Akt/Akt和Bcl-2/Bax均明显升高(P<0.01)。结论槲皮素能够减少高糖培养下海马神经元的凋亡,其作用机制与增加Akt信号通路中Akt蛋白磷酸化的程度,进而增加Bcl-2蛋白的表达、抑制Bax蛋白的表达有关。
槲皮素;蛋白激酶B;高糖;海马神经元;凋亡;大鼠
随着世界糖尿病患病率逐年增加,糖尿病慢性并发症给患者和社会带来的负担日益沉重,其中糖尿病认知功能障碍严重影响患者的学习记忆能力和执行功能,受到越来越多的重视。关于糖尿病认知功能障碍的发病机制,目前认为与高浓度的血糖水平在大脑神经元中通过渗透压的改变、氧化应激、慢性高血糖导致晚期糖基化终末产物(advanced glycationend products,AGEs)等多种机制[1],造成神经元损伤、海马体结构发生变化有关[2]。这被认为是2型糖尿病患者较非糖尿病患者形成认知障碍、脑萎缩风险更高的原因之一。
菟丝子是临床常用治疗糖尿病认知功能障碍的药物,槲皮素(quercetin)是菟丝子的有效成分。本实验以原代培养海马神经元为靶细胞,观察槲皮素对高糖环境下海马神经元凋亡及蛋白激酶B(protein kinase B,Akt)、p-Akt、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 Associated X Protein,Bax)表达的影响,以期探讨槲皮素对高糖培养海马神经元的保护机制。
1 材料与方法
1.1 动物
SPF级新生24 h Sprague-Dawley大鼠,体质量4~6 g,购自北京华阜康生物科技有限公司,许可证号SCXK(京)2009-0004。
1.2 主要试剂与设备
槲皮素,分子式C15H10O7,分子量302.24,纯度99.1%,批号100081-201610:中国食品药品检定研究院。Akt信号通路抑制剂MK-2206 2HCl,分子式C25H21N5O·2HCl,分子量480.39,纯度99.91%,货号S1078:美国SELLECK公司。Akt信号通路激动剂SC79,分子式C17H17ClN2O5,分子量364.78,纯度>97%,货号S7863:美国SELLECK公司。葡萄糖(Glu):北京国药集团化学试剂有限公司。DMEM-高糖、PBS:北京协和细胞资源中心。Neurobasal®-A、B-27®Serum-Free Supplement:美国 GIBCO 公司。BCA蛋白浓度测定试剂盒:江苏碧云天生物技术研究所。DAB显色试剂盒:北京中杉金桥公司。
Fresco冷冻离心机:美国THERMO公司。TD5A-WS台式低速离心机:湖南湘仪实验室仪器开发有限公司。电泳仪、蛋白湿转电转仪:美国BIO-RAD公司。ImageQuant LAS 4000mini凝胶成像系统:美国GE公司。
1.3 方法
1.3.1主要溶液、试剂的配置
DMEM完全培养基:DMEM-高糖培养基180 ml加入胎牛血清(fetal bovine serum,FBS)(终浓度10%)、谷氨酰胺2 mmol/L、丙酮酸钠1 mmol/L、Hepes 20 mmol/L、双抗(青霉素 100 U/ml,链霉素 100 μg/ml)、神经生长因子(nerve growth factor,NGF)10 ng/ml,置4℃冰箱保存备用。
Neurobasal+B27培养基:Neurobasal®-A培养基100 ml加入B-27添加剂及L-谷氨酞胺(终浓度1 mmol/L)溶液2 ml混合均匀,置4℃冰箱保存备用。
槲皮素储存液:微量天平称取槲皮素15.11 mg,溶于DMSO 2.5 ml,充分混匀,0.22 μm滤器过滤,终浓度20 mmol/L,-20℃避光保存。
MK-2206 2HCl储存液:微量天平称取MK-2206 2HCl 5 mg,溶于DMSO 2.08 ml,充分混匀,0.22 μm滤器过滤,终浓度5 mmol/L,-20℃避光保存。
SC79储存液:微量天平称取SC79 5 mg,溶于DMSO 1.37 ml充分混匀,0.22 μm滤器过滤,终浓度10 mmol/L,-20℃避光保存。使用时用DMEM完全培养基稀释储存液至需要浓度。
1.3.2分组
正常对照组:Neurobasal+B27完全培养基(含25 mmol/L葡萄糖)。高糖组:在Neurobasal+B27完全培养基中添加葡萄糖,使培养基中葡萄糖终浓度为50 mmol/L。槲皮素组:高糖组培养基+0.01 μmol/L槲皮素。槲皮素+Akt抑制剂组:高糖组培养基+0.01 μmol/L 槲皮素+0.3 μmol/L MK-2206 2HCl。Akt激动剂组:高糖组培养基+5 μmol/L SC79。
1.3.3海马神经元的分离、纯化与培养
出生24 h新生鼠,75%酒精浸泡5 min,取出后置-20℃约3~5 min,分离脑内两侧海马组织;用D-Hank氏液冲洗2次后将组织剪碎至0.5~1.0 mm3,加入0.25%胰蛋白酶37℃消化约20 min;观察液体呈一定悬浊度即加入FBS终止消化,用200目细胞筛过筛,收集细胞悬液;将细胞悬液小心加入15 ml离心管中淋巴细胞分离液(与细胞悬液的比例1∶1.6)的上层,2000 r/min离心20 min,收集细胞层细胞;用D-Hank氏液重悬细胞,1500 r/min再次离心5 min;弃上清,用DMEM完全培养基30 ml重悬细胞,细胞计数后按一定的细胞密度接种于多聚赖氨酸(Poly-D-lysine,PDL)包被的培养瓶或培养板中。
1.3.4海马神经元的鉴定
将细胞悬液以5×105/孔的浓度接种到预先放置了盖玻片的6孔培养板中,培养72 h取出盖玻片进行免疫荧光鉴定,共聚焦激光显微镜检测非特异性酯酶(nonspecial esterase,NSE)的表达。取出盖玻片,0.01 mmol/L PBS浸洗后加入4℃预冷的4%多聚甲醛常温固定1 h;0.01 mmol/L PBS漂洗2 min,共3次,加入0.1%Triton-X100浸泡10 min;0.01 mmol/L PBS清洗2 min,共3次,加入山羊血清封闭液与非特异性蛋白结合,室温孵育20 min;加入兔抗鼠NSE多克隆抗体(1∶10),湿盒内37℃孵育1 h,阴性对照组以0.01 mmol/L PBS代替一抗;0.01 mmol/L PBS清洗2 min,共3次,加入异硫氰酸荧光素(fluorescein isothiocyanate,FITC)偶联山羊抗兔IgG(1∶50),37℃湿盒避光孵育1 h;0.01 mmol/L PBS振洗5 min,共6次,加入苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)工作液封片;使用共聚焦激光显微镜进行检测,所摄图像以Leica Confocal图像分析软件分析,每组计数15~20个细胞。
1.3.5流式细胞仪检测海马神经元凋亡率
将细胞悬液以1.5×106/瓶的密度接种到预先用0.01%PDL包被的T25培养瓶中,每瓶接种6 ml。细胞生长至72 h,根据上述实验分组,更换不同条件的培养基。72 h时弃掉原培养基,用D-Hank氏液轻轻清洗1次,弃上清。每个培养瓶加入0.05%胰酶-EDTA 3 ml,37℃消化约1 min。倒置相差显微镜下观察,部分细胞突触连接消失,细胞呈小圆形,浮起,即用吸管轻轻吹打细胞,加入FBS 1 ml终止消化,并将细胞悬液吸入15 ml离心管中。800 r/min离心5 min,弃上清。加入PBS 5 ml,重悬细胞。800 r/min再次离心5 min,弃上清。按照Annexi n-V-FLUOS试剂盒的说明,避光配置反应液。每组加入反应液100 μl,正常对照组另设立3个阴性对照组,即分别加入Hepes、Annexin-V-Fluos、PI各100 μl。各组避光反应15 min。每组加入PBS 1 ml,使用流式细胞仪检测各组神经元,记录结果。
1.3.6 Western blotting检测p-Akt、Akt、Bcl-2和Bax蛋白的表达
将待检测的各组细胞样本加入预冷RIPA裂解液,冰上孵育20 min,离心取上清,按照BCA蛋白浓度测定试剂盒的使用方法计算出各组蛋白浓度;根据目的蛋白的分子量加入等量2×SDS-PAGE加样缓冲液,100℃加热5 min使蛋白充分变性;冷却样品后,按顺序将处理好的样品加入浓缩胶加样孔内进行SDS-PAGE电泳,分离蛋白;使用湿转法将分离胶上的蛋白转移到PVDF膜上,丽春红染色观察转膜效果,对照marker,剪出膜上的目的蛋白及内参蛋白β-actin的条带;将膜完全浸泡于3%BSA-TBST中,摇床上室温封闭30 min,TBST洗膜;按照1∶1000稀释一抗(p-Akt、Akt、Bcl-2、Bax 和 β-actin),将膜的封闭液吸尽后,立即加入稀释好的一抗,室温摇床上缓慢摇动孵育40 min,4℃过夜;第二天将膜室温放置30 min,TBST洗膜3次,5%脱脂奶粉-TBST按1∶1000稀释HRP山羊抗兔IgG(H+L),加入二抗稀释液,室温轻摇40 min。将ECL发光液加到膜上后反应3~5 min,胶片曝光10~300 s,显影2 min,定影。所摄图像以LabWorks 4.6图像分析软件分析,记录各组目的蛋白及内参蛋白的灰度扫描值,每组重复3次。
1.4 统计学分析
采用SPSS 17.0统计软件包分析处理。经One Sample Kolmoglrov-SmimovZ检验,数据符合正态分布,采用(xˉ±s)进行描述。多组独立样本比较采用单因素方差分析(one-wayANOVA)。显著性水平α=0.05。
2 结果
2.1 海马神经元纯度
NSE免疫荧光染色,倒置相差显微镜下观察,所有细胞的胞核均被染成蓝色,即该视野下细胞总数,胞浆和突起被染成绿色者为阳性细胞,即神经元(见图1)。在共聚焦激光扫描显微镜下进行观察并拍照,计算该视野下神经元和细胞总数

随机取5个视野,经鉴定神经元纯度为(96.5±1.2)%。
2.2 海马神经元凋亡率
与正常对照组比较,各组神经元凋亡率均明显增加(P<0.01);与高糖组比较,各组神经元凋亡率均明显减少(P<0.01);槲皮素+Akt抑制剂组神经元凋亡率高于槲皮素组(P<0.01);与Akt激动剂组比较,槲皮素组凋亡率无显著性差异(P>0.05)。见表1、图2。

表1 各组神经元凋亡率
2.3 海马神经元p-Akt、Akt、Bcl-2和Bax的表达
与正常对照组比较,各组p-Akt/Akt和Bcl-2/Bax均明显减少(P<0.01);与高糖组比较,槲皮素组、Akt激动剂组p-Akt/Akt和Bcl-2/Bax比值均明显升高(P<0.01);与槲皮素组比较,槲皮素+Akt抑制剂组p-Akt/Akt、Bcl-2/Bax的比值均明显下降(P<0.01);与Akt激动剂组比较,槲皮素组Bcl-2/Bax的比值减少(P<0.05),p-Akt/Akt的比值无显著性差异(P>0.05)。见表2、图3。
3 讨论
Akt又称PKB,是一种相对分子量为60 kDa的丝/苏氨酸蛋白激酶,与PKA和PKC均有较高的同源性,故又称为PKA与PKC的相关激酶(related to the A and C kinase,RAC-PK)。该激酶被证明是v-Akt的编码产物,故又称Akt。Akt位于多条信号通路的交叉点,包括丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase,PI3K)/Akt信号通路、Jak激酶/信号转导子和转录激活子(just another kinase/signal transducer and activator of transcription,Jak/Stat)信号通路、转化生长因子-β/Smad蛋白(transforming growth factor-β/drosophila mothers against decapentaplegic protein,TGF-β/Smad)信号通路等,影响着细胞的存活、生长、增殖、凋亡、新陈代谢,提高细胞复制和存活能力,同时减弱生长阻滞和细胞凋亡[3]。Akt信号通路对细胞周期和基因表达起着重要的调控作用;通过与胰岛素样生长因子-1(insulin-like growth factors-1,IGF-1)、糖原合成酶激酶-3(glycogen synthase kinase-3β,GSK3β)[4]相互作用,对胰岛β细胞的增殖起着重要作用;激活的Akt信号通路通过抑制tau蛋白、Bax、含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase-9)[5-6]抑制细胞的凋亡级联反应;磷酸化的Akt还能下调叉头转录因子O1(Forkhead box protein O1,FoxO1)的表达[7],上调胰腺十二指肠同源盒1(pancreatic and duodenal homeobox 1,PDX-1)的表达,实现胰岛β细胞再生。Akt信号通路受神经营养因子家族(neurotrophic factors,NTFs)、张力蛋白同源10号染色体缺失的磷酸酶基因(gene of phosphate and tension homology deleted on chromsome ten,PTEN)等影响,对神经细胞的凋亡[8-10]、代谢起着重要的作用。Akt信号通路通过调节叉头转录因子(forkhead transcription factor,FKHR)有助于提高细胞存活率,调节哺乳动物雷帕霉素靶体蛋白(mammalian target of rapamycin,mTOR)有助于增加蛋白的合成,影响神经突触的生长和突触可塑性的形成,这与学习和记忆密切相关[11]。体外细胞培养实验证实,在高糖环境下,Akt信号通路受到明显抑制,因此,Akt信号通路可能是糖尿病认知功能障碍的发生发展过程中的一个关键通路。
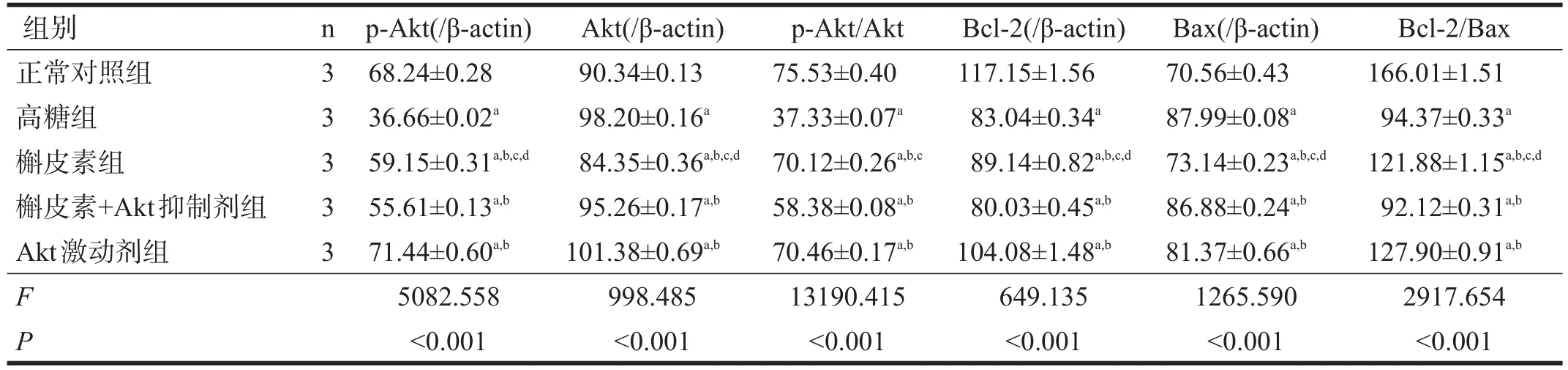
表2 各组海马神经元p-Akt、Akt、Bcl-2、Bax蛋白的灰度值以及p-Akt/Akt和Bcl-2/Bax值(×10-2)
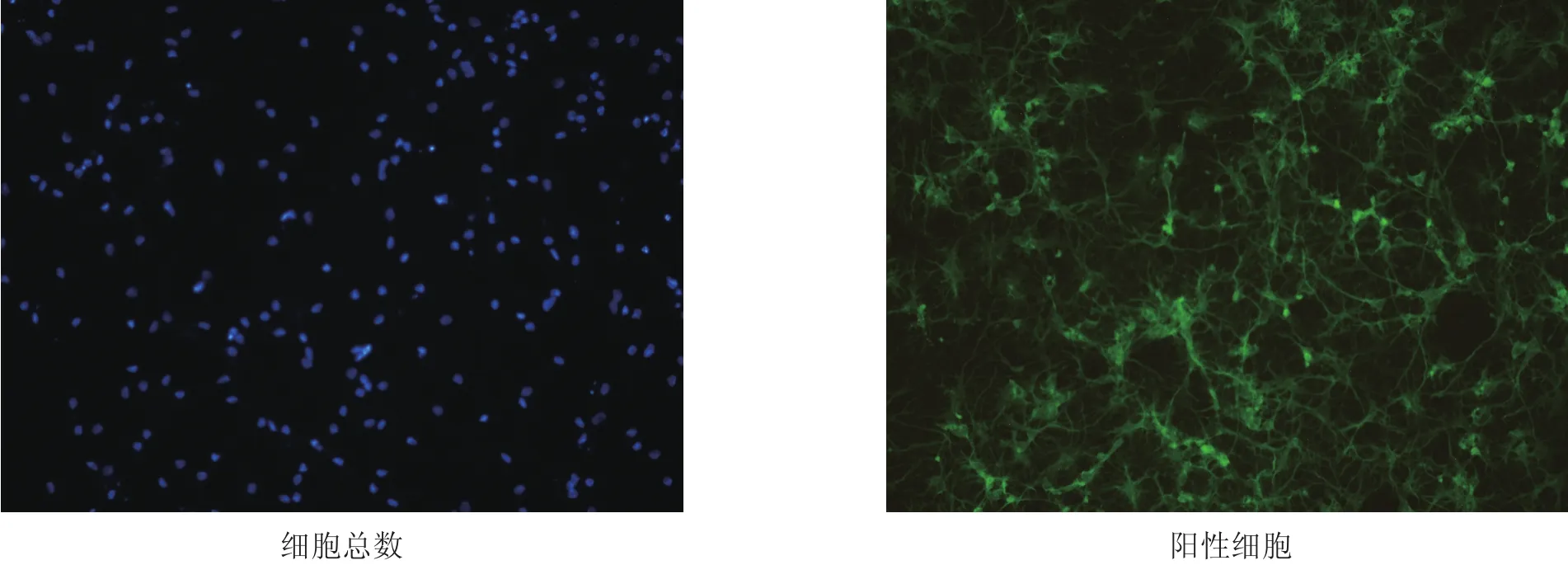
图1 大鼠海马神经元(NSE免疫荧光染色,200×)
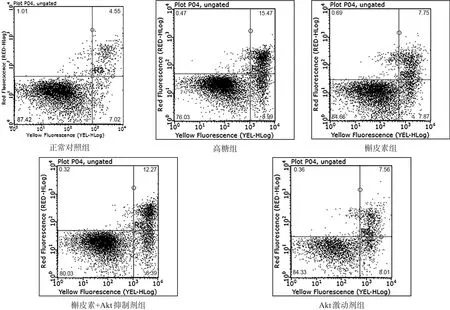
图2 流式细胞仪检测各组神经元凋亡

图3 各组p-Akt、Akt、Bcl-2、Bax和β-actin的Western blotting检测结果
糖尿病认知功能障碍在中医属消渴病并发“呆症”“健忘”的范畴。《圣济总录》曾载“消渴日久,健忘怔忡”。消渴病本在肾,历代医家在针对消渴病治疗时多以补肾填精益髓为法,应用菟丝子、淫羊藿、女贞子、枸杞子、红景天等药物。菟丝子味甘,性温,归肝、肾、脾经,属补益药,具有滋补肝肾,固精缩尿,安胎,明目,止泻等功效。现代研究发现,菟丝子含有树脂甙和糖类,主要有效成分包括槲皮素,紫云(astragalin),金丝桃甙(hyperin)及槲皮素-3-O-β-D-半乳糖-7-O-β-葡萄糖甙[12]。槲皮素是一种天然黄酮类化合物,研究发现其具有抗氧化[12]、抗肿瘤[13]、抗炎[14]、改善内皮功能、抗血小板聚集、提高人体免疫力等多种生物活性[15-16]。
为了研究槲皮素对高糖导致海马神经元凋亡的保护机制与Akt信号通路的关系,选取SC79作为阳性对照组,MK-2206 2HCl作为Akt信号通路阻断剂。SC79是能穿透血脑屏障的Akt磷酸化激活剂,具有降低神经元兴奋性毒性、增加神经元存活的功能[17-18];MK-2206 2HCl是Akt的高度选择性抑制剂,属于变构抑制剂,能抑制Akt T308和S473的自身磷酸化,MK-2206 2HCl还防止Akt介导的下游信号分子磷酸化[19]。
根据课题组既往试验结果、查阅文献及实验前期结果[20-23],设置各分组药物浓度:槲皮素浓度0.01 μmol/L,Akt抑制剂浓度0.3 μmol/L,Akt激动剂浓度5 μmol/L。流式细胞仪检测海马神经元凋亡率,与正常对照组比较,高糖组海马神经元凋亡率明显增加;当在高糖培养基中加入槲皮素、Akt激动剂以后,凋亡率明显下降,提示,槲皮素、Akt激动剂可以抑制高糖导致的海马神经元凋亡;当槲皮素组中加入Akt抑制剂后,凋亡率明显增加,槲皮素的抗细胞凋亡作用减弱,说明在该通路受到特异性抑制后槲皮素的作用失去了发挥途径。同时,槲皮素组、Akt激动剂组的凋亡率差异无统计学意义,提示两者在改善高糖引起的海马神经元凋亡上的作用相似。Western blotting结果显示,与正常对照组比较,高糖组p-Akt/Akt、Bcl-2/Bax明显下降;与高糖组比较,槲皮素组、Akt激动剂组p-Akt/Akt的表达均升高,提示槲皮素、Akt激动剂可以逆转高糖对Akt蛋白磷酸化的抑制作用。进一步检测Akt信号通路的下游效应分子(Bcl-2、Bax)显示,槲皮素组、Akt激动剂组的Bcl-2/Bax都较高糖组升高;应用Akt特异性抑制剂后,槲皮素组p-Akt/Akt、Bcl-2/Bax明显下降,提示在Akt信号通路被阻断后,槲皮素提高p-Akt/Akt、Bcl-2/Bax、保护海马神经元的作用明显减弱,可以推测,Akt信号通路是槲皮素的海马神经元保护机制之一。此外,与Akt激动剂组比较,槲皮素组p-Akt/Akt比值无显著性差异,提示槲皮素逆转高糖抑制Akt蛋白磷酸化的效果与SC79相似。
综上所述,我们认为,槲皮素能够减轻高糖培养下海马神经元的凋亡,其作用机制与增加Akt信号通路中Akt蛋白磷酸化的程度,进而增加Bcl-2蛋白的表达,抑制Bax蛋白的表达有关。
[1]Yamagishi S,Ueda S,Okuda S.Food-derived advanced glyca
tion end products(AGEs):a novel therapeutic target for various disorders[J].Curr Pharm Des,2007,13(27):2832-2836.
[2]Kerti L,Witte AV,Winkler A,et al.Higher glucose levels associated with lower memory and reduced hippocampal microstructure[J].Neurology,2013,81(20):1746-1752.
[3]Balzano D,Fawal MA,Velázquez JV,et al.Alternative activation mechanisms of protein kinase B trigger distinct downstream signaling responses[J].J Biol Chem,2015,290(41):24975-24985.
[4]Liu Y,Tanabe K,Baronnier D,et al.Conditional ablation of Gsk-3β in islet beta cells results in expanded mass and resistance to fat feeding-induced diabetes in mice[J].Diabetologia,2010,53(12):2600-2610.
[5]Tokutake T,Kasuga K,Yajima R,et al.Hyperphosphorylation of Tau induced by naturally secreted amyloid-β at nanomolar concentrations is modulated by insulin-dependent Akt-GSK3β signaling pathway [J].J BiolChem,2012,287(42):35222-35233.
[6]Calissano P,Malone C,Amadoro G.Apoptosis and in vitro Al-zheimer disease neuronal models[J].Cornmun Integr Biol,2009,2(2):163-169.
[7]Manning BD,Cantley LC.AKT/PKB signaling:navigating down stream[J].Cell,2007,129(129):1261-1274.
[8]Carracedo A,Pandolfi PP.The PTEN-PI3K pathway:of feedbacks and cross-talks[J].Oncogene,2008,27(41):5527-5541.
[9]李明明,李林林,季晓燕.神经生长因子治疗周围神经损伤的疗效观察[J].中国实用神经疾病杂志,2015,18(4):24-26.
[10]Aberg ND,Brywe KG,Isgaard J.Aspects of growth hormone and insulin-like growth factor-1 related to neruoprotection regeneration and functional plasticity in the adult brain[J].Scientific World J,2008,18(6):53-80.
[11]Horwood JM,Dufour F,Laroche S,et al.Signaling mechanisms mediated by the phosphoinositide PI3K/Akt cascade in synaptic plasticity and memory in the rat[J].Eur J Neurosci,2006,23(12):3375-3384.
[12]王敏,刘保林,国旭丹.槲皮素及其代谢物抑制氧化应激与炎症[J].食品科学,2013,34(15):256-260.
[13]孙怡,顾君.槲皮素抑制乳腺癌细胞迁移侵袭及分子机制研究[J].中国中医药杂志,2015,40(6):1144-1150.
[14]李鸿佳.槲皮素通过TLR4/NF-κB信号调节哮喘气道炎症机制研究[D].济南:山东大学,2015:21-24.
[15]孙涓,余世春.槲皮素的研究进展[J].现代中药研究与实践,2011,25(3):85-88.
[16]李敏.槲皮素及其糖苷衍生物芦丁对心肌纤维化的抑制作用及机制研究[D].长春:吉林大学,2014:111-113.
[17]Hakryul J,Subhanjan M,Dewar T,et al.Small molecule-induced cytosolic activation of protein kinase Akt rescues ischemia-elicited neuronal death [J].PNAS,2012,109(26):10581-10586.
[18]So EY,Ouchi T.BRAT1 deficiency causes increased glucose metabolism and mitochondrial malfunction[J].BMC Cancer,2014,14(1):1-13.
[19]Chen X,Dai XX,Zou P,et al.Curcuminoid EF24 enhances the anti-tumour activity of Akt inhibitor MK-2206 through ROS-mediated endoplasmic reticulum stress and mitochondrial dysfunction in gastric cancer[J].Br J Pharmacol,2017.
[20]刘頔.ERK信号通路在高糖诱导的髓鞘化损伤中的作用及槲皮素、桂皮醛、水蛭素和单体组合对其影响的研究[D].北京:北京协和医学院,2016:36-37.
[21]徐小涵.红景天苷、葛根素对高糖培养SD大鼠海马神经元凋亡的影响及其机制研究[D].北京:北京协和医学院,2014.
[22]郭蕾蕾.筋脉通对高糖培养SD大鼠海马神经元凋亡的影响[D].北京:北京协和医学院,2012.
[23]王靖博.淫羊藿苷、槲皮素对高糖培养SD大鼠海马神经元凋亡的影响及其机制研究[D].北京:北京协和医院,2017.
Effects of Quercetin on Expression of Akt,p-Akt,Bcl-2 and Bax and Apoptosis of Hippocampal Neurons Cultured in High Glucose
YAN Bin1,WANG Jing-bo1,ZHANG Hong2,TIAN Guo-qing1,LIU Yu-qin2
1.Department of Traditional Chinese Medicine,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences,Beijing 100730,China;2.Institute of Basic Medical Sciences,Chinese Academy of Medical Sciences,Beijing 100730,China
TIAN Guo-qing.E-mail:gq-tian@163.com
ObjectiveTo explore the possible mechanism of quercetin on apoptosis of hippocampal neurons cultured in high glucose.MethodsHippocampus was obtained from newborn 24 hours Sprague-Dawley rats and then primarily cultured.Then hippocampal neurons were divided into normal control group,high glucose group,quercetin group,quercetin+Akt inhibitor group and Akt agonist group.After each group was cultured in different conditioned medium for 72 hours,they were detected the apoptosis of neurons with flow cytometry,and the expression of Akt,p-Akt,Bcl-2 and Bax with Western blotting.ResultsCompared with the normal control group,the apoptosis rate of hippocampal neurons increased significantly(P<0.01),and p-Akt/Akt and Bcl-2/Bax decreased significantly(P<0.01)in the high glucose group.Compared with the high glucose group,the apoptosis rates of hippocampal neurons decreased significantly(P<0.01),and p-Akt/Akt and Bcl-2/Bax increased significantly(P<0.01)in the quercetin group and the Akt agonist group.Compared with the quercetin+Akt inhibitor group,the apoptosis rate of hippocampal neurons decreased significantly(P<0.01),and p-Akt/Akt and Bcl-2/Bax increased significantly(P<0.01)in the quercetin group.ConclusionQuercetin could reduce the apoptosis of hippocampal neurons cultured in high glucose,which may be achieved by increasing the phosphorylation of Akt protein in Akt signal pathway,and then increasing the expression of Bcl-2 and inhibiting the expression of Bax.
quercetin;protein kinase B;high glucose;hippocampal neurons;apoptosis;rats
R587.1
A
1006-9771(2017)12-1390-07
[本文著录格式]闫斌,王靖博,张宏,等.槲皮素对高糖培养海马神经元凋亡及Akt、p-Akt、Bcl-2、Bax蛋白表达的影响[J].中国康复理论与实践,2017,23(12):1390-1396.
北京市中医药科技发展资金项目(No.JJ2015-68)。
1.中国医学科学院北京协和医学院北京协和医院中医科,北京市100730;2.中国医学科学院基础医学研究所,北京市100730。作者简介:闫斌(1991-),男,汉族,山西新绛县人,硕士研究生,主要研究方向:糖尿病及其慢性并发症的中西医结合防治。王靖博(1989-),男,汉族,河南内乡县人,硕士,主要研究方向:糖尿病及其慢性并发症的中西医结合防治。闫斌和王靖博为共同第一作者。通讯作者:田国庆,男,博士,博士生导师,主要研究方向:糖尿病及其慢性并发症的中西医结合防治。E-mail:gq-tian@163.com。
10.3969/j.issn.1006-9771.2017.12.005
CITED AS:Yan B,Wang JB,Zhang H,et al.Effects of quercetin on expression of Akt,p-Akt,Bcl-2 and Bax and apoptosis of hippocampal neurons cultured in high glucose[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(12):1390-1396.
2017-08-21
2017-10-11)
