毛细管电泳法用于三种苦参生物碱的分离
2018-01-04张舒雯蔡雨晴马凯婷
武 曦,张舒雯,蔡雨晴,马凯婷
(长治学院 化学系,山西 长治 046011)
毛细管电泳法用于三种苦参生物碱的分离
武 曦,张舒雯,蔡雨晴,马凯婷
(长治学院 化学系,山西 长治 046011)
文章通过优化流动相pH、流动相中有机相种类以及比例、分离电压等条件实现了槐果碱、氧化苦参碱以及苦参碱的有效分离。结果表明,本研究提出的方法具有更高的分离效率,在分离速度快的前提下,得到了可靠的实验结果。
毛细管电泳;苦参碱;氧化苦参碱;槐果碱
苦参来源于豆科槐属植物苦参的根部,具有清热燥湿、杀虫和利尿的功效,在我国传统医学中是一味常见的中药。其中苦参碱类化合物是苦参中最重要的一类活性化合物,其对人体的消化系统、中枢神经系统和心血管系统的部分疾病具有良好的治疗效果,同时还具有一定的抗肿瘤作用[1]。苦参碱类化合物由苦参碱、氧化苦参碱、槐果碱等数十种化合物组成,成分十分复杂[2]。而且苦参碱类化合物存在分子结构相似,分离难度大的问题,这使得对苦参中苦参碱类化合物的定性定量分析变成了一项及其困难的挑战。
目前,以液相色谱(HPLC)和气相色谱(GC)为代表的色谱技术由于其具有分离效率高,应用范围广的优点,被广泛用于中药活性成分的定性定量分析。Zeng等[3]利用超声辅助提取接合HPLC,对锦鸡儿植物中的酚酸进行了提取分离,确定了锦鸡儿植物中的酚酸主要为绿原酸、香草酸、咖啡酸和迷迭香酸。Stavrianidi等[4]则利用高效液相色谱质谱联用技术(HPLC-MS)对含人参功能性食品中的皂苷进行了定量分析,利用HPLC-MS技术,在不需要提供标准品的前提下,作者实现了16种人参皂苷的快速检测。Yang等[5]利用GC结合氢火焰离子检测器(FID)对广藿香中的挥发油进行了分析,作者对36个广藿香样品进行了指纹图谱分析,从而建立了一种对广藿香进行质量控制的方法。此外,针对生物碱类化合物的分析,江林等[6]采用GC检测了苦参及其制剂中的苦参碱和氧化苦参碱的含量。叶锦雄[7]等使用HPLC检测了阳和膏中3种生物碱的含量。上述研究表明,采用色谱法对生物碱进行分析是一项十分成熟的技术,然而,也需要注意到,应用色谱法对生物碱进行分析也存在一些不足,如GC法的应用范围窄,且样品不可回收;HPLC的分离效能无法满足复杂基质样品的分析,需要进行复杂的样品预处理排除杂质干扰,并且还存在着试剂消耗大,分析时间长的缺点。
毛细管电泳法(CE)是以石英毛细管为分离部件、高压电场为驱动力,依据各组分之间淌度的差异实现对混合物的分离的分析技术。具有分析速度快,分离效率高、试剂消耗少和实验成本低等突出优点。此外CE还有多种分离模式,大大扩展了其应用范围。目前,CE也被广泛应用于药物分析领域。张国庆等[8]采用CE法测定了3批次肝力保胶囊中苦参碱以及氧化苦参碱的含量,证明此法操作简便,结果可靠。上述研究表明CE法在生物碱的分离分析中有良好的应用前景。其中苦参碱、氧化苦参碱和槐果碱由于分子结构相似(如图1所示),因而分离难度大。文章通过CE技术对苦参中的苦参碱、氧化苦参碱和槐果碱三种生物碱进行分离,优化了其分离条件。结果表明:CE法分离苦参碱类化合物具有分析速度快,分离效率高等特点,可以为苦参中活性成分的快速检测提供了一种新的途径。

图1 苦参碱、氧化苦参碱和槐果碱分子结构
1 实验部分
1.1 仪器与试剂
CL3030高效毛细管电泳仪(北京华阳利民仪器有限公司),石英毛细管(100 μm i.d./375 μm o.d.,河北鑫诺光纤公司),CEC-MSP-001手动泵(上海通微分析技术有限公司),KQ5200DE数控超声波清洗器(昆山市超声仪器有限公司),BSA124S-CW电子天平(赛多利斯科学仪器有限公司)。
盐酸(永飞化学试剂有限公司),氢氧化钠(天津市凯通化学试剂有限公司),乙酸(天津市大茂化学药剂厂),无水乙酸钠(天津市大茂化学药剂厂),乙醇(天津市凯通化学试剂有限公司),异丙醇(天津市凯通化学试剂有限公司),以上试剂均为分析纯。乙腈(色谱纯,天津奥普升化工有限公司),实验用水为哇哈哈纯净水,购自当地超市。苦参碱、氧化苦参碱和槐果碱标准品均由山西振东制药有限公司提供。
1.2 电泳条件
在本研究中,选择醋酸/醋酸钠缓冲溶液做为流动相水相,乙腈为流动相有机相,采用紫外检测器,紫外检测波长210 nm,采用位差进样,分离电压为15 kV。石英毛细管(100 μm i.d.,375 μm o.d.)有效长度为50 cm,每次使用前,需用0.1 mol/L的盐酸冲洗至少15 min,然后使用去离子水冲洗10 min,随后用0.1 mol/L的氢氧化钠溶液冲洗15 min,再用去离子水冲洗10 min,使用前用流动相冲洗10 min。分析过程中,两次分析间同样使用流动相冲洗5 min。所有溶液使用之前全部用超声波清洗脱气1 min,并用微孔滤膜过滤。样品在使用前超声脱气10 min,微孔滤膜过滤后进样,电泳运行时间为30 min。同一样品在相同条件下重复测试至少三次。
1.3溶液的配制
缓冲溶液的配制:量取2.86 mL的乙酸,转移至250 mL容量瓶中并用去离子水定容,得到200 mM的乙酸溶液;称取4.10 g的乙酸钠固体,溶解并转移至250 mL的容量瓶中并用去离子水定容,得到200 mM的乙酸钠溶液,实验中根据需要稀释使用。
模拟样品的配制:取苦参碱、氧化苦参碱和槐果碱标准瓶适量,加流动相稀释10倍,低温保存于具塞样品瓶中。
2 结果与讨论
2.1 有机相种类对三种生物碱分离效果的影响
苦参中生物碱的主要成分为苦参碱、氧化苦参碱以及槐果碱,在研究中,我们将三种生物碱混合,作为模拟样品,考察影响其分离的因素,筛选出了最佳的毛细管电泳条件。为了研究流动相中有机相种类对生物碱CE分离的影响,笔者选用了异丙醇,乙醇,乙腈作为流动相的有机相进行考察。在考察过程中,笔者使用的盐浓度为20 mM,pH为6.0,电泳电压15 kV,醋酸/醋酸钠缓冲溶液作为背景电解液水相(85%),检测波长210 nm,采用位差进样。实验结果如图2所示,图中谱峰1、2、3分别为苦参碱、氧化苦参碱以及槐果碱。从图中可以看出,当使用乙醇作为有机相时,苦参碱与氧化苦参碱的分离度较差,没有达到基线分离。使用异丙醇以及乙腈作为有机相时,三种生物碱均实现了基线分离。但是乙腈作为有机相时,分析时间明显更短,分离效果更佳,峰形更为对称、尖锐。因此,文章采用乙腈作为背景电解液的有机相来分离这三种苦参生物碱。
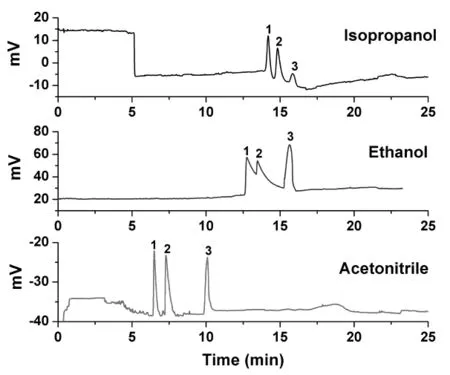
图2 有机相种类对三种生物碱分离效果的影响
2.2 流动相pH对苦参活性成分分离的影响
文章进一步考察了背景电解液pH值对三种生物碱电泳分离的影响。在考察过程中,采用了醋酸盐缓冲溶液:乙腈(85∶15)为流动相,缓冲溶液盐浓度为20 mM,运行电压为15 kV,紫外检测波长为210 nm,位差进样。实验结果如图3所示。从图中可以看出,在12 min内就完成了对三种生物碱的分离,图中谱峰1、2、3分别为苦参碱、氧化苦参碱以及槐果碱。其中槐果碱与其他组分均有良好的分离效果,然而当流动相pH为5.0时,苦参碱与氧化苦参碱的分离没有达到基线分离。而当缓冲溶液pH分为6.0以及7.0时,苦参碱与氧化苦参碱的分离效果良好,如图中谱峰1和谱峰2所示,可以看出两者实现了基线分离,显然当pH为6.0时,苦参碱与氧化苦参碱的分离效果更好,因此,笔者认为用CE分离这三种生物碱时,流动相的最佳pH为6.0。

图3 流动相pH对三种生物碱分离效果的影响
2.3 流动相中乙腈含量对苦参活性成分分离的影响
进一步考察流动相中乙腈含量对电泳分离苦参生物碱的影响。在考察过程中,笔者使用的乙腈在流动相中的体积比分别为15%,20%,25%,盐浓度为20 mM,pH为6.0,电压为15 kV,检测波长210 nm,采用位差进样。实验结果如图4所示。图中谱峰1、2、3分别为苦参碱、氧化苦参碱以及槐果碱。从图中可以看出,当乙腈含量为15%时,三种生物碱取得了良好的分离效果。但随着乙腈在背景电解液中含量的增加,三种生物碱的分离效果逐渐变差,因此,可以认为背景电解液中乙腈含量较低时,有利于三种苦参生物碱的分离。此外需要说明的是,当乙腈含量低于15%时,由于电流较大,焦耳热效应使毛细管中的流动相产生气泡,造成断流现象,因此,本实验中乙腈含量低于15%的条件没有进行考察。

图4 乙腈含量对三种生物碱分离效果的影响
2.4 分离电压对苦参活性成分分离的影响
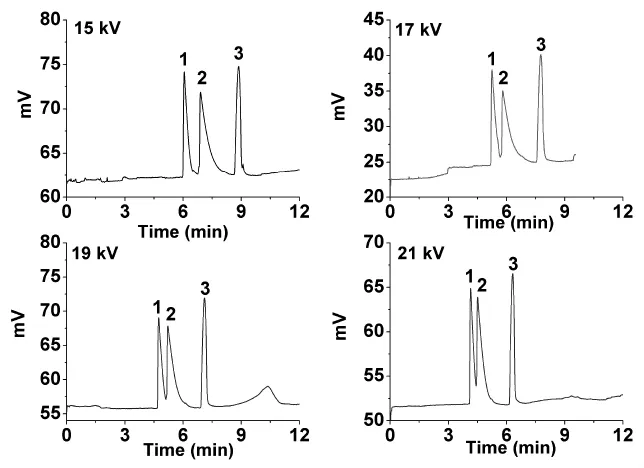
图5 分离电压对三种生物碱分离效果的影响
分离电压对毛细管电泳的分离有较大影响,因此在对生物碱电泳分离条件的优化过程中,分离电压的选择也是一个重要的工作。在考察过程中,我们使用的分离电压分别为15 kV,17 kV,19 kV,21 kV,盐浓度为20 mM,pH为6.0,醋酸盐缓冲溶液作为流动相水相(85%),乙腈为流动相有机相(15%),紫外检测波长210 nm,位差进样。实验结果如图5所示,图中谱峰1、2、3分别为苦参碱、氧化苦参碱以及槐果碱。从图中可以看出,使用较高的分离电压时组分出峰时间早,分离速度快,但苦参碱以及氧化苦参碱的分离效果也随之下降。当分离电压降低时,苦参碱以及氧化苦参碱的分离度以及峰形得到明显改善。当分离电压为15 kV时,三种生物碱实现了基线分离且峰形良好。因此,在保证分离速度尽可能快的前提下,我们选择15 kV作为最佳分离电压来对三种生物碱进行分离。
3 总结
文章通过优化分离电压、流动相pH、有机相种类以及水相有机相的比例四个条件实现了苦参碱、氧化苦参碱以及槐果碱的有效分离。首先,我们考察了流动相pH对苦参生物碱CE分离效果的影响,结果表明当缓冲溶液pH为6.0时,三种生物碱的分离效果更好。其次,在缓冲溶液中加入了三种常用的有机溶剂,异丙醇、乙醇以及乙腈,我们发现当使用乙醇以及异丙醇作为流动相有机相时,三种生物碱的分离效果差。乙腈作为背景电解液的有机相时,分析时间最短,且谱峰峰形更好,得到的分离效果最佳。因此,本研究选择乙腈作为背景电解液的有机相。然后,优化乙腈在背景电解液中的比例,在保证系统电流不过大的前提下,发现随着乙腈比例的增大,三种生物碱的分离度逐渐降低,因此综合考虑各项因素,本研究选择乙腈在背景电解液中的比例为15%。最后,我们采用四种不同的分离电压,考察了电压对CE分离三种生物碱的影响,发现随着电压的升高,苦参碱以及氧化苦参碱的分离效果越来越差。因此,在保证分离速度尽可能快的前提下,选择15 kV作为最佳分离电压来对三种生物碱进行分离。
[1]张静涛,王伟,段振华.苦参碱类生物碱的应用进展[J]现代生物医学进展,2007,7(3):451-454.
[2]刘梅,刘雪英,程建峰.苦参碱的药理研究[J].中国中药杂志,2003,28(9):801-804.
[3]Zeng Z,Ji Z Y,Hu N,et al.Synchronous determination with double-wavelength by RP-HPLC-UV and optimization of ultrasoundassisted extraction of phenolic acids from Caragana species using response surface methodology[J].J Pharm Biomed Anal,2017,(140):182-189.
[4]Stavrianidi A,Stekolshchikova E,Porotova A,et al.Combination of HPLC-MS and QAMS as a new analyticalapproach fordetermination of saponins in ginseng containing products[J].J Pharm Biomed Anal,2017,(132):87-92.
[5]Yang Y H,Kong W J,Feng H H,et al. Quantitative and fingerprinting analysis of Pogostemon cablin based on GC-FID combined with chemometrics[J].J Pharm Biomed Anal, 2016,(121):84-90.
[6]江林,王海霞.气相色谱法测定苦参及其制剂中的苦参碱类生物碱[J].分析仪器通讯,1997,7(4):222-227.
[7]叶锦雄,罗嘉琪,翟文泽.高效液相色谱法测定阳以及膏中双酯型生物碱限量[J].中国药业,2017,26(3):22-24.
[8]张国庆,吕磊,赵亮.优化的高效毛细管电泳法测定肝力保胶囊中苦参碱以及氧化苦参碱的含量[J].第二军医大学学报,2008,29(1):148-154.
O657.8
A
1673-2014(2017)05-0013-04
山西省大学生创新创业训练项目“中药党参HPLC指纹图谱研究”(2015434)
2017—03—21
武曦(1984— ),男,山西长治人,副教授,博士,主要从事复杂体系分析方法研究。
(责任编辑 周成勇)
