有氧运动对高脂饮食大鼠窦房结神经及心功能的影响
2018-01-04刘福泉王松涛孙艳艳宋亚萍
刘福泉,王松涛,孙艳艳,宋亚萍
LIU Fu-quan1,2,WANG Song-tao2,SUN Yan-yan2,SONG Ya-ping2
有氧运动对高脂饮食大鼠窦房结神经及心功能的影响
刘福泉1,2,王松涛2,孙艳艳2,宋亚萍2
LIU Fu-quan1,2,WANG Song-tao2,SUN Yan-yan2,SONG Ya-ping2
高脂膳食可导致心脏传导系统发生脂肪浸润和纤维化,进而引发心律异常和心血管意外,这些改变可能涉及内源性心脏神经的重塑。为探讨有氧运动对高脂饮食大鼠心功能及心内神经的保护作用,选取8周龄雄性SD大鼠24只,随机分为对照组(C)、高脂组(HF)、有氧运动结合高脂饮食组(FE),各组8只,运动组进行8周的无负重游泳训练,6 次/周,1 h/次。多普勒超声测试大鼠心功能,取窦房结进行HE染色,免疫组化检测窦房结神经标志物PGP 9.5以及CGRP和NPY神经递质的表达。结果发现:1)与C组相比,HF组大鼠窦房结心肌纤维排列趋于混乱,神经团块部位存在空泡,窦房结神经纤维丛萎缩,神经元数量减少,有氧运动在一定程度上抑制了窦房结及其神经的结构改变;2)有氧运动改变了窦房结内神经递质分布,使 CGRP含量升高,NPY含量降低;3)运动干预引起高脂饮食大鼠心脏射血分数、左心室缩短分数、左心室收缩内经和左心室收缩容积增加,心肌纤维增粗,心脏功能增强。结果说明,高脂饮食可导致大鼠窦房结神经萎缩,心功能下降,有氧运动可通过窦房结神经丛重塑和相关神经递质含量变化发挥对高脂饮食大鼠窦房结结构及心功能的保护作用。
有氧运动;高脂饮食;窦房结神经;心脏功能;大鼠
心脏神经病是指心脏内的神经节和神经纤维发生病理性改变,并引起心脏功能紊乱的一类疾病总称[16]。窦房结是心脏受神经支配最多的部位,且神经纤维较粗,支配窦房结的神经统称为窦房结神经[20]。窦房结神经对维持窦房结节律稳定和调节心功能均具有重要的意义,如果其受累可使窦房结产生不稳定电生理活动,甚至诱发死亡[15,21]。
窦房结神经是心内神经的一部分。心内神经又称为心脏内源性神经系统,是独立于外源性自主神经的后交感神经系统,具有完整的神经调节网络,因此被人们称为“心脏微脑”。 研究已证实,长期高脂膳食可导致心脏传导系统产生脂肪侵润和纤维化,进而引发心律异常和心血管意外,这些改变可能涉及内源性心脏神经的重塑。既往对高热量饮食相关的心血管健康问题,人们关注的主要是冠状动脉及心肌本身的结构和功能改变,而较少以心内神经作为研究的靶组织。同时,在体育科学研究领域,有学者从心血管自主神经中枢以及外周神经递质的变化,探讨了有氧运动对心脏自主神经平衡状态的影响,但关于运动结合高脂饮食对心内神经系统的影响还鲜见报道。
基于此,本研究通过分析窦房结神经的形态及相关神经肽的改变,探讨有氧运动保护和调节高脂饮食大鼠心脏功能的机制,为“运动与自主神经”研究领域相关理论的丰富,以及阐释有氧运动、高脂饮食和心血管健康之间的关系奠定初步的实验基础。
1 研究方法
1.1 实验对象及分组
SPF级8周龄雄性SD大鼠24只,体重180~200 g,广州中医药大学实验动物中心提供,动物批号(SCXK(粤)2008-0020,NO:0104975)。适应性饲养1周后,随机分为对照组(C)、高脂组(HF)、有氧运动结合高脂饮食组(FE),每组8只。对照组普通饲料饲养,不运动;高脂组高脂饲料喂养,不运动。实验分组如表1所示。
表1 实验动物分组Table 1 Experimental Animals Grouping()

表1 实验动物分组Table 1 Experimental Animals Grouping()
组别n体重 (g)对照组(C) 8 264.29±18.80高脂组(HF) 8 255.63±16.13有氧运动结合高脂组(FE) 8 257.22±19.38
1.2 高脂饲料配方
高脂饲料配方[2,6]:猪油9%,蔗糖20%,蛋黄粉15%,胆固醇1%,胆酸钠0.5%,普通饲料54.5%(广东省医学实验动物中心)。
1.3 运动方案
运动干预采用不负重游泳训练法。水深为大鼠身体长度(包括尾长)的2倍,水温33~36 ℃,标准纯水。游泳训练中每只大鼠活动水面不少于0.70 m2。训练时间安排在下午6:00~8:00之间。
正式训练前,第1周进行适应性游泳,第1次游泳时间10 min,之后每天递增10 min,至第1周末游泳时间达到1 h,第2周开始正式实验,游泳训练每周6天,每天1 h,周日休息,训练8周[13,14]。
1.4 测试指标及方法
主要试剂:蛋白基因产物9.5(protein gene product 9.5,PGP 9.5)、降钙素基因相关肽(Calcitonin gene related peptide, CGRP)、神经肽Y(Neuropeptidetyrosine,NPY)的抗体(北京博奥森生物技术有限公司)、DAB(北京康为世纪生物科技有限公司)。
1.彩色多普勒心功能测试:采用除毛膏,将大鼠胸部的毛发清除干净,2%异氟烷吸入麻醉,应用Vevo2100型小动物彩色多普勒超声诊断仪测试大鼠心脏泵血功能。
2. 窦房结形态观察:大鼠处死后取心脏,甲醛溶液固定24 h后进行窦房结组织取材(以上下腔静脉、界沟、右心耳脊作为定位标志。以界沟为中心,沿静脉窦的长轴从其后面剪开,然后以剪刀在界沟的左、右各5 mm处并与其平行剪开,上方在上腔静脉口略上方剪断,下方在下腔静脉口处横断,得到条状组织)。所取组织进行酒精梯度脱水,石蜡包埋,5μm厚切片。进行HE染色,中性树胶封片。镜下观察大鼠窦房结部心肌细胞形态、神经分布及数量等。
3. 窦房结部PGP 9.5、CGRP、NPY免疫组化检测:采用SABC法进行组化染色:常规脱水、包埋切片、滴加抗体、DAB显色、封片。在100倍光镜视野下进行组织部位辨别,400倍镜下分别对PGP 9.5、CGRP、NPY染色阳性细胞进行统计。光镜下神经染为棕黄色为阳性细胞。运用Image-Pro Plus软件进行阳性面积定量分析,计算积分光密度。
1.5 数据统计与分析
用SPSS 18.0统计分析软件对各组数据进行分析,测试结果以平均数±标准差(X±SD)表示。组间比较采用单因素方差分析,P<0.05代表差异具有统计学意义。
2 研究结果
2.1 大鼠窦房结形态结构观察
从图1可以看出,对照组大鼠窦房结心肌纤维排列整齐,形态完整,胞浆丰富染色均匀,细胞之间间隙正常,心肌与间质未见异常。高脂组大鼠窦房结心肌纤维排列混乱、细胞间隙明显增宽,胞浆染色不均匀。运动高脂组大鼠心肌纤维排列欠整齐,细胞间隙稍增宽,胞浆染色较均匀,细胞核形态稍增大。

图1 各组大鼠窦房结组织HE染色Figure 1. Sinoatrial Node Tissue HE Staining (40 × 10)
2.2 大鼠窦房结PGP 9.5、CGRP、NPY神经阳性表达量
图2可见,PGP 9.5免疫反应阳性细胞呈棕色,神经组织多数呈大小不等团块状,FE组、C组、HF组神经的大小有递减的趋势,并且棕色逐渐变淡;CGRP阳性表达多数处于肌膜处,呈大小不等的圆形团块状。C组神经数量较多,但染色较浅。HF组团块数量少,染色浅,并且神经周围出现空泡。FE组神经较多,但神经团块要比C组小;NPY阳性表达细胞多数呈圆状,个别呈条状。HF组神经团块较C组、FE组要多。FE组神经较少,但组织形态结构较完整。
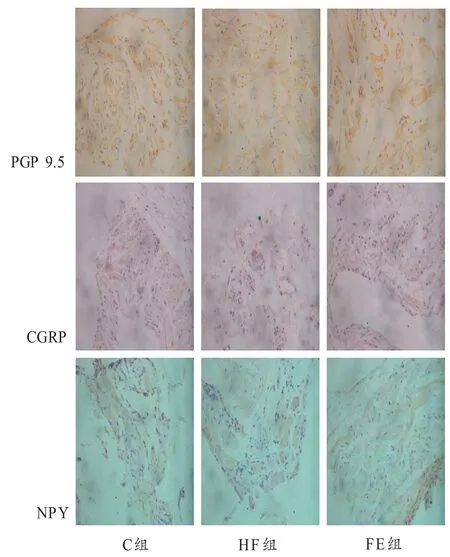
图2 各组大鼠窦房结组织PGP 9.5、CGRP和NPY免疫组化阳性表达Figure2. Immunohistochemical Expression of PGP 9.5,CGRP and NPY in the Sinoatrial Node of Rats in Each Group (40 × 10)
表2可以看出,PGP 9.5、CGRP神经阳性表达量C组和FE组显著高于HF组(P<0.05),FE组略低于C组,但没有显著性差异。NPY神经阳性表达量在C组和FE组显著低于HF组(P<0.05),FE组略高于C组,但没有显著性差异。
表2 各组大鼠PGP 9.5、CGRP、NPY神经阳性表达量Table 2 Nerve-positive Expression of PGP 9.5,CGRP,NPY of Rats in Each Group()

表2 各组大鼠PGP 9.5、CGRP、NPY神经阳性表达量Table 2 Nerve-positive Expression of PGP 9.5,CGRP,NPY of Rats in Each Group()
注:1)与C组比较 P<0.05 ;2)与HF组比较 P<0.05,下同。
C组(N=8) HF组(N=8) FE组(N=8)PGP9.5 3 396.62±26.47 2 874.01±41.61) 3 027±35.822)CGRP 973.96±57.85 426.77±43.131) 914.80±103.382)NPY 1 318.12±12.18 1 538.24±50.541) 1 336.41±29.512)
2.3 大鼠心脏功能的变化
表3所示,与C组相比,HF组心脏泵血功能各指标虽有不同的变化,但均没有显著性差异;FE组射血分数出现显著性升高(P<0.05),其余指标没有显著性变化。与HF组相比,FE组射血分数、左心室缩短分数显著性升高(P<0.05),左心室收缩内经、左心室收缩容积显著性降低(P<0.05)。
表3 不同组大鼠心功能指标的变化Table 3 Cardiac Function Changes of Rats in Different Groups(

表3 不同组大鼠心功能指标的变化Table 3 Cardiac Function Changes of Rats in Different Groups(
C组(n=8) HF组(N=8) FE组(N=8)左心室收缩内径(DS mm)3.74±0.38 4.44±0.20 3.25±0.232)左心室舒张内径(DD mm)4.41±0.45 5.03±0.46 4.19±0.22左心室收缩容积(VS ul)62.66±12.98 90.84±9.49 43.48±7.932)92.04±18.67 121.14±12.76 79.02±9.91左心室舒张容积(VD ul)心搏量(SV ul) 29.28±5.80 30.30±4.50 35.76±3.12射血分数(EF %) 32.29±1.13 24.82±2.24 45.95±3.501)2)心输出量(CO ml/min)14.02±1.05 11.60±1.54 14.63±2.78左心室缩短分数(FS %)15.16±0.52 11.50±1.23 22.77±1.992)
3 讨论
长期高脂膳食可导致心肌组织和心脏传导系统脂肪侵润和纤维化,进一步可引发心功能下降、心律异常,甚至发生心血管意外。有证据表明,这些改变可能涉及心脏内源性神经的病变与损伤。有氧运动是多种慢性疾病运动干预的常用手段,而在国内和国外的既往研究中,学者多采用1 h的不负重或低负重游泳(每周5~6次,数周)作为有氧运动的方式,探讨运动对健康或多种疾病模型大鼠(高血压、代谢综合征、肥胖等)的干预作用。有研究证实,2 h的不负重游泳训练(8周)亦可明显改善动脉粥样硬化大鼠的脂代谢状况[24]。对于该负荷下的急性运动,Gegentonglaga等研究发现,2 h的急性不负重游泳运动可增加大鼠海马组织的氧分压水平,并且与负重游泳运动相比,其氧分压在运动后的恢复期维持更长时间和更高的水平[23]。虽然上述研究并没有直接测量运动负荷的耗氧量水平,而且目前尚缺乏直接定量评价实验动物游泳运动耗氧量水平的研究,但从这些急性和慢性运动所产生的应激性或适应性变化可推知,1~2 h的不负重游泳运动属于有氧运动的范畴。因此,本研究以高脂饲料喂养的SD大鼠为实验对象,以不负重游泳训练为有氧运动的实现方案,通过心脏泵血功能、心脏组织形态以及心内神经分布与表达状况的变化,探讨有氧运动是否对高脂膳食状态下的心脏内神经组织具有保护作用。
3.1 有氧运动对高脂饮食大鼠窦房结神经的影响
窦房结神经是心内神经系统的重要组成部分,其内部神经丰富,控制着窦性心律的快慢及肌电的传导,并把窦房结与自主神经系统联系起来。结内神经根据类型的不同分布于不同的部位,但多数聚集在心肌外膜与内膜处[17,20]。
蛋白基因产物9.5(PGP 9.5)是由212个氨基酸组成的能够特异性标记神经节的胞浆蛋白,特异地存在于神经节及弥散分布的神经内分泌细胞中[9]。PGP 9.5特异性染色为研究神经系统形态结构变化提供了一种高质量的染色技术,可特异性地标记神经元细胞及神经纤维。因此,本研究采用PGP 9.5免疫组化来标记窦房结内部神经的形态结构,分析高脂及运动对窦房结内神经的影响。
本研究发现,与C组相比,HF组大鼠PGP 9.5阳性表达减弱,神经元数目显著减少,且神经周围出现空泡化现象。上述变化的可能原因在于:1)伴随高脂饮食体内出现代谢紊乱,心脏外膜处脂肪大量堆积,逐渐向心内浸润,可导致神经细胞纤维化增多;2)血脂增高致血管发生粥样硬化性改变,导致心肌和神经组织供血不足。覃飞等[4]在对Ⅱ型糖尿病大鼠结肠肌间神经丛的研究中也发现,糖尿病高脂膳食组PGP9.5阳性表达量显著低于糖尿病普食对照组。本研究FE组与HF组相比,PGP 9.5阳性表达明显升高(P<0.05),神经丛得到改善,空泡化程度减少,分析其机制可能是有氧运动在降低体脂和血脂的同时也增加了细胞的抗氧化能力。研究已证实[12],长期有规律的有氧运动能够启动体内的抗氧化系统,使体内超氧化物歧化酶、谷胱甘肽水平适度提高,机体的抗氧化能力增强。还有研究显示[11],有氧运动可以使心脏内神经增生,体积增大,尤其是小神经增加比例较多,抵抗增龄导致的神经退行性改变;薛香莉等[5]的研究也表明,有规律的运动也可调节脂肪细胞因子的表达与分泌,进而调节神经递质的表达。本研究中FE组大鼠窦房结神经呈现的良好改善,说明有氧运动可通过多种途径发挥对窦房结神经的保护作用。
3.2 有氧运动对高脂饮食大鼠窦房结神经肽CGRP和NPY的影响
心脏功能受各部位神经丛释放的神经递质的调节,其中兴奋性神经递质主要有降钙素基因相关肽(CGRP)、血管活性肠肽(VIP)等,可刺激腺体分泌及血管扩张,对心脏起到正性变时、变力、变传导的作用。抑制性神经递质主要包括NPY、生长抑素(SS)等,能够使心输出量减少,心率变慢。这些神经递质相互影响、相互作用、协调对抗,共同调节心脏的功能。
CGRP是目前发现的最强的舒张血管神经肽,在窦房结内分布最多,对心脏主要起到正性变时、变力、变传导作用,使心肌收缩力增加,心跳加快,心输出量增加[1,10,22]。本实验发现,与C组相比,HF组CGRP阳性表达量显著性下降(P<0.05),说明长期高脂饮食可导致大鼠窦房结CGRP能神经或CGRP合成分泌减少;与HF组比较,FE组CGRP阳性表达显著增高(P<0.05),说明运动能够抵抗高脂饮食对CGRP神经的损害,使神经趋向正常化。其原因可能是长期有氧运动消耗了由高脂饮食摄入并存在体内过多的能量,增加了脂肪的利用,减少了脂肪向心内的浸润。
NPY具有极强的缩血管功能,在窦房结内含量较高,有研究表明对心脏具有负性变时和变力作用[3,19]。本研究显示,与C组相比,HF组NPY表达含量呈显著性增高(P<0.05)。同时,本研究还发现,高脂饮食导致肥胖大鼠其窦房结内NPY神经含量显著高于同组非肥胖大鼠,提示,长期高脂饮食可导致心内NPY能神经增生。与HF组比较,FE组NPY阳性神经表达量呈显著性下降(P<0.05),说明运动能够抵抗高脂饮食造成的NPY增加,使窦房结NPY神经趋向正常。
3.3 有氧运动对高脂饮食大鼠窦房结结构及心脏功能的影响
窦房结神经病变影响心脏功能,结内神经递质的变化与心脏血流动力学指标存在紧密的联系。本研究结果显示,高脂组大鼠窦房结心肌排列混乱,胞浆染色不均匀,细胞间隙增大,内部出现脂肪浸润现象。结内神经阳性表达量减少,部分神经细胞呈现纤维化。CGRP阳性神经表达量降低,NPY阳性神经表达量增高。心肌收缩力下降,心率增快。本研究中的高脂饮食组所呈现的窦房结神经病变,可能是左心室收缩内径和左心室收缩容积升高和心搏量、射血分数、心输出量、左心室缩短分数下降的原因,说明高脂饮食可导致心脏泵血功能的全面下降。与HF组相比,FE组大鼠窦房结心肌纤维排列趋于整齐,细胞间隙缩小,胞浆染色较均匀,且脂肪浸润程度降低,左心室收缩内径、左心室收缩容积显著性下降(P<0.05),射血分数与左心室缩短分数显著性增高(P<0.05),说明有氧运动可以使高脂饮食大鼠的心功能得以改善,这可能是由于长期中等强度的有氧运动可以使心内神经发生重塑,NPY能神经及其递质降低,CGRP能神经及其递质增加,进而导致心肌的收缩力增强;还可能由于运动降低了体内脂肪酸的含量,进而减少了体内脂肪的堆积性损害。既往关于心脏病变及运动训练可导致心脏外源性自主神经重塑及其相关机制的研究,也可为本研究中的心内神经变化提供间接的支持[7,8,18]。
4 结论
有氧运动可在一定程度上通过促使窦房结神经重塑,改善CGRP能和NPY能神经及其神经肽的失衡,进而提高心脏泵血功能,这些作用对于防治高脂饮食导致的心脏功能紊乱具有重要意义。
[1] 郭文,罗学港.降钙素基因相关肽对大鼠运动型疲劳的影响[J].体育科学,2016,36(7):63-70.
[2] 韩静,余俊达,潘秋,等.四种高脂饲料诱发胰岛素抵抗的研究[J].江西中医学院学报,2010,22(4):64-66.
[3] 雷静,钟巧青.神经肽Y与心血管疾病的研究进展[J].国际心血管病杂志,2014,41(5):311-314.
[4] 覃飞,郝选明,王松涛.有氧运动对Ⅱ型糖尿病大鼠结肠肌间神经丛及结肠功能障碍的影响[J].中国病理生理杂志,2013,29(6):1059-1064.
[5] 薛香莉,刘微娜,季浏.脂肪细胞因子与运动的抗抑郁作用[J].体育科学,2016,36(11):66-71.
[6] 朱磊,路瑛丽,冯连世.不同配方高脂饲料构建SD大鼠肥胖模型的实验研究[J].中国运动医学杂志,2016,35(7):642-644.
[7] AJIJOLA O A,SHIVKUMAR K. Neural remodeling and myocardial infarction:the stellate ganglion as a double agent [J]. J Am Coll Cardio1,2012,59(10):962-964.
[8] BILLMAN G E. Cardiac autonomic neural remodeling and susceptibility to sudden cardiac death:effect of endurance exercise training [J]. Am J Physiol Heart Circ Physio1,2009,297(4):H1171-1193.
[9] BLAIR P J,BAYGUINOV Y,SANDERS K M,et al. Relationship between enteric neurons and interstitial cells in the primate gastrointestinal tract [J]. Neurogastroent Motil,2012,24(9):e437-e449.
[10] EBERHAROT M,HOFFMANN T. Calcitonin generelated peptide release from intact isolated dorsal root and trigeminal ganglia [J].Neuropeptides,2008,42(3):311-317.
[11] GAMA E F,SANTAREM J M,LIBERTI E A,et al. Exercise changes the size of cardiac neurons and protects them from age-related neurodegeneration [J]. Ann Anat,2010,192(1):52-57.
[12] GOMEZ-CABRERA M C,DOMENECH E,VINA J. Moderate exercise is an antioxidant:upregulation of antioxidant genes by training [J]. Free Radic Biol Med,2008,44(2):126-131.
[13] HART K J,SHAW J M,VAJDA E,et al. Swim-trained rats have greater bone mass,density,strength,and dynamics[J]. J Appl Physiol,2001,91(4):1663-1668.
[14] HUANG C C,CHIANG W D,HUANG W C,et al. Hepatoprotective effects of swimming exercise against d-galactose-induced senescence rat model[J]. Evid Based Compl Alt Med,2013:275431.
[15] JAMES T N. Cardiac ganglionitis associated with sudden unexpected death[J]. Ann of Int Med,1979,91(5):727-730.
[16] JAMES T N. Primary and secondary cardio neuropathies and their functional signif i cance[J]. J Am Coll Cardiol,1983,14(5):983-1002.
[17] KANAZAWA H,IEDA M. Heart failure cause cholinergic transdifferentiation of cardiac sympathetic nerves via gp130-signaling cytokines in rodents [J]. J Clin Invest,2010,120(2):408-421.
[18] LI Z,WANG M,ZHANG M,et al. The effect of the left stellate ganglion on sympathetic neural remodeling of the left atrium in rats following myocardial infarction [J]. Pacing Clin Electrophysiol,2015,38(1):107-114.
[19] MORRIS M J,TORTELLI C F. Vascular and brain neuropeptide Y in banded and spontaneously hypertensive rats [J]. Peptides,2004,25(8):1313-1319.
[20] PAUZA D H,RYSEVAITE K,INOKAITIS H. Innervation of sinoatrial nodal cardiomyocytes in mouse. A combined approach using immunofluorescent and electron microscopy[J]. J Mol Cell Cardiol,2014,75(7):188-197.
[21] SHINOHARA T,SHEN M J,HAN S,et al. Heart failure decreases nerve activity in the right atrial ganglionated plexus[J].J Cardiovasc Electrophysiol,2012,23(4):404-412.
[22] WU D M,ZWIETEN P A,DOODS H N. Effects of calcitonin gene-related peptide and BIBN4096BS on myocardial ischemia in anesthetized rats [J]. Acta Pharmacol Sin,2001,22(7):588-594.
[23] YOSHIZATO H,HIGUCHI Y. Variable alteration of regional tissue oxygen pressure in rat hippocampus by acute swimming exercise[J]. Life Sci,2013,93(21):773-777.
[24] YOU Y,LIU W,LI Y,et al. Joint preventive effects of swimming and Shenlian extract on rat atherosclerosis[J]. Clin Hemorheol Micro,2011,47(3):187-198.
Effect of Aerobic Exercise on Nervous Remolding in Sinus Node and Cardiac Function of Rats with High Fat Diet
A high fat diet can induce fatty inf i ltration and fi brosis of the cardiac conduction system,which can disrupt the heart’s rhythm and lead to cardiac arrest. These changes may involve the remolding of intrinsic cardiac nerve. This study aimed to evaluate the effect of aerobic exercise on the remolding of intrinsic cardiac nerve induced by high fat diet. Methods:Twenty-four male 8-week old Sprague Dawley rats were randomly divided into 3 groups:Control (C),High fat diet (HF,fat accounted for 45% of kcal),and High fat diet with Exercise (FE). FE groups underwent 8-wk of swim training (6 days/week,1 h/day). Twenty-four hours after the last training,Color Doppler and ECG were used to evaluate heart function on anesthetized rats. Immunohistochemical technique was used to predict the expression of PGP 9.5,CGRP,and NPY in sinus node zone. Group differences were examined using one-way ANOVA and post-hoc comparisons. Results:1) Compared with the group C,nerve tissue in sinus node zone showed vacuolization and atrophy,and neurons decreased in HF group,which is inhibited or reversed to some extent by aerobic exercise;2) Aerobic exercise changes the distribution of neurotransmitters in the sinoatrial node,with increased CGRP and decreased NPY. 3) Aerobic exercise improved the cardiac function in high fat diet rats,with the increased cardiac ejection fraction,left ventricular shortening fraction,left ventricular systolic internal diameter,left ventricular systolic volume,and thickened myocardial fi ber. Conclusions:8-week high fat diet can reduce myocardial contractility and heart pumping function,which maybe involve decreasing intracardiac nerve innervation in sinus node area and imbalanced nervous distribution of CGRP and NPY nerves. Regular moderate-intensity aerobic exercise can reverse these nervous remolding to some extent.
aerobic exercise;high fat diet;sinoatrial nerve;cardiac function;rats
G804.7
A
2017-07-27;
2017-12-06
广东省社会发展领域科技计划项目(2013B031600003;2017A020220001);贵州省科学技术基金项目(黔科合LH字[2014]7455号)。
刘福泉,男,助教,在读博士研究生,主要研究方向为运动与心血管健康,E-mail:857828452@qq.com。
1.沧州医学高等专科学校,河北 沧州 061000;2.华南师范大学,广东 广州 510006 1.Cangzhou Medical College,Cangzhou 061000,China;2. South China Normal University,Guangzhou 510006,China.
