升麻增效口腔溃疡散治疗口腔溃疡大鼠模型的研究❋
2018-01-02艾黄萍左渝陵
金 钊,郑 涛,严 航,艾黄萍,左渝陵
(1. 成都中医药大学基础医学院,成都 610075; 2. 成都中医药大学临床医学院,成都 610075; 3. 成都中医药大学附属医院,成都 610075)
【实验研究】
升麻增效口腔溃疡散治疗口腔溃疡大鼠模型的研究❋
金 钊1,郑 涛2,严 航2,艾黄萍2,左渝陵3△
(1. 成都中医药大学基础医学院,成都 610075; 2. 成都中医药大学临床医学院,成都 610075; 3. 成都中医药大学附属医院,成都 610075)
目的:研究升麻对口腔溃疡散治疗口腔溃疡大鼠增效作用及机制。方法:将大鼠分为空白组、模型组、溃疡散组、溃疡散+升麻组,除空白组外,以NaOH晶体化学烧灼法建立溃疡模型,检测各组溃疡面积、愈合率,HE染色法观察组织病理学变化,ELISA法检测IFN-γ 和IL-6含量,Western-blot检测MMP-2、MMP-9蛋白表达。结果:造模大鼠溃疡明显,周围组织红肿;给药后溃疡面积缩小,其中口腔溃疡散联合升麻组在溃疡面积、IFN-γ、IL-6和MMP-2、MMP-9表达水平上较单独用药组均显著降低。结论:升麻增效口腔溃疡散发挥治疗作用,其机制可能与抑制炎性介质的释放以及下调MMP-2、MMP-9蛋白表达有关。
口腔溃疡散;升麻;口腔溃疡;协同;炎性介质;MMPs
口腔溃疡又名口疮,不定期或周期性在口腔黏膜任何部位孤立或多发出现[1],疼痛明显反复,给生活带来极大不便[2],临床治疗以补充维生素和微量元素、对症处理为主,但依从性差。口腔溃疡散能有效去除溃疡坏死组织,减轻炎症程度,促进溃疡及糜烂面愈合[3],是治疗复发性和疱疹性口腔溃疡的要药[4]。现代研究显示,升麻具有杀菌活性,可治疗肿胀、炎症等症状[5],对口舌生疮及咽喉肿痛疗效极佳[6]。基于此,本研究建立口腔溃疡大鼠模型,在口腔溃疡散的基础上联合风药升麻,从组织形态学、细胞因子水平以及MMPs蛋白的表达探讨升麻是否增效口腔溃疡散的治疗作用,为临床提供参考。
1 材料与方法
1.1 动物
SD 大鼠44只,体质量(180~220) g,雌雄各半,由成都中医药大学动物中心提供(合格证号SCXK(川) 2011-11)。实验温度(22~25) ℃,相对湿度55%~70%。
1.2 主要试剂与仪器
口腔溃疡散(内蒙古蒙药股份有限公司)散剂,升麻(三九医药)颗粒剂,左旋咪唑(科伦药业);肿瘤生长因子-α(TNF-α)、白介素-6 (IL-6)ELISA试剂盒、β-acting购自武汉博士德,考马斯亮蓝蛋白测定试剂盒、显色剂 DAB购自南京建成生物,MMP-2、MMP-9单克隆抗体(北京中杉),ECL发光液(上海碧云天)。
酶标定量测定仪(Thermo Multiskan AsCant公司);离心机5415D(Eppendorf 公司,德国);超薄石蜡切片机(德国莱卡);多功能照相显微镜(日本 Olympus);垂直电泳仪及转膜仪(北京六一)。
1.3 方法
1.3.1 口腔溃疡大鼠造模方法与处理 大鼠适应性喂养,将大鼠分为空白组、模型组、给药组1(口腔溃疡散)、给药组2(口腔溃疡散+升麻),采用化学烧灼法建立口腔溃疡动物模型,空白组不做任何处理。以1%戊巴比妥钠(0. 025 g /kg) 麻醉,将大鼠固定,以蘸有NaOH晶体的滤纸(直径3 mm)在下唇靠口角黏膜处烧灼5~8 s,生理盐水冲洗,1 d后形成溃疡。给药组1(敷口腔溃疡散3次/d)给药以覆盖创面为度,给药组2在给药组1的基础上以1 g/kg灌胃2 mL升麻药液,空白组与模型组灌胃相应体积生理盐水,治疗10 d。每组11只大鼠,1只用于HE染色,5只用于第6天ELISA试剂盒检测IFN-γ、IL-6含量,剩余5只用于观察整个实验过程中溃疡面积的变化,以及第10天检测MMP-2、MMP-9蛋白。
1.3.2 HE染色 给药后第6天,各组随机选取1只大鼠颈部脱臼法处死,以眼科剪剪下0.5×0.5×0.1 cm的溃疡面黏膜组织,PBS冲洗,置入4%多聚甲醛固定24 h,后置入自动组织脱水机中梯度酒精脱水,二甲苯透明、浸蜡、石蜡包埋。经组织切片、摊片、捞片、烤片后脱蜡至水,苏木精染色、盐酸分化、流水冲洗后酒精脱水,伊红溶液染色。最后梯度酒精脱水、二甲苯透明、中性树胶封片,显微镜下观察并拍照[1]。
1.3.3 溃疡的形成及愈合情况 实验期间,隔天记录溃疡从发生至愈合的时间,治疗完成后用游标卡尺测量溃疡的直径并计算其面积。
1.3.4 ELISA法检测组织中IFN-γ、IL-6含量的变化 给药6 d后收集各组大鼠溃疡组织,4℃PBS中漂洗,除去血液滤纸拭干,放入5 mL含有匀浆介质的小烧杯内,剪碎组织块,用组织捣碎机以(10000~15000)r/min上下研磨制成10%组织匀浆,考马斯亮蓝法测定蛋白浓度。按照ELISA试剂盒说明书操作,反应终止后450 nm波长处测量光密度(OD值)。
1.3.5 Western-blot检测MMP-2、9蛋白的表达 给药第10天收集溃疡组织,组织匀浆样品制备同1.3.4,将制备好的组织匀浆100 mg加入500 μL裂解液,4 ℃持续振荡30 min,离心10000 r/min 10 min后,将上清转入预冷的离心管,考马斯亮蓝测定蛋白浓度,样品以上样缓冲液稀释后煮沸5 min使蛋白变性备用。灌制80 g/L SDS-PAGE凝胶,取已制备好的蛋白,每孔上样量20 μL,150 V稳压电场中电泳,约90 min后转膜,滤膜经脱脂奶粉封闭过夜,剪膜根据分子量分开后分别加以1∶1000稀释的一抗(MMP-2、MMP-9)及内参抗体(β-actin,1∶3000)室温孵育3 h,洗膜3次,以1∶3000稀释的HRP标记二抗孵育1 h后,洗膜3次,ECL发光液发光后X光片曝光,扫描记录结果,Gel-analyze分析软件分析条带灰度进行半定量比较分析,以目的基因的条带灰度与内参β-actin的灰度比值表示蛋白表达水平。
1.4 统计学方法

2 结果
2.1 HE染色结果
图1显示,空白组口腔黏膜组织上皮完整连续,细胞排列有序,胞核胞浆无异型性。模型组溃疡呈圆形或椭圆形,边缘充血,周围组织红肿,表面覆有灰黄或灰白色膜。给药组1、2在给药5 d后,溃疡面积逐渐缩小,充血症状减轻,渗出物减少,给药组2溃疡症状减轻程度大于给药组1。

图1 大鼠口腔黏膜组织病理染色(HE ×100)
2.2 溃疡面积变化
结果显示,造模24 h后黏膜形成明显溃疡症状;分别给药后,溃疡面积逐渐缩小,且给药组2的溃疡面积较给药组1明显缩小,第6天给药组2的溃疡面积消失,创面形成瘢痕,8 d以后溃疡愈合,而模型组基本自愈的时间大于10 d。
表1显示,与模型组比较,从第2天起,给药组1、2的溃疡面积均显著缩小,差异有统计学意义(P<0.01);且给药组2的溃疡面积显著小于给药组1,2组第2、4、6、8天比较差异有统计学意义(P<0.05,P<0.01)。
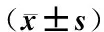
表1 各组大鼠溃疡面积变化
注: 与模型组比较:**P<0.01;给药组2与给药组1比较:△P<0.05,△△P<0.01
2.3 各组溃疡组织中IFN-γ、IL-6含量及MMP-2、MMP-9表达的变化
表2显示,在给药后6 d与空白组比较,模型组与给药组1、2的IFN-γ、IL-6含量均明显增加 (P<0.05,P<0.01);与模型组比较,给药组1、2的IFN-γ、IL-6水平显著降低 (P<0.01),其中给药组2均显著低于给药组1,差异有统计学意义(P<0.05,P<0.01)。
表2图2显示,在给药后10 d,模型组的MMP-2、MMP-9表达量较空白组明显升高(P<0.01);与模型组比较,给药组1、2的MMP-2、MMP-9表达量明显降低(P<0.01);给药组组间比较,给药组2的MMP-2、MMP-9表达量显著低于给药组1(P<0.01)。
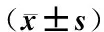
表2 各组溃疡组织IFN-γ、IL-6含量和MMP-2、MMP-9表达的变化
注: 与空白组比较:☆P<0.05,☆☆P<0.01;与模型组比较:**P<0.01;给药组2与给药组1比较:△P<0.05,△△P<0.01

图2 Western-Blot检测MMP-2、MMP-9蛋白的表达A.空白组;B.模型组;C.给药组1;D.给药组2
3 讨论
口腔溃疡属于中医口疮范畴,其病因可以包括由于外感邪热、心脾积热或阴虚阳亢、虚阳浮越等造成的虚火上浮或邪热上蒸[7]。口腔黏膜溃疡动物模型的制备方法较多[8],本研究以化学灼烧法[9]建立大鼠口腔黏膜溃疡模型,其方法简单,可重复性强,能形成典型的急性口腔溃疡,且能保持溃疡大小、深度、部位一致,避免较大系统误差。本结果中,口腔溃疡散能明显改善大鼠溃疡症状,联合升麻后有效治疗和纠正灼烧引起的溃疡黏膜结构改变,二者产生增效协同作用,大大缩短了溃疡愈合时间,有助于溃疡创面的加速愈合。
IFN-γ和IL-6是参与口腔溃疡形成过程中具有代表性的主要炎症细胞因子[10],其含量高低与病情轻重密切相关,即溃疡数目越多、面积越大,IFN-γ和IL-6含量越高[11]。本研究结果表明,造模后炎症细胞因子水平均极显著升高,升麻及口腔溃疡散能显著抑制大鼠口腔溃疡组织TNF-α、IL-6水平基础上增强其抑制溃疡的能力;在溃疡后期,溃疡大部分已经愈合,机体炎症症状减轻,不再分泌大量炎性介质,升麻联合组的溃疡愈合能力优于单独口腔溃疡散组,升麻联合组6 d溃疡面积消失,单独口腔溃疡散的溃疡面积消失需8 d,而溃疡自然愈合需10 d以上,说明升麻杀菌、治疗炎症[5]的功效加强了口腔溃疡散对口腔溃疡的治愈能力。提示升麻对口腔溃疡散治疗大鼠口腔溃疡具有增效的积极作用,且随着溃疡面积的愈合,可明显降低组织细胞内炎性介质IFN-γ和IL-6的释放,减少炎症的发生,进一步反馈增强溃疡的愈合能力。
MMPs参与如胚胎发育、器官形态发生、骨重建、伤口愈合、细胞凋亡等生理过程,还与炎症、心血管疾病、牙周病、溃疡、肿瘤的侵袭及转移等病理过程有关[12]。MMP-2、MMP-9属于明胶酶,主要降解Ⅳ型胶原和层黏连蛋白(基底膜的骨架),作为屏障能阻止炎症细胞浸润和炎症扩散[1]。造模后,大鼠口腔溃疡创面组织MMP-2、MMP-9表达水平明显升高,说明炎性细胞浸润使基质金属蛋白酶活性增加,参与整个炎症过程,给药后MMP-2、MMP-9表达水平明显降低,且升麻+口腔溃疡散组的表达量显著低于单独口腔溃疡散组,升麻+口腔溃疡散组MMP-2、MMP-9的表达水平更加趋近于未造模的空白组,说明升麻联合口腔溃疡散具有增效的作用,作用机制可能与下调MMP-2、MMP-9的表达、减少炎性介质的释放有关,从而降低炎性症状,增加溃疡愈合能力。
综上所述,风药升麻能达到增效口腔溃疡散治疗大鼠口腔溃疡模型的作用,减轻症状,缩短病程,加速愈合溃疡创面,其抗溃疡的实验机制可能与降低炎性介质的合成和释放、下调基质金属蛋白酶MMP-2、MMP-9的表达有关。
[1] 黄彬, 陈黄琴. 口腔溃疡病理机制的研究[J].医学美学美容,2013,3:71.
[2] RIOBOO-CRESPO MDEL R, PLANELLS-DEL POZO P, RIOBOO-GARCIA R. Epidemiology of the most common oral mucosal diseases in children[J]. Med Oral Patol Oral Cir Bucal,2005,10(5): 376-387.
[3] 高兰敏,邱宁. 口腔炎喷雾剂治疗复发性口腔溃疡与口腔溃疡散的疗效对比[J].中国医药指南,2012,10(18):240-241.
[4] 蒋王林,傅风华,田京伟,等. 口腔溃疡含片对大鼠实验性口腔溃疡的治疗作用[J].中草药,2003,34(9):835-837.
[5] 郑雅楠. 含升麻、黄连和花椒等的口腔护理剂用于防治牙周病等[J].现代药物与临床,2004(2):83-83.
[6] 侯淑军. 升麻黄连汤治疗口腔溃疡疗效观察[J]. 河北中医,2013,35(8):1147-1148.
[7] 文建华.合方治疗口疮40例[J].中国民间疗法,2012,20(9):35.
[8] 崔相一,彭芳,等.口腔溃疡动物模型的制备及其评价[J].大连学院学报,2007,10(6):30-32.
[9] 李喜香,禚君,豆金彦,等. 养阴生肌膜对大鼠实验性口腔溃疡的治疗作用[J].中国中医基础医学杂志,2014,(4):474-476.
[10] 柏景坪,王红健,蓝爱仙,等. 乳香酸治疗口腔溃疡的动物实验研究[J]. 北京口腔医学,2012,20(6):318-321.
[11] 张琳,李秦,张涛. 复发性口腔溃疡患者肿瘤坏死因子的变化及临床意义[J]. 第四军医大学学报,2006,27(6):530-532.
[12] 孙蕾,韩婷婷. 浅谈基质金属蛋白酶及其与口腔疾病的关系[J]. 科技信息,2011,(5):71.
CimicifugaSynergisticUlcerPowderCurativeEffectandItsMechanisminTheTreatmentofOralMucosalUlcerModelofRats
JIN Zhao1, ZHENG Tao2, YAN Hang2, AI huang-ping2, ZUO Yu-ling3△
(1.CollegeofbasicmedicineofChengduUniversityofTCM,Chengdu610075,China; 2.CollegeofclinicalmedicineofChengduUniversityofTCM,Chengdu610075,China; 3.AffiliatedHospitalofChengduUniversityofTCM,Chengdu610075,China)
Objective: To study the treatment of oral ulcer powder Cimicifuga experimental oral ulcer in rats and its partly mechanisms of synergistic effect. Methods: The rats were divided into blank group, oral ulcer film group, ulcer powder group, ulcer powder combined + cohosh group. Those groups were established by film NaOH crystal chemical cauterization except the blank group. Then HE method for oral mucosal tissue staining to observe the pathological changes, the detection area rats of group size, healing rate changes. ELISA method was used to detect the changes of IFN-γ and IL-6 detection. Western-blot method was used to detect the expression of MMP-2,9. Results:After modeling, ulcer in the rats of model group was round or oval, the surrounding tissue swelling; the ulcer area was gradually reduced after administration. In the ulcer area, IFN-γ, the levels of IL-6 and MMP-2, MMP-9 expression level, the oral ulcers scattered combined with cohosh group were significantly lower than the single drug group. Conclusion: Oral ulcer powder combined with Rhizoma Cimicifugae synergy in the treatment of oral ulcer, and its mechanism may release and inhibition of inflammatory mediators and down regulated the expression of MMP-2, MMP-9.
Oral ulcer powder; Cimicifuga; Oral ulcer; Synergy; Inflammatory mediators; MMPs
国家自然基金面上基金项目(81574035);四川省科技厅项目(2015SZ0195)
金 钊(1978-),男,讲师,医学博士,从事中医历代医家学术思想及临床应用与口腔黏膜疾病的临床与研究。
△通讯作者:左渝陵(1975-),男,副主任医师,医学博士,从事口腔临床医学研究,E-mail: 2279025416@qq.com。
R781.5+1
B
1006-3250(2017)11-1569-04
2017-03-15
