RNAi沉默NGAL表达对胃癌细胞生物学特性的机制研究
2017-12-28张世同金建军白艳丽吴利娟
张世同, 金建军, 白艳丽, 吴利娟
河南科技大学第一附属医院消化内科,河南 洛阳 471003
RNAi沉默NGAL表达对胃癌细胞生物学特性的机制研究
张世同, 金建军, 白艳丽, 吴利娟
河南科技大学第一附属医院消化内科,河南 洛阳 471003
目的探讨RNAi沉默中性粒细胞相关载脂蛋白(neutrophil gelatinase-associated lipocalin, NGAL)基因表达对胃癌细胞增殖凋亡的影响及机制。方法提取胃癌组织及相应癌旁组织中的总RNA及总蛋白,RT-PCR及Western blotting检测NGAL基因的mRNA及蛋白表达;将NC-siRNA组、NGAL-siRNA转染生长至对数期的人胃癌BGC823细胞,未转染任何siRNA的作为对照组,48 h后收集细胞,Western blotting检测NGAL、Ki67、PCNA、Cleaved caspase3、β-catenin、Cyclin D1蛋白表达;CCK8实验检测细胞增殖;流式细胞术检测细胞凋亡。结果胃癌组织中NGAL基因的mRNA及蛋白表达均显著高于癌旁组织(P<0.01);NC-siRNA组NGAL的蛋白表达与对照组比较,差异无统计学意义(P>0.05),NGAL-siRNA组NGAL的蛋白表达显著低于对照组(P<0.01);与对照组及NC-siRNA组比较,NGAL-siRNA组细胞存活率及Ki67、PCNA、β-catenin、Cyclin D1蛋白表达显著降低,细胞凋亡率及Cleaved caspase3蛋白表达显著升高(P<0.01)。结论NGAL基因在胃癌中高表达,RNA干扰其表达后可降低人胃癌BGC823细胞增殖及促进细胞凋亡,其机制与抑制Wnt/β-catenin信号通路有关。
RNA干扰;NGAL;胃癌;增殖;凋亡;Wnt/β-catenin信号通路
胃癌是常见的消化系统恶性肿瘤,是世界第二大死亡原因,我国胃癌的发病率及死亡率是世界平均水平的2倍多[1]。目前,对胃癌的治疗主要采用手术辅助放化疗,但治疗效果并不理想。胃癌的发生、发展是一个较复杂的过程,涉及到多种抑癌基因的失活或癌基因的激活,研究引起胃癌的发病原因及机制对于该病的诊断及治疗具有重要意义[2]。中性粒细胞相关载脂蛋白(neutrophil gelatinase-associated lipocalin, NGAL)是脂质运载蛋白(lipocalin)家族中的一个新成员,一个25 kD的糖蛋白,参与细胞分化及凋亡、胚胎发育、脂质代谢、炎症免疫应答、肿瘤发生发展等多种生化过程,在食管癌、脑部肿瘤、卵巢癌等多种人类肿瘤中均出现异常表达,其高表达影响肿瘤的增殖、凋亡、分化等生物学过程,因此被称为癌基因[3-5]。目前NGAL对胃癌的影响及机制研究尚不明确。RNA干扰(RNA interference, RNAi)能使序列特异性基因转录后发生沉默,是研究基因功能有效的方法[6]。本研究通过RNAi沉默NGAL基因表达,探讨其对胃癌细胞增殖、凋亡的影响及机制,以期为该病的诊断及治疗提供理论基础。
1 材料与方法
1.1组织和细胞40例胃癌组织及相应的癌旁组织(距癌变组织5 cm以上且经病理学组织诊断无癌变)由河南科技大学第一附属医院2015年3月至2016年7月经手术病理切除后冻存标本,经组织学类型检测均为腺癌,男22例,女18例,年龄35~72岁,平均年龄58岁,所有患者术前均未行放疗及化疗,且有完整的临床资料。人胃癌细胞株BGC823购自中科院保藏细胞库。
1.2主要试剂和仪器青链霉素、胰酶、胎牛血清、RPMI 1640培养基均购自美国Gibco公司;CCK8试剂盒、BCA试剂盒、Annexin V-FITC凋亡试剂盒均购自碧云天生物技术研究所;荧光定量试剂盒及反转录试剂盒购自日本Takala;NGAL、Ki67、PCNA、Cleaved caspase3、β-catenin、Cyclin D1单克隆抗体及辣根过氧化物标记的二抗均购自美国Abcam公司;倒置显微镜购自日本OLYMPUS公司;CO2细胞培养箱购自美国SIM公司;酶标仪、电泳凝胶图像分析系统、聚丙烯酰胺凝胶电泳仪均购自Bio-Rad公司。
1.3胃癌组织中NGAL基因的mRNA表达检测根据总RNA提取试剂盒及转录试剂盒说明提取胃癌组织及相应的瘤旁组织中的总RNA,并将RNA反转录为cDNA。根据NCBI数据库中公布的人mRNA序列设计目的基因NGAL及内参基因GAPDH的RT-PCR定量引物。所有引物由上海生工生物工程有限公司合成。NGAL引物序列:上游引物:5′-GAAGACAAAGACCCGCAAAAG-3′,下游引物:5′-CTGGCAACCTGGAACAAAAG-3′。GAPDH引物序列:上游引物:5′-AAGAGTGGGTTTAAGTGGAAGGCT-3′,下游引物:5′-GAAGATGGTGATGGGATTTC-3′。PCR反应参数:A:预变性95 ℃ 10 min;B:变性95 ℃ 10 s;退火55 ℃ 15 s,延伸72 ℃ 20 s,共40个循环。C:72 ℃ 15 min。4 ℃终止反应。每个样品设置3个重复,取均值采用2-△△Ct法对数据进行相对定量分析。
1.4胃癌组织中NGAL基因的蛋白表达检测组织蛋白提取试剂盒提取胃癌组织及相应的瘤旁组织中的总蛋白,二喹啉甲酸(bicinchoninic acid, BCA)试剂盒对蛋白进行定量,蛋白样品与上样缓冲液混匀后煮沸变性10 min,缓慢冷却后进行分装,置于-80 ℃冰箱中保存。配置质量浓度为120 g/L的分离胶及质量浓度为50 g/L的浓缩胶,进行聚丙烯酰氨凝胶电泳(SDS-PAGE)分离,电泳结束后电转印至PVDF膜上,质量浓度为50 g/L的脱脂奶粉37 ℃封闭1 h,加入一抗(NGAL 1∶200稀释,GAPDH 1∶1 000稀释),4 ℃孵育过夜,然后孵育二抗(辣根过氧化物酶标记的羊抗鼠IgG,1∶1 000稀释),室温杂交1 h,ECL发光剂显影,自动凝胶成像系统采集图像。以GAPDH作为内参,分析NGAL的蛋白表达水平。
1.5细胞培养取出保存于液氮罐中的人胃癌BGC823细胞,置于37 ℃的水浴锅中解冻,期间轻摇冻存管使之在1~2 min内溶解。将溶解后的细胞在RPMI 1640细胞培养基中培养,培养基中加入含有质量浓度为100 g/L的胎牛血清及青链霉素双抗的混合液,置于37 ℃、体积分数为5%的CO2、95%饱和湿度的恒温培养箱中培养,细胞生长密度达到80%时,用质量浓度为2.5 g/L的胰蛋白酶消化细胞后传代,细胞进行对数生长期后再用于实验研究。
1.6细胞转染及转染效果检测转染分为三组,即NC-siRNA组(转染非特异性siRNA干预细胞)、NGAL-siRNA组(转染NGAL-siRNA干预细胞)、未转染任何的siRNA的对照组。取生长至对数期的BGC823细胞,以1×106ml-1浓度接种至6孔细胞培养板中,每孔加入2 ml,细胞汇集率70%~80%时,采用Invitrogen公司的脂质体LipofectamineTM2000方法进行转染,整个转染步骤严格按照说明书进行操作。转染48 h后收集细胞,提取细胞中的蛋白,按照1.4方法检测各组细胞中NGAL的蛋白表达。
1.7CCK8实验检测细胞增殖取转染48 h后的上述三组细胞,每孔加入10 μl的CCK-8试剂,37 ℃条件下继续培养4 h,酶标仪测定490 nm的吸光度(A)。计算细胞增殖率。细胞增殖率(%)=(转染组细胞A/对照组细胞A)×100%。
1.8流式细胞术检测细胞凋亡收集转染48 h的上述三组细胞,胰蛋白酶消化细胞,调整细胞质量浓度为(1~5)×105ml-1,根据细胞凋亡试剂盒说明书进行操作,室温下避光反应20 min,再加400 μl结合缓冲液,上机,流式细胞仪检测细胞凋亡率。
1.9Westernblotting检测Ki67、PCNA、Cleavedcaspase3、β-catenin、CyclinD1蛋白表达收集转染48 h的上述各组细胞,提取细胞中的蛋白,根据1.4方法检测各组细胞中Ki67、PCNA、Cleaved caspase3、β-catenin、Cyclin D1蛋白表达。
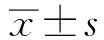
2 结果
2.1NGAL基因在胃癌组织中的mRNA及蛋白表达
胃癌组织中NGAL基因的mRNA及蛋白表达均显著高于癌旁组织(P<0.01)(见图1)。
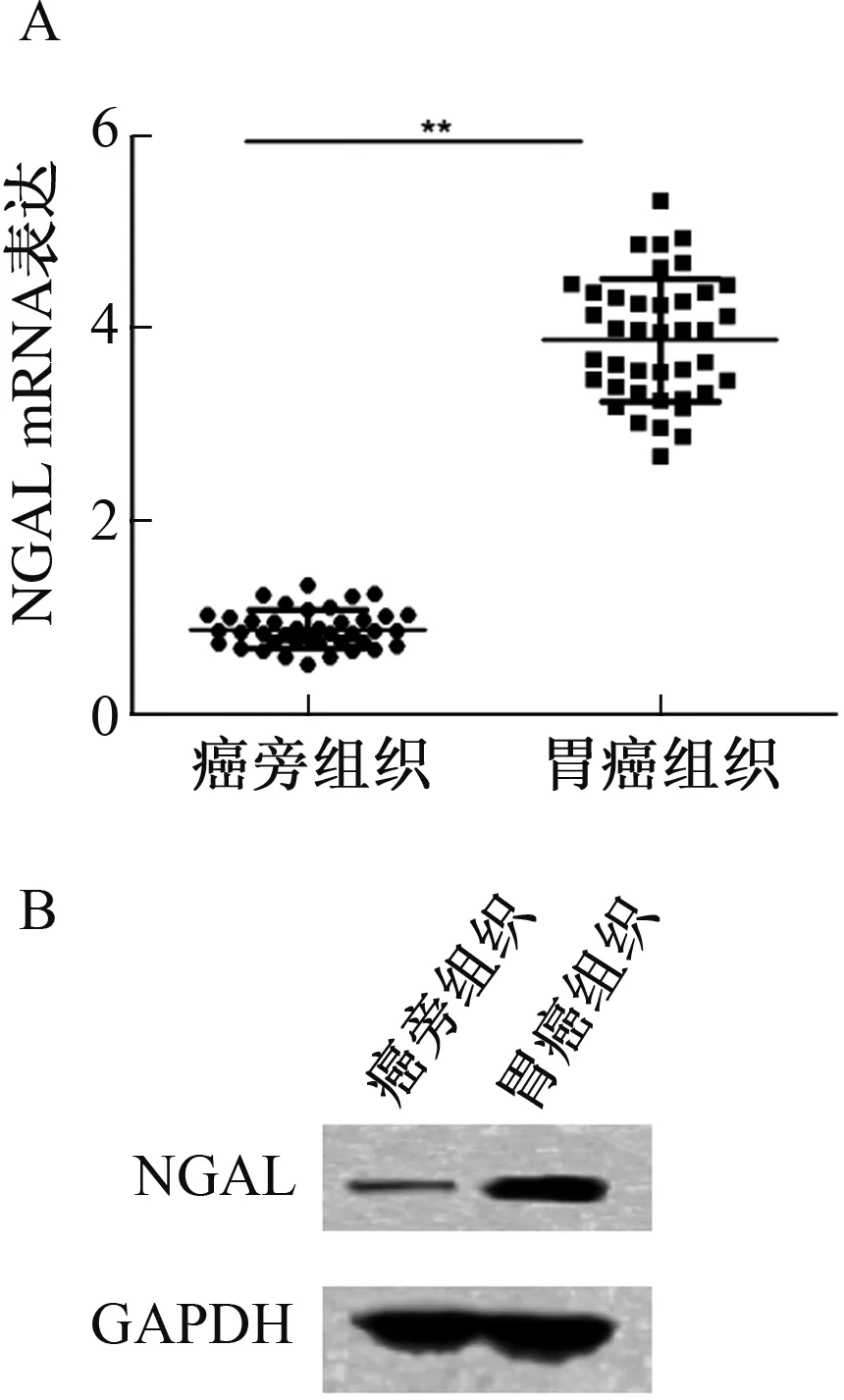
注:与癌旁组织比较,**P<0.01。图1 NGAL基因在胃癌组织中的mRNA及蛋白表达A:NGAL mRNA表达;B:NGAL蛋白表达Fig 1 Expressions of NGAL mRNA and protein in gastric cancerA: expression of NGAL mRNA; B: expression of NGAL protein
2.2转染后细胞中NGAL基因的蛋白表达将NC-siRNA组、NGAL-siRNA转染人胃癌BGC823细胞,48 h后收集细胞,Western blotting检测各组细胞中NGAL的蛋白表达,结果显示,NC-siRNA组NGAL的蛋白表达与对照组比较,差异无统计学意义(P>0.05),NGAL-siRNA组NGAL的蛋白表达显著低于对照组(P<0.01)(见图2)。
2.3抑制NGAL基因表达降低BGC823细胞增殖收集转染48 h的各组细胞,CCK8实验检测细胞增殖情况,结果显示,与对照组及NC-siRNA组比较,NGAL-siRNA组细胞存活率显著降低(P<0.01)(见图3)。
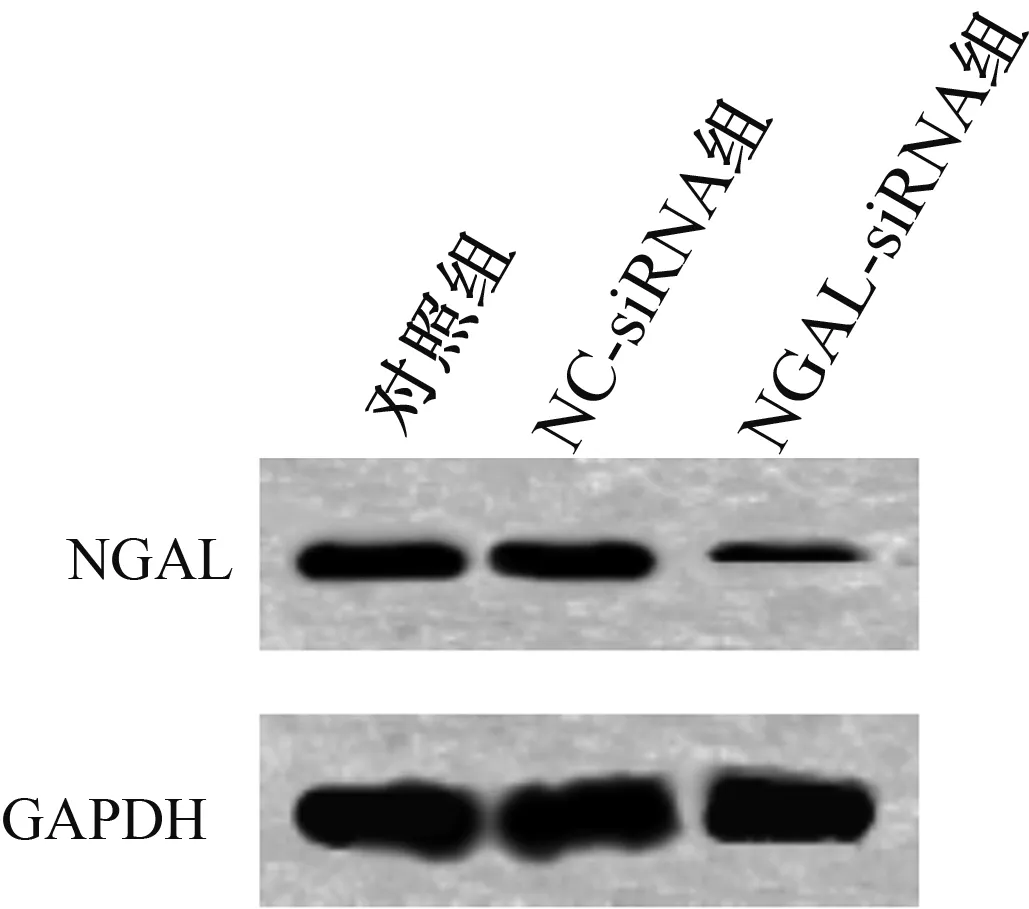
图2 NGAL基因在转染后细胞中的蛋白表达
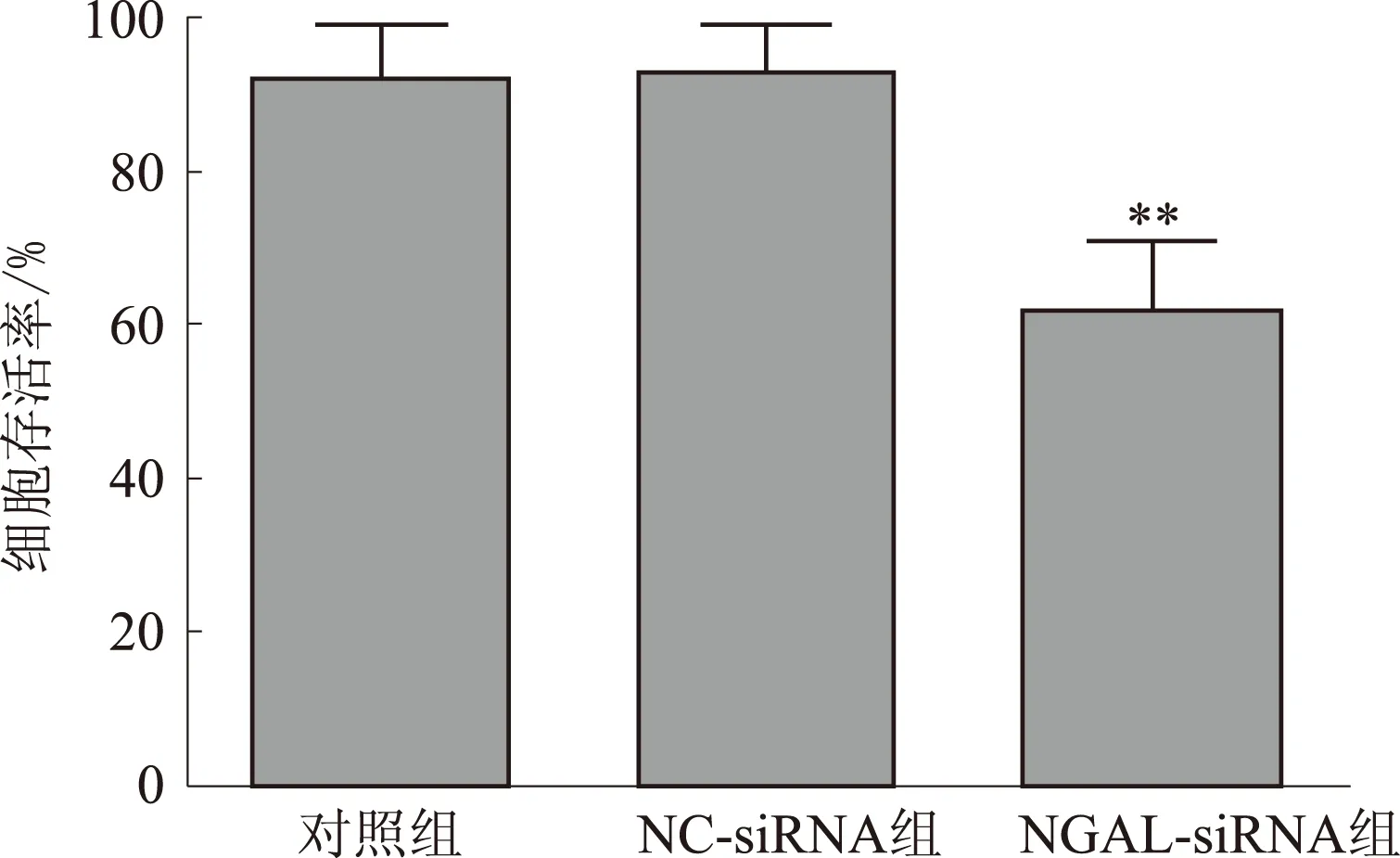
注:与对照组比较,**P<0.01。
2.4抑制NGAL基因表达促进BGC823细胞凋亡流式细胞仪检测各组细胞转染48 h的细胞凋亡情况,结果显示,与对照组及NC-siRNA组比较,NGAL-siRNA组细胞凋亡率显著升高(P<0.01)(见图4)。
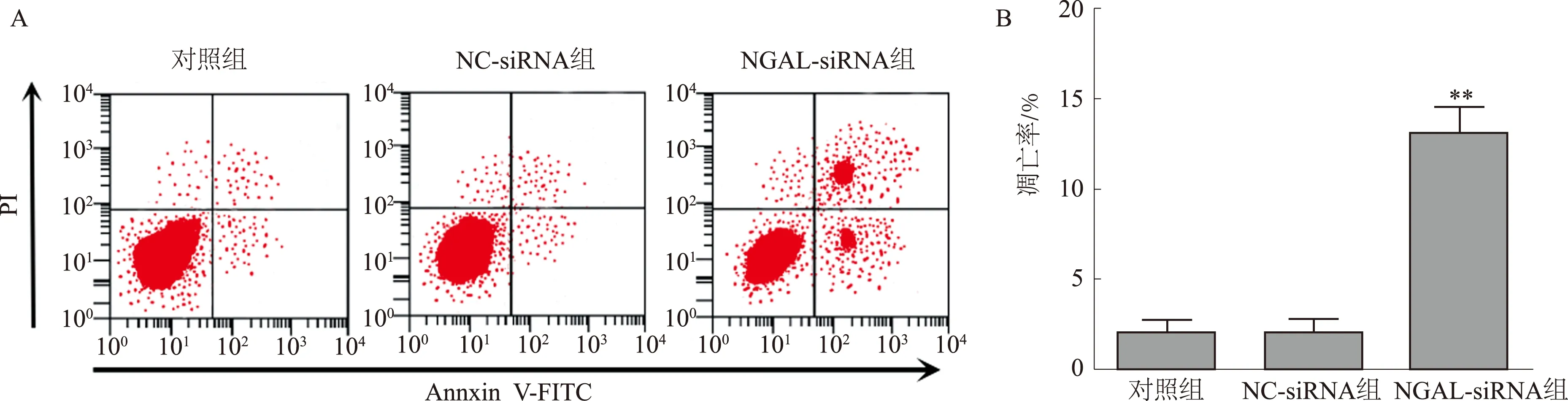
注:与对照组比较,**P<0.01。
2.5抑制NGAL基因表达对Ki67、PCNA、Cleavedcaspase3、β-catenin、CyclinD1蛋白表达的影响Western blotting检测各组细胞转染48 h后Ki67、PCNA、Cleaved caspase3、β-catenin、Cyclin D1蛋白表达情况,结果显示,与对照组及NC-siRNA组比较,NGAL-siRNA组Ki67、PCNA、β-catenin、Cyclin D1蛋白表达显著下调,Cleaved caspase3蛋白表达显著上调(P<0.01)(见图5)。
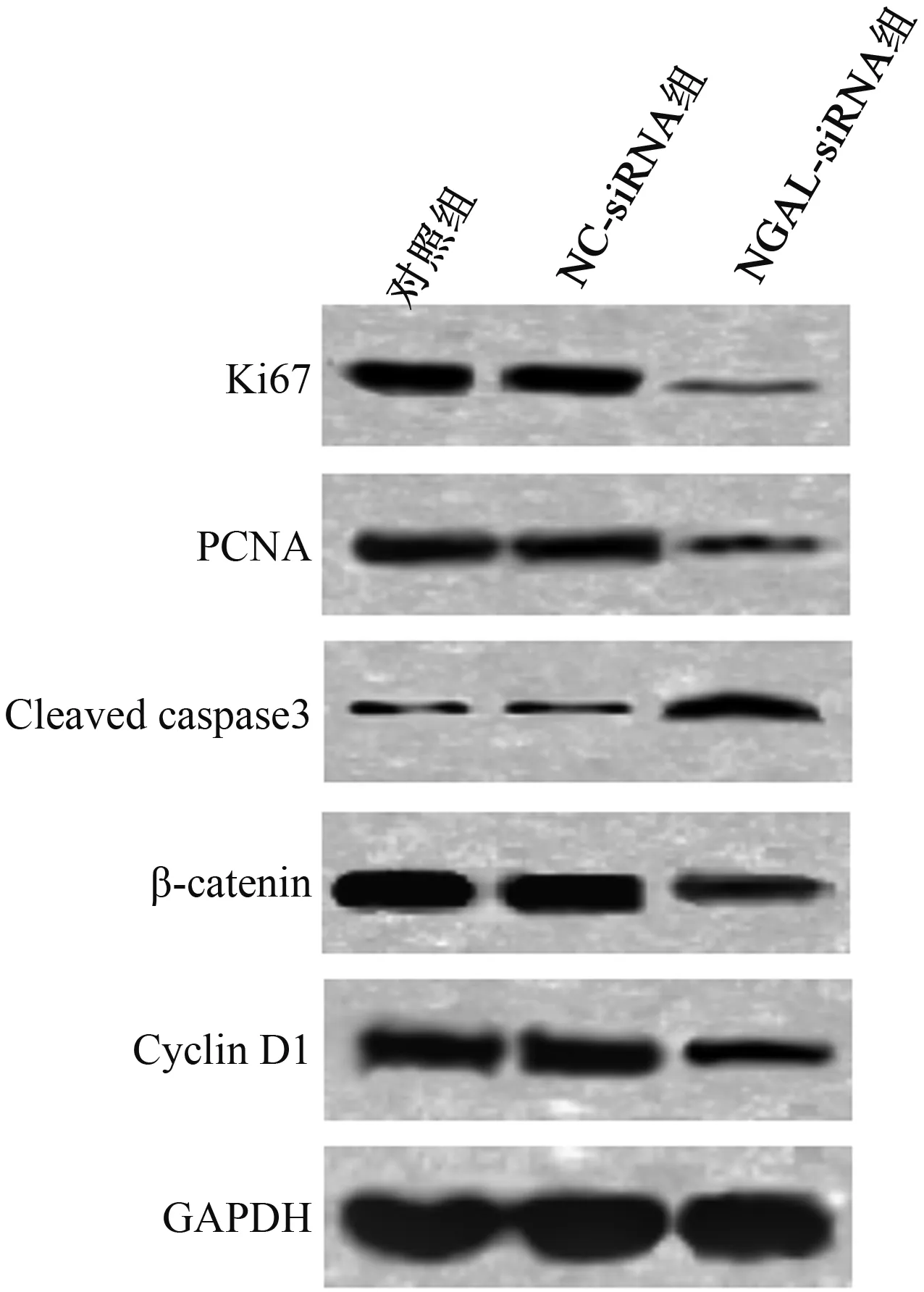
图5 抑制NGAL基因表达对Ki67、PCNA、Cleaved caspase3、β-catenin、Cyclin D1蛋白表达的影响Fig 5 Effect of inhibition of NGAL gene expression on the expressions of Ki67, PCNA, Cleaved caspase3, β-catenin, Cyclin D1 proteins
3 讨论
胃癌是常见的危害人类健康的恶性肿瘤之一,其发生及发展是一个多基因控制的过程,研究胃癌的病因及发病机制具有重要的临床意义。NGAL定位于人9q34染色体上,是Lipocalin家族的一个成员,是人类的一种新的癌基因,在多种恶性肿瘤的发生及发展过程中发挥重要功能[7]。在不同的肿瘤中NGAL的表达不均一,在肝癌、甲状腺癌、食管癌等肿瘤中上调表达,而在肾癌、前列腺癌等肿瘤中表达下调[8-10],在肺癌、甲状腺癌、乳腺癌等肿瘤中抑制NGAL的表达可降低肿瘤细胞的侵袭及迁移能力,而过表达NGAL能增强肿瘤细胞的侵袭及迁移[11-12]。本研究中检测到NGAL在胃癌中高表达,通过转染NGAL-siRNA降低胃癌细胞中NGAL的表达,通过CCK8法及流式细胞术检测细胞的增殖及凋亡情况,结果显示,抑制NGAL的表达能显著降低胃癌细胞的增殖及促进凋亡。
细胞的增殖及凋亡平衡对于机体的正常生长发育具有重要影响,其平衡被打破可能导致肿瘤的发生。Ki67、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)及Caspase3与细胞的增殖及凋亡密切相关。Ki67定位于10q2.5染色体,是与细胞增殖密切相关的一种蛋白质,是公认的反映肿瘤细胞增殖活性的标志物,已有研究[13-14]表明,Ki67与胃癌、食管癌等肿瘤的发病有关,可能影响肿瘤细胞的发生、转移、分期及预后等过程。PCNA只存在于肿瘤细胞及正常细胞内,是肿瘤细胞异常增殖的关键蛋白,在肝癌、胃癌等肿瘤组织中高表达,已被用于检测肿瘤的标志物[15-16]。Caspase3是细胞凋亡过程的关键蛋白,属于Caspase家族。位于Caspase级联反应的下游,在受到凋亡信号刺激后被激活,是凋亡过程中的效应蛋白,也被称为“凋亡的执行者”,目前在胃癌、肺癌等多种肿瘤中均有研究[17-18]。本研究检测Ki67、PCNA及Caspase3蛋白表达,结果显示,抑制胃癌中NGAL的表达可显著下调Ki67、PCNA蛋白表达,上调Caspase3蛋白表达。
Wnt信号通路是一条在进化上相对保守的信号传导途径,具有广泛的生物学效应, 参与细胞凋亡、个体发育、坏死、分化等过程,对大多数生命现象均有调控作用,可分为经典的Wnt信号通路和非经典的Wnt信号通路,Wnt/β-catenin信号通路是一条经典的Wnt信号通路,也是近年来的研究热点,与肿瘤、衰老和退化、骨质疏松等人类疾病密切相关[19]。在多种人类肿瘤中均发现Wnt/β-catenin信号通路的异常激活,如胃癌、肺癌、脑胶质瘤等,也有研究[20-22]显示,抑制该通路可抑制肿瘤细胞的发生及发展进程。β-catenin是Wnt/β-catenin信号通路的关键分子,当有Wnt信号存在时,可通过一系列过程激活Wnt/β-catenin信号通路,也可通过与TCF/LEF蛋白结合,激活Cyclin D1、c-myc等下游靶基因[23]。本研究中检测β-catenin、Cyclin D1蛋白表达,结果显示,抑制胃癌中NGAL的表达可显著下调β-catenin、Cyclin D1蛋白表达。
综上所述,NGAL在胃癌的增殖及凋亡过程中具有重要作用,抑制NGAL的表达可降低胃癌细胞增殖及促进凋亡,其机制为抑制Wnt/β-catenin信号通路有关。该研究为胃癌的治疗和新药开发提供了一个新的靶点,也为该病的分子靶向治疗提供了新的方向。
[1] ZHAO Y, GUO Q, CHEN J, et al. Role of long non-coding RNA HULC in cell proliferation, apoptosis and tumor metastasis of gastric cancer: a clinical and in vitro investigation [J]. Oncol Rep, 2014, 31(1): 358-364.
[2] HESS LM, MICHAEL D, MYTELKA DS, et al. Chemotherapy treatment patterns, costs, and outcomes of patients with gastric cancer in the United States: a retrospective analysis of electronic medical record (EMR) and administrative claims data [J]. Gastric Cancer, 2016, 19(2): 607-615.
[3] DU Z P, WU B L, WANG S H, et al. Shortest path analyses in the protein-protein interaction network of NGAL (neutrophil gelatinase-associated lipocalin) overexpression in esophageal squamous cell carcinoma [J]. Asian Pac J Cancer Prev, 2014, 15(16): 6899-6904.
[4] LI Q, CHEN B, CAI J, et al. Comparative analysis of matrix metalloproteinase family members reveals that MMP9 predicts survival and response to temozolomide in patients with primary glioblastoma [J]. PLoS One, 2016, 11(3): e0151815.
[5] 林建姣, 刘艳, 胡红松, 等. 胃癌患者血清中性粒细胞明胶酶相关载脂蛋白水平及临床意义[J]. 胃肠病学和肝病学杂志, 2016, 25(6): 642-645.
LIN J J, LIU Y, HU H S, et al. The clinical significance and level of serum neutrophil gelatinase-associated lipocalin in human gastric cancer [J]. Chin J Gastroenterol Hepatol, 2016, 25(6): 642-645.
[6] LI-BYARLAY H, LI Y, STROUD H, et al. RNA interference knockdown of DNA methyl-transferase 3 affects gene alternative splicing in the honey bee [J]. Proc Natl Acad Sci U S A, 2013, 110(31): 12750-12755.
[7] AU V, FEIT J, BARASCH J, et al. Urinary neutrophil gelatinase-associated lipocalin (NGAL) distinguishes sustained from transient acute kidney injury after general surgery [J]. Kidney Int Rep, 2016, 1(1): 3-9.
[8] ZHAO J, LAWLESS M W. Resminostat: opening the door to epigenetic treatments for liver cancer [J]. Hepatology, 2016, 63(2): 668-669.
[9] CANDIDO S, DI MASO M, SERRAINO D, et al. Diagnostic value of neutrophil gelatinase-associated lipocalin/matrix metalloproteinase-9 pathway in transitional cell carcinoma of the bladder [J]. Tumour Biol, 2016, 37(7): 9855-9863.
[10] CHIANG K C, HSU S Y, Lin S J, et al. PTEN insufficiency increases breast cancer cell metastasis in vitro and in vivo in a xenograft zebrafish model [J]. Anticancer Res, 2016, 36(8): 3997-4005.
[11] DARLIX A, LAMY P J, LOPEZ-CRAPEZ E, et al. Serum HER2 extra-cellular domain, S100ß and CA 15-3 levels are independent prognostic factors in metastatic breast cancer patients [J]. BMC cancer, 2016, 16(1): 428.
[12] VOLPE V, RAIA Z, SANGUIGNO L, et al. NGAL controls the metastatic potential of anaplastic thyroid carcinoma cells [J]. J Clin Endocrinol Metab, 2013, 98(1): 228-235.
[13] KINDLUND B, SJOLING Å, YAKKALA C, et al. CD4+regulatory T cells in gastric cancer mucosa are proliferating and express high levels of IL-10 but little TGF-β [J]. Gastric Cancer, 2017, 20(1): 116-125.
[14] DING Z, LAO Y, ZHANG H, et al. Griffipavixanthone, a dimeric xanthone extracted from edible plants, inhibits tumor metastasis and proliferation via downregulation of the RAF pathway in esophageal cancer [J]. Oncotarget, 2016, 7(2): 1826-1837.
[15] YU X J, SUN K, TANG X H, et al. Harmine combined with paclitaxel inhibits tumor proliferation and induces apoptosis through down-regulation of cyclooxygenase-2 expression in gastric cancer [J]. Oncol Lett, 2016, 12(2): 983-988.
[16] SHALINI S, NIKOLIC A, WILSON C H, et al. Caspase-2 deficiency accelerates chemically induced liver cancer in mice [J]. Cell Death Differ, 2016, 23(10): 1727-1736.
[17] 申建刚, 张定国, 朱惠明. 血管内皮生长因子-A siRNA 对人肝癌HepG2细胞凋亡的影响及机制[J]. 中国老年学杂志, 2016, 36(3): 542-544.
[18] WANG X, CHENG Y, WU H, et al. The natural secolignan peperomin E induces apoptosis of human gastric carcinoma cells via the mitochondrial and PI3K/Akt signaling pathways in vitro and in vivo [J]. Phytomedicine, 2016, 23(8): 818-827.
[19] YE S, ZHANG D, CHENG F, et al. Wnt/β-catenin and LIF-Stat3 signaling pathways converge on Sp5 to promote mouse embryonic stem cell self-renewal [J]. J Cell Sci, 2016, 129(2): 269-276.
[20] FAN D, REN B, YANG X, et al. Upregulation of miR-501-5p activates the Wnt/β-catenin signaling pathway and enhances stem cell-like phenotype in gastric cancer [J]. J Exp Clin Cancer Res, 2016, 35(1): 177.
[21] SHI J, JIANG X, YU Z, et al. ZNRF3 contributes to the growth of lung carcinoma via inhibiting Wnt/β-catenin pathway and is regulated by miR-93 [J]. J Tumour Biol, 2016, 37(3): 3051-3057.
[22] YUE X, CAO D, LAN F M, et al. MiR-301a is activated by the Wnt/β-catenin pathway and promotes glioma cell invasion by suppressing SEPT7 [J]. Neuro Oncol, 2016, 18(9): 1288-1296.
[23] LU P, WANG Y, LIU X, et al. Malignant gliomas induce and exploit astrocytic mesenchymal-like transition by activating canonical Wnt/β-catenin signaling [J]. Med Oncol, 2016, 33(7): 66.
StudyonthemechanismofRNAisilencingNGALgeneexpressiononthebiologicalcharacteristicsofgastriccancercells
ZHANG Shitong, JIN Jianjun, BAI Yanli, WU Lijuan
Department of Gastroenterology, the First Affiliated Hospital of Henan University of Science and Technology, Luoyang 471003, China
ObjectiveTo investigate the effect and its mechanism of RNAi silencing NGAL gene expression on the proliferation and apoptosis of gastric cancer cells.MethodsTotal RNA and total protein were extracted from gastric cancer and paracancerous tissues, and expressions of NGAL gene mRNA and protein were detected by RT-PCR and Western blotting; NC-siRNA, NGAL-siRNA were transfected into the logarithmic phase of growth of human gastric cancer BGC823 cells, and not transfected with any siRNA as the control group, cells were collected transfected for 48 hours, the expressions of NGAL, Ki67, PCNA, Cleaved caspase3, β-catenin, Cyclin D1 protein were detected by Western blotting; cell proliferation was detected by CCK8 assay; cell apoptosis was analyzed by flow cytometry.ResultsThe expressions of NGAL gene mRNA and protein in gastric cancer tissues were significantly higher than those in adjacent tissues (P<0.01); the expression of NGAL protein in NC-siRNA group and control group had no significant difference (P>0.05), the expression of NGAL protein in NGAL-siRNA group was significantly lower than that in the control group (P<0.01); compared with the control group and NC-siRNA group, the cell survival rate and expressions of Ki67, PCNA, β-catenin, Cyclin D1 protein in NGAL-siRNA group were significantly decreased, cell apoptosis rate and Cleaved caspase3 protein were significantly increased (P<0.01).ConclusionNGAL gene is highly expressed in gastric cancer, and RNA interference NGAL expression can decrease the proliferation and promote apoptosis of human gastric cancer cell line BGC823, which may be related to the inhibition of Wnt/β-catenin signaling pathway.
RNA interference; NGAL; Gastric cancer; Proliferation; Apoptosis; Wnt/β-catenin signaling pathway
10.3969/j.issn.1006-5709.2017.12.010
张世同,硕士,主治医师。E-mail: 1768397479@qq.com
R735.2
A
1006-5709(2017)12-1360-05
2017-03-03
马 军)
