肉羊胚胎移植成活的影响因素实例分析
2017-12-28省部共建绵羊遗传改良与健康养殖国家重点实验室新疆农垦科学院畜牧兽医研究所新疆石河子832000克拉玛依肉羊研究所新疆克拉玛依834000新疆华牛天俊生物技术有限公司新疆昌吉831100
(1.省部共建绵羊遗传改良与健康养殖国家重点实验室/新疆农垦科学院畜牧兽医研究所,新疆石河子 832000;2.克拉玛依肉羊研究所,新疆克拉玛依 834000;3.新疆华牛天俊生物技术有限公司,新疆昌吉 831100)
doi:10.6048/j.issn.1001-4330.2017.11.022
肉羊胚胎移植成活的影响因素实例分析
郭延华1,刘长彬1,万鹏程1,倪建宏1,王立民1,周 平1,杨永林1,方志忠2,顾宏伟2,付炳哲3,卢全胜3
(1.省部共建绵羊遗传改良与健康养殖国家重点实验室/新疆农垦科学院畜牧兽医研究所,新疆石河子 832000;2.克拉玛依肉羊研究所,新疆克拉玛依 834000;3.新疆华牛天俊生物技术有限公司,新疆昌吉 831100)
目的胚胎移植技术是获得优秀种质资源的一种重要应用技术,研究影响胚胎存活和妊娠的因素。方法回顾性调查分析影响胚胎移植后成活的胚胎和受体因素。结果三种胚胎运输方式的妊娠率极显著低于就近移植的妊娠率(P<0.01);胚胎卵裂期与囊胚期移植妊娠率差异不显著(P>0.05),但以 2 细胞移植的妊娠率最低;鲜胚与冻胚的妊娠率差异不显著(P>0.05),2 枚胚胎的妊娠率高于1枚胚胎的妊娠率,胚胎妊娠率随着胚胎质量而下降;囊胚与受体同期性差-24 h,妊娠率差异不显著(P>0.05);放牧与舍饲的受体羊在胚胎妊娠率方面没有显著差异性(P>0.05)。结论胚胎和受体因素对胚胎发生成功妊娠具有重要的影响。
绵羊;胚胎;受体;影响因素
0 引 言
【研究意义】目前我国绵羊的地方品种42个,而新疆绵羊的地方品种有13个,居全国之首,但为了提高肉用性能、实现高效集约化以及风味的同质化,需要引进萨福克、陶赛特、特克赛尔、杜泊等几个知名肉羊品种进行杂交改良,良种的引进尤其是胚胎移植技术在种源上起到了关键作用。【前人研究进展】F. Baria等[1]研究发现,胚胎发育速度、5~6日胚龄、胚胎质量和类型对移植妊娠率都具有影响,而且供体品种间胚胎移植妊娠也显示出差异性。此外权富生等[2]研究发现运输方式、受体使用次数对移植妊娠也具有较大的差异性。而付静涛等[3]研究受体黄体数量和胚胎移植数量对妊娠率都具有显著的影响。胚胎移植已经实现商业化应用,但在实际生产过程中,各个地区的受限因素并不相同,也就造成胚胎移植成功率不尽相同。目前有关于受限因素各地区也不尽相同。【本研究切入点】试验以影响胚胎移植的胚胎和受体因素为切入点,通过生物统计学配对样本和非配对样本独立性T检验、方差分析,对移植妊娠数据进行回顾性调查分析,以追溯引起妊娠差异的假定因素,评价对胚胎移植妊娠的影响显著性。【拟解决的关键问题】充分发挥胚胎和受体的潜力,提高肉羊胚胎移植成功率,为实践进行科学指导,为肉羊品种改良奠定基础。
1 材料与方法
1.1 材 料
1.1.1 试验羊
供体母羊由澳大利引进的黑头萨福克和白头萨福克、杜泊和道赛特,年龄2~6岁成年母羊,健康,无繁殖疾病。
1.1.2 受体羊
受体羊为2~6岁的小尾寒羊、巴蒙羊、哈萨克羊,新疆军垦型美利奴羊,均为经产母羊,胚胎移植时间均在9~12月进行。试验基地为克拉玛依肉羊研究所,昌吉华牛天俊生物技术有限公司,图木舒克江南牧业有限公司和新疆农垦科学院试验种羊场。
1.1.3 受体羊的营养
描述方式参照文献[4]如下,高营养日粮组总量为3.5 kg,日粮结构为青贮1.5 kg、苜蓿草0.5 kg,玉米0.3 kg,玉米秸秆1.2 kg,微量元素为新疆石河子六旺饲料公司生产舔食砖任由羊自行舔食;普通营养日粮组总量为2.5 kg,日粮结构为青贮1.5 kg、苜蓿草0.5 kg、精料和微量元素为大北农羊用全价哺乳料0.5 kg;放牧组在超排程序期间进入舍饲,移植后1周继续放牧,舍饲营养日粮组总量为2.3 kg,日粮结构为青贮1.5 kg,麦草秸0.5 kg,精料0.3 kg,微量元素等从放牧植被中摄取。
1.1.4 激素药品与仪器
超排药物 FSH由加拿大(每支400 mg/20 mL,批号F10244-10140)生产,孕酮海绵栓为宁波激素制品有限公司生产(42 mg/支),PMSG由宁波激素制品有限公司生产(1000 IU/支,生产批号150312-150315),胚胎保存液(ICP bio New Zealand),冲胚液为含0.3% BSA的 PBS(GBICO)液。胚胎程序冷冻仪 CL5500(Cryologic),体式显微镜(SMZ8000),水浴锅。
1.2 方 法
1.2.1 同期发情处理与冲胚
供体羊的同期发情处理:供体羊埋植孕酮海绵栓,供体在执行超排程序的第6针撤栓。撤栓的同时肌肉注射PMSG 500 IU,观察并记录发情情况,在第15 d下午(pm)输精(artifical inseminiation,AI),第16 d从输卵管收集2细胞,第17 d从输卵管收集4~8细胞胚胎,第21 d从子宫角收集囊胚。图1

图1 体内胚回收程序
Fig.1 Protocol to embryonic transfer In Vivo embryos
受体羊的同期发情处理与移植:受体羊埋植孕酮栓11~13 d,比供体羊撤栓早12 h,撤栓的同时肌肉注射PMSG 500 IU,观察并记录发情情况,或者选择自然周期的受体羊肌肉注射0.1 mg PG,将24~48 h发情的母羊通过试情公羊挑选出来作为受体。采用常规手术法移植到受体羊的输卵管中,腹腔镜法移植到受体子宫角。
1.2.2 胚胎来源
胚胎分为鲜胚、自制冻胚和进口冻胚。
1.2.3 受胎率统计
胚胎移植完毕后,在妊娠的第45~60 d B超检查妊娠结果,怀孕母羊的统计以产羔和流产记录为准。
1.3 数据处理
采用SPSS19.0统计软件进行差异显著性分析。P<0.01 为差异极显著;0.01
2 结果与分析
2.1 胚胎运输方式对受体妊娠率的影响
研究表明,三种胚胎运输方式上,供体运输、鲜胚运输和受体运输的胚胎妊娠率差异不显著(P>0.05),但与不运输的方式在胚胎妊娠率方面差异极显著(P<0.01),鲜胚运输的标准差比其余三组的标准差都大。表1
表1 不同胚胎运输方式下受体妊娠率变化
Table 1 Effect of embryo transition on pregnancy rate in surrogacy

胚胎运输方式Targetoftransition供体数No.Donor胚胎数No.Embryo受体数No.Transfers妊娠数Pregnancies妊娠率(%)Pregnancyrate供体运输Donortransition1038381026.04±3.57Aa鲜胚运输Freshembryotransition538381334.21±16.49Aa受体运输Surrogacytransition52116531.65±2.35Aa不运输Control11100925358.78±6.69B
注:上标不同大写字母表示差异极显著(P<0.01),上标相同字母表示差异不显著(P>0.05)
Note: Values in the same column with different capital superscripts differ significantly (P< 0.01 ),the same letters in the same vertical column means no significant difference between the methods (P>0.05)
2.2 不同发育时期的胚胎对移植后妊娠率影响
胚胎不同发育时期的分类为供体人工输精后的36、48和60 h。2~8细胞期胚胎通过输卵管回收,囊胚通过子宫角回收。研究表明,胚胎发育早期2细胞以上至-8细胞冲胚与囊胚冲胚移植,在胚胎妊娠率差方面差异不显著(P>0.05),但其中以2细胞进行移植后的妊娠率最低,而4~8细胞移植妊娠率最高。表2
表2 不同发育时期胚胎下妊娠率变化
Table 2 Effect of embryo development stage on pregnancy rate in surrogacy

胚胎发育阶段Embryodevelopmentstage胚胎数No.Embryo移植数No.Transfers妊娠数Pregnancies妊娠率(%)Pregnancyrate2细胞 Twocells127922732.81±16.15a2-4细胞 Twotofourcells36130413943.18±11.30a4-8细胞 Fourtoeightcells30301649.54±4.80a囊胚 blastocyst2101667843.39±16.29a
注:上标相同字母表示差异不显著(P>0.05)
Note: the same letters in the same vertical column means no significant difference between the methods (P>0.05)
2.3 胚胎类型,数量和质量等级对受胎率影响
研究表明,根据胚胎质量进行分类(BA、MA和MB)移植受体时,鲜胚组囊胚、A级和B级桑葚胚在妊娠率方面逐渐降低,但差异不显著(P>0.05),而C级桑葚胚与前三组差异极显著(P<0.01),冻胚组妊娠率方面差异不显著(P>0.05)。从胚胎质量相同,移植数量差异方面比较,移植2枚胚胎时,桑葚胚移植受体后妊娠率显示逐渐降低,A级和B级胚妊娠率差异不显著(P>0.05),C级胚妊娠率差异极显著(P<0.01),但2枚胚胎的妊娠率比移植1枚胚胎的妊娠率高,但差异不显著(P>0.05)。从胚胎质量相同,胚胎数量相同,胚胎不同类型方面进行比较,冻胚组比鲜胚移植妊娠率有所降低,但差异不显著(P>0.05)。表3
2.4 同步性对受体妊娠率的影响
在供体与受体胚胎移植生理同期化时,由于优质囊胚胚胎数量超出受体数量,因此选择部分受体提前24 h进行胚胎。研究表明,提前移植的受体在胚胎妊娠率方面与同期化受体胚胎妊娠率差异不显著(P>0.05)。表4
2.5 不同饲养方式对受体妊娠率的影响
在繁殖季节,放牧组受体在胚胎移植前,进行自然放牧,待胚胎移植手术伤口恢复完后仍然进行放牧,至妊娠后期进行全舍饲;圈舍饲养(配合饲料)组的日粮组成为青贮,苜蓿草粉和大北农母羊哺乳预混料。圈舍饲养(自制饲料)组的日龄组成为青贮,苜蓿草粉,玉米秸秆,玉米和六旺添食砖。受体在不同的饲养条件下移植胚胎,在胚胎妊娠率方面差异不显著(P>0.05)。表5
表3 不同胚胎类型,数量和质量等级下受胎率变化
Table 3 Effect of the type, number and quality of embryo transferred on pregnancy rate in surrogacy

胚胎类型Typeofembryo胚胎数量No.embryo胚胎质量Qualityofembryo移植数No.transfers妊娠数Pregnancies妊娠率(%)Pregnancyrate鲜胚Fresh12BA362158.33±3.92AaMA823643.90±3.45AacMB502040.00±5.65AacMC21418.33±2.35BcBA5483.33±23.57aMA251455.77±8.16AacMB23634.31±1.39AbcMC23825.84±1.18Bc自制冻胚OPS1BA10550.00±14.14aMA351542.56%±1.27a冻胚Freeze1BA17735352.94%±14.44a
注:上标不同大写字母表示差异极显著(P<0.01),上标不同小写字母表示差异显著(0.01
Note: Values in the same column with different capital superscripts differ significantly (P< 0.01 ), Values in the same column with different lowercase superscripts differ significantly (0.01
表4 同步性下受体妊娠率变化
Table 4 The relationship between surrogacy pregnancy rate and recipient synchronization

同期化程度Synchronization移植数No.transfers妊娠数Pregnancies妊娠率(%)Pregnancyrate-24h201053.57±5.04a01185748.31±12.44a
注:上标相同字母表示差异不显著(P>0.05)
Note: the same letters in the same vertical column means no significant difference between the methods (P>0.05)
表5 不同饲养方式下受体妊娠率变化
Table 5 The relationship between on Pregnancy rate in different ration requirement of surrogacy
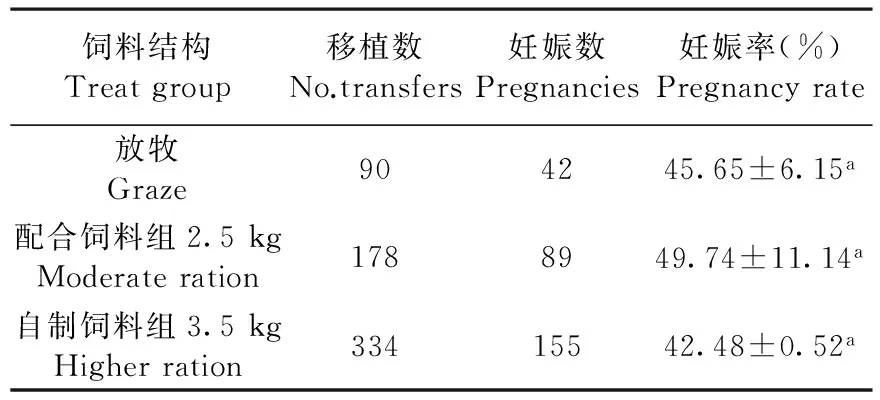
饲料结构Treatgroup移植数No.transfers妊娠数Pregnancies妊娠率(%)Pregnancyrate放牧Graze904245.65±6.15a配合饲料组2.5kgModerateration1788949.74±11.14a自制饲料组3.5kgHigherration33415542.48±0.52a
注:上标相同字母表示差异不显著(P>0.05)
Note: the same letters in the same vertical column means no significant difference between the methods (P>0.05)
3 讨 论
胚胎能否发生妊娠,在人类辅助生殖中已经有很多评估方法[5-7],但在动物胚胎移植中,仍然从胚胎和受体两类因素考虑,即胚胎的发育速度、胚龄、质量、类型、数量、运输方式和受体的品种、年龄、同期化程度、黄体数、使用次数和营养水平等等。
3.1 胚胎运输方式对受体妊娠率的影响
供体与受体进行异地饲养的情况偶有发生,比较了供体运输、胚胎运输、受体运输与就地移植鲜胚的妊娠效果,结果表明,供体运输、鲜胚运输和受体运输之间的移植妊娠率没有显著差异性,但都比不运输就地移植的方式低。通过资料回顾性调查发现,供体运输是发生在超排输精程序执行完毕后3 d进行的运输,受体的运输是发生在受体撤栓完毕后进行的,结果说明该种运输方式对供体和受体是有影响的,相比于权富生等[2]的研究,受体应当在囊胚移植期进行运输而减少对受体的应激刺激。绵羊的发情周期(17 d)相对于山羊(21 d)短4 d,在绵羊发情排卵LH高峰后的22~24 h,即发情开始后的3~3.5 d是形成功能黄体的重要时期,因此无论供体还是受体运输刺激均会容易引起黄体的退化和胚胎质量的下降[8-9],应当采用子宫角法6.5~7 d回收胚胎。进行胚胎运输相比于供体和受体运输来说,减少了对供体和受体的应激刺激,试验妊娠结果也能说明这一点,但鲜胚运输的标准差比其余三组的标准差都大,说明胚胎保存条件至关重要,不仅受到温度的限制,而且也受到胚胎冲出后移植时间的影响[10]。通过回顾性调查分析发现,胚胎保存在便携式培养箱中的四孔板中具有一定的局限性,而权富生等[7]使用麦管保存运输更值得借鉴,或利用中间受体[11]携带胚胎,在到达移植地区再行取出进行胚胎移植而不影响胚胎存活与后期妊娠。
3.2 不同发育时期的胚胎对移植后妊娠率影响
在繁殖季节,有些胚胎工程技术人员通常会跨地区进行多个地点的胚胎移植任务,而移植时间就成了制约因素,因此根据胚胎发育的时间[12],选择不同发育阶段的胚胎进行鲜胚移植以保证妊娠效果就显得十分必要。试验结果表明,胚胎在2细胞组、2~4细胞组、4~8细胞组、囊胚期组的胚胎妊娠率差异不显著,该研究结果与张果平等[13]的研究结果基本一致,但其中以2细胞进行移植妊娠率最低,而4~8细胞移植妊娠率最高,这在张立等[10]在多地区的移植结果基本相似。通过对移植资料和产羔记录的回顾性调查分析,发现2细胞期胚胎刚从原核期完成分裂,且仍具有部分尚未分裂的胚胎,推测这是由于未给予原核期胚胎充分的受精和发育时间,大大降低了胚胎妊娠率。另外在受体移植时,绵羊卵巢排卵形成红体很脆弱,容易出血,手术过程稍微不慎就会破坏红体,继而影响移植后的胚胎发育,因此认为应当避免2细胞期胚胎的移植,应当选择4~8细胞期胚胎进行移植更加合理有效。
3.3 胚胎类型,数量和质量等级对移植后妊娠率的影响
目前在胚胎移植妊娠率方面普遍形成的共识为鲜胚高于或等于冻胚,移植数多的高于移植数量少的,质量高的优于质量差的。研究表明鲜胚组高于自制冻胚和进口冻胚组,这与S. Papadopoulos[13]的研究结果相一致。在该试验中除了自制冻胚组移植数量较少,无法充分说明之外,进口冻胚妊娠标准差显示高于鲜胚组,这表明囊胚冷冻前后发生较大的差异,因此自制冻胚除了注意胚胎冷冻方法之外,还应考虑囊胚质量评价。这不仅需要参考以往的胚胎质量评价方法[14],还应当借鉴新的囊胚质量评价[15]方法,依据不同形态期囊胚以确定移植胚胎与受体的生理同期性和时间同期性,达到最佳的移植效果。
在胚胎移植数量方面,试验表明2枚胚胎的移植妊娠率高于1枚胚胎的移植妊娠率,但这种移植妊娠率并没有表现出倍数关系,这在Brown[16]等的研究中也有相关报道。但不论是1枚还是2枚桑葚C级(MC)胚均达不到30%以上的妊娠率,而1枚或2枚MB胚胎也只能达到30%~40 % 妊娠率,这就需要改变移植方案以满足移植要求。
在胚胎移植质量方面,研究表明,移植胚胎随着质量下降,妊娠率也有逐级下降的趋势,这说明高等级质量的胚胎比低质量等级的胚胎更具有优势调节并适应子宫内环境,这与F. Baria等报道[1,17]相一致,但对胚龄从日龄上的划分我们会发现同一供体会有不同发育阶段的胚胎,这种胚胎发育阶段的非整齐性除了受到卵子受精自身质量的影响[18]之外,还与发情排卵的时间差有关联,即2~5 mm的卵泡生长从12~24 h至48 h到达排卵阶段大约在48~60 h,会出现6~12 h的卵泡排卵时间差[8],因此为了提高胚胎的质量以促进胚胎妊娠不仅需要考虑供体肉羊的内外和外在影响因素[19],也要兼顾饲养管理[20]以更好的发挥肉羊遗传资源效应。
3.4 胚胎同步性对受体妊娠率的影响
在胚胎移植中,胚胎数量超出受体数量时除了进行双胚移植外,也会选择同期化程度间隔较小的受体进行移植,尤其是对于高质量等级的胚胎。Carey Satterfield等[21]研究绵羊供体与受体发情时间不同步对受胎率的影响,结果表明,同步发情的受胎率极显著高于3、12 d的结果,因此子宫内环境接收同步胚龄的时间是相对的。研究表明囊胚比同期受体提前24 h并不影响胚胎的受胎率,而陈童等[22]的研究表明±24 h与 0 h是有显著差异性的,而Sun Shangxin等[23]指出,供体与受体发情时间差不应超过 ±12 h,而超过48 h将几乎无法受孕,因此相差±24 h受胎率是否受到影响及程度问题,除了在研究中样本数少有失客观之外,还应考虑胚龄与质量问题,但多数学者[18,23]认为供体与受体发情时间差不宜超过 ±12 h,最大不超过 ±24 h,避免受胎率明显下降。
3.5 不同饲养方式对受体妊娠率的影响
多数学者认为,饲养管理好、膘肥体壮的受体更符合移植要求,且受胎率和产羔(犊)率都明显高于饲养条件差的受体,但在牧区尤其是在绵羊品种居首的新疆地区,放牧绵羊的饲喂仍然与草原植被息息相关,且膘情表现出明显的植被生长季节性。试验比较了放牧组受体与不同圈舍饲喂条件组胚胎移植的妊娠率,结果表明,放牧组与其余组无显著差异,表明放牧条件下的受体能够满足胚胎移植条件,不受影响,这与何振富等[24]的研究结果相一致。受体营养不良会对移植的胚胎产生不利影响[25],但也仅限于胚胎植入前,而对植入期(preimplantation)的胚胎不会造成流产[26],只会影响新生动物的生殖机能与新生健康问题,此外在粗饲料、青绿饲料、青贮饲料、矿物质饲料、维生素饲料和添加剂等6类饲料差异中,粗蛋白也只能对供体胚胎产生不利影响[27],而对受体移植胚胎并不能产生影响,VE缺乏和矿物元素磷的缺乏与过量都不利于胚胎的妊娠与新生动物的生存质量,因此在繁殖季节,放牧条件下的受体能够获得充分的营养,能够满足胚胎移植要求,与舍饲饲养受体进行胚胎移植,在妊娠率方面没有差异性。
4 结 论
三种胚胎运输方式即供体运输、受体运输在早期胚胎卵裂阶段进行胚胎移植不利于胚胎后期植入妊娠,但为保证能够进行胚胎移植,远途运输胚胎的保存条件将至关重要。早期卵裂胚胎与囊胚移植妊娠率无显著差异,但不推荐使用胚胎期2细胞进行移植,尤其是同时多地区进行胚胎移植。鲜胚与冻胚移植妊娠率无显著差异,但为避免妊娠率差异较大,应当注意胚胎冷冻程序和胚胎质量;胚胎移植2枚的妊娠率高于1枚的妊娠率,胚胎妊娠率随着胚胎质量下降而有降低的趋势,尤其应当注意C级胚胎的移植数量策略。受体与囊胚期胚胎移植数量不对等时,可考虑同期性差 -24 h的受体进行移植。繁殖季节放牧的受体羊能满足胚胎移植要求,不影响妊娠。
参考文献(References)
[1] F. Baria, M. Khalidb, W. Haresigna.(2003). Factors affecting the survival of sheep embryos after transfer within a MOET program[J].Theriogenology, (59): 1,265-1,275.(in Chinese)
[2]权富生.山羊和绵羊超数排卵及规模化胚胎移植技术研究[D].杨凌.西北农林科技大学博士论文,2010.
Quan Fu-sheng.(2010).Superovulationandlarge-scaletransferembryoingoatsandsheep[D]. Northwest A&F University, Yangling.(in Chinese)
[3]付静涛,朱士恩,余文莉,等.影响绵羊、山羊超数排卵极胚胎移植效果因素分析[J].中国农业大学学报,2005,(5):64-67.
Fu Jing-tao,Zhu Shi-en,Yu Wen-li,et al.(2005).Factors on superovulation and embryo transfer efficiency in goat and sheep[J].JournalofChinaAgriculturalUniversity, (5):64-67.(in Chinese)
[4]王峰,黄春华,张东,等. 多种因素对牛超数排卵效果影响的研究[J]. 中国农学通报,2013,29(17):19-24.
Wang Feng, Huang Chun-hua, Zhang Dong, et al. (2013).Study on Effects of Multi-factors on Superovulation in Cattle[J].ChineseAgriculturalScienceBulletin,29(17):19-24.(in Chinese)
[5]R.Singh,K.D.Sinclair.(2007).Metabolomics:Approaches to assessing oocyte and embryo quality[J].Theriogenology,68(1):56-62.(in Chinese)
[6]Sakkas,Denny,Gardner,David K.(2005).Nonivasive methods to assess embryo quality[J].CurrentopinioninObstetrics&Gynecology, 17(3):283-288.(in Chinese)
[7]Andres Salumets,Christel Hyden-Granskog,Anne-maria Suikkari.(2001).The predictive valne on pronuclear morphology of zygotes in the assessment of human embryo quality[J].HumReprod,16(10): 2,177-2,181.(in Chinese)
[8]Cognie y,Ba G,Poulin N,Mermillod P.(2003).Current status of embryo technologies in sheep and goat[J].Theriogenology, 59(1):171-188.(in Chinese)
[9]Cognie y,Chupin D,Saumande J.(1986).The effect of modifying the FSH/LH ratio during the superovulatory treatment in ewes[J].Theriogenology, (25):148.(Abstract)
[10]张立.牛羊胚胎工程技术产业化研究与应用[D]. 杨凌.西北农林科技大学硕士论文,2005.
Zhang Li.(2005).Researchandapplicationforindustrializationofembryoengineeringtechnologyincattleandsheep[D]. Shanxi,Northwest A&F University,Yangling. (in Chinese)
[11]B.P. Enright , P. Lonergan , a, A. Dinnyes , (2000). Culture of in vitro produced bovine zygotes in vitro vs in vivo: Implications for early embryo development and quality[J].Theriogenology, (54): 659-673.(in Chinese)
[12]Ann Van Soom, Bart Mateusen, Jo Leroy, et al.(2003). Assessment of mammalian embryo quality: what can we learn from embryo morphology[J].ReproductiveBioMedicineOnline,7(6):664-670.(in Chinese)
[13]S.Papadopoulos,D. Rizos,P.Duffy,et al.(2002).Embryo survival and recipient pregnancy rates after transfer of fresh or vitrified, in vivo or in vitro produced ovine blastocysts[J].AnimalReproductionScience,(74):35-44.(in Chinese)
[14]D.K Gardner,Michelle Lane,John Stevens et al.(2000). Blastocyst score affects implantation and pregnancy outcome: towards a single blastocyst transfer[J].FertilityandSterility, 73(6):1,155-1,158.(in Chinese)
[15] Koji Matsuura,Nobuyoshi Hayashi,Chisato Takiue ,et al.(2010).Blastocyst qulity scoring based on morphologic grading correlates with cell number[J].FertilityandSteriltiy,94(3): 1,135-1,137.(in Chinese)
[16]B.W Brown, T Radziewic.(1998). Production of sheep embryos in vitro and development of progeny following single and twin embryo transfers[J].Theriogenology, (49):1,525-1,536.(in Chinese)
[17]Breuel KF,Baker RD,Buther RL.et al.(1991).The effects of breed,age of donor and dosage of foll icle-stimulating hormone on the superovulatory response of beef-cows[J].Theriogenology, (36): 241-255.(in Chinese)
[18]汪立芹,陈童,林嘉鹏,等. 影响转基因绵羊胚胎移植受胎率的因素[J].西北农业学报,2012,21(9):6-9.
Wang Li-qin ,Chen Tong,Lin Jia-peng, et al.(2011).Factors influencing the pregnancy rate of embryo-transferred transgenic sheep[J].ActaAgriculturaeBoreali-occidentalissinica,21(9):6-9. (in Chinese)
[19]Antonio González-BulnesA, David T. Baird, Bruce K. Campbell et al. (2004). Multiple factors affecting the efficiency of multiple ovulation and embryo transfer in sheep and goats[J].Reprodu-ction,FertilityandDevelopment, (16):421-435.(in Chinese)
[20]S Freret, B Grimard, A A Ponter, et al.(2006).Reduction of body-weight gain enhances in vitro embryo production in overfed superovulated dairy heifers[J].Reproduction,(131):783-794.(in Chinese)
[21]Carey Satterfield M,Spencer T E.(2011).Asynchronous Embryo Transfer in sheep:Lack of survival in progestinized recipient ewes[J].JournalofanimalSciences,2(1):8-19.(in Chinese)
[22]陈童.萨福克肉羊胚胎移植关键技术的研究与应用[D],石河子,石河子大学硕士论文,2013.
Chen Tong.(2013).TheresearchandapplicationofkeyembryotransfertechnologyinSuffolksheep[D].Xinjiang,Shihezi University , shihezi,(in Chinese)
[23]Sun Shang-xin.(2010). Effects of environment on gestation ratio of sheep embryo transfer and its control measures[J].JouranlofAgriculturalScience,2(2):234-238.(in Chinese)
[24]何振富,苏永生,董俊,等. 绵羊胚胎移植受胎率影响因素的研究[J].畜牧兽医杂志,2013,32(2):6-9.
He Zheng-fu,Su Yong-sheng,Dong Jun. et al.2013.Study on influencing factors of embryo transfer fertility rate[J].journalofAnimalScienceandVeterinaryMedicine,32(2):6-9. (in Chinese)
[25]A.U. Mani, E.D.Watson,W.A.C.Mckelvey.(1994).The effects of subnutrition before of after embryo transfer on pregnancy rate and embryo survival in does[J].Theriogenology,41(8):1,673-1,678.(in Chinese)
[26]M.A.Velazquez.(2015).Impact of maternal malnutrition during the periconceptional period on mammalian preimplantation embryo development[J].DomesticAnimalEndocrinology, (51):27-45.(in Chinese)
[27]D.O.Callaghan and M.P.Boland.(1999).Nutritional effects on ovulation,embryo development and the establishment of pregnancy in ruminants[J].AnimalScience,68(2):299-314.(in Chinese)
CaseStudyontheFactorsInfluencingtheSurvivalofMuttonSheepEmbryoTransfer
GUO Yan-hua1, LIU Chang-bin1, WAN Peng-cheng1, NI Jian-hong1, WANG Li-min1, ZHOU Ping1,YANG Yong-lin1, FANG Zhi-zhong2, GU Hong-wei2, FU Bing-zhe3, LU Quan-sheng3
(1.InstituteofAnimalHusbandryandVeterinary,XinjiangAcademyofAgriculturalandReclamationSciences/StateKeyLaboratoryofSheepGeneticImprovementandHealthyProduction,ShiheziXinjiang832000China; 2.TheSheepResearchInstituteofKaramay,KaramayXinjiang834000,China;3.XinjiangHuaniuTianjunLivestockBreedingEngineeringCo.Ltd.,ChangjiXinjiang831100,China)
ObjectiveMultiple ovulation and embryo transfer (MOET) technology is an important technique for obtaining excellent germplasm resources, but many factors affect embryo survival and pregnancy, and a large amount of data is needed to support it. The purpose of this study is to investigate the influence of embryonic and receptor factors on survival after embryo transfer.MethodA retrospective survey about embryonic and recipient factors on the survival rate of transferred embryo was done in our application in mutton sheep.ResultThese results showed that the remote transition of donor, recipient and fresh embryo were adverse to gestation than on site transition (P<0.01). There was no significant difference on pregnancy between embryonic cleavage and blastocyst stage(P>0.05), but the rate of pregnancy with two cell transplantation on the embryonic cleavage stage was the lowest. And it was the same to embryo survival and recipient pregnancy rates after transfer of the fresh and vitrified in vitro produced ovine blastocysts (P>0.05). The pregnancy rate of 2 embryos was higher than that of 1 embryo. The rate of embryo pregnancy decreased with the quality of embryo. The recipient pregnancy rate was not be affected by the blastocysts earlier than the synchronizing recipient on 24 hours after embryonic transfer (P>0.05). There was no significant difference in the receptor pregnancy rate between the grazing and feeding sheep embryos (P>0.05).ConclusionThese results confirm that both embryonic and recipient factors play an important role in the success after embryo transfer in sheep.
sheep; embryo; recipient; factors
Supported by: The Academician fund of Xinjiang Production and Construction Corps "Optimization of high efficiency MOET production and receptor processing in sheep" (2013BB023); Programs of tackling key scientific problems and achievements transformation of XPCC "Breeding of new varieties and innovation of germplasm resources (superfine wool sheep)" (2016AC027) ; National Natural Scientific Foundation of China "Study on the transcriptome analysis and cytoplasmic maturation of lamb mature oocytes in vitro" (31160460)
Wan Peng-cheng (1977-) male, native place: Kasha, Xinjiang. Researcher, research field: ovine embryo engineering g.(E-mail) pengcheng.wan@gmail.com
Liu Chang-bin(1977-),male, native place: Yucheng, Henan. Associate Researcher, research field: Bovine and ovine embryo engineering.(E-mail)406271412@qq.com
S826.8
A
1001-4330(2017)11-2138-08
2017-07-24
兵团院士基金“绵羊高效MOET生产及受体处理程序优化研究”(2013BB023);兵团科技攻关与成果转化计划项目“新品种选育与种质资源创新(超细毛羊)”(2016AC027);国家自然科学基金“基于羔羊体外成熟卵母细胞转录组分析及核质成熟相关机制研究”(31160460)
郭延华(1983-),男,新疆喀什人,助理研究员,硕士,研究方向为动物遗传育种与繁殖,(E-mail)guoyanhuatlr@sohu.com
万鹏程(1977-),男,新疆喀什人,研究员,研究方向为羊胚胎工程,(E-mail)pengcheng.wan@gmail.com
刘长彬(1977-),男,河南虞城人,副研究员,研究方向为牛羊胚胎工程,(E-mail)406271412@qq.com
