生物转化提高黄芪多糖含量的发酵条件优化
2017-12-28郑卫红杨胜利
陈 弘,郑卫红,杨胜利*
(1.浙江工业大学 药学院,浙江 杭州 310014;2.湖州师范学院 生命科学院,浙江 湖州 313000)
生物转化提高黄芪多糖含量的发酵条件优化
陈 弘1,郑卫红2,杨胜利1*
(1.浙江工业大学 药学院,浙江 杭州 310014;2.湖州师范学院 生命科学院,浙江 湖州 313000)
以黑曲霉(Aspergillus niger)为出发菌株,黄芪提取液为唯一碳源进行生物转化。在单因素试验的基础上采用正交试验设计,以黄芪多糖含量为指标对发酵条件中的发酵时间、发酵温度、起始pH及摇床转速进行优化。结果表明,在起始pH 5.0、发酵温度30℃、摇床转速180 r/min的条件下发酵6 d,黄芪多糖含量最高,为(2.473±0.062)g/L。利用红外光谱分析发酵前后黄芪多糖的结构变化,结果表明发酵前后黄芪多糖的结构没有发生较大变化。
黄芪提取液;正交试验;发酵条件优化;红外光谱
黄芪(Astragalus memberanaceus)是一种常用的中药,含有多糖、生物碱、氨基酸、黄酮类、苷类等多种生物活性物质,其中黄芪多糖(Astragalus polysacharides,APS)是其主要生物活性成分。黄芪多糖的组成主要为葡聚糖和杂多糖,目前认为其单糖种类主要包括L-鼠李糖、L-阿拉伯糖、D-木糖、L-木糖、D-半乳糖、D-葡萄糖和D-甘露糖等。 黄芪多糖作为一类生物大分子成分,具有提高免疫力、抗病毒、抗菌、抗氧化、调节血糖等多方面的生物活性与功能[1-5]。
随着传统中药的推广和普及,人们对黄芪等中药的需求量不断增加,通过改善其生长条件提高其中有效物质含量成为越来越热门的研究方向。20世纪80年代后期人们发现了微生物和植物之间有机结合的中药生产工艺,利用微生物的代谢作用,对中药中的有效成分进行转化和利用,从而提高了其有效成分的含量,起到减毒增效的作用[6-9]。
以中药为基质进行固态发酵,提高多糖含量的研究有所报道[10-12],但是以中药提取物进行发酵的研究未见报道。本试验采用液体深层发酵技术,选用安全的黑曲霉为发酵菌种,以中药黄芪提取物为基质进行发酵,比较发酵前后多糖的变化,为新药的研发提供依据。
1 材料与方法
1.1 材料与试剂
黄芪:河北金开中药材有限公司;黑曲霉(Aspergillus niger):浙江工业大学生物制药实验室;葡萄糖、蔗糖、NaNO3、KH2PO4、MgSO4·7H2O(均为分析纯):广东光华科技股份有限公司;KCl(分析纯):上海凌峰化学试剂有限公司;FeSO4(分析纯):天津福晨化学试剂厂;苯酚(分析纯):杭州双林化工试剂厂;H2SO4(分析纯):西陇科学股份有限公司。
种子培养基:NaNO33 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,KCl 0.5 g/L,FeSO40.01 g/L,蔗糖30 g/L。
发酵培养基:黄芪提取液多糖1.4 g/L,蛋白胨20 g/L,NaNO34g/L,KH2PO41g/L,MgSO4·7H2O0.8g/L,KCl0.6g/L。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器:河南㈣华仪器有限公司;SWCJ-1F单人双面净化工作台:苏州净化设备有限公司;UV-1402053紫外可见分光光度计:上海美谱达仪器有限公司;HXBL-38立式压力蒸汽灭菌锅:上海华线医用核子仪器有限公司;ZHWY-2102C恒温培养摇床:上海智诚分析仪器制造有限公司;SC-3610低速离心机:安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 黄芪提取液的制备
用高速粉碎机将黄芪药材粉碎至100目。黄芪粉末以1∶20(g∶mL)的固液比与蒸馏水混合,90 ℃条件下冷凝回流提取150 min。将黄芪提取液4 000 r/min离心10 min,除去残渣后取上清液冷藏备用[13-15]。
1.3.2 种子液的制备
从斜面保藏培养基中挑取适量菌落接种于100 mL种子培养基中,在32℃、160 r/min条件下培养48 h,作为种子液备用。
1.3.3 黄芪提取液发酵条件优化单因素试验
将种子液以10%的接种量接入100 mL发酵培养基中,分别考察发酵时间(3 d、4 d、5 d、6 d、7 d)、发酵温度(30℃、32℃、34 ℃、36℃、38 ℃)、起始pH(3.0、4.0、5.0、6.0、7.0)、摇床转速(160 r/min、170 r/min、180 r/min、190 r/min、200 r/min)对发酵液中黄芪多糖含量的影响。
1.3.4 黄芪提取液发酵条件优化正交试验
根据单因素试验的结果,以黄芪多糖含量为指标,采用正交试验法[16-17]考察发酵时间(A)、发酵温度(B)、起始pH(C)、摇床转速(D)4个因素对黄芪多糖含量的影响。正交试验因素与水平见表1。

表1 黄芪提取液发酵工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for fermentation process optimization ofAstragalusextract
1.3.5 黄芪多糖含量的测定方法
精确称取无水D-葡萄糖100mg,加水溶解定容于100mL容量瓶中,摇匀得1 mg/mL的葡萄糖标准液。精密吸取葡萄糖标准液2.0 mL、2.5 mL、3.0 mL、3.5 mL、4.0 mL、4.5 mL于100 mL容量瓶中,定容摇匀。精密吸取上述各溶液2 mL于具塞试管中,分别加入5%苯酚溶液1.0 mL,摇匀,立即加入浓硫酸5.0mL,振荡2 min后放入沸水浴中加热15 min,然后放入冷水浴中冷却30 min,以蒸馏水作为空白对照,在波长490nm处测定吸光度值,绘制葡萄糖标准曲线[18]。根据葡萄糖标准曲线回归方程计算发酵液中黄芪多糖的含量。1.3.6红外光谱检测
将发酵前后的黄芪多糖粗提样干燥至无水的粉末状态,利用红外光谱仪在4 000~400 cm-1范围内扫描测定红外光谱。
2 结果与分析
2.1 葡萄糖标准曲线的建立
以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标,建立葡萄糖标准曲线,结果如图1所示。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
由图1可知,葡萄糖标准曲线的回归方程为y=15.643x+0.033 9,相关系数R2=0.994。结果表明,葡萄糖质量浓度与吸光度值之间呈现较好的线性关系。
2.2 发酵条件优化单因素试验
2.2.1 起始pH对黄芪多糖含量的影响
黑曲霉生长的最适pH范围为4.0~6.0。考察发酵培养基起始pH对黄芪多糖含量的影响,结果如图2所示。
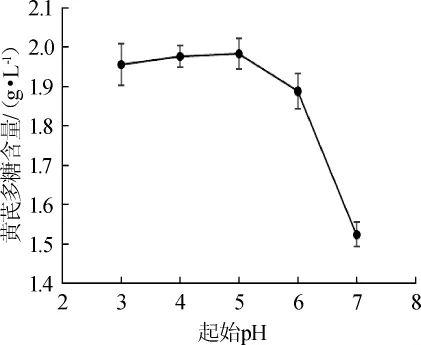
图2 起始pH对黄芪多糖含量的影响Fig.2 Effect of initial pH of fermentation medium onAstragalus polysaccharide content
由图2可知,起始pH在3.0~5.0之间对黄芪多糖含量的影响不大,并且当起始pH值为5.0时,黄芪多糖的含量最高,为(1.984±0.039)g/L,说明该黑曲霉生长的最适起始pH范围为3.0~5.0。之后随着起始pH的升高,黄芪多糖的含量明显下降。因此,选择起始pH值为5.0。
2) z方向升降台调整标准件的位置,同时对激光二维扫描传感器的高度也进行调整,使标准件处于激光二维扫描传感器的测量范围内;
2.2.2 摇床转速对黄芪多糖含量的影响
通过调节摇床转速来改变溶解氧,考察不同的摇床转速对黄芪多糖含量的影响,结果如图3所示。
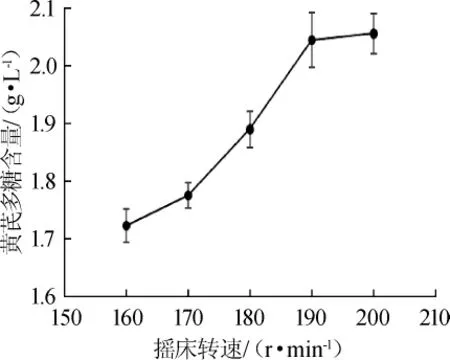
图3 摇床转速对黄芪多糖含量的影响Fig.3 Effect of shaker speed onAstragaluspolysaccharide content
由图3可知,随着摇床转速的增大,黄芪多糖含量增加。当摇床转速为190r/min时,黄芪多糖含量为(2.045±0.048)g/L,之后黄芪多糖含量的增加明显减缓,说明190 r/min的摇床转速已经能够满足黑曲霉生长发酵的耗氧需求。因此,选择摇床的转速为190 r/min。
2.2.3 发酵温度对黄芪多糖含量的影响
在最适温度下有利于微生物的生长和发酵。考察发酵温度对黄芪多糖含量的影响,结果如图4所示。
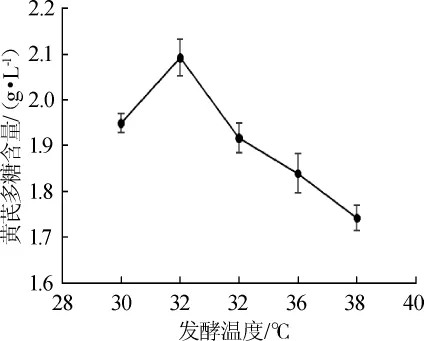
图4 发酵温度对黄芪多糖含量的影响Fig.4 Effect of fermentation temperature onAstragalus polysaccharide content
由图4可知,随着发酵温度的升高,黄芪多糖的含量也随之增加。当发酵温度达到32℃时,黄芪多糖的含量为最大值(2.093±0.041)g/L,随着发酵温度继续升高,黄芪多糖的含量明显降低,说明32℃是黑曲霉内酶参与代谢的最适发酵温度。因此,选择发酵温度为32℃。
2.2.4 发酵时间对黄芪多糖含量的影响
由图5可知,随着发酵时间的增加,黄芪多糖的含量先增加再减少,在发酵5 d时达到最大值(2.093±0.073)g/L。之后由于培养基中营养成分不足,菌体生长利用了积累的代谢产物,所以导致黄芪多糖含量下降。因此,选择发酵时间为5 d。
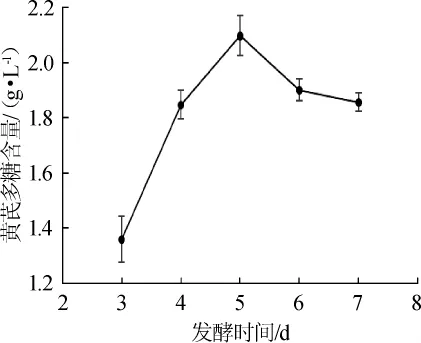
图5 发酵时间对黄芪多糖含量的影响Fig.5 Effect of fermentation time onAstragaluspolysaccharide content
2.3 发酵条件优化正交试验
在单因素试验的基础上,通过3因素3水平正交试验考察发酵时间(A)、发酵温度(B)、起始pH(C)、摇床转速(D)对黄芪多糖含量的影响。正交试验结果见表2,方差分析见表3。
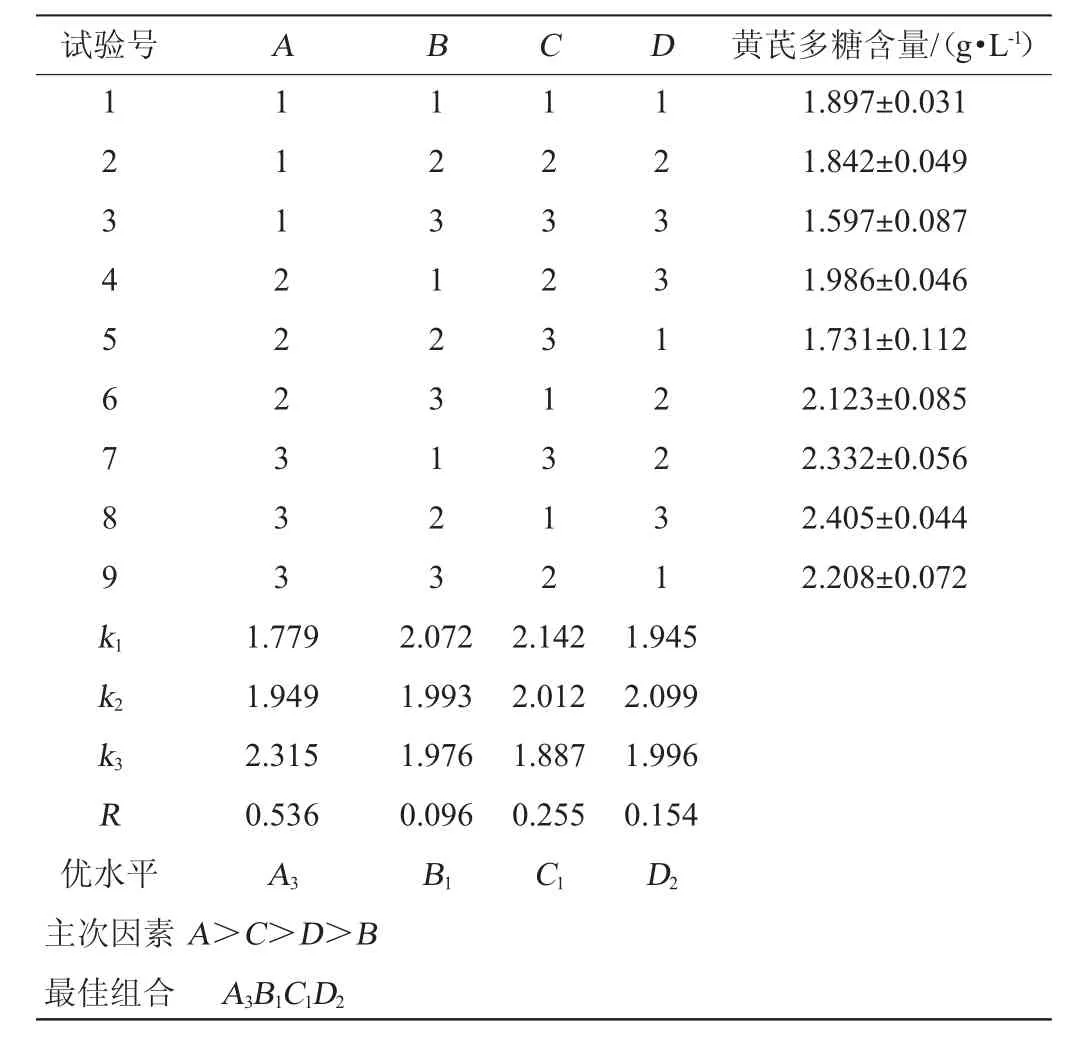
表2 黄芪提取液发酵工艺优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for fermentation process optimization ofAstragalusextract
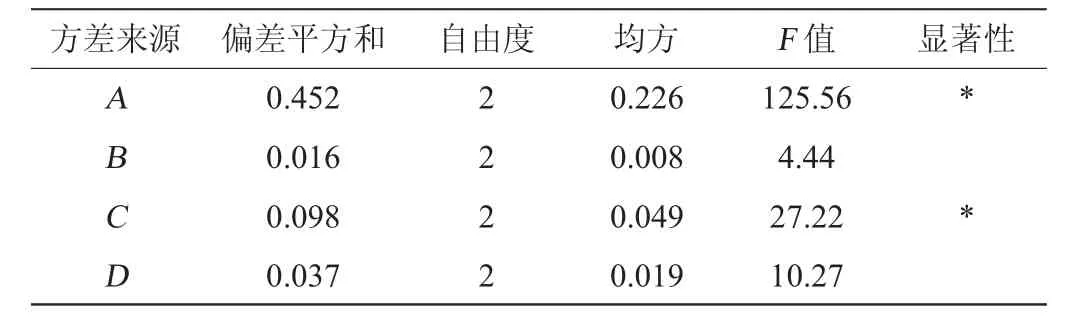
表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表2、表3可知,发酵条件为A3B1C1D2,即发酵时间6d、发酵温度30℃、起始pH 5.0、摇床转速180 r/min,在此条件下黄芪多糖的含量达到(2.473±0.062)g/L。FA=125.56,FB=4.44,FC=27.22,FD=10.27,按α=0.05的检验标准F0.05(2,2)=19。其中FA和FC>F0.05(2,2),所以因素A(发酵时间)和因素C(起始pH)有显著性(P<0.05)。
2.4 红外光谱检测
发酵前后黄芪多糖粗提物的红外光谱如图6所示。
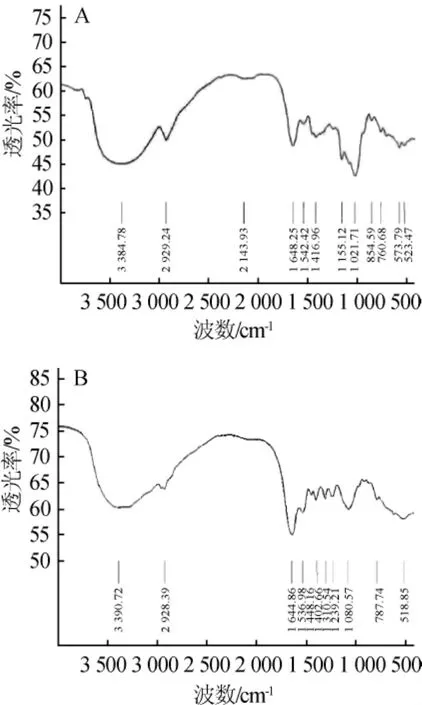
图6 发酵前(A)、后(B)黄芪多糖粗提物的红外光谱Fig.6 Infrared spectroscopy of crude extract ofAstragalus polysaccharide before (A)and after(B)fermentation
由图6可知,在4000~400cm-1波长范围内,发酵前的黄芪多糖粗提物于3384cm-1、2929cm-1、1648cm-1、1416cm-1、1 021 cm-1、854 cm-1、573 cm-1处有明显吸收峰,为糖类化合物的一般吸收峰,发酵后的黄芪多糖粗提物的吸收峰与发酵前较为相似,除了后者在1 500~1 200 cm-1之间有多个特征吸收峰,可能是因为(-CH3)上的C-H键断裂形成C-N键或者(-CH3)上的H被NO2取代,其余吸收峰范围基本一致(3 390~3 384 cm-1、2 929~2 928 cm-1、1 648~1 644 cm-1、1 542~1 536 cm-1、787~760 cm-1、523~518 cm-1)[19-21]。
3 结论
本研究以黑曲霉(Aspergillus niger)为出发菌株,黄芪提取液为唯一碳源进行生物转化。对发酵条件中的发酵时间、发酵温度、起始pH及摇床转速进行了优化,得到较优的发酵条件为起始pH 5.0,发酵温度30℃,摇床转速180 r/min,发酵时间6 d。在该条件下发酵所得黄芪多糖含量为(2.473±0.062)g/L。利用红外光谱对发酵前后黄芪多糖结构进行分析,证明发酵前后黄芪多糖的结构没有发生较大变化。
[1]JIN M,ZHAO K,HUANG Q,et al.Structural features and biological activities of the polysaccharides fromAstragalus membranaceus[J].Int J Biol Macromol,2014,64(2):257-266.
[2]张 蔷,高文远,满淑丽.黄芪中有效成分药理活性的研究进展[J].中国中药杂志,2012,37(21):3203-3207.
[3]陈国辉,黄文凤.黄芪的化学成分及药理作用研究进展[J].中国新药杂志,2008,17(17):1482-1485.
[4]吴 梅,谭 睿.黄芪多糖研究进展[J].川北医学院学报,2013,28(1):17-22.
[5]LI R,CHEN W C,WANG W P,et al.Extraction,characterization ofAstragaluspolysaccharides and its immune modulating activities in rats with gastric cancer[J].Carbohyd Polym,2009,78(4):738-742.
[6]孙 静,马 琳,吕斯琦,等.中药发酵技术研究进展[J].药物评价研究,2011,34(1):49-52.
[7]王延年,董 雪,乔延江,等.中药发酵研究进展[J].世界科学技术:中医药现代化,2010,12(3):437-441.
[8]侯志帆,梁永红,何礼标,等.灵芝双向固体发酵雷公藤后菌质化学成分变化初步研究[J].中草药,2012,43(2):234-237.
[9]潘 扬,张 弦,蒋亚平,等.双向发酵前后马钱子生物碱含量及其HPLC 指纹谱的比较[J].南京中医药大学学报,2006,22(6):362-365.
[10]陈丽艳,李 月,张 迎,等.黄芪经侧耳菌发酵后多糖成分及含量的变化[J].食品工业科技,2011,32(10):253-255.
[11]宋艳秋,陈有为.红曲霉转化中药葛根固体发酵条件研究[J].安徽农业科学,2010,38(4):1707-1708.
[12]王英姿,韩春超,张兆旺,等.当归苦参丸方药固体发酵前后2种水提取液的成分比较[J].中国中药杂志,2010,35(8):973-976.
[13]李万玉,李安荣,徐晓玉,等.黄芪多糖的提取方法[J].中国药业,2009,18(11):87-88.
[14]WANG S P,XIAO J L,ZHANG G Z.Study on optimization of the technology for extraction and purification polysaccharide fromAstragalus membranaceus[J].J Mol Sci,2008,24(1):60-64.
[15]CHEN R Z,TAN L,JIN C G,et al.Extraction,isolation,characterization and antioxidant activity of polysaccharides fromAstragalus membranaceus[J].Ind Crop Prod,2015,77(19):434-443.
[16]史同瑞,陈楠楠,杨淑萍,等.黄芪固态发酵工艺的优化研究[J].黑龙江畜牧兽医,2017(13):206-208.
[17]贾艳姝.黄芪乳酸菌发酵工艺研究[D].哈尔滨:黑龙江中医药大学,2012.
[18]杨 莉,王志华,陶健生.黄芪中黄芪多糖含量测定方法的比较[J].中国医药工业杂志,2005,36(9):562-563.
[19]李利红,赵玉丛.黄芪多糖的提取分离与光谱分析[J].郑州牧业工程高等专科学校学报,2010,30(4):1-3.
[20]杜晋平,贾陈忠,薛翼鹏,等.黄芪多糖纯化和硫酸酯化及红外光谱分析[J].湖北农业科学,2015,54(1):154-158.
[21]ZHAO Y C,LI L H.Study on rapid identification forAstragalus polysaccharide based on FT-IR[J].Chinese J Vet Med,2014,50(5):79-81.
Optimization of fermentation conditions for increasingAstragaluspolysaccharide contents by biotransformation
CHEN Hong1,ZHENG Weihong2,YANG Shengli1*
(1.College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310014,China;2.College of Life Science,Huzhou University,Huzhou 313000,China)
The biotransformation was carried out withAspergillus nigeras the starting strain andAstragalusextraction as the only carbon source.The orthogonal experiments were designed on the basis of single factor experiments.The optimized fermentation conditions were investigated by orthogonal experiments with the content ofAstragaluspolysaccharide as the index which was determined by fermentation time,temperature,initial pH and shaker speed.The results showed that the content ofAstragaluspolysaccharide was the highest of(2.473±0.062)g/L and the concentration of polysaccharide was increased by 76%under the conditions of initial pH 5.0,fermentation temperature 30℃,shaker speed 180 r/min and fermentation time 6 d.The structural changes ofAstragaluspolysaccharides before and after fermentation were analyzed by infrared spectroscopy,and the results showed that there was little change in structurae ofAstragaluspolysaccharides before and after fermentation.
Astragalusextract;orthogonal experiments;fermentation conditions optimization;infrared spectroscopy
TQ920.9
0254-5071(2017)12-0130-04
10.11882/j.issn.0254-5071.2017.12.027
2017-10-17
陈 弘(1993-),男,硕士研究生,研究方向为微生物制药。
*通讯作者:杨胜利(1972-),男,副教授,博士,研究方向为微生物制药。
