罗汉果内生真菌的分离及其发酵产物的抗氧化活性研究
2017-12-28范彩琴张昌志龙楚媚赵丰丽宋云飞杨文国
范彩琴,张昌志,龙楚媚,付 强,赵丰丽,*,宋云飞,杨文国
(1.广西师范大学 生命科学学院,广西 桂林 541006;2.桂林莱茵生物科技股份有限公司,广西 桂林 541199)
罗汉果内生真菌的分离及其发酵产物的抗氧化活性研究
范彩琴1,张昌志1,龙楚媚1,付 强1,赵丰丽1,2*,宋云飞2,杨文国2
(1.广西师范大学 生命科学学院,广西 桂林 541006;2.桂林莱茵生物科技股份有限公司,广西 桂林 541199)
为探究罗汉果内生真菌发酵产物的化学成分及其抗氧化活性,从罗汉果内生真菌中筛选8株菌株的代谢产物进行化学成分试验,用DPPH·清除法和·OH清除法测定发酵产物的体外抗氧化活性。结果表明,8株罗汉果内生真菌发酵产物通过化学成分定性试验,推测可能含有蛋白质、多糖、有机酸、黄酮和醌类等物质。在供试液质量浓度为1 mg/mL时,其中菌株F5发酵液对DPPH·的清除率大小顺序为乙酸乙酯萃取相(96.83%)>VC(95.77%)>氯仿相(95.24%);菌株F5发酵液对·OH的清除率大小顺序为VC(99.36%)>原液(73.56%)>水相(61.98%),表明罗汉果内生真菌发酵产物具有较强的抗氧化作用,并且抗氧化的成分极性较大。
罗汉果;内生真菌;发酵产物;抗氧化活性
罗汉果(Siraitia grosvenorii)是我国传统的药食两用植物,主要分布在我国广东、广西、湖南、云南、贵州等地。据报道,罗汉果果实中的甜苷[1-3]、多糖[4]、黄酮[5]等都具有很好的抗氧化活性。从罗汉果中寻找天然抗氧化物质也一直是科研工作者研究的热点,但罗汉果对种植环境要求苛刻,适栽区Ⅱ狭窄,生长周期长,这给天然抗氧化活性物质的大量生产带来很大困难。内生真菌是指生活在健康动植物的组织、器官内部细胞内或细胞间隙的一类微生物,在长期的进化过程中和宿主形成了互惠互利、相互制约的共生关系[6]。研究发现,特殊生态环境下的微生物能够产生特殊的次生代谢产物,内生真菌存在于植物体内的特殊生长环境,已被证实具有合成和宿主植物相同或相似活性成分的能力[7]。这表明内生真菌能够产生具有抗氧化活性的代谢产物,同时也是抗氧化活性物质的重要来源。目前,在医疗和食品领Ⅱ使用较多的是合成抗氧剂,而动物试验研究结果表明,合成抗氧剂(如丁基羟基甲苯(butylated hydroxytoluene,BHT)、丁基羟基茴香醚(butylated hydroxyanisole,BHA)等)对生物体有潜在的毒副作用[8]。因此,从动植物资源中寻找天然、安全的抗氧化剂逐渐成为研究热点。为了更好地开发利用罗汉果内生真菌,本研究通过对实验室分离的罗汉果内生真菌发酵产物进行化学成分预试验,初步推断出其化学成分,采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基[9]和羟基自由基(·OH)清除法,对罗汉果内生菌发酵产物不同极性溶剂萃取相进行抗氧化活性及部位进行研究,以期为罗汉果内生菌的开发利用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
菌种:罗汉果于2015年10月采自广西桂林龙胜县,菌株F1~F8内生真菌分离自健康罗汉果。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:称取已去皮马铃薯200 g,切块,煮30 min,四层纱布过滤,加入蔗糖20 g,琼脂20 g,自来水定容1 000 mL,pH自然,121℃灭菌30 min。
发酵培养基[10]:葡萄糖20 g/L,蛋白胨2.5 g/L,酵母浸膏2.0 g/L,NaCl 0.5 g/L,K2HPO40.5 g/L,MgSO4·7H2O 0.5 g/L,pH值7.0,121℃灭菌30 min。
1.1.3 化学试剂
DPPH(分析纯):天津凯玛科技有限公司;H2O2、次氯酸钠(NaClO)、石油醚、氯仿、乙酸乙酯、无水乙醇(均为分析纯):西陇化工股份有限公司;维生素C(vitamin C,VC)、水杨酸(均为分析纯):成都市科龙化工试剂厂;硫酸亚铁(分析纯):天津市福晨化学试剂厂。
1.2 仪器与设备
SY100型显微镜:日本Nikon公司;BXM-30R型立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;HZ200LB型恒温摇床、HP400S型生化培养箱:武汉瑞华仪器设备有限责任公司;UV mini-1240型紫外分光光度计:日本岛津公司。
1.3 方法
1.3.1 罗汉果内生真菌的分离纯化
在超净工作台上,将洗净的罗汉果用体积分数为75%酒精浸泡1 min,无菌水冲洗1次;再用次氯酸钠(NaClO)浸泡5 min,无菌水冲洗1次;最后用体积分数为75%的酒精浸泡30 s,无菌水冲洗3次,并吸取1 mL第3次冲洗的无菌水涂布于培养基上培养5 d,作为阴性对照[11]。将已消毒的罗汉果接种到PDA培养基上,26℃培养,定期观察生长情况,待组织周围长出菌落,进行分离纯化得到罗汉果果实的内生真菌。
1.3.2 内生真菌的发酵及产物提取
将活化好的内生菌株接种到装液量200 mL/500 mL的发酵培养基中,28℃、160 r/min条件下摇床发酵7 d。发酵完成后,减压抽滤分离菌丝体,滤液减压浓缩成浸膏。菌丝体50 ℃烘干,粉碎,料液比1∶10(g∶mL),超声波(350W,45kHz)辅助提取30 min,提取3次,抽滤合并提取液,减压浓缩成浸膏[12-13],4℃冰箱保存备用。
1.3.3 内生真菌发酵产物化学成分定性试验
将内生真菌发酵液减压浓缩得到的浸膏和菌丝体水提液浓缩的浸膏,分别加蒸馏水制备成水提液、加体积分数为75%的酒精制备成醇提液和加蒸馏水混悬用石油醚萃取得石油醚提取液。采用试管法、颜色反应和圆形滤纸法等方法对不同提取液进行化学成分鉴定系统定性试验,具体实验方法参见文献[14]。
1.3.4 抗氧化活性菌株初步筛选
称取一定质量的发酵液浸膏和菌丝体浸膏,用无水乙醇配成1 mg/mL的待测液,对罗汉果内生真菌的发酵产物进行DPPH·清除能力测定,筛选出对DPPH·清除能力强的菌株做进一步抗氧化活性部位的追踪。
1.3.5 抗氧化活性部位的追踪
为进一步研究活性菌株发酵产物中抗氧化活性部位,将筛选得到的活性菌株发酵液浸膏和菌丝体浸膏用蒸馏水混悬,依次用石油醚、氯仿和乙酸乙酯萃取3次[15],合并萃取液,得到石油醚相、氯仿相、乙酸乙酯相和剩余水相,减压浓缩至浸膏。称取一定质量的各萃取相浸膏,用无水乙醇配成质量浓度为1 mg/mL的待测液,分别进行DPPH·清除能力测定,研究活性菌株发酵产物中抗氧化活性部位。定
1.3.6 DPPH·清除能力测定
参照张新国等[16]的方法有所改动:吸取1.0 mL待测液,加入0.15 mmol/L DPPH·乙醇溶液1.0 mL,摇匀后置于黑暗处室温反应30 min,以无水乙醇调零,在波长517 nm处测定吸光度值A1,用无水乙醇代替DPPH·所测值为吸光度值A2,用无水乙醇代替待测液所测值为吸光度值A0,同时与抗氧化阳性对照1 mg/mL维生素C(VC)溶液对DPPH·清除能力进行比较。每个试验重复3次,试验数据处理采用Q值检测[17]。DPPH·清除率计算公式如下:

1.3.7 ·OH清除能力的测定
参照SMIRNOFF N等[17]的方法有所改动:试管中依次加入1.0 mL样品提取液,9 mmol/L的硫酸亚铁1.0 mL,9 mol/L的H2O2溶液1.0 mL,静置10 min,再加入9.0 mmol/L水杨酸-乙醇溶液1.0 mL,混合均匀,静置30 min,在波长510 nm处测定吸光度值A1,用蒸馏水代替水杨酸测得吸光度值A2,蒸馏水代替待测液测得吸光度值为A0,同时与1 mg/mL VC溶液对·OH清除能力进行比较。每个试验重复3次,试验数据处理采用Q值检测[17]。·OH清除率计算公式如下:
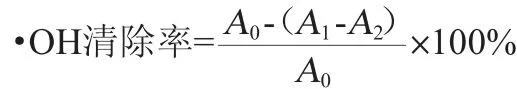
2 结果与分析
2.1 内生真菌分离纯化结果
罗汉果经过消毒处理后接种于PDA培养基,2d后组织周围开始出现菌落,而对照组培养基中未发现菌落生长,说明罗汉果表面没有杂菌,本试验选择表面消毒剂的浓度和消毒时间比较合适。罗汉果内生真菌经分离纯化,共得到12株内生真菌。挑选菌株生长速度快且健壮的8株内生真菌株进行发酵。 菌株依次编号为F1、F2、F3、F4、F5、F6、F7、F8,如图1所示。

图1 8株内生真菌菌落形态Fig.1 Colonial morphology of 8 strains of endophytic fungi
2.2 内生真菌发酵产物化学成分定性试验结果
对这8株内生真菌发酵液浸膏和菌丝体浸膏的乙醇提取液、水提液和石油醚提取液的化学成分进行定性试验,结果如表1所示。
由表1可知,初步推断出这8株罗汉果内生真菌无论是发酵液中还是菌丝体中大部分都含有蛋白质、多糖、有机酸、黄酮和醌类等化学成分,其中菌株F8发酵液中的泡沫实验表明含有皂苷,碘化铋钾有淡黄色沉淀和改良的碘化铋钾-碘-碘化钾有棕色斑点,表明含有生物碱类化学成分。说明罗汉果内生菌中含有多种活性成分,值得开发利用。
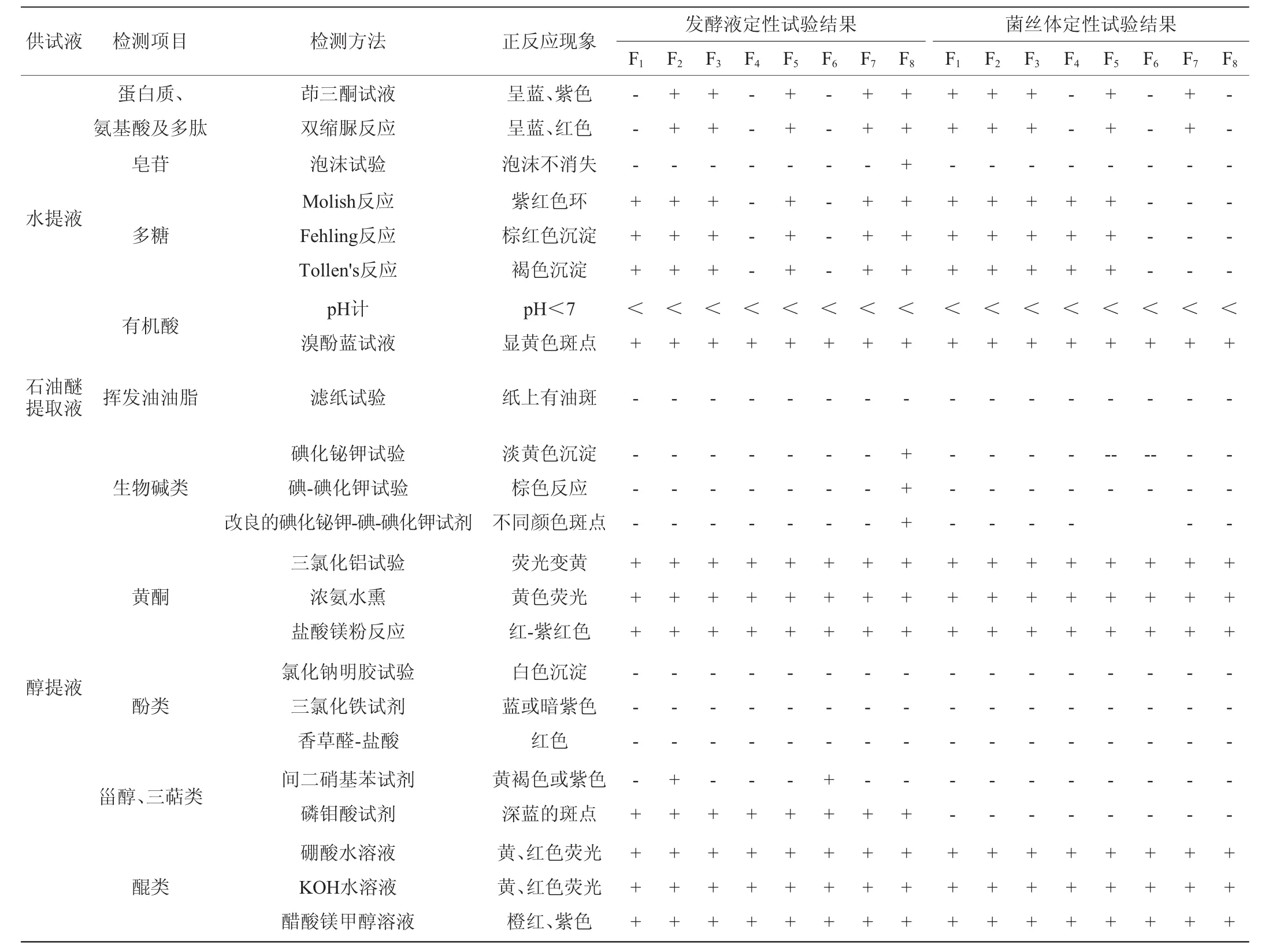
表1 8株内生菌发酵液与菌丝体化学成分系统预试验结果Table 1 Experimental results of chemical compositions of fermentation broth and mycelial of 8 endophytic strains
2.3 抗氧化活性菌株初步筛选
8株内生真菌发酵产物对DPPH·清除率试验结果如图2所示。由图2可知,与阳性对照VC相比,试验的8株菌株无论是发酵液还是菌丝体提取物均对DPPH·具有清除作用,但清除能力不同。在供试液质量浓度为1mg/mL时,其中菌株F5无论菌丝体浸膏还是发酵液浸膏提取物都对DPPH·具有较强的清除作用,分别是94.09%和93.56%,剩余7株菌株发酵液提取物对DPPH·的清除率分别是93.54%、67.67%、94.71%、86.65%、92.81%、93.53%、73.63%,菌丝体提取物对DPPH·的清除率分别是87.43%、91.77%、94.61%、89.52%、87.87%、42.30%、96.57%。综合考虑,选择两者对DPPH·均有较强清除作用的菌株F5进行菌株抗氧化活性部位的筛选。

图2 8株内生真菌发酵产物对DPPH·的清除率Fig.2 Clearance rate of fermentation products of 8 strains of endophytic fungi on DPPH·
2.4 菌株F5发酵产物抗氧化活性部位筛选
采用DPPH·清除法和·OH清除法测定菌株F5发酵液浸膏和菌丝体浸膏两者的原液、石油醚相、氯仿相、乙酸乙酯相和水相的抗氧化活性,结果如图3所示。由图3(a)可知,当菌株F5发酵液浸膏的质量浓度为1 mg/mL时,原液、石油醚相、氯仿相、乙酸乙酯相和水相对DPPH·的清除率分别是94.09%%、90.48%、95.24%、96.83%、39.80%。菌株F5菌丝体浸膏质量浓度为1 mg/mL时,5个相对DPPH·的清除率分别是93.56%、26.46%、66.67%、78.84%、78.11%。阳性对照VC(1 mg/mL)对DPPH·的清除率为95.77%,菌株F5发酵液和菌丝体浸膏各个相对DPPH·的清除率小于1 mg/mL VC的清除率。结果表明,抗氧化活性最大的部位是发酵液浸膏的乙酸乙酯相,而菌丝体浸膏最大的是乙酸乙酯相和水相。说明具有抗氧化作用的成分极性较大。
由图3(b)可知,当菌株F5发酵液浸膏的质量浓度为1 mg/mL时,菌株F5发酵原液、石油醚相、氯仿相、乙酸乙酯相和水相对·OH清除率分别是73.56%、25.17%、25.56%、26.20%、61.98%。菌株F5菌丝体浸膏质量浓度为1mg/mL时,菌株F5菌丝体5个相对·OH清除率分别是71.25%、12.78%、35.14%、54.25%、52.09%。菌株F5发酵液浸膏和菌丝体浸膏各个相对·OH清除率<1 mg/mL VC的清除率(99.36%),结果表明,无论是发酵液浸膏还是菌丝体浸膏的水相和乙酸乙酯相具有较强的抗氧化作用,说明抗氧化的成分极性较大。
综合菌株F5发酵液浸膏和菌丝体浸膏各萃取相对DPPH·和·OH的清除作用结果可以发现,总体上对DPPH·的清除作用较强,对·OH的清除作用较弱,表1中菌株F5化学成分预实验结果显示含有多糖、黄酮、蒽醌等成分,结合现在已经研究证实的抗氧化成分[2-5],推断具有抗氧化作用的成分可能是多糖、黄酮、蒽醌等,但这有待于进一步的研究。

图3 菌株F5发酵产物不同相萃取物对DPPH·(a)及·OH(b)的清除率Fig.3 Clearance rates of different phase extracts of fermentation products of strain F5on DPPH·(a)and·OH(b)
3 结论
从罗汉果中分离纯化得到了12株罗汉果内生真菌,从中筛选出8株进行发酵产物化学成分预试验及抗氧化能力测定,初步鉴定出这8株罗汉果内生真菌的发酵产物大部分都含有蛋白质、多糖、有机酸、黄酮、醌类等化学成分。对8株内生真菌发酵产物的发酵液和菌丝体进行DPPH·清除能力的测定,发现8株内生真菌都表现出良好的DPPH·清除能力。对DPPH·清除率越大,发酵产物中多糖、黄酮、皂苷等抗氧化活性成分含量也会相对较高。而从罗汉果中提取的多酚、多糖、黄酮和皂苷类等成分已被证实具有良好的抗氧化活性[1-6]。这也证实了植物内生真菌一般能够产生与宿主植物相同或相似的生理活性物质。
结果表明,菌株F5发酵液对DPPH·的清除率大小顺序为乙酸乙酯萃取相(96.83%)>VC(95.77%)>氯仿相(95.24%);菌株F5发酵液对·OH的清除率大小顺序为VC(99.36%)>原液(73.56%)>水相(61.98%),表明罗汉果内生真菌发酵产物具有较强的抗氧化作用,并且抗氧化的成分极性较大,这为进一步研究罗汉果内生真菌发酵产物中的抗氧化活性成分奠定基础。
[1]TSURTEMATSU T,SHIGENOBU A.Study on the constituents from fruits ofMommordicae grosvenori[J].J Pharm (Japan),1983,103(2):1151-1173.
[2]刘 兆,荣永海,王志滨,等.闪提技术提取罗汉果甜甙[J].天然产物与开发,2011,23(3):561-564.
[3]赵 燕,刘国艳,史贤明.罗汉果水提取物及其甜甙的体内抗氧化作用[J].食品研究与开发,2012,33(2):174-176.
[4]陈 瑶,贾恩礼.罗汉果化学成分和药理作用的研究进展[J].解放军药学学报,2011,27(2):171-174.
[5]张贵会,王 贺,杨 玲.新疆药桑叶中黄酮类化合物的分离及其抗氧化活性评价[J].中国酿造,2016,35(2):101-105.
[6]肖 刚,王 勤.罗汉果甜苷保肝作用实验研究[J].中国实验方剂学杂志,2013,19(2):196-200.
[7]KLEOPPE J W,SCHIPPER B,BAKKER P.Proposed elimination of the term endorhizosphere[J].Phytopatholology,1992,82(3):726-727.
[8]LAURA F A,PILAR D V,DOLORES D A,et al.Binary combinations of BHA and other natural and synthetic phenolics:antimicrobial activity againstStaphylococcus aureusand antioxidant capacity[J].Food Control,2014,42:303-309.
[9]徐盼菊,孟凡欣,唐 萌,等.黑虎掌菌粗多糖制备及体外抗氧化活性研究[J].中国酿造,2017,36(3):150-155.
[10]付东兴.罗汉果块根内生真菌及其次级代谢产物的研究[D].南宁:广西大学,2012.
[11]陈海燕,付东兴,林翠梧,等.罗汉果内生真菌SG-69次级代谢产物的研究[J].应用化工,2012,41(8):1318-1320.
[12]杨海涛,曹小燕.酶-超声辅助提取苦荞秆中总黄酮及抗氧化活性研究[J].中国酿造,2016,35(9):72-76.
[13]刘海鸥,虎春艳,赵声兰,等.滇黄芩总黄酮酶解超声提取工艺及抗氧化活性研究[J].中国酿造,2016,35(1):110-114.
[14]张 宁.棘豆波丝菌发酵产物化学成分及药理作用的研究[D].长春:吉林农业大学,2011.
[15]潘 峰,苏天骄,邓克莉,等.川贝母内生真菌Fusarium tricinctum CBY11 抗氧化活性及代谢成分研究[J].菌物学报,2017,36(6):752-765.
[16]张新国,唐 鹏,刘英娟,等.6种药用植物内生菌提取物的抗氧化活性研究[J].现代食品科技,2016,32(4):66-74.
[17]SMIRNOFF N,CUMBES Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060.
Separation of endophytic fungi ofSiraitia grosvenoriiand antioxidant activity of fermentation products
FAN Caiqin1,ZHANG Changzhi1,LONG Chumei1,FU Qiang1,ZHAO Fengli1,2*,SONG Yunfei2,YANG Wenguo2
(1.College of Life Science,Guangxi Normal University,Guilin 541006,China;2.Guilin Layn Biotechnology Co.,Ltd.,Guilin 541199,China)
To explore the chemical composition of fermentation products of endophytic fungi ofSiraitia grosvenoriiand its antioxidant activity,8 strains from endophytic fungi ofS.grosvenoriiof metabolites system was screened,to conduct preliminary experiments on chemical composition tests,and then thein vitroantioxidant activity of fermentation products was determined by DPPH·and·OH clearance methods.The results showed that the chemical compositions of fermentation products of 8 endophytic fungi fromS.grosvenoriiwas qualitatively tested,and it showed that it may contain protein,polysaccharide,organic acids,flavonoid,anthraquinone and other substances.When the concentration of test liquid was 1 mg/ml,the fermentation broth of strain F5had good antioxidant activity,and the clearance rate of ethyl acetate extract phase (96.83%)on·DPPH was higher than VC(95.77%)and chloroform phase (95.24%).While the clearance rate on·OH in order was VC (99.36%),fermentation broth (73.56%),and water phase (61.98%).The results showed that the fermentation products of endophytic fungi ofS.grosvenoriihad strong antioxidant activity,and the polarity of the antioxidant ingredients was larger.
Siraitia grosvenorii;endophytic fungi;fermentation products;antioxidant activity
Q939.9
0254-5071(2017)12-0046-05
10.11882/j.issn.0254-5071.2017.12.010
2017-10-17
桂林市科学研究与技术开发计划项目(2016010304-2,20171015-2)
范彩琴(1992-),女,硕士研究生,研究方向为生物化学与分子生物学。
*通讯作者:赵丰丽(1961-),女,教授,硕士,研究方向为功能性食品、发酵工程及生物活性成分。
