luxS基因介导乳酸菌益生特性研究进展
2017-12-28贾芳芳孙思睿孟祥晨
贾芳芳,孙思睿,孟祥晨*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
luxS基因介导乳酸菌益生特性研究进展
贾芳芳,孙思睿,孟祥晨*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
一些乳酸菌具有高肠道耐受性、高粘附肠上皮细胞和产具有抑菌活性的细菌素等益生特性。某些乳酸菌的细菌素合成量、耐受性及黏附特性可以被诱导物-2(autoinduction-2,AI-2)提高,AI-2是通过甲基循环合成的一种信号分子。luxS基因可以编码合成LuxS蛋白,而LuxS蛋白是AI-2合成的关键酶,因此展开对luxS在细菌素合成量和耐受性、黏附特性方面的作用研究具有重要意义。该文通过讨论luxS基因在乳酸菌益生特性的研究现状,提出该研究领Ⅱ中存在的问题以及发展趋势,从而为提高乳酸菌的益生特性提供理论依据。
AI-2/luxS;乳酸菌;细菌素;耐受性;黏附特性
乳酸菌是目前世界公认安全的食品级微生物(generally regard as safe,GRAS),已广泛应用于食品相关技术中。为了能够有效地适应变化的环境条件,乳酸菌需要群体感应(quorum sensing,QS)系统来检测特定的环境信号[1]。
QS被称为“依赖细胞密度的基因表达”,也被称为“细胞与细胞之间的交流”[2]。信号分子和双组分调控系统共同调控群体感应,群体感应是细菌之间通过化学信号分子进行信息传递的一种形式。信号分子分为三类:即自诱导肽(auto-inducing polypeptides,AIP)、 自体诱导物-1(autoin duction-1,AI-1)-酞基高丝氨酸内酯类化合物和AI-2[3]。AI-2是G-和G+中共有的AI-2/LuxS QS系统的信号分子,由S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)转化成的呋喃硼酸二酯,它是合成脱氧核糖核酸(deoxyribonucleicacid,DNA)、核糖核酸(ribonucleic acid,RNA)和蛋白质的重要辅助因子,经至少三步酶促反应完成[4]。SAM作为甲基供体转化生成S-腺苷同型半胱氨酸(S-adenosylhomocysteine,SAH),然后被SAH核苷酸酶水解为S-核糖高半胱氨酸(S-ribosylhomocy-steine,SRH)和腺嘌呤,随后,luxS基因编码的LuxS蛋白催化SRH生成同型半胱氨酸和4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedion,DPD),最后DPD进一步环化、重排形成AI-2[4]。
DNA数据库分析显示,包括大肠杆菌、沙门氏菌、金黄色葡萄球菌等30多种G-和G+中都含有高度保守的luxS同源基因。luxS肩负着代谢和信号传递的双重功能,迄今,luxS介导乳酸菌益生特性的研究内容主要包括细菌素、抗胁迫能力和黏附能力三方面,本文综述了luxS基因在乳酸菌细菌素、抗胁迫能力和黏附能力三方面的研究现状,提出该研究领Ⅱ中存在的问题以及发展趋势,以期为通过luxS基因的表达量改善乳酸菌的益生特性提供理论依据。
1 luxS基因介导乳酸菌细菌素产生特性的研究
1.1 细菌素的定义与分类
在21世纪,细菌素的定义为核糖体合成的具有生物活性的蛋白质或蛋白质复合物,有杀菌作用或抑菌功能,且抑菌谱中包含G-和G+[5]。乳杆菌属、片球菌属、肉杆菌属、假单胞菌属、葡萄球菌属、肠球菌属和链球菌属都能产生细菌素。鉴定细菌素的方法多种多样,如抑菌法、遗传学法、分子质量大小法和其生成方式法。细菌素的分类方法也多种多样,包括依据末端氨基酸序列或基因簇的组织同源性、细菌属和细菌素分子量进行分类[6]。目前,氨基酸理化性质和结构是乳酸菌细菌素进行分类的主要依据。根据KLAENHAMMER T R[7]提出并经过其他学者修改,乳酸菌所产生的细菌素可分为四大类,具体内容见表1。其中羊毛硫抗生素,即玉类细菌素,是被报道最多,工业应用也较为广泛的一种。

表1 根据细菌素分子质量的分类方法Table 1 Classification methods of bacteriocins according to molecular mass
1.2 AI-2/LuxS QS系统对细菌素产量的影响
当前研究表明,通过与某些G+共培养能够诱导植物乳杆菌细菌素的合成,且共培养导致植物乳杆菌细菌素合成量增加可能是通过特定的群体感应系统来实现的[8]。BUCKBL等[9]发现,植物乳杆菌(Lactobacillus plantarum)NC8纯培养时,无法合成细菌素,当其与乳酸乳杆菌(L.lactis)MG1363共培养时,细菌素合成量可达2 560 IU/mL[10],由此推测共培养物中自诱导体活性的提高,有利于促进细菌素的合成[11]。MAN L L等[12]将植物乳杆菌(L.plantarum)KLDS1.0391与瑞士乳杆菌(L.helveticus)KLDS 1.9207、屎肠球菌(Enterococcus faecium)KLDS 4.0352、罗伊氏乳杆菌(L.reuteri)KLDS1.0737和粪肠球菌(E.faecalis)KLDS 4.0313共培养,可以明显升高L.plantarumKLDS1.0391所产细菌素-Plantaricin MG的产量,且L.plantarumKLDS1.0391的活菌数目达最高的时间短于单独培养。MANLL等[13]进一步研究发现,L.plantarumKLDS1.0391与L.helveticusKLDS 1.9207共培养可以增加AI-2信号分子的积累,当其积累到一定程度,被双组分调控系统中的组氨酸蛋白激酶识别,经过磷酸化或去磷酸化,将信号分子传递给感应调节子,从而启动细菌素编码相关基因编码合成细菌素。再者,张筠[14]研究发现,AI-2信号分子的添加可以诱导L.plantarum KLDS1.0391的细菌素合成量,且可显著提高L.plantarum KLDS 1.0391细菌素编码基因及群体感应相关基因的转录表达水平;另外蛋白质组学研究结果表明,当在L.plantarum KLDS1.0391的培养过程添加AI-2信号分子时,该菌中涉及碳水化合物、脂肪、蛋白质、双组分调控代谢途径的相关蛋白表达水平显著上调。
2 luxS基因介导乳酸菌对抗胃肠道胁迫能力的研究
2.1 抗胃肠道胁迫能力
根据联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)及世界卫生组织(World Health Organization,WHO)(2002)的规定,在正式应用益生菌前,需对其进行一系列试验以证实其对人体的安全性,并确保益生菌抵达肠道后仍能保持较好的存活力和定殖肠道的能力。具体包括耐酸和胆盐试验、黏附于人体上皮细胞或者黏液的能力、对病原菌的黏附抑制能力、水解胆盐的能力和抑制致病菌的能力。由于体内试验昂贵且耗时,通过可靠的体外试验,可在选择新的益生菌株时预测其在体内的益生效应[15]。
2.2 乳酸菌食用后可能面临的环境胁迫
2.2.1 酸胁迫
由于在食用后,益生菌首先面临胃部的酸性环境,因此人们日益重视乳酸菌在消化道中存活的能力。已知胃的pH值从1~2可波动至4~5,大多数体外评价试验都尽量选择能够承受极端低pH值的菌株。
除某些乳酸杆菌、明串珠菌和酒球菌,多数乳酸菌细胞属于中性粒细胞(即最佳生长pH值为5~9)。酸应激对菌体生理上的具体影响还不清楚,目前已知的是,酸可以被动扩散通过细胞膜进入细胞质,迅速分解成质子和带电的衍生物,使细胞膜不可渗透。胞内积累的质子可降低细胞内pH,从而影响跨膜△pH值,进而有助于质子动力势的增加。内部酸化还会降低酸敏感酶的活性并损害蛋白质和DNA,游离有机酸阴离子部分在细胞质中积累能和重要元素螯合,对细胞生理机能产生不利影响[16],乳酸菌的酸胁迫反应机制以及质子转运与脱羧反应机制分别见图1和图2。
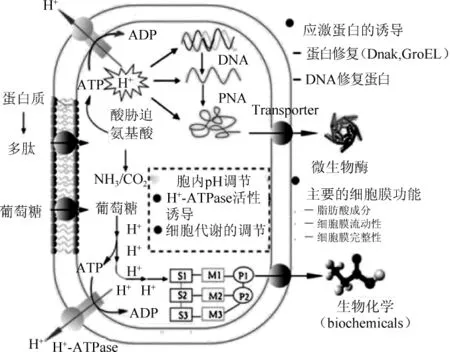
图1 乳酸菌的酸胁迫反应[17]Fig.1 Reactions of lactic acid bacteria to acid stress

图2 质子的转运与脱羧反应[18]Fig.2 Reactions of proton transport and decarboxylation
经测试,大部分乳酸菌都存在对数增长适应性反应,这一反应能够提高菌体对于致死酸浓度的存活率[15],不仅有利于乳酸菌应对酸胁迫,也可应对其他应激反应如高温、渗透压或氧化应激等。多个关于对数增长适应性反应的蛋白质组学研究表明,在乳酸菌的酸适应过程中诱导产生大量的蛋白,然而仅有少数的酸应激蛋白被证实[17]。
2.2.2 胆盐胁迫
胆盐是一种生物活性物质,由胆固醇转化而来。在正常的生理条件下,人体肠道中胆盐浓度范围为0.05%~2.00%。在肝脏中,游离的胆汁酸可在宿主酶的催化下与牛磺酸或者甘氨酸生成共轭胆盐,它们储存在胆囊中,消化时释放到十二指肠发挥其生理功能,溶解从饮食中吸收的脂肪。乳酸杆菌和双歧杆菌等肠道细菌已经进化出了特异性防Ⅸ机制,以抵抗胆盐等化合物的有害作用。甾环的强亲脂性干扰细胞膜上的脂质和扰乱质子动力,从而造成细胞死亡[19]。此外,游离形式的胆酸可以扩散进入细胞,胆酸分解从而导致细胞质酸化[20]。胆盐的其他副作用还包括诱导氧化应激反应和DNA修复机制、糖代谢的改变和蛋白质的错误折叠[21]。
利用高通量技术研究发现,耐胆盐反应是一种多因素现象,涉及对胆盐的解毒和抵消对细菌结构有害影响的过程。胆汁酸(盐)的外排[22]、胆盐的水解[23]和细胞膜、细胞壁的结构或组成的变化[24]是目前普遍报道过的乳酸菌的耐胆盐机制。此外,菌体暴露在胆盐环境中产生的常见应激反应如抵抗氧化损伤,以及调整糖酵解途径等,可能抵消某些由胆盐化合物造成的细胞损伤[25]。
将积累在细胞质中的胆盐通过外排泵主动排出是菌体应对胆盐毒性的常见机制[26],而活性胆盐水解酶(bile salt hydrolase,BSHs)可通过早期解离胆盐起到保护作用。BSHs可催化甘氨酸和牛磺酸共轭结合胆汁酸盐后的解离反应,产生的相应的游离酸可进一步被其他肠道细菌利用进行代谢反应[27](见图3)。在乳酸菌和植物乳杆菌中,通过比较野生型菌株和BSHs突变型菌株可确定BSHs活性和胆盐耐受性的紧密关系[21]。提高益生菌耐胆盐特性可有助于发展对其他技术上或是胃肠道因素更有抵抗能力的优秀菌株[28]。
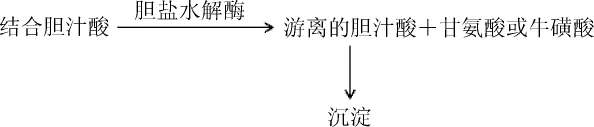
图3 胆盐水解酶参与胆汁酸代谢Fig.3 Metabolic process of bile acid caused by bile salt hydrolase
2.2.3 其他胁迫
在胃肠道中,乳酸菌还会面临胃肠道中其他物质等的胁迫。在遭受各种胁迫过程中,菌体细胞会发生一系列变化,这些变化包括产生应激蛋白、细胞膜改变、基因表达差异化和改变代谢途径等[26]。
2.3 AI-2/LuxS QS系统对抗胃肠道胁迫能力的影响
哈氏弧菌是检测AI-2信号分子的一种报告菌株,SALOOMEH M J等[29]研究指出,在酸胁迫条件下,随着pH值的降低,L.acidophilusNCFM和鼠李糖乳杆菌GG(L.rhamnosusGG,LGG)的AI-2活性显著增高,表明微生物可以通过合成更多的AI-2信号分子来应对外界严峻的环境条件。此外,L.acidophilusNCFM和LGG中luxS基因转录水平显示出和AI-2活性同样的变化规律,一方面证实了luxS是合成AI-2的相关基因,另一方面说明某些乳酸菌可以通过提高luxS转录水平使得AI-2活性增高,这暗示出AI-2/LuxSQS系统可能与酸胁迫过程相关,能够提高乳酸菌经胃肠道后的存活率,并发挥与肠道内其他菌群交流的重要作用[28]。通过全基因组芯片分析,AZCARATE-PERILMA等[30]发现,L.acidophilusNCFM双组分信号分子转导系统的突变株与野生型菌株相比,对酸更为敏感,且酸胁迫会导致包含luxS在内的80多个基因上调其表达量。同时,LEBEERS等[31]的研究指出,LGG的luxS缺失菌株在胃汁中的存活率降低,表明luxS基因在抗酸胁迫中发挥重要作用。而luxS基因与乳酸菌胆盐耐受性的关系目前为止鲜有报道。
3 luxS基因介导乳酸菌黏附能力的研究
益生菌黏附肠道能够发挥的重要益生作用有:改善肠道菌群以及对粘膜和上皮组织上病原菌竞争性黏附等[32]。益生菌抵达肠道后,必须及时在肠道中定殖才能避免肠道蠕动而脱落,使得其在肠道中能形成一层表面保护膜,抑制病原菌的黏附和侵袭。黏附能力还与免疫调节关系密切,由于通过体内试验研究乳酸菌的黏附特性较难,近年来发展出多种不同的体外模型用于评价乳酸菌的黏附能力,最广泛应用的模型是从人体肠组织、粪便、回肠造口流出物分离的肠粘液或是组织培养细胞[33]。乳酸菌黏附作用通常依据在肠粘膜的目标(即黏液组分,细胞外基质)、在细菌表面(即表面层蛋白)的定位和锚定到细菌表面的方式(即分选酶依赖性蛋白)进行分类。
(1)黏液结合蛋白
在大多数情况下,乳酸菌的粘附作用是由蛋白质介导的[34],也有报道称糖基和脂磷壁酸也参与其中。目前,乳酸菌黏附的鉴定和功能分析包含三种:罗伊氏乳杆菌(L.reuteri)1063产生的胞外黏液结合蛋白(Mub)[35]、植物乳杆菌(L.plantarum)WCFS1的凝集素类的甘露糖特异性黏附蛋白(Msa)[34],和嗜酸乳杆菌(L.acidophilus)NCFM产生的黏液结合蛋白(mucin-binding protein)[36]。这3种黏液结合蛋白在革兰氏阳性菌中具有相同的典型的Ⅱ[37]。
(2)作为黏附介质的分选酶相关蛋白
细菌的表面蛋白与菌体的黏附、侵袭、信号分子和与宿主免疫系统或环境的相互作用等重要功能息息相关[38]。在革兰氏阳性菌中,某些表面蛋白包含可被分选酶识别的C-末端锚定基序(LPxTG),它分开了T-和G-残基之间的共价连接,苏氨酸羧基通过细胞壁肽聚糖前体的横桥连接至氨基。分选酶反应的产物(一种连接至肽聚糖的表面蛋白)会并入壳层进而展示在细胞表面,然后显示在微生物表面。因此,这些表面蛋白通常被称为分选酶相关蛋白。现已确定了4种乳酸菌分选酶相关蛋白的功能特征:罗伊氏乳杆菌1063黏液结合蛋白Mub、植物乳杆菌WCFS1中Msa和嗜酸乳杆菌NCFM中黏液结合蛋白(mucin-binding protein),第四种是唾液乳杆菌UCC118的LspA蛋白,有研究表明此蛋白能够介导菌体黏附于人体上皮细胞[37]。
(3)表层黏附蛋白
乳酸杆菌S-层蛋白通常表现出形态相似的分子晶体阵列,斜点阵结构,占细菌细胞壁蛋白质的10%~15%。部分乳酸杆菌的编码S-层蛋白的基因已经成功克隆,测序并登陆在GeneBank中。然而除4株乳酸杆菌S-层蛋白之外,这些蛋白质的生物学功能有待验证[39]。一些已被鉴定的S-层蛋白有相似的结构,如CsbA和Slp的含有细菌S-层蛋白结构Ⅱ[37]。有报道指出这些蛋白与调节黏附肠上皮细胞和细胞外基质等的能力有关。此外,这些蛋白被证明在防止病原菌黏附上皮细胞过程中有重要作用[40]。
(4)其他蛋白
除了某些乳酸杆菌,研究表明乳酸菌表面蛋白的黏附能力与对各种胞外基质的黏附性有关,如介导黏附于细胞外基质的蛋白。此外,乳酸菌中还存在介导黏附的特异性乳酸菌蛋白,在黏附作用中发挥着重要作用[37]。
(5)非蛋白介导的黏附作用
脂磷壁酸(lipoteichoic acid,LTA)是强负电荷的多醇磷酸酯聚合物,在约氏乳杆菌NCC 533中该分子与黏附Caco-2细胞有关。除了LTA,由乳酸菌产生的胞外多糖也影响对肠的黏附作用,其可以松弛地附着于细胞表面或被分泌到环境中[41]。在嗜酸乳杆菌CRL639中,其黏附能力被证实与能够合成不同类型的胞外多糖有关[42]。
目前为止,关于AI-2/LuxS QS系统与乳酸菌在肠道中黏附和定殖能力之间关系的研究很少。BUCK B L等[9]通过研究发现,嗜酸乳杆菌的luxS基因突变株与野生型菌株相比,完全失去了合成AI-2的能力,且突变株黏附于Caco-2细胞的能力较野生型菌株下降了58%。由此推测,AI-2/LuxSQS系统可能在乳酸菌发挥黏附能力的过程中扮演着重要角色。
4 结论与展望
luxS基因的表达量直接或间接影响着乳酸菌细菌素合成量、耐受性及黏附特性,且其表达量与特性作用为正相关关系。重要的是,该文从一定程度上揭示细胞间信号传递的机制,为luxS基因在乳酸菌代谢途径中的功能作用提供理论依据。但是迄今,luxS基因介导乳酸菌益生特性的研究内容主要包括细菌素、抗胁迫能力和黏附能力三方面,且其在每类乳酸菌菌种中的每一方面的具体研究机制仍不明确,因此今后对luxS基因在具体的乳酸菌菌种每一条代谢途径中具体的功能机制是热门研究,从而在基因工程方面为乳酸菌益生特性更好的表达提供理论依据。
[1]STURME M H,FRANCKE C,SIEZEN R J,et al.Making sense of quorum sensing in lactobacilli:a special focus onLactobacillus plantarum WCFS1[J].Microbiology,2007,153(12):3939-3947.
[2]MILLER M B,BASSLER B L.Quorum sensing in bacteria[J].Ann Rev Microbiol,2001,55(1):165-199.
[3]HASTINGS J W,NEALSON K H.Bacterial bioluminescence[J].Ann Rev Microbiol,1977,31(1):549-595.
[4]PEREIRACS,THOMPSONJ A,XAVIERKB.AI-2-mediated signalling in bacteria[J].FEMS Microbiol Rev,2013,37(2):156-181.
[5]BEASLEY S.Isolation,identification and exploitation of lactic acid bacteria from human and animal microbiota[D].Helsinki:University of Helsinki,2004.
[6]BALCIUNAS E M,MARTINEZ F A C,TODOROV S D,et al.Novel biotechnologicalapplicationsofbacteriocins:Areview[J].Food Control,2013,32(1):134-142.
[7]KLAENHAMMER T R.Genetics of bacteriocins produced by lactic acid bacteria[J].FEMS Microbiol Rev,1993,12(1-3):39-85.
[8]CAGNO R D,ANGELIS M D,CODA R,et al.Molecular adaptation of sourdoughLactobacillusplantarumDC400underco-cultivationwithother lactobacilli[J].Res Microbiol,2009,160(5):358-366.
[9]BUCK B L,AZCARATE-PERIL M A,KLAENHAMMER T R.Role of autoinducer-2 on the adhesion ability ofLactobacillus acidophilus[J].J Appl Microbiol,2009,107(1):269-279.
[10]MALDONADO A,RUIZ-BARBA J L,JIMÉNEZ-DÍAZ R.Production of plantaricin NC8 byLactobacillus plantarumNC8 is induced in the presence ofdifferent typesofgram-positive bacteria[J].Arch Microbiol,2004,181(1):8-16.
[11]WILSON C M,AGGIO R B M,O'TOOLE P W,et al.Transcriptional and metabolomic consequences ofluxSinactivation reveal a metabolic rather than quorum-sensingrole for LuxS inLactobacillus reuteri100-23[J].J Bacteriol,2012,194(7):1743-1746.
[12]MAN L L,MENG X C,ZHAO R H.Induction of plantaricin MG under co-culture with certain lactic acid bacterial strains and identification of LuxS mediated quorum sensing system inLactobacillus plantarum KLDS1.0391[J].Food Control,2012,23(2):462-469.
[13]MAN L L,MENG X C,ZHAO R H,et al.The role of plNC8HK-plnD genes in bacteriocin production inLactobacillus plantarumKLDS1.0391[J].Int Dairy J,2014,34(2):267-274.
[14]张 筠.信号分子AI-2调节植物乳杆菌细菌素合成的作用[D].哈尔滨:东北农业大学,2015.
[15]CAGGIA C,DE ANGELIS M,PITINO I,et al.Probiotic features of Lactobacillusstrains isolated from Ragusano and Pecorino Siciliano cheeses[J].Food Microbiol,2015,50:109-117.
[16]VANDEGUCHTEM,SERRORP,CHERVAUXC,etal.Stressresponses in lactic acid bacteria[J].Anton Leeuw,2002,82(1-4):187-216.
[17]WU C,HUANG J,ZHOU R.Progress in engineering acid stress resistance of lactic acid bacteria[J].Appl Microbiol Biot,2014,98(3):1055-1063.
[18]CUNIN R,GLANSDORFF N,PI RARD A,et al.Biosynthesis and metabolism of argininein bacteria[J].Microbiol Rev,1986,50(3):314-352.
[19]KURDI P,KAWANISHI K,MIZUTANI K,et al.Mechanism of growth inhibition by free bile acids in lactobacilli and bifidobacteria[J].J Bacteriol,2006,188(5):1979-1986.
[20]SÁNCHEZ B,RUIZ L,GUEIMONDE M,et al.Adaptation of bifidobacteria to the gastrointestinal tract and functional consequences[J].Pharmacol Res,2013,69(1):127-136.
[21]MIRE B,GAHAN C G M,COLIN H.The interaction between bacteria and bile[J].FEMS Microbiol Rev,2005,29(4):625-651.
[22]RUIZ L,O'CONNELL-MOTHERWAY M,ZOMER A,et al.A bile-inducible membrane protein mediates bifidobacterial bile resistance[J].Microbial Biotechnol,2012,5(4):523-535.
[23]BURDEN R S,CLARK T,HOLLOWAY P J.Functional analysis of four bile salt hydrolase and penicillin acylase family members inLactobacillus plantarumWCFS1[J].Appl Environ Microbiol,2008,74(15):4719-4726.
[24]RUIZ L,S NCHEZ B,RUAS-MADIEDO P,et al.Cell envelope changes inBifidobacterium animalisssp.lactisas a response to bile[J].FEMS Microbiol Lett,2007,274(2):316-322.
[25]ALCNTARA C,ZIGA M.Proteomic and transcriptomic analysis of the response to bile stress ofLactobacillus caseiBL23[J].Microbiology,2012,158(5):1206-1218.
[26]RUIZ L,MARGOLLES A,SÁNCHEZ B.Bile resistance mechanisms in LactobacillusandBifidobacterium[J].Front Microbiol,2013,4:396.
[27]BOEVER P D,WOUTERS R,VERSCHAEVE L,et al.Protective effect of the bile salt hydrolase-activeLactobacillus renteriagainst bile salt cytotoxicity[J].Appl Microbiol Biot,2000,53(6):709-714.
[28]SÁNCHEZ B,RUIZ L,GUEIMONDE M,et al.Toward improving technologicalandfunctional propertiesofprobioticsin foods[J].Trend Food Sci Technol,2012,26(1):56-63.
[29]SALOOMEH M J,KLAUS G,LENE J.AI-2 signalling is induced by acidic shock in probiotic strains ofLactobacillusspp.[J].Int J Food Microbiol,2009,135(3):295-302.
[30]AZCARATE-PERIL M A,MCAULIFFE O,ALTERMANN E,et al.Microarray analysis of a two-component regulatory system involved in acid resistance and proteolytic activity inLactobacillus acidophilus[J].Appl Environ Microbiol,2005,71(10):5794-5804.
[31]LEBEER S,CLAES I J,VERHOEVEN T L,et al.Impact of luxS and suppressor mutations on the gastrointestinal transit ofLactobacillus rhamnosusGG[J].Appl Environ Microbiol,2008,74(15):4711-4718.
[32]LUIS F,MIRIAM B B,JULIO P D,et al.Sources,isolation,characterisation and evaluation of probiotics[J].Brit J Nutr,2013,109(S2):S35-S50.
[33]VESTERLUND S,PALTTA J,KARP M,et al.Adhesion of bacteria to resected human colonic tissue:Quantitative analysis of bacterial adhesion and viability[J].Res Microbiol,2005,156(2):238-244.
[34]PRETZER G,SNEL J,MOLENAAR D,et al.Biodiversity-based identification and functional characterization of the mannose-specific adhesin ofLactobacillus plantarum[J].J Bacteriol,2005,187(17):6128-6136.
[35]ROOS S,JONSSON H.A high-molecular-mass cell-surface protein fromLactobacillus reuteri1063 adheres to mucus components[J].Microbiology,2002,148(2):433-442.
[36]BUCK B L,ALTERMANN E,SVINGERUD T,et al.Functional analysis of putative adhesion factors inLactobacillus acidophilusNCFM[J].Appl Environ Microbiol,2005,71(12):8344-8351.
[37]VELEZ M P,DE KEERSMAECKER S C,VANDERLEYDEN J.Adherence factors ofLactobacillusin the human gastrointestinal tract[J].FEMS Microbiol Lett,2007,276(2):140-148.
[38]DRAMSI S,TRIEU-CUOT P,BIERNE H.Sorting sortases;a nomenclature proposal for the various sortases of Gram-positive bacteria[J].Res Microbiol,2005,156(3):289-297.
[39]AVALL-JÄÄSKELÄINEN S,PALVA A.Lactobacillussurface layers and their applications[J].FEMS Microbiol Rev,2005,29(3):511-529.
[40]CHEN X,XU J,SHUAI J,et al.The S-layer proteins ofLactobacillus crispatusstrain ZJ001 is responsible for competitive exclusion against Escherichia coliO157:H7 andSalmonella typhimurium[J].Int J Food Microbiol,2007,115(3):307-312.
[41]RUAS-MADIEDO P,DE LOS REYES-GAVILÁN C G.Invited review:methods for the screening,isolation,and characterization of exopolysaccharides produced by lactic acid bacteria[J].J Dairy Sci,2005,88(3):843-856.
[42]LORCA G,TORINO M I,FONT DE VALDEZ G,et al.Lactobacilliexpress cell surface proteins which mediate binding of immobilized collagen and fibronectin[J].FEMS Microbiol Lett,2002,206(1):31-37.
Research progress on probiotic characteristics of lactic acid bacteria mediated byluxSgene
JIA Fangfang,SUN Sirui,MENG Xiangchen*
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Some lactic acid bacteria (LAB)have a variety of probiotic characteristics,such as high intestinal tolerance,high adhesion intestinal epithelial cells and producing bacteriocin that exhibits the antimicrobial activity against pathogenic bacteria.The bacteriocin synthetic amount,tolerance and adhesion characteristics of certain LAB can be increased by autoinduction-2 (AI-2),which is a signal molecule synthesized by methyl cycle.LuxS protein enzyme,which is encoded byluxSgene,is the key emzyme for AI-2 synthesis.Therefore,it is important to study the role ofluxSgene in bacteriocin synthesis,tolerance and adhesion characteristics.By discussing the research progress ofluxSgene on probiotic characteristics of LAB,the existing problems and development trend in this field were put forward.Thus it provided a theoretical basis for improving the probiotic characteristics of LAB.
AI-2/luxS;lactic acid bacteria;bacteriocin;tolerance;adhesion characteristic
Q939.95
0254-5071(2017)12-0005-05
10.11882/j.issn.0254-5071.2017.12.002
2017-07-12
国家自然科学基金项目(3167101455)
贾芳芳(1990-),女,硕士研究生,研究方向为乳品微生物及乳酸菌代谢产物。
*通讯作者:孟祥晨(1970-),女,教授,博士,研究方向为乳品微生物及乳酸菌代谢产物。
