QuEChERS结合超高效液相色谱-串联质谱法同时测定番茄中噻虫嗪、噻虫胺、螺虫乙酯及其代谢物残留
2017-12-27欧阳迪庆叶玉凤王成秋焦必宁赵其阳张耀海王海燕
刘 炎,欧阳迪庆,叶玉凤,王成秋,焦必宁,赵其阳,张耀海,敖 艳,王海燕
(1.农业部柑桔产品质量安全风险评估实验室(重庆),中国农业科学院柑桔研究所/西南大学柑桔研究所,重庆 400712;2.西南大学 食品科学学院,重庆 400715;3.农业部柑桔及苗木质量监督检验测试中心,重庆 400712;4.国家柑桔工程技术研究中心,重庆 400712;5.柑桔学重庆市重点实验室,重庆 400712;6.重庆市畜牧科学院,重庆 402460)
QuEChERS结合超高效液相色谱-串联质谱法同时测定番茄中噻虫嗪、噻虫胺、螺虫乙酯及其代谢物残留
刘 炎1,3,欧阳迪庆1,3,叶玉凤1,3,王成秋1,2,3,4*,焦必宁1,2,3,4,5*,赵其阳1,3,张耀海1,3,敖 艳2,3,王海燕6
(1.农业部柑桔产品质量安全风险评估实验室(重庆),中国农业科学院柑桔研究所/西南大学柑桔研究所,重庆 400712;2.西南大学 食品科学学院,重庆 400715;3.农业部柑桔及苗木质量监督检验测试中心,重庆 400712;4.国家柑桔工程技术研究中心,重庆 400712;5.柑桔学重庆市重点实验室,重庆 400712;6.重庆市畜牧科学院,重庆 402460)
建立了QuEChERS-UPLC-MS/MS法快速同时检测番茄中噻虫嗪及其代谢产物(噻虫胺)、螺虫乙酯及其4种代谢产物(BYI08330-enol-glucoside、BYI08330-mono-hydroxy、BYI08330-enol和BYI08330-ketohydroxy)残留的分析方法。样品经乙腈提取,NaCl和无水MgSO4除水后,经N-丙基乙二胺(PSA)和C18粉末净化,用超高效液相色谱-串联质谱(UPLC-MS/MS)分析,采用多反应离子监测模式(MRM)检测,基质匹配标准溶液外标法定量。7种目标物质在0.2~2 000 μg/L质量浓度范围内均具有良好的线性关系(r2≥0.999 2),在0.002、0.02、0.20、2.00 mg/kg 加标水平下的平均回收率为79.9%~104%,相对标准偏差(RSD)为0.94%~6.4%,方法定量下限(LOQ)为0.002 mg/kg。该方法快速简便、灵敏度高、重现性好,能满足番茄中噻虫嗪、噻虫胺和螺虫乙酯及其代谢产物残留的快速检测和确证要求。
QuEChERS法;超高效液相色谱-串联质谱法;农药残留;番茄
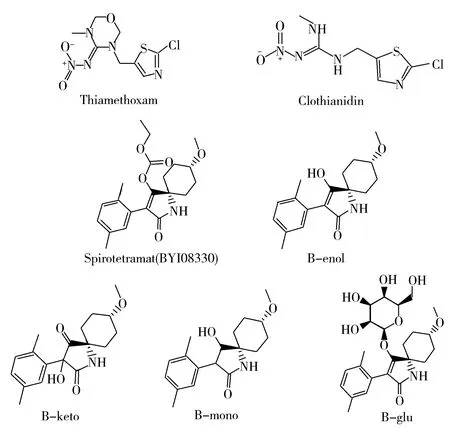
图1 噻虫嗪、噻虫胺、螺虫乙酯及其代谢物的结构Fig.1 Structures of thiamethoxam,clothianidin,spirotetramat and its metabolites
番茄(SolanumlycopersicumL.)是世界第一大蔬菜作物,我国的番茄产量约占世界的1/3[1]。随着全球气候变化、结构调整和设施农业的快速发展,烟粉虱在番茄上的危害逐年增加,造成其传播的番茄黄化曲叶病毒病日益加重[2]。目前主要采用化学法防治烟粉虱,但吡虫啉等常规杀虫剂会造成抗药性,因此广谱、高效、低毒、安全的新型杀虫剂正逐渐受到关注。根据中国农药信息网的数据,噻虫嗪、噻虫胺以及螺虫乙酯已被登记用于防治番茄上的烟粉虱。
噻虫嗪、噻虫胺、螺虫乙酯及其代谢物(结构式见图1)作为高毒农药的替代品种,可有效防治半翅目、鞘翅目和某些鳞翅目害虫。毒理研究表明:噻虫嗪、噻虫胺对哺乳动物、鸟类和水生生物具有低毒性,对蜜蜂具有高毒性[3];螺虫乙酯的主要代谢产物对鸟类和哺乳动物具有低急性和短期毒性,其代谢物的毒性均等于或低于母体化合物;也有研究表明,大鼠的雄性生殖毒性可能是由代谢物B-enol引起[4]。由于噻虫嗪在植物体内可转化为噻虫胺,所以JMPR评估报告中噻虫嗪的膳食评估残留物包括噻虫嗪和噻虫胺[3],螺虫乙酯的膳食评估残留物包括螺虫乙酯、B-enol、B-glu、B-mono和B-keto[4]。我国规定番茄中噻虫胺的最大残留限量为1 mg/kg,但尚未制定噻虫嗪的限量标准;规定番茄中螺虫乙酯及其烯醇类代谢产物的临时最大残留限量为1 mg/kg[5],但未包括螺虫乙酯其他的代谢物残留。
目前国内外测定噻虫嗪、噻虫胺和螺虫乙酯残留主要采用液相色谱法(HPLC)[6-7]和液相色谱-质谱法(LC-MS)[8-12]等,也有较少关于气相色谱法(GC)[13-15]和气相色谱-质谱法(GC-MS)[16]的报道,前处理方法大多采用固相萃取法(SPE),也有研究采用QuEChERS方法。但尚未见同时检测番茄中噻虫嗪、噻虫胺和螺虫乙酯及其4种代谢物的方法报道。因此,研究建立高效准确、同时测定以上几种农药残留的检测方法,对于保障食品安全、进行农药安全性评价具有重要意义。
本研究以改进的QuEChERS结合UPLC-MS/MS技术,建立了快速检测番茄中的噻虫嗪、噻虫胺和螺虫乙酯及其代谢物等7种杀虫剂残留的分析方法。重点对样品量和净化条件等进行了优化,并将此方法应用于柑橘、节瓜、苹果和茄子中上述杀虫剂残留的测定。本方法简单方便、易于操作,能够满足番茄中噻虫嗪、噻虫胺和螺虫乙酯及其代谢物残留量快速检测和确证的要求,并为我国制定噻虫嗪和螺虫乙酯的代谢物在番茄中的最大残留限量提供参考依据。
1 实验部分
1.1 仪器、试剂与样品
Agilent 1290-6495液相色谱串联质谱仪(美国Agilent公司);Milli-Q A10 超纯水仪(美国Millipore公司);CL31/CL31R 多用途离心机(美国Thermo Fisher公司);KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司)等。
标准品:噻虫嗪(纯度99.0%),噻虫胺(纯度99.0%),螺虫乙酯(BYI08330,纯度98.5%),B-glu(纯度98.6%),B-mono(纯度98.2%),B-enol(纯度99.6%),B-keto(纯度94.8%),均购于德国Dr.Ehrenstorfer GmbH;乙腈、甲醇(色谱纯,德国CNW Technologies GmbH);N-丙基乙二胺(PSA,德国 CNW Technologies GmbH );超纯反相C18填料(加拿大SiliCycle公司);氯化钠和无水硫酸镁(分析纯,国药集团化学试剂有限公司);甲酸(分析纯,重庆川东化工有限公司)。
番茄、柑橘、节瓜、苹果、茄子样品购于当地超市。
1.2 实验方法
1.2.1超高效液相色谱条件色谱柱:Agilent ecipes plus C18液相色谱柱(1.8 μm,2.1 mm×50 mm);柱温40 ℃;流动相:0.1%甲酸水溶液(A)-甲醇(B);梯度洗脱程序:0~0.2 min,10% B;0.2~6.0 min,10%~90% B;6.0~8.0 min,90% B;8.0~8.1 min,90%~10% B;8.1~9.0 min,10% B。进样量:3 μL;流速:0.3 mL/min。
1.2.2质谱条件离子化模式:电喷雾离子源,正离子模式(ESI+);质谱扫描方式:多反应监测(MRM);干燥气温度250 ℃,干燥气流速14 L/min,氮气压力30 psi,鞘气温度375 ℃,鞘气流速12 L/min,毛细管电压4 000 V,喷嘴电压500 V,iFunnel parameters高压为200 V,低压100 V。7种农药的监测离子、锥孔电压、碰撞能量等质谱参数如表1所示。
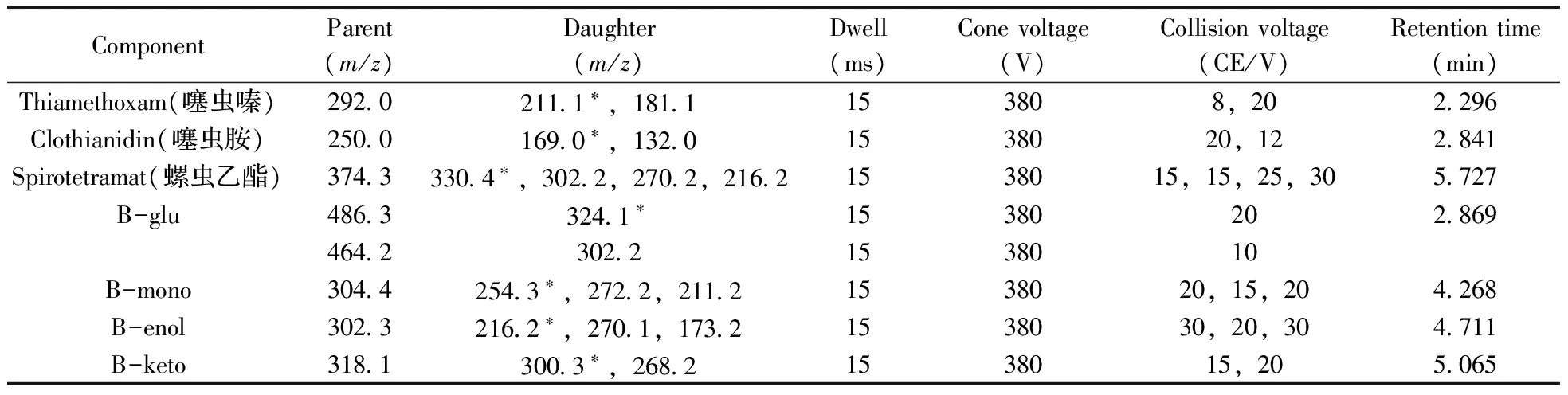
表1 7种农药的串联质谱测定参数Table 1 MS /MS parameters for the seven pesticides
* quantification ion
1.2.3标准溶液的配制标准工作液:分别准确称取 10 mg(精确至 0.01 mg) 农药标准品,用甲醇溶解并定容至10.0 mL,配成1 000 mg/L标准工作液,于-50 ℃避光保存。用甲醇将标准储备液逐级稀释配成2、1、0.5、0.1、0.05、0.01、0.005、0.001、0.000 2 mg/L的 7种农药的系列混合标准溶液,置于-50 ℃保存。
基质空白标准溶液:以不含7种农药的番茄果实为材料,利用本实验前处理方法制备番茄的基质空白溶液。分别移取适量的 20、10、5、1、0.5、0.1、0.05、0.01、0.002 mg/L 的混合标准溶液,用基质空白溶液稀释成一系列质量浓度为 2、1、0.5、0.1、0.05、0.01、0.005、0.001、0.000 2 mg/L的基质空白标准溶液,在优化条件下测定,分别得到番茄中7种农药的标准曲线。
1.2.4样品前处理方法准确称取5.00 g(精确至0.01 g) 番茄匀浆样品于50 mL离心管中,加入5.00 mL乙腈,超声波提取20 min,加入2.0 g MgSO4和0.5 g NaCl,剧烈振摇1 min,10 000 r/min离心5 min。取上清液2 mL转入已加有25 mg PSA和25 mg C18的4 mL 聚四氟乙烯离心管中,振荡混合1 min,3 000 r/min离心5 min。取上清液过0.22 μm有机滤膜,滤液经 UPLC-MS/MS分析。
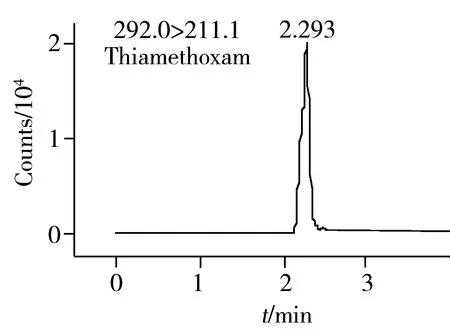



图2 0.2 mg/L 7种农药的UPLC-MS/MS MRM色谱图Fig.2 UPLC-MS/MS MRM chromatograms of 7 pesticides
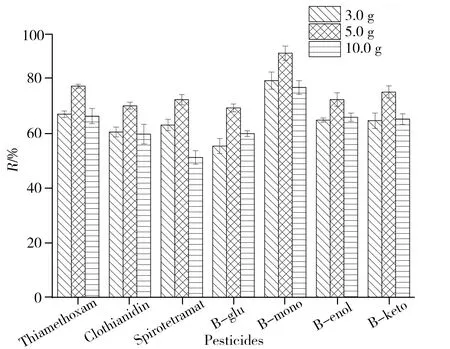
图3 不同样品量对番茄中噻虫嗪和螺虫乙酯及其代谢物加标回收率的影响Fig.3 Effects of different sample amounts on the recovery of thiamethoxam and spirotetramat and their metabolites in tomato
2 结果与讨论
2.1 色谱条件优化
选择Agilent ecipes plus C18(1.8 μm,2.1 mm×50 mm)色谱柱进行分离,在优化色谱条件下,以含0.1%甲酸的纯水溶液和纯甲醇溶液为流动相可获得较好的分离度及较高的响应值,各种农药的保留时间见表1。图2为0.2 mg/L番茄基质标准溶液的MRM离子色谱图。
2.2 前处理条件的优化
2.2.1称样量QuEChERS方法中,称样量一般为10.0 g[17-19],本实验考察了称样量(3.0、5.0、10.0 g)对7种农药回收率的影响,实验结果见图3。结果表明,称样量过少或过多均会影响回收率;当称样量为5.0 g时,7种农药的回收率均最佳。随着称样量的增加,有机溶剂等试剂耗材的成本也会增加,因此本实验选取最佳称样量为5.0 g。
2.2.2吸附剂PSA去除有机酸的效果较好,但去除色素、甾醇和维生素的效果一般;C18去除维生素、色素和甾醇的能力较好,但对少部分农药有一定的吸附。欧盟[20]和AOAC[21]在QuEChERS方法中,一般采用1 mL提取上清液中加入25 mg PSA或25 mg C18。本实验比较了单一PSA和C18以及PSA-C18混合对回收率的影响。结果表明,对单一PSA而言,B-mono和B-enol的回收率会随着吸附剂用量的增加而提高,其他农药则相反,但PSA的最小使用量为50 mg时,螺虫乙酯、B-glu、B-enol和B-keto的回收率均低于70%。对单一C18而言,7种农药的回收率基本随着吸附剂用量的增加而升高,但C18的最大使用量为100 mg时,B-glu的回收率仍不足70%。Li等[8]指出,PSA量对农药的回收率产生负面影响,即随着PSA添加量的增加目标物的回收率会有所下降;GCB和C18的用量对目标物的提取效率没有显著影响。当使用PSA-C18混剂后,B-mono和B-enol的回收率会随着添加量的增加先升高后降低,而其他农药的回收率反而降低;当PSA+C18为25 mg+25 mg时,所有目标物的回收率均可达到70%~110%。因此,本实验选择加入25 mg PSA 和25 mg C18的混合净化剂。
2.3 基质效应
基质效应是由共洗脱基质组分引起的分析信号的抑制或增强现象,已被广泛研究并被认为是食品样品LC-MS/MS定量分析中的误差源[22]。本研究使用基质匹配的校准标准物来补偿基质溶液中目标农药的基质效应。计算基质效应的公式如下:

ME为正值表明基质效应增强,反之减弱。一般当基质效应增强或抑制超过10%,则认为基质效应对定量检测具有显著影响,不可忽略[10]。从表2可看出,除了B-glu和B-mono外(|ME|<10%),其余5种农药的ME绝对值均大于10%,表明这5种农药的基质减弱效应明显。为确保结果的准确性,本文采用基质标准工作液为基准进行校正。
2.4 方法评价
2.4.1线性关系与检出限在优化的前处理和色谱条件下,对系列质量浓度的基质空白混合标准溶液进行检测,其线性范围等结果见表2。结果表明,7种农药的质量浓度(x,μg/L)在0.2~2 000 μg/L范围内与其积分峰面积(y)呈良好的线性关系,r2≥0.999 2。当实际样品残留量超过此线性范围时,应对样品溶液适当稀释后再进行定量测定。在信噪比(S/N)为3时,7种农药的检出限(LOD)为0.03~1.6 μg/kg。
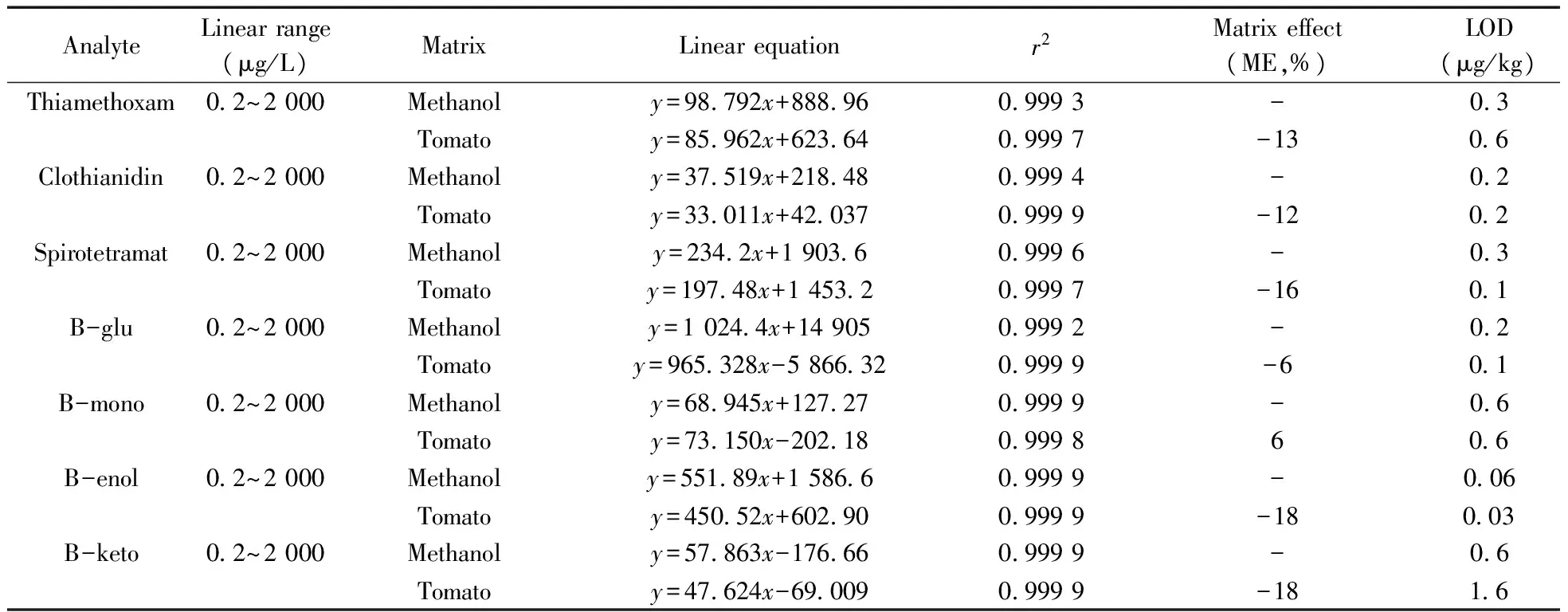
表2 7种农药的线性范围、线性方程、相关系数、基质效应和检出限Table 2 Linear ranges,regression equations,correlation coefficients,matrix effect and limits of detection(LODs) for seven pesticides
-:no data
2.4.2回收率与精密度分别在空白番茄样品中添加0.002、0.02、0.20、2.00 mg/kg水平的混标溶液,每个添加浓度平行测定5次,进行加标回收率试验。7种农药的平均回收率为79.9%~104%,相对标准偏差(RSD)为0.94%~6.4%(表3)。以最低加标浓度可知,7种农药的定量下限(LOQ)为0.002 mg/kg。结果表明,本方法具有较高的回收率和精密度,满足农药多残留检测要求。
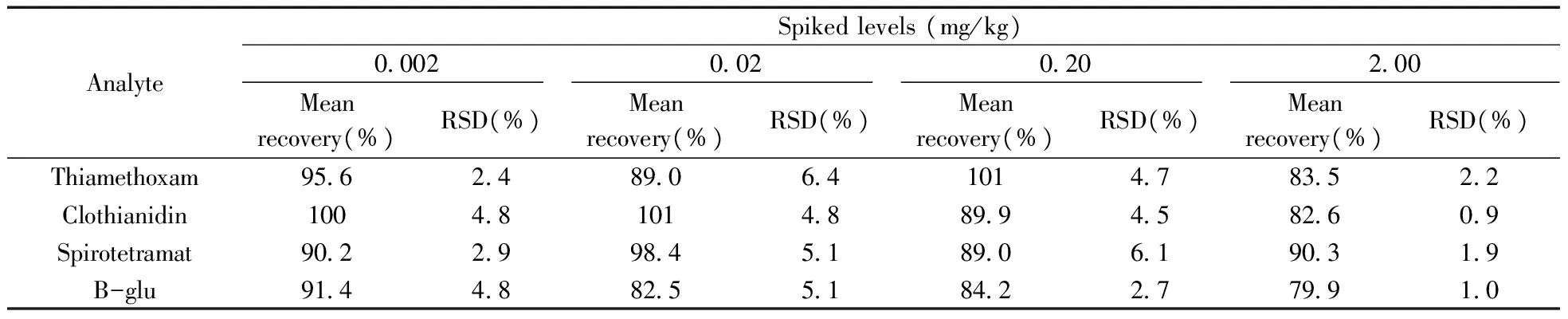
表3 7种农药的平均回收率和相对标准偏差Table 3 Mean recoveries and relative standard deviations of 7 pesticides
(续表3)

AnalyteSpikedlevels(mg/kg)0 0020 020 202 00Meanrecovery(%)RSD(%)Meanrecovery(%)RSD(%)Meanrecovery(%)RSD(%)Meanrecovery(%)RSD(%)B-mono86 44 01024 899 81 186 42 4B-enol84 12 31042 01012 889 31 5B-keto91 64 295 94 694 73 692 91 4
2.5 与其他前处理方法的比较
表4对比了本方法与文献方法的优缺点,由表可知,同样使用QuEChERS技术,本方法的试剂和净化剂用量相对更少,成本更低。并且本方法可同时测定7种农药,总体回收率相对较好,RSD较小,能满足实际样品的分析测定要求。

表4 QuEChERS方法测定7种农药与其他样品前处理方法的比较Table 4 Comparison of QuEChERS methods for the determination of 7 pesticides and other sample pretreatment methods
2.6 方法应用
将本方法应用于柑橘、节瓜、苹果、茄子中7种目标农药残留量的测定,通过在这4种空白基质中加入0.2、1.0、5.0、10.0、50.0、100.0、500.0、1 000.0、2 000.0 μg/L的7种农药混标,获得7种农药的溶剂标准曲线和相关系数,并计算各基质的基质效应,结果见表5。由表可知,4种基质中7种农药大多数表现为抑制作用,在实际样品测定时需用基质匹配标准曲线进行定量。分别在柑橘、节瓜、苹果和茄子空白匀浆样品中添加0.20 mg/kg 的混标溶液,各平行测定5次,进行加标回收率实验,结果见表5。不同样品基质中7种农药的平均回收率为71.1%~102%,RSD为0.61%~6.1%。4种基质中农药的回收率基本满足农药残留分析的要求。
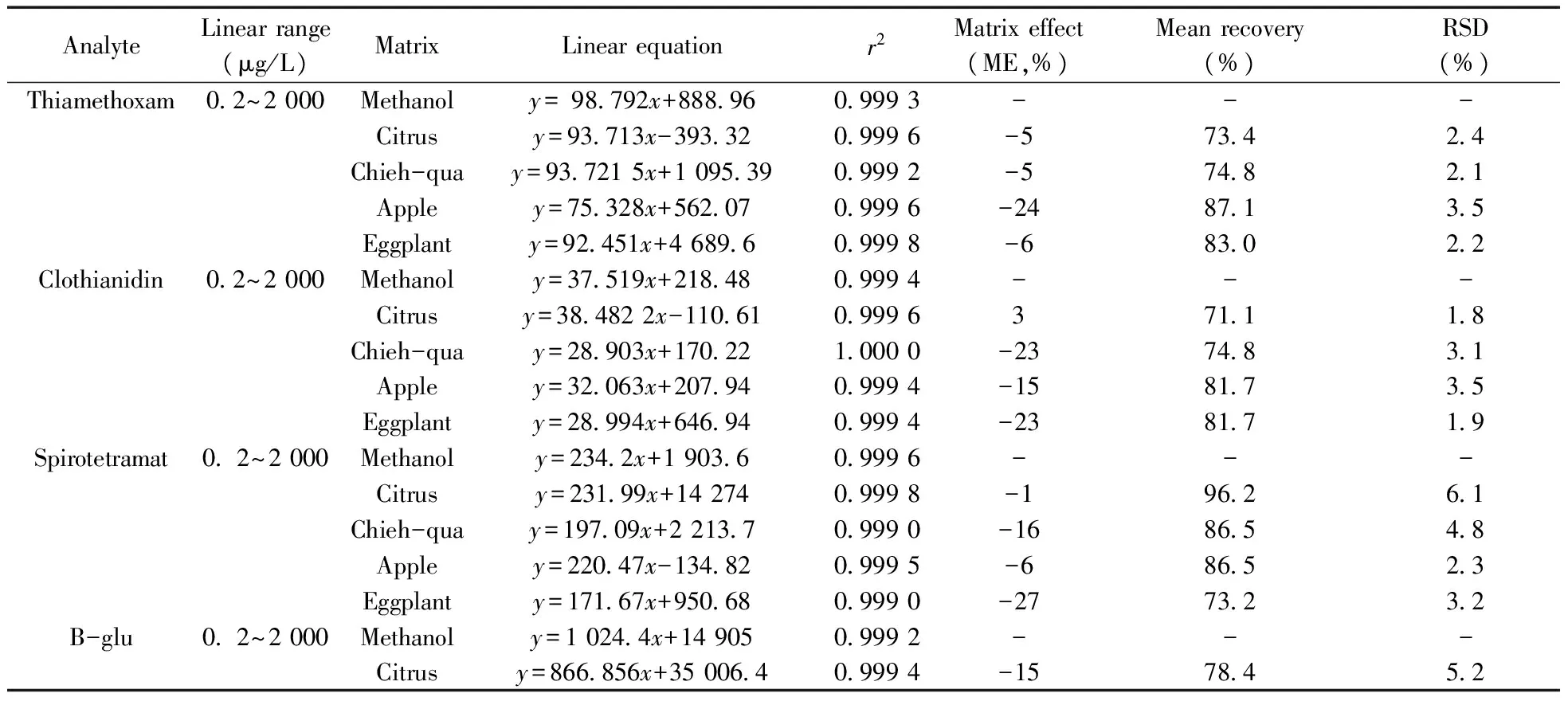
表5 7种农药测定方法的应用Table 5 Application of seven pesticide determination methods
(续表5)
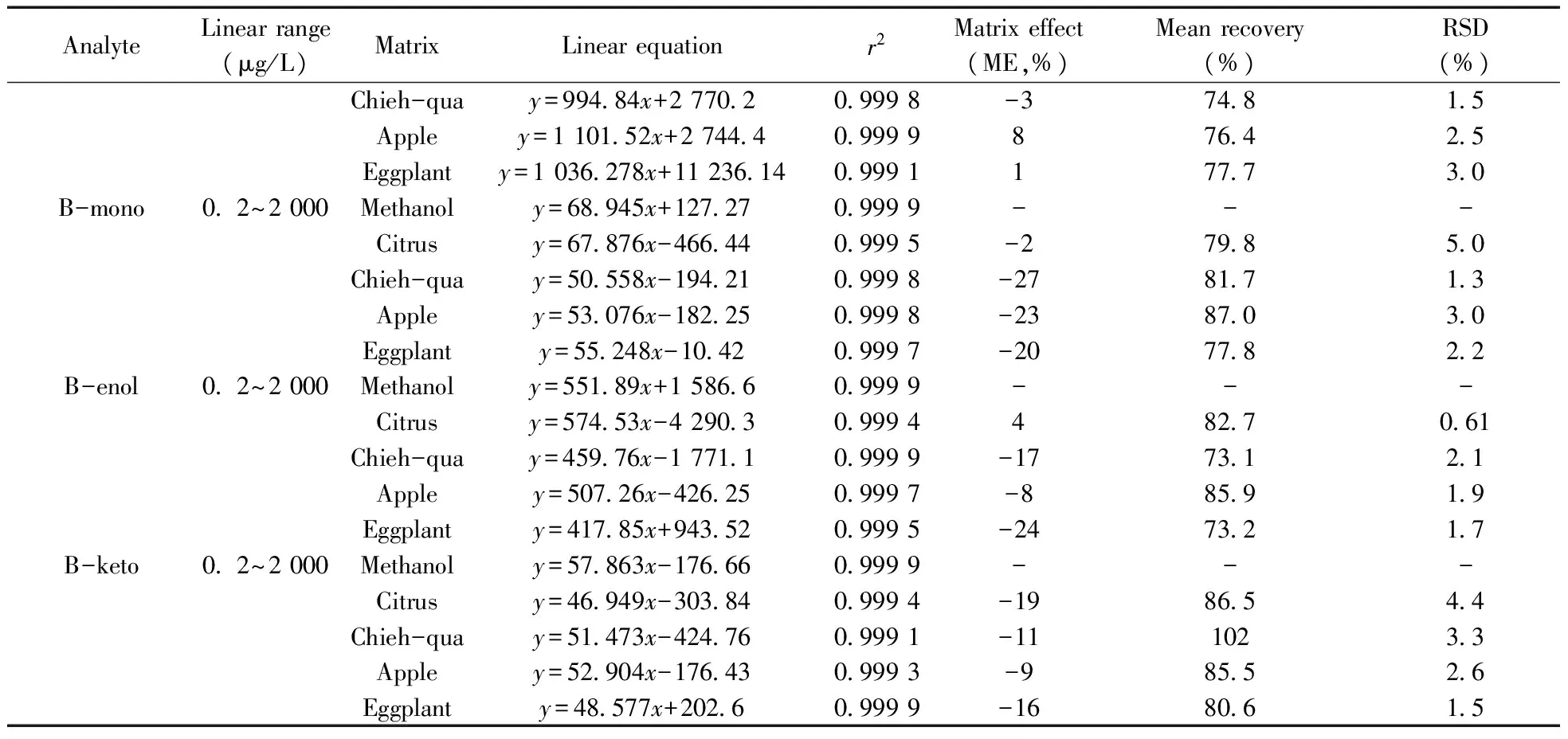
AnalyteLinearrange(μg/L)MatrixLinearequationr2Matrixeffect(ME,%)Meanrecovery(%)RSD(%)Chieh-quay=994 84x+2770 20 9998-374 81 5Appley=1101 52x+2744 40 9999876 42 5Eggplanty=1036 278x+11236 140 9991177 73 0B-mono0 2~2000Methanoly=68 945x+127 270 9999---Citrusy=67 876x-466 440 9995-279 85 0Chieh-quay=50 558x-194 210 9998-2781 71 3Appley=53 076x-182 250 9998-2387 03 0Eggplanty=55 248x-10 420 9997-2077 82 2B-enol0 2~2000Methanoly=551 89x+1586 60 9999---Citrusy=574 53x-4290 30 9994482 70 61Chieh-quay=459 76x-1771 10 9999-1773 12 1Appley=507 26x-426 250 9997-885 91 9Eggplanty=417 85x+943 520 9995-2473 21 7B-keto0 2~2000Methanoly=57 863x-176 660 9999---Citrusy=46 949x-303 840 9994-1986 54 4Chieh-quay=51 473x-424 760 9991-111023 3Appley=52 904x-176 430 9993-985 52 6Eggplanty=48 577x+202 60 9999-1680 61 5
-:no data
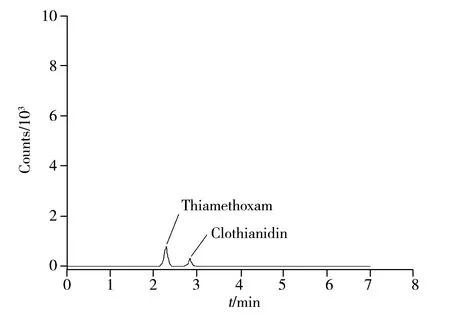
图 4 番茄样品的色谱图Fig.4 Chromatogram of a tomato sample
采用本方法检测市售20份番茄、20份节瓜、20份苹果、20份茄子样品,其中节瓜中未检出上述7种农药,番茄有1份样品检出噻虫嗪和噻虫胺,苹果有1份样品检出噻虫嗪,茄子有2份样品检出噻虫嗪,检出量为0.003~0.027 mg/kg,但均未超标。图4为检出农药的市售番茄样品的色谱图。
3 结 论
本研究采用优化后的QuEChERS结合UPLC-MS/MS技术,建立了快速检测番茄中噻虫嗪、噻虫胺、螺虫乙酯及4种代谢产物残留的方法。本方法具有操作简单、快速、灵敏度高、检出限低和重现性好等优点,能满足番茄中噻虫嗪、噻虫胺、螺虫乙酯及4种代谢产物同时检测的要求。该方法同时适用于柑橘、节瓜、苹果、茄子中上述7种农药残留的检测,有较高的应用推广价值。
[1] Gouvêa M M,Freitas D M,Rezende J A,Watanabe L F,Lourenão A L.Phytoparasitica,2017,45(1):95-101.
[2] Fang Y,Jiao X G,Xie W,Wang S L,Wu Q J,Shi X B,Chen G,Su Q,Yang X,Pan H P,Zhang Y J.ScientificReports,2013,3(2876):1-5.
[3] Authority E F S.EfsaJournal,2012,10(11):2990.
[4] Authority E F S.EfsaJournal,2016,14(3):4429.
[5] GB 2763-2016.Maximum Residue Limits for Pesticides in Food.National Food Safety Standards (食品中最大残留限量.国家食品安全标准).
[6] Malhat F M,Watanabe H,Loutfy N M,Ahmed M T.Toxicological&EnvironmentalChemistry,2014,96(2):318-327.
[7] Gong Y,Huang W,Zhang Y F,Li J Z.AsianJournalofChemistry,2012,24(11):5289-5291.
[8] Li S S,Liu X G,Dong F S,Xu J,Xu H Q,Hu M F,Zheng Y Q.FoodChem.,2016,192:893-899.
[9] Iwafune T,Ogino T,Watanabe E.J.Agric.FoodChem.,2014,62(13):2790-2796.
[10] Zhu Y L,Liu X G,Xu J,Dong F S,Liang X Y,Li M M,Duan L F,Zheng Y Q.J.Chromatogr.A,2013,1299:71-77.
[11] Wang D,Hou C J,Zhao E C,Jia C H.J.Instrum.Anal.(王东,侯传金,赵尔成,贾春虹.分析测试学报),2015,34(6):681-685.
[12] Zhan X P,Chen J B,Ma L,Huang L Q,Zhao L,Yu S H.J.Instrum.Anal.(占绣萍,陈建波,马琳,黄兰淇,赵莉,余淑红.分析测试学报),2016,35(4):476-481.
[13] Li L,Jiang G Q,Liu C Y,Liang H Y,Sun D L,Li W.FoodControl,2012,25(1):265-269.
[14] Hafez R O,Singh B.JournalofInsectScience,2016,29(1):25-31.
[15] Zhang F,Zhang X Z,Luo F J,Chen Z M,Sun W J,Liu G M,Lou Z Y.J.Instrum.Anal.(张芬,张新忠,罗逢健,陈宗懋,孙威江,刘光明,楼正云.分析测试学报),2013,32(4):393-400.
[16] Melo A,Cunha S C,Mansilha C,Aguiar A,Pinho O,Ferreira I M.FoodChem.,2012,135(3):1071-1077.
[17] Anastassiades M,Lehotay S J,tajnbaher D,Schenck F J.J.AOACInt.,2003,86(2):412-431.
[18] Lehotay S J,Kok A D,Hiemstra M,Bodegraven P V.J.AOACInt.,2005,88(2):595-614.
[19] Xie W,Han C,Qian Y,Ding H Y,Chen X M,Xi J Y.J.Chromatogr.A,2011,1218(28):4426-4433.
[20] Determination of Pesticide Residues Using GC-MS and/or LC-MS (/MS) Following Acetonitrile Extraction/Partitioning and Clean-up by Dispersive SPE-QuEChERS Method.EN 15662.2008.
[21] AOAC Official Method 2007.01 Pesticide Residues in Foods by Acetonitrile Extraction and Partitioning with Magnesium Sulfate Gas Chromatography/Mass Spectrometry and Liquid Chromatography/Tandem Mass Spectrometry.AOAC International,2007.
[22] Niessen W M A,Manini P,Andreoli R.MassSpectrometryReviews,2006,25(6):881-899.
[23] Ramadan G,Shawir M,El-Bakary A,Abdelgaleil S.ChileanJournalofAgriculturalResearch,2016,76(1):129-133.
[24] Zhang Y,Xu J,Dong F S,Liu X G,Li X G,Li Y B,Wu X H,Liang X Y,Zheng Y Q.Anal.Methods,2013,5(6):1449-1455.
[25] Mohapatra S,Kumar S,Prakash G S.Environ.Monit.Assess.,2015,187(632):1-12.
Analysis of Thiamethoxam,Clothianidin and Spirotetramat and Their Metabolites Residues in Tomato Using QuEChERS Method with Ultra Performance Liquid Chromatography-Mass Spectrometry
LIU Yan1,3,OUYANG Di-qing1,3,YE Yu-feng1,3,WANG Cheng-qiu1,2,3,4*,JIAO Bi-ning1,2,3,4,5*,ZHAO Qi-yang1,3,ZHANG Yao-hai1,3,AO Yan2,3,WANG Hai-yan6
(1.Laboratory of Risk Assessment for Citrus Quality and Safety,Ministry of Agriculture,Citrus Reserch Institute,Chinese Academy of Agricultural Sciences/Southwest University,Chongqing 400712,China;2.College of Food Science,Southwest University,Chongqing 400715, China;3.Quality Supervision and Testing Center for Citrus and Seedling,Ministry of Agriculture,Chongqing 400712,China;4.National Center for Citrus Engineering,Chongqing 400712,China;5.Chongqing Key Laboratory of Citrus,Chongqing 400712,China;6.Chongqing Academy of Animal Science,Chongqing 402460,China)
In this study,an analytical method was established for the determination of thiamethoxam and its metabolites clothianidin,spirotetramat and its four metabolites such as BYI08330-enol-glucoside,BYI08330-ketohydroxy,BYI08330-enol and BYI08330-mono-hydroxy residues in tomatoes using QuEChERS cleanup with ultra-performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS).The residues in samples were extracted with acetonitrile,dehydrated with anhydrous magnesium sulfate and sodium chloride,then purified with primary secondary amine (PSA) sorbent and C18,finally detected by ultra-performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS) under the multi-reactive ion monitoring mode(MRM) and quantified by external standard method.The results showed that good linearities for the seven analytes i.e.thiamethoxam,clothianidin,spirotetramat,BYI08330-enol-glucoside,BYI08330-mono-hydroxy,BYI08330-enol and BYI08330-ketohydroxy were observed in the concentration range of 0.2-2 000 μg/L with the correlation coefficients(r2) not less than 0.999 2. The limits of quantification(LOQs) were 0.002 mg/kg.The average recoveries at the fortified levels of 0.002,0.02,0.20 and 2.00 mg/kg were in the range of 79.9%-104% with the relative standard deviations of 0.94%-6.4%.With the advantages of rapidness,simplicity,high sensitivity and good reproducibility,the method is suitable for the determination of thiamethoxam,clothianidin,spirotetramat and their four metabolites residues in tomatoes.
QuEChERS;UPLC-MS/MS;pesticide residues;tomato
2017-07-24;
2017-08-21
2017年国家柑桔及热带作物产品质量安全风险评估项目(GJFP2017004);国家现代农业(柑桔)产业技术体系建设项目 (CARS-26)
*
焦必宁,研究员,研究方向:果蔬贮藏加工技术与质量安全,Tel:023-68349046,E-mail:jiaobining@citrus.cn
王成秋,副研究员,研究方向:食品安全与质量控制,Tel:023-68349046,E-mail:citruszhx@163.com
10.3969/j.issn.1004-4957.2017.12.003
O657.63;O657.7
A
1004-4957(2017)12-1431-08
