干扰水通道蛋白3对胃癌细胞增殖与凋亡的影响
2017-12-27南京医科大学第一附属医院普外科江苏南京210029皖南医学院附属铜陵市人民医院普外科安徽铜陵244000
(1.南京医科大学第一附属医院 普外科,江苏 南京 210029;2.皖南医学院附属铜陵市人民医院 普外科,安徽 铜陵 244000)
·基础医学·
干扰水通道蛋白3对胃癌细胞增殖与凋亡的影响
高励斌1,2,张 强1,陈 亮1,徐 皓1
(1.南京医科大学第一附属医院 普外科,江苏 南京 210029;2.皖南医学院附属铜陵市人民医院 普外科,安徽 铜陵 244000)
目的:探究水通道蛋白3(AQP3)对胃癌细胞增殖与凋亡的影响及其可能机制。方法通过RT-PCR、Western-blot实验检测胃癌细胞株中的AQP3表达水平;小干扰RNA构建AQP3低表达细胞系;CCK-8增殖实验和流式细胞术分别检测细胞增殖与凋亡水平;Western-blot检测细胞自噬水平,透射电镜观察自噬小体数目。结果胃癌细胞AQP3表达水平较高;与干扰前相比,AQP3低表达细胞系中胃癌细胞增殖水平降低(P<0.05),凋亡水平提高(P<0.001),自噬标记蛋白LC3Ⅱ水平降低(P<0.001),P62表达水平上升(P<0.001)。结论AQP3在胃癌细胞中高表达,干扰AQP3可通过降低自噬水平促进细胞凋亡,进而抑制胃癌细胞增殖,提示AQP3具有成为胃癌治疗分子靶点的潜能。
水通道蛋白3;自噬;增殖;凋亡;胃癌
胃癌是高发的恶性肿瘤之一,其发病率在所有恶性肿瘤中位列第四,在恶性肿瘤相关致死率中位列第二[1]。我国是胃癌的高发区,发病率明显高于世界平均水平[2]。目前胃癌的发生发展机制尚不明确,影响了胃癌诊治水平的进一步提高。
水通道蛋白家族(Aquaporins,AQPs)属于膜内在蛋白家族,其单体分子质量约30 ku,主要生理功能为跨膜被动转运水分子以及甘油、尿素等小分子。AQP3在正常胃组织及胃癌组织中都表达,但在胃癌组织中的表达显著高于癌旁组织,且未分化肿瘤中AQP3的表达高于分化良好的肿瘤[3]。Zhao等[4]发现,胃黏膜杯状细胞中AQP3差异性表达,肠上皮化生严重的黏膜组织的AQP3阳性杯状细胞更常见,提示AQP3可能在从肠上皮化生到胃癌发生的过程中起到重要的促进作用。此外,文献报道,幽门螺杆菌与人胃腺癌细胞体外培养可上调AQP3表达水平,AQP3的表达水平与胃癌组织、癌旁黏膜中幽门螺杆菌的感染相关,提示AQP3有可能是治疗幽门螺杆菌相关胃癌的潜在靶点[5]。本文从AQP3影响胃癌细胞增殖与凋亡的角度出发,探究AQP3促进胃癌细胞增殖的机制,为胃癌的分子治疗提供基础。
1 材料与方法
1.1 材料 胃癌细胞株HGC27、MKN45、SGC7901、MGC803、BGC823、AGS以及人胃黏膜细胞GES-1均购自ATCC公司;RPMI 1640 1X培养液、F12K培养液、胎牛血清、PBS均购自维森特生物技术有限公司;青链霉素购自Sigma公司;SDS-PAGE蛋白、甘氨酸、氯化钠、Tris-base等试剂均购自Biosharp公司;AQP3抗体、LC3抗体、P62抗体、GAPDH抗体均购自Abcam公司;Cell counting kit-8试剂购自Selleck公司;逆转录试剂盒购自TAKARA公司;Fast-start SYBR-green qPCR Mix购自TOYOBO公司;Lipofectamine 3000购自Invitrogen公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术有限公司;核蛋白和胞浆蛋白提取试剂盒购自凯基生物科技发展有限公司;显色液、定影液购自灵琦服务用品厂;Annexin V-FITC 凋亡检测试剂盒购自BD公司。
1.2 方法
1.2.1 细胞培养 配制含10%胎牛血清、1%青链霉素的RPMI 1640培养液,在37℃、5%CO2恒温恒湿培养箱中进行胃癌细胞传代培养,当细胞生长到对数期时进行实验。
1.2.2 AQP3-siRNA细胞系构建 AQP3-siRNA序列由商业公司构建,干扰序列为: 5′-GGATATGATCAATGGCTTCTT-3′,对照序列为:5′-TTCTCCGAACGTGTCACGT-3′。将2.5×105个细胞均匀铺在六孔板中,培养24 h后进行转染。按照siRNA说明书要求步骤,将Lipofectamine 3000每孔5 μL与100 μL全培混合,同时取干扰序列或者对照序列5 μL与100 μL混合,静置5 min后,将两者转移至同一离心管中,轻弹管底后静置25min备用。六孔板常规换液后,每孔加入配制好的液体200 μL。培养24 h后,进行提取RNA、蛋白质等后续实验。
1.2.3 Real-time PCR实验 提取细胞总RNA,采用一步法逆转录合成cDNA文库。RT-PCR检测AQP3表达量,β-actin为内参。β-actin-F:5′-CTTGCAGCTCTTCCGGAGTC-3′; β-actin-R:5′-GCTCAGTGAGCATCAGCGTG-3′。AQP3-F:5′-CGAAGTGCCAGATTGCATCATAA-3;AQP3-R:5′-TAGCCTTGTCAGATAAGGAAGGA-3′。反应体系为:SYBR荧光定量预混液5 μL、上游引物0.3 μL、下游引物0.3 μL、模板cDNA 1μL、DEPC水3.4 μL,总体积为10 μL。反应条件为:95℃ 5min;循环PCR反应:95℃ 10 s,60℃ 30 s(重复40个循环);溶解曲线:95℃ 15 s,60℃ 30 s和95℃ 15 s。用2-ΔΔCT计算其相对表达量。
1.2.4 CCK8细胞增殖实验 按照每孔2×103个胃癌细胞的密度将其接种到96孔板中,每种细胞接种4个副孔,每孔加入完全培养液200 μL,每块板设置4个培养液空白对照孔。在培养箱中连续培养4 d,每天同一时间进行CCK-8孵育及吸光度值检测。检测前,吸弃孔中的培养液,用完全培养液配制10%的CCK-8溶液,每孔加入100 μL CCK-8溶液后继续孵育2 h。随后利用酶标仪,在450 nm/490 nm的波长下测量吸光度。细胞吸光值=样品孔吸光值-空白对照孔吸光值。实验至少重复3次。
1.2.5 流式细胞凋亡检测 将2.5×105个/孔的细胞接种于6孔板中,对细胞进行相应处理后,进行流式细胞学检测。检测方法如下:用移液器吸出培养液,移入标记好的10 mL离心管中;将不含EDTA的胰酶消化细胞,清洗的PBS、消化用的胰酶以及终止消化的培液均加入相应离心管中;将离心管放入离心机中,配平后,1500 r/min离心3 min。弃去上清,加入PBS重悬清洗细胞沉淀,然后以同样的条件离心细胞(即用PBS清洗细胞一遍),弃液;每孔加入Binding buffer 500 μL重悬细胞,然后加入Fitc-Annexin Ⅴ和PI各5 μL,室温避光孵育15 min。随后上机检测。
1.2.6 Western-blot检测自噬水平 使用核蛋白和胞浆蛋白提取试剂盒,按照操作说明书提取总蛋白。然后按照BCA蛋白浓度测定试剂盒操作说明检测蛋白浓度。制备12%的上层分离胶以及5%的下层浓缩胶,待SDS-PAGE凝胶凝固后,加入适量蛋白marker以及待测蛋白,浓缩胶期间使用80 V恒定电压电泳,约20 min后调至120 V,待溴酚蓝到达胶的最底部时,停止电泳。随后用PVDF膜进行转膜,5%脱脂奶粉封闭2 h。TBST洗涤条带3次、每次5 min。将条带放入相应一抗稀释液中,于4℃冰箱过夜。翌日TBST洗涤3次,操作同前。随后,放入二抗稀释液中孵育2 h后进行条带曝光。
1.2.7 透射电镜观察自噬小体 计数106个细胞均匀接种在6孔板中。培养48 h后,将细胞消化至1.5 mL离心管中,1500 r/min离心15 min。弃去上清,用2.5%戊二醛溶液于4℃冰箱中过夜。然后用1%四氧化锇固定1 h,再用乙醇脱水,环氧树脂包埋。上述处理结束之后将样本送至南京医科大学分析和监测中心,通过JEM-1010透射电子显微镜观察不同处理细胞的自噬小体水平。
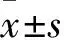
2 结果
2.1 胃癌细胞中AQP3表达水平较高 通过RT-PCR及Western-blot检测胃癌细胞株及人胃黏膜细胞中AQP3的表达水平,我们发现胃癌细胞株AQP3的mRNA表达水平高于胃黏膜细胞(图1A、1B),Western-blot亦表明AQP3在胃癌细胞中表达高于正常细胞(F分别为38.17、24.68、11.29、82.74、31.12、130.1;t分别为4.377、7.865、20.13、3.26、14.69、8.348;P均<0.05)。
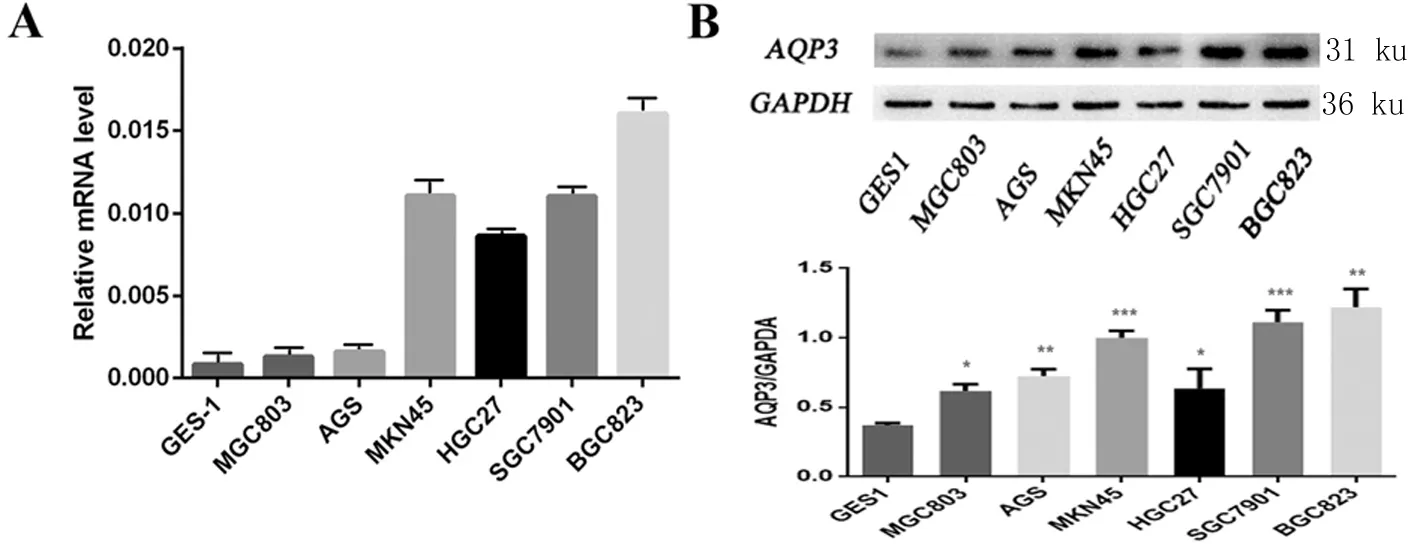
A:通过RT-PCR实验在转录水平检测GES1以及胃癌细胞株中AQP3表达水平。B:Western-blot实验显示在蛋白表达水平胃癌细胞中AQP3表达水平高于正常胃黏膜细胞(与正常黏膜细胞GES1相比,*P<0.05,**P<0.01,***P<0.001)。
图1 胃癌细胞中AQP3表达水平
2.2 干扰AQP3后胃癌细胞凋亡水平上升,增殖能力下降 为了研究AQP3表达水平对胃癌的发生、发展可能造成的影响,我们根据胃癌细胞株中AQP3的表达水平,构建了AQP3干扰的细胞株:SGC7901-siRNA、BGC823-siRNA,并通过RT-PCR(图2A,t分别为10.29、12.38;P均<0.001)以及Western-blot验证敲除效率(图2B,F分别为18.84、4.850;t分别为9.603、9.239;P均<0.001)。经过流式细胞检测,我们发现干扰AQP3表达后胃癌细胞的凋亡水平增加(图2C,F分别为2.526、2.778;t分别为10.87、38.62;P均<0.001)。CCK-8增殖实验表明AQP3敲除后胃癌细胞的增殖能力下降(图2D),铺板72h后差异有统计学意义(F分别为1.210、1.027;t分别为2.796、3.885;P均<0.05),96 h后敲除AQP3的胃癌细胞增殖能力比对照组降低(F分别为13.98、1.197;t分别为6.508、8.357;P均<0.01),差异有统计学意义。
2.3 干扰AQP3表达抑制胃癌细胞自噬水平 为了进一步探究干扰AQP3后抑制胃癌增殖能力的机制,我们推测AQP3表达降低后,可能限制了物质的扩膜运输,进而影响细胞的自噬水平,而自噬水平改变可作用于胃癌细胞的增殖。通过对自噬标记蛋白的检测,我们发现AQP3干扰后,细胞内LC3Ⅱ蛋白的表达量降低(F分别为1.194、13.57;t分别为29.50、29.46;P均<0.001),P62蛋白的表达量升高(F值分别为4.538、1.193;t分别为12.18、28.60;P均<0.001)。LC3Ⅱ与P62表达水平的改变标志着细胞自噬水平的降低,而透射电镜中也观察到AQP3水平降低后,胃癌细胞中自噬小体随之减少,见图3。
3 讨论
随着医疗器械不断进步、医疗技术不断革新以及分子靶向药物的相继问世,全球范围内胃癌5年生存率有了较大提高,但在肿瘤相关致死率中仍位于前列[1]。胃癌发生发展的机制研究以及早期诊断及治疗的靶点探寻一直都是科学热点问题。AQPs是一类通道蛋白,控制水、甘油、过氧化氢等小分子物质的扩膜运输[6-7]。研究发现在消化道肿瘤中,AQP3、5、7的表达水平在肿瘤组织中显著高于癌旁组织[8]。AQP3属于水甘油通道蛋白质,它可以通过调控表皮细胞、脂肪组织以及其他组织的甘油浓度而调节皮肤的水合作用、细胞增殖、肿瘤生成、脂质代谢[9]以及三磷酸腺苷(ATP)合成[10]等复杂而重要的生化过程。国内外已有研究报道AQP3在多个器官系统的肿瘤发生发展中有着重要的调节作用,如鳞状细胞癌、胸部肿瘤、消化道肿瘤以及泌尿生殖系统肿瘤等[9,11-12]。
本文探究了AQP3对于胃癌细胞凋亡和增殖的影响,发现干扰AQP3后胃癌细胞的凋亡水平升高,而细胞增殖能力下降,提示干扰AQP3的表达可以抑制胃癌增殖。进一步机制分析表明,AQP3表达水平降低时,细胞自噬水平也随之降低,这意味着干扰胃癌细胞AQP3表达水平后,其凋亡水平的升高可能是由自噬水平降低引起。在营养物质缺乏的条件下,细胞自噬可通过降解细胞内衰老或损伤的相关蛋白、非必需细胞器等以循环利用原料物质并提供能量,并通过消化长寿命蛋白等物质以减少细胞自身损害以及降解细胞周期抑制蛋白而缓解细胞周期抑制,使细胞进入快速增殖阶段,促进肿瘤细胞的增殖[13]。研究发现自噬是细胞体内的一种高度进化保守过程。在细胞发生应激的情况如遭遇营养剥夺、细胞毒性剂等损伤时,自噬可以通过消化细胞内无用蛋白及细胞器,循环能量及物质,帮助细胞应对应激状态[14-15]。通常认为在多数情况下,自噬对细胞的生存起保护作用,但研究发现过强的自噬可导致细胞的死亡,该过程被称为自噬性细胞死亡。Sun等[16]研究发现抑制细胞自噬可能促进细胞的凋亡; AQP3作为物质扩膜运输的通道,是否参与氧化应激介导的细胞自噬目前尚未见报道,仍需深入的研究探讨。
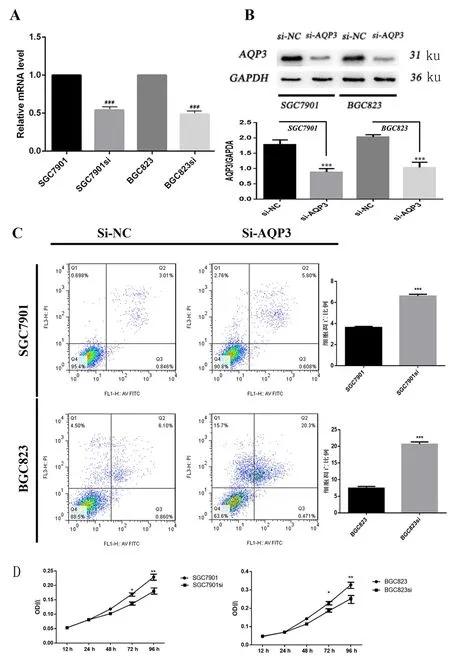
干扰AQP3后胃癌细胞凋亡水平上升,增殖能力下降。 A、B.转染实验之后胃癌细胞的AQP3表达水平降低。C.AQP3表达水平的降低可导致胃癌细胞凋亡增加。D.与对照组相比,干扰AQP3后,胃癌细胞的增殖能力下降(与对照组相比,*P<0.05,**P<0.01,***P<0.001)。
图2 干扰AQP3后胃癌细胞凋亡水平和增殖能力
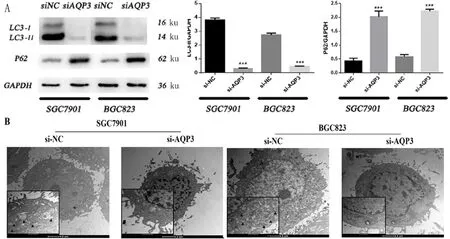
AQP3表达水平下降后胃癌细胞自噬水平降低。A.干扰AQP3后,SGC7901si和BGC823si细胞中自噬水平降低。B.转染siAQP3序列后,SGC7901si和BGC823si细胞内自噬小体数目减少。电镜图片标尺分别为2 μm、500 nm,黑色实心三角形标注为自噬小体(与对照组相比,*P<0.05,**P<0.01,***P<0.001)。
图3 AQP3表达水平下降后胃癌细胞的自噬水平
我们认为在癌症中AQP3的深入研究亟需解决以下问题:①明确AQP3在各种癌症中的确切作用,以AQP3为靶点,从DNA-RNA-蛋白质角度出发,发现AQP3特异的激活物或者抑制物,利用分子生物学手段来印证AQP3在癌症中作用;②从AQP3生理功能的角度出发,作为水甘油通道蛋白质,AQP3所转运的物质在癌症发生和发展中具有关键作用。比如对AQP3转运甘油、过氧化氢进而影响癌症的发生发展的作用已经被初步发现,但其中潜在的机制仍不明朗。除了甘油以及过氧化氢,AQP3是否还转运其他重要小分子物质亦尚未可知,仍需进一步研究;③从膜蛋白相互作用的角度来看,目前已经发现AQP3与氯离子通道相互作用,进而影响癌症细胞的体积[17]。AQP3与其他蛋白相互作用的研究在癌症中尚未见报道。
综上所述,我们认为干扰AQP3表达可以降低胃癌细胞自噬水平,促进细胞凋亡,进而影响胃癌细胞的增殖能力。AQP3作为膜内在蛋白,在胃癌发生发展中的作用以及成为治疗胃癌分子药物靶点的可能性有待进一步研究。
【参考文献】
[1] TORRE LA,BRAY F,SIEGEL RL,etal. Global cancer statistics,2012[J]. CA: a cancer journal for clinicians,2015,65(2):87-108.
[2] CHEN W,ZHENG R,ZENG H,etal. Annual report on status of cancer in China,2011[J]. Chin J Cancer Res,2015,27(1):2-12.
[3] SHEN L,ZHU Z,HUANG Y,etal. Expression profile of multiple aquaporins in human gastric carcinoma and its clinical significance[J]. Biomedicine & Pharmacotherapy,2010,64(5):313-318.
[4] ZHAO H,YANG X,ZHOU Y,etal. Potential role of aquaporin 3 in gastric intestinal metaplasia[J]. Oncotarget,2015,6(36):38926-38933.
[5] WANG G,GAO F,ZHANG W,etal. Involvement of aquaporin 3 in helicobacter pylori-related gastric diseases[J]. Plos One,2012,7(11):e49104.
[6] WU B,BEITZ E. Aquaporins with selectivity for unconventional permeants[J]. Cellular & Molecular Life Sciences,2007,64(18):2413-2421.
[7] YOOL AJ,CAMPBELL EM. Structure,function and translational relevance of aquaporin dual water and ion channels[J]. Molecular Aspects of Medicine,2012,33(5-6):553-561.
[8] SHEN L,ZHU Z,HUANG Y,etal. Expression profile of multiple aquaporins in human gastric carcinoma and its clinical significance[J]. Biomedicine & Pharmacotherapy,2010,64(5):313-318.
[9] SOVERAL G,CASINI A. Aquaporin modulators: a patent review (2010-2015)[J]. Expert Opinion on Therapeutic Patents,2016,27(1):49-62.
[10] LI Z,LI B,ZHANG L,etal. The proliferation impairment induced by aqp3 deficiency is the result of glycerol uptake and metabolism inhibition in gastric cancer cells[J]. Tumor Biology,2016,37(7):9169-9179.
[11] LIU YL,MATSUZAKI T,NAKAZAWA T,etal. Expression of aquaporin 3 (aqp3) in normal and neoplastic lung tissues[J]. Human Pathology,2007,38(1):171-178.
[12] KUSAYAMA M,WADA K,NAGATA M,etal. Critical role of aquaporin 3 on growth of human esophageal and oral squamous cell carcinoma[J]. Cancer Science,2011,102(6):1128-1136.
[13] JIN S. White E.Role of autophagy in cancer: management of metabolic stress[J]. Autophagy,2007,3(1):28-31.
[14] MARINO G,NISO-SANTANO M,BAEHRECKE EH,etal.Self-consumption: the interplay of autophagy and apoptosis[J]. Nature reviews Molecular cell biology,2014,15(2):81-94.
[15] BURSCH W. The autophagosomal-lysosomal compartment in programmed cell death[J]. Cell death and differentiation,2001,8(6):569-581.
[16] SUN Y,GUO W,REN T,etal. Gli1 inhibition suppressed cell growth and cell cycle progression and induced apoptosis as well as autophagy depending on ERK1/2 activity in human chondrosarcoma cells[J]. Cell death & disease,2014,5:e979.
[17] ISHIMOTO S,WADA K,USAMI Y,etal. Differential expression of aquaporin 5 and aquaporin 3 in squamous cell,carcinoma and adenoid cystic carcinoma[J]. International Journal of Oncology,2012,41(1):67-75.
Effectsofinhibitingaquaporin-3expressionontheproliferationandapoptosisofgastriccancercells
GAOLibin,ZHANGQiang,CHENLiang,XUHao
Department of General Surgery,The First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China
Objective: To investigate the effects of inhibiting aquaporin-3 (AQP3) on the proliferation and apoptosis of gastric cancer cells and the potential mechanisms.Methods: The expression level of AQP3 in gastric cancer cell lines was determined by RT-PCR and Western-blot. AQP3 low expression cell line was constructed by small interfering RNA. CCK-8 proliferation assay and flow cytometry were used to detect the cell proliferation and apoptosis. The autophagy level was detected by Western-blot and number of autophagosomes was measured by transmission electron microscopy.Results: Significantly higher expression of AQP3 was seen in the gastric cancer cells,yet was markedly down-regulated following interference (P<0.05). Increased apoptotic level,P62 expression and decreased autophagy biomarker of LC3Ⅱ were also seen in the gastric cancer cells after interfering(allP<0.001).Conclusion:AQP3 is highly expressed in gastric cancer cells,and interfering the expression of AQP3 can promote cell apoptosis by decreasing the level of autophagy and inhibiting the proliferation of gastric cancer cells. This suggests that AQP3 may be potential target for treating gastric cancer.
aquaporin-3; autophagy; proliferation; apoptosis; gastric cancer
1002-0217(2017)06-0516-05
江苏省六大人才高峰项目(WSW-038)
2017-09-13
高励斌(1978-),男, 副主任医师,(电话)13965208002,(电子信箱)doctor_gaolb@163.com;
徐 皓,男,副主任医师,副教授, (电子信箱)hxu@njmu.edu.cn,通信作者。
R 735.2
A
10.3969/j.issn.1002-0217.2017.06.002
