携IL-8单抗靶向超声微泡对损伤心肌细胞的体外寻靶实验研究
2017-12-26李鸿利王禹雪杨寒凝朱桂敏陆永萍
孙 月 李鸿利 王禹雪 杨寒凝 朱桂敏 陆永萍
携IL-8单抗靶向超声微泡对损伤心肌细胞的体外寻靶实验研究
孙 月 李鸿利 王禹雪 杨寒凝 朱桂敏 陆永萍
目的 制备携IL-8单克隆抗体(以下简称单抗)靶向超声微泡,检测其基本特性,并探讨其对损伤心肌细胞的体外黏附能力。方法 采用共价偶联法制备携IL-8单抗靶向超声微泡,利用缺氧、缺糖方法制备损伤心肌细胞,通过靶向超声微泡与损伤心肌细胞的体外结合实验检测其寻靶能力,并与SonoVue微泡进行比较。结果 携IL-8单抗靶向微泡与轻度及重度损伤心肌细胞的黏附比分别为(61.9±18.9)%和(86.6±5.1)%,明显高于SonoVue微泡与轻度损伤及重度损伤心肌细胞的黏附比[(12.0±0.6)%和(11.8±1.0)%],差异均有统计学意义(均 P<0.01);且随着损伤程度的加重,携 IL-8单抗靶向超声微泡与心肌细胞的黏附作用逐渐加强(r=0.945,P<0.01)。结论 携IL-8单抗靶向超声微泡对损伤心肌细胞具有较强的靶向性。
白细胞介素8;靶向;超声微泡;损伤心肌细胞
在我国,急性心肌梗死(acute myocardial infarction,AMI)已经逐渐成为死亡的最主要原因,致死率、致残率高。AMI由于冠状动脉急性闭塞导致部分心肌缺血、坏死及炎细胞浸润。白细胞介素8(IL-8)作为免疫和炎症反应的重要调节因子,可通过介导中性粒细胞向内皮细胞迁移和释放氧自由基、蛋白分解酶等毒性产物损伤心肌细胞,在AMI中发挥重要作用。本实验采用交联剂将抗IL-8单克隆抗体(以下简称单抗)偶联至SonoVue微泡表面,制备靶向超声微泡,并将其作用于损伤心肌细胞,探讨携IL-8单抗靶向超声微泡对损伤心肌细胞的体外寻靶能力,为AMI提供新的治疗靶点。
材料与方法
一、主要试剂与仪器
鼠抗人 IL-8单抗(英国剑桥 Abcam公司);SonoVue(意大利Bracco公司);羊抗鼠IgG血清(美国KPL公司);荧光标记羊抗鼠IgG血清(IgG-FITC,美国Invitrogen公司);3-(2-吡啶二羟基)丙酸 N-羟基琥珀酰亚胺酯(SPDP,德国Merck公司);H9c2新生大鼠原代心肌细胞(深圳白恩维生物科技有限公司)。IEC-Multi型常温高速离心机(德国Sigma公司);倒置光学显微镜(日本Olympus公司)。
二、靶向超声微泡的制备
将鼠抗人IL-8单抗溶于缓冲溶液,加入SPDP溶液反应,离心、洗涤得到带吡啶二硫基的单抗;加入1 ml的DTT醋酸溶液反应,离心、洗涤得到带巯基的抗体溶液。取SonoVue悬液加入SPDP交联剂,洗涤后与带巯基的抗体溶液混合,再次反应、洗涤,得到携IL-8 单抗的超声微泡悬液[1]。
三、基本特性检测及免疫荧光染色检验
取制备好的靶向超声微泡与SonoVue微泡各20μl,分别经PBS缓冲液稀释成1 ml均匀分布的悬浮液,各取10 μl悬浮液滴于载玻片,压片后置于倒置光学显微镜下观察两种超声微泡的性状、大小、形态及分散度。另取1 ml靶向超声微泡与SonoVue微泡分别经PBS缓冲液稀释至5 ml,各加入10 μl鼠抗人IL-8单抗,常温孵育2 h,经PBS液3次洗涤、离心后,加入10 μl标记异硫氰光荧光素的羊抗鼠IgG,4℃孵育1 h,经PBS缓冲液洗涤、离心,荧光显微镜下观察两种超声微泡的免疫荧光染色情况。
四、体外细胞寻靶实验
1.损伤心肌细胞模型的制备:体外培养新生大鼠H9c2原代心肌细胞,取对数生长期细胞接种于40个35 mm的培养皿中,每个培养皿接种1×105个心肌细胞。向培养皿中加入高糖培养基,放入无菌培养箱中适应1 h后取出。分为实验组(缺氧、缺糖)和对照组(有氧高糖),实验组再分为A、B组,对照组分为C、D组,每组10个培养皿。其中A、B组加入低糖培养基,C、D组加入高糖培养基,放入无菌培养箱中适应1 h后,将A、B组培养皿放置于氮气的无氧袋中,使心肌细胞在纯氮气袋中缺氧、缺糖6 h后取出。倒置光学显微镜下观察实验组和对照组心肌细胞形态结构的变化。
2.心肌细胞损伤程度分级标准[2]:①正常心肌细胞(-):饱满,呈圆形、梭形及锥形,折光性好;②轻度损伤心肌细胞(+):形态不规则,部分细胞膜破裂,部分可见胞浆颗粒,细胞间偶联破坏,折光性尚可;③重度损伤心肌细胞(++):细胞皱缩,细胞膜破裂,胞浆颗粒增加,细胞间偶联破坏,足突消失,折光性下降。
3.超声微泡与心肌细胞相互作用的观察:实验组缺氧、缺糖损伤6 h后,同时取出4组培养皿,A、C组加入6×109/ml SonoVue微泡100μl,B、D组加入6×109/ml自制的携IL-8单抗靶向超声微泡100 μl;室温静置5 min,使微泡与心肌细胞表面充分接触;再将微泡悬液吸出,PBS缓冲液清洗细胞5次,于倒置光学显微镜下观察各组培养皿中心肌细胞与超声微泡的黏附作用,并随机拍摄图片,每个培养皿5张。统计每张图片中黏附于超声微泡的各型心肌细胞数及各型心肌细胞的总数,计算超声微泡黏附各型心肌细胞数占各型心肌细胞总数的百分比即细胞黏附比。
五、统计学处理
应用SPSS 17.0统计软件,计量资料以x±s表示,实验组和对照组超声微泡与心肌细胞黏附作用比较行独立样本t检验;两种超声微泡与各型心肌细胞的黏附作用与心肌细胞损伤程度的关系采用Spearman线性相关分析。P<0.05为差异有统计学意义。
结 果
一、两种超声微泡基本特性检测及免疫荧光染色检验结果
肉眼观察:所制备的携IL-8单抗靶向超声微泡外观呈均匀的凝乳状混悬液;倒置光学显微镜下观察微泡分布均匀,形态规则,90%以上的自制靶向超声微泡粒径约2~4 μm,微泡间无成簇及聚集现象,与普通SonoVue微泡比较无明显改变。未偶联SonoVue微泡平均浓度为(6.34±0.60)×109/ml,偶联后携 IL-8 单抗靶向超声微泡平均浓度为(6.28±0.53)×109/ml,二者比较差异无统计学意义。免疫荧光染色实验结果显示SonoVue微泡表面未见荧光显现,携IL-8单抗靶向超声微泡表面可见绿色荧光。见图1。
二、实验组和对照组心肌细胞的分布
1.实验组(A、B组):重度损伤心肌细胞约占52%,轻度损伤心肌细胞约占35%,正常心肌细胞约占13%。
2.对照组(C、D组):重度损伤心肌细胞约占2%,轻度损伤心肌细胞约占13%,正常心肌细胞约占85%。

图1 两种超声微泡形态、分布及免疫荧光染色效果图
三、两种微泡对心肌细胞的黏附作用
1.实验组中,A组可见极少量SonoVue微泡黏附于损伤心肌细胞表面(图2);B组可见部分携IL-8单抗靶向超声微泡黏附于轻度损伤心肌细胞表面(图3A),大量携IL-8单抗靶向超声微泡黏附于重度损伤心肌细胞表面(图3B)。
2.对照组中,C组可见极少量SonoVue微泡黏附于正常心肌细胞表面(图4A);D组可见极少量携IL-8单抗靶向超声微泡黏附于正常心肌细胞表面(图4B)。
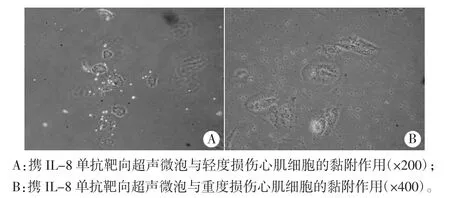
图3 实验B组携IL-8单抗靶向超声微泡与轻度及重度损伤心肌细胞的黏附作用
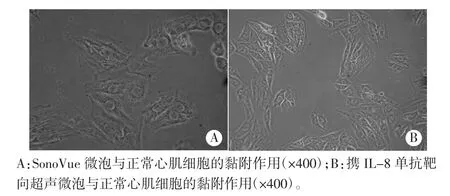
图4 对照组SonoVue及携IL-8单抗靶向超声微泡与正常心肌细胞的黏附作用
四、实验组两种超声微泡与各型心肌细胞黏附作用的定量分析
实验B组携IL-8单抗靶向超声微泡与轻度及重度心肌细胞黏附比明显高于实验A组SonoVue微泡与轻度及重度心肌细胞黏附比,差异均有统计学意义(均 P<0.01),见表 1;且随着损伤程度的加重,携 IL-8单抗靶向超声微泡与心肌细胞的黏附作用逐渐加强(r=0.945,P<0.01)。见图 5。
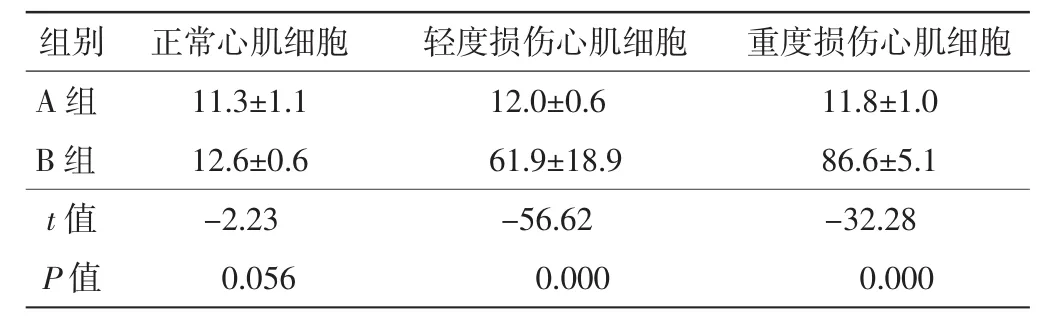
表1 实验组两种超声微泡与各型心肌细胞黏附比比较(x±s) %
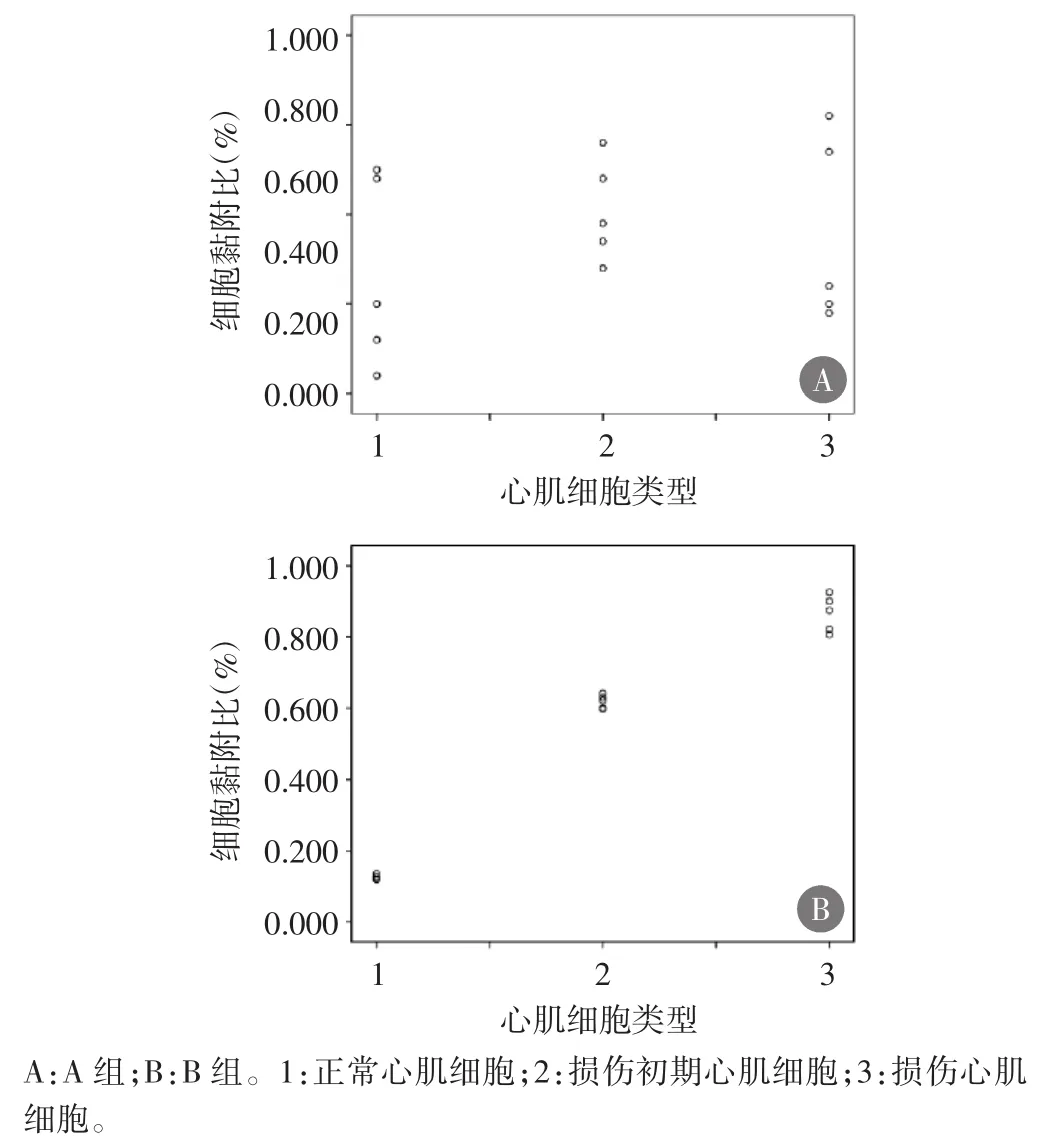
图5 实验组两种微泡与各型心肌细胞黏附比与心肌细胞损伤程度的相关性散点图
讨 论
随着靶向超声造影的发展,其在心血管疾病的诊断价值弥补了CT、MRI及常规超声检查的局限性,为疾病的靶向早期诊断提供了新的手段[3]。“炎症、损伤”已成为心血管领域的一个研究热点,炎症反应可激活中性粒细胞和单核细胞,黏附及吞噬携带相关炎症因子的靶向超声微泡,通过靶向造影发现炎症发生的部位[4]。IL-8是参与AMI重要的炎症因子,具有强有力的趋化性和促炎作用,可介导激活的中性粒细胞黏附和运动[5]。本实验将抗IL-8单抗作为靶向抗体偶联至SonoVue微泡表面,并通过体外实验验证了其良好的靶向作用和超声成像特性,为靶向超声造影早期诊断AMI奠定了基础。
本实验结果表明,经过SPDP交联后,SonoVue微气泡大小、形态及形状无显著改变,即其物理、生物性状未发生改变,可作为造影剂作用于生物体内。羊抗鼠IgG血清作为二抗可以与一抗(鼠抗人IL-8单克隆抗体)发生凝集反应,从而证实微泡中存在鼠抗人IL-8单抗。免疫荧光检验结果显示:自制携IL-8单抗靶向超声微泡混悬液与二抗混合反应后发生了明显的凝集反应,未偶联的Sono Vue微泡无阳性结果,说明IL-8单抗已成功偶联到微泡外壳表面。
本实验采用缺氧、缺糖法建立损伤的心肌细胞模型,H9c2心肌细胞从大鼠胚胎心肌组织分离,生长传代性质稳定,已广泛应用于与心肌细胞相关的实验研究[6]。据文献[7]报道,缺氧诱导 H9c2 心肌细胞,可使IL-8等炎症因子表达水平显著升高。于高倍显微镜下(×400)直接观察普通及自制靶向微泡分别与正常、轻度及重度损伤心肌细胞的结合作用,并通过计数多个高倍视野下黏附微泡的心肌细胞数,对靶向黏附作用进行定量分析、比较。Spearman相关性分析结果显示,携IL-8单抗靶向超声微泡黏附细胞数与心肌细胞损伤程度显著相关(r=0.945,P<0.01),随着心肌细胞损伤程度的加重,携IL-8单抗靶向超声微泡黏附心肌细胞的数量逐渐增加。其原因可能为损伤致使心肌细胞活化分泌IL-8,损伤越重,则分泌的IL-8越多。同时也说明通过缺氧、缺糖处理可成功诱导损伤的心肌细胞分泌IL-8。携IL-8单抗靶向超声微泡与损伤心肌细胞的黏附作用显著高于普通SonoVue微泡(P<0.01),而与正常心肌细胞的黏附作用比较中,两种微泡间无明显差异。由此可见,靶向性超声微泡的特异性及敏感性明显高于普通超声微泡,为进一步的在体实验研究奠定了基础。
综上所述,本实验采用共价偶联法通过SPDP交联剂将IL-8单抗偶联至SonoVue微泡表面,制备出携特异性抗体的超声微泡;且体外实验观察发现其与轻度及重度损伤心肌细胞黏附作用强于普通SonoVue微泡,为靶向超声造影早期诊断AMI奠定了理论基础。
[1] 杨薇,陆永萍,邵庆华,等.IL-8单抗靶向偶联SonoVue微气泡造影剂的方法学研究[J].中国超声医学杂志,2011,27(6):485-488.
[2] Weerasinghe P,Hallock S,Brown RE,et al.A model for cardiomyocyte cell death:insights into mechanisms of oncosis[J].Exp Mol Pathol,2013,94(1):289-300.
[3] 郑海荣,严飞,邓志婷.超声探针是超声分子成像技术的关键[J].中华核医学与分子影像杂志,2013,33(1):1-3.
[4] Lu Y,Wei J,Shao Q,et al.Assessment of atherosclertic plaques in the rabbit abdominal aorta with interleukin-8 monoclonal antibodytargeted ultrasound microbubbles[J].Mol Biol Rep,2013,40(4):3083-3092.
[5] Kukielka GL,Smith CW,LaRosa GJ,et al.Interleukin -8 gene induction in the myocardium after ischemia and reperfusion in vivo[J].J Clin Invest,1995,95(1):89-103.
[6] Park EJ,Lee GH,Yoon C,et al.Biodistribution and toxicity of spherical aluminumoxidenanoparticles[J].JApplToxicol,2016,36(3):424-433.
[7] Yu J,Lu Y,Li Y,et al.Role of S100A1 in hypoxia-induced inflammatory response in cardiomyocytes via TLR4/ROS/NF-κB pathway[J].J Pharm Pharmacol,2015,67(9):1240-1250.
Experimental study on interleukin-8 monoclonal antibody-targeted ultrasound microbubbles targeting to injured cardiomyocytes in vitro
SUN Yue,LI Hongli,WANG Yuxue,YANG Hanning,ZHU Guimin,LU Yongping
Department of Ultrasound,the Fourth Affiliated Hospital of Kunming Medical University,Kunming 650021,China
Objective To prepare interleukin-8 monoclonal antibody-targeted ultrasound microbubbles,determine the basic characteristies,and investigate their adhesion ability to injured cardiomyocytes in vitro.Methods IL-8 monoclonal antibody-targeted ultrasound microbubbles agent was prepared using covalent coupling method,and injured cardiomyocytes were prepared using cellular oxygen/glucose deficiency method.The targeting capacity of the microbubbles agent was assessed by combining targeted ultrasound microbubbles with injured cardiomyocytes in vitro,and the results was compared with SonoVue microbubbles.Results The adhesion ratio of IL-8 monoclonal antibody-targeted ultrasound microbubbles to early injured and injured cardiomyocytes was(61.9±18.9)%and(86.6±5.1)%,respectively.The effect was significantly higher than those of SonoVue microbubbles with the adhesion ratio of(12.0±0.6)%and(11.8±1.0)%,respectively,the difference was statistically significant(P<0.01).With the increase of injury severity,the adhesion of IL-8 monoclonal antibody-targeted ultrasound microbubbles and cardiomyocytes was gradually enhanced(r=0.945,P<0.01).Conclusion IL-8 monoclonal antibody-targeted ultrasound microbubbles has strong targeting performance to injured cardiomyocytes.
Interleukin-8;Targeted;Ultrasound microbubbles;Injured cardiomyocytes
R-33
A
国家自然科学基金项目(81460062、81660084);云南省医学领军人才培养基金项目(L-201616)
650021 昆明市,昆明医科大学第四附属医院云南省第二人民医院超声科
陆永萍,Email:luyongp@163.com
2017-06-21)
