响应面分析法优化莲子心多糖的提取工艺
2017-12-25陈培琳陈钏杰周雨嘉沈瑾烨郑宝东曾红亮
陈培琳, 陈钏杰, 周雨嘉, 沈瑾烨, 张 怡, 郑宝东, 曾红亮
(1.福建农林大学食品科学学院;2.福建农林大学生命科学学院,福建 福州 350002)
响应面分析法优化莲子心多糖的提取工艺
陈培琳1, 陈钏杰1, 周雨嘉1, 沈瑾烨2, 张 怡1, 郑宝东1, 曾红亮1
(1.福建农林大学食品科学学院;2.福建农林大学生命科学学院,福建 福州 350002)
为研究莲子心多糖热水浸提的最佳工艺,在考察浸提温度、浸提时间和液料比对多糖得率影响的基础上,采用响应面分析法对热水浸提工艺进行优化,并对提取前后莲子心粉末和莲子心多糖进行环境扫描电镜观察和红外光谱扫描.结果表明,莲子心多糖最佳的热水浸提工艺条件为:浸提温度92 ℃、浸提时间2.6 h、液料比49∶1(mL∶g),该条件下的多糖得率为(14.49±0.06)%.环境扫描电镜观察结果表明,提取前后的莲子心粉末的细胞结构有明显区别,莲子心多糖呈多孔网状结构.红外光谱扫描结果显示,莲子心多糖主要以呋喃环和α型糖苷键为主.这表明热水浸提法能将多糖较好地从莲子心细胞中提取出来,响应面分析法能较好地应用在莲子心多糖热水浸提工艺的研究中.
莲子心; 多糖; 响应面分析法; 提取工艺
莲子心又名苦薏、名薏、莲心和莲薏,系睡莲水生植物的成熟种子中间的绿色胚根(莲心)[1],湖南、江西、湖北、江苏、福建和浙江等地都有产莲[2].中国四大历史名莲包括浙江宣莲、湖南湘莲、江西广昌白莲和福建建莲,福建建宁有“建莲之乡”的美称.研究表明,莲子心具有多重的营养价值,含有丰富的蛋白质、脂肪、多糖、生物碱、黄酮类物质、β-谷甾醇、棕榈酸、正辛烷酸酯以及铁、镁、钙等微量元素[3-4],具有多种生理活性,如抗溃疡、抗血栓、镇痛,抗腹泻、加强子宫收缩等[5-7].
莲子心多糖为莲子心的主要活性成分之一,目前,对莲子心多糖的研究较少.Liao et al[8]探究纯化后的莲子心多糖的抗炎作用;俞远志等[9]对莲子心多糖的提取纯化、中性单糖的组成及抗氧化活性进行了初步的探究.多糖是极性大分子物质,不易溶于冷水,易溶于热水,不溶于醇、醚和丙酮等有机溶剂.目前,多糖的提取方法有超声波辅助法、微波辅助法、酸碱提取法和热水浸提法等,超声波辅助法和微波辅助法需要特殊的设备,大大增加了提取费用[10-11],且长时间的超声波和微波都会破坏糖链结构,改变其活性,且微波还会导致物料受热不均[12];酸碱提取法则容易降解多糖,不利于后续研究多糖的构效关系[13].刘韶等[14]采用正交试验对莲子心多糖水煎煮工艺进行优化的结果表明,莲子心多糖得率为(3.19±0.17)%.目前多采用沸水提取莲子心多糖,用沸水直接炖煮,所得多糖得率较低,能耗相对较高.寻找对多糖结构影响较小且提取率较高的提取方法至关重要.目前尚未见采用环境扫描电镜分析提取前后莲子心粉末和莲子心多糖的报道.
本试验采用热水浸提法提取莲子心多糖,在考察浸提温度、浸提时间和液料比等3个单因素对多糖得率影响的基础上,通过响应面分析法对热水浸提工艺进行优化,并对提取前后莲子心粉末和莲子心多糖进行环境扫描电镜观察,旨在研究莲子心多糖热水浸提的优化工艺,探索热水浸提方法对莲子心粉末和莲子心多糖微观结构的影响,研究莲子心多糖的红外光谱,为进一步对莲子心多糖的分离纯化、结构表征和功能活性开发提供参考.
1 材料与方法
1.1 材料
莲子心购自福建建宁;无水乙醇等均为国产分析纯试剂;本试验用水为双蒸水.
仪器与设备有RE-2000型旋转蒸发器(上海开迈科学仪器有限公司)、FW100型高速植物粉碎机(尚族机电有限公司)、AR224CN精密分析天平[奥豪斯仪器(常州)有限公司]、TDZ4-WS型台式低速离心机(湖南湘仪实验室仪器开发有限公司)、XL30 ESEM-TMP环境扫描电镜(荷兰Philips-FEI公司)、HH-4型恒温水浴锅(常州国华电器有限公司)、数显电热鼓风恒温干燥箱(上海森信实验仪器有限公司)、LGJ-10D型冷冻干燥机(北京四环科学仪器厂有限公司)、傅里叶红外光谱(美国尼高力公司)和卤素快速水分测定仪(深圳市冠亚电子科技有限公司).
1.2 方法
1.2.1 样品前处理 在50 ℃恒温干燥箱中,将新鲜的莲子心进行烘干处理,用植物粉碎机粉碎后过40目筛,得到莲子心粉末样品.取一定量的莲子心粉末,采用卤素快速水分测定仪测定水分含量,测得莲子心粉末的水分含量小于3%.
1.2.2 提取工艺流程 取一定量的莲子心粉末样品,加入一定比例的双蒸水在一定的温度下浸提,于4 000 r·min-1离心20 min后取上清液.上清液中加入4倍体积的无水乙醇沉降20 h,于4 000 r·min-1离心20 min ,将沉淀用双蒸水溶解减压浓缩后冷冻干燥,称重.
1.2.3 多糖得率的测定 多糖得率/%=多糖质量/样品质量×100.式中,多糖质量:经乙醇醇析,双蒸水溶解减压浓缩冷冻干燥称重得到;样品质量:用于提取的莲子心粉末的质量.
1.2.4 单因素试验 取5.00 g试验样品,以莲子心多糖得率为指标,研究浸提温度、浸提时间和液料比(文中均为mL∶g)对多糖得率的影响.分别选取浸提温度为50、60、70、80、90、100 ℃,浸提时间为0.5、1.0、1.5、2.0、2.5、3.0、3.5 h,液料比为10∶1、20∶1、30∶1、40∶1、50∶1、60∶1、70∶1进行单因素试验(平行试验3次).
1.2.5 响应面试验 在单因素试验的基础上,通过二次回归分析的方法研究浸提温度、浸提时间和液料比对多糖得率的影响.
1.2.6 环境扫描电镜观察 取一定量的提取前后的莲子心粉末和莲子心多糖于样品台上,置真空喷镀仪内镀导电层铂,厚度10 nm,采用扫描电镜观察,电子枪加速电压为15 keV.
1.2.7 红外光谱扫描 取一定量的莲子心多糖粉末研磨后,按1∶(100~200)的比例加入干燥后的溴化钾继续研磨,研磨均匀后,将粉末装入压片磨具中压成薄片,于红外光谱下扫描,扫描波长4 000~400 cm-1,扫描次数32次,分辨率4 cm-1.
1.2.8 数据处理 采用Design-Expert 8.0.6和Spss 13.0软件对试验数据进行分析.
2 结果与分析
2.1 单因素试验结果
2.1.1 浸提温度对莲子心多糖得率的影响 称取5.00 g莲子心粉末,加入150 mL双蒸水,分别在50、60、70、80、90和100 ℃下浸提1 h.结果(图1)显示,浸提温度为50~90 ℃时,莲子心多糖得率随着浸提温度的升高而增大,温度升高到90 ℃后随着温度的升高而减小.这可能是因为随着温度的升高,分子运动速率加快,提取液的粘度降低,多糖的溶解度升高,因此得率升高;当温度升高到90 ℃后,由于多糖被氧化及分子结构受到破坏,导致多糖得率降低[15-16].因此,最适的浸提温度为90 ℃.
2.1.2 浸提时间对莲子心多糖得率的影响 称取5.00 g莲子心粉末,加入150 mL双蒸水,在浸提温度为90 ℃的条件下,分别提取0.5、1.0、1.5、2.0、2.5、3.0和3.5 h.结果(图2)显示:浸提0.5~2.5 h时,莲子心多糖得率随着浸提时间的增加而增大;浸提2.5~3.5 h时,多糖得率随着浸提时间的增加而下降.这可能是因为随着浸提时间的增加,莲子心被破坏的细胞数量增加,释放出的多糖增加,当浸提时间增加到2.5 h后,释放出的多糖被水解,从而导致多糖得率下降[17-18].因此,浸提时间选择2.5 h.

图1 浸提温度对莲子心多糖得率的影响Fig.1 Effect of extraction temperature on the yield of lotus plumula

图3 液料比对莲子心多糖得率的影响Fig.3 Effect of liquid/material ratio on the yield of lotus plumula
2.1.3 液料比对莲子心多糖得率的影响 称取5.00 g莲子心粉末,分别加入50、100、150、200、250、300和350 mL双蒸水,在浸提温度为90 ℃的条件下浸提2.5 h.结果(图3)显示:液料比为(10~50)∶1时,莲子心多糖得率随着液料比的增大而提高;液料比为(50~70)∶1时,多糖得率随着液料比的增大而下降.这可能是因为液料比为(50~70)∶1时,随着液料比的增大,细胞内和细胞外的浓度差不断增大,导致多糖的传质驱动力增大;当液料比继续增大时,由于溶剂渗透到细胞内部的扩散距离增大,导致时间延长,多糖得率下降[19-20].因此,液料比选择50∶1.
2.2 响应面试验结果
根据单因素试验结果,选取浸提温度(A)、浸提时间(B)和液料比(C)为自变量,以多糖得率(Y)为衡量指标,采用Box-Behnken设计3因素3水平,进行响

表1 响应面设计莲子心多糖提取试验的因素和水平表Table 1 Factors and levels of response surface design for polysaccharide extraction from lotus plumula
应面优化试验,各试验因素和水平见表1.
试验设计及结果见表2.表2中,1~12号为析因试验点,13~19号为中心试验点.
2.3 模型的建立以及显著性分析
采用Design-Expert 8.0.6软件分析浸提温度、浸提时间和液料比3个因素对多糖得率的影响,建立二次多元回归模型为:
Y=14.414 3+0.517 5A+0.261 2B-0.093 8C+0.395 0AB+0.185 0AC-0.157 5BC-1.565 9A2-1.413 4B2-0.603 4C2
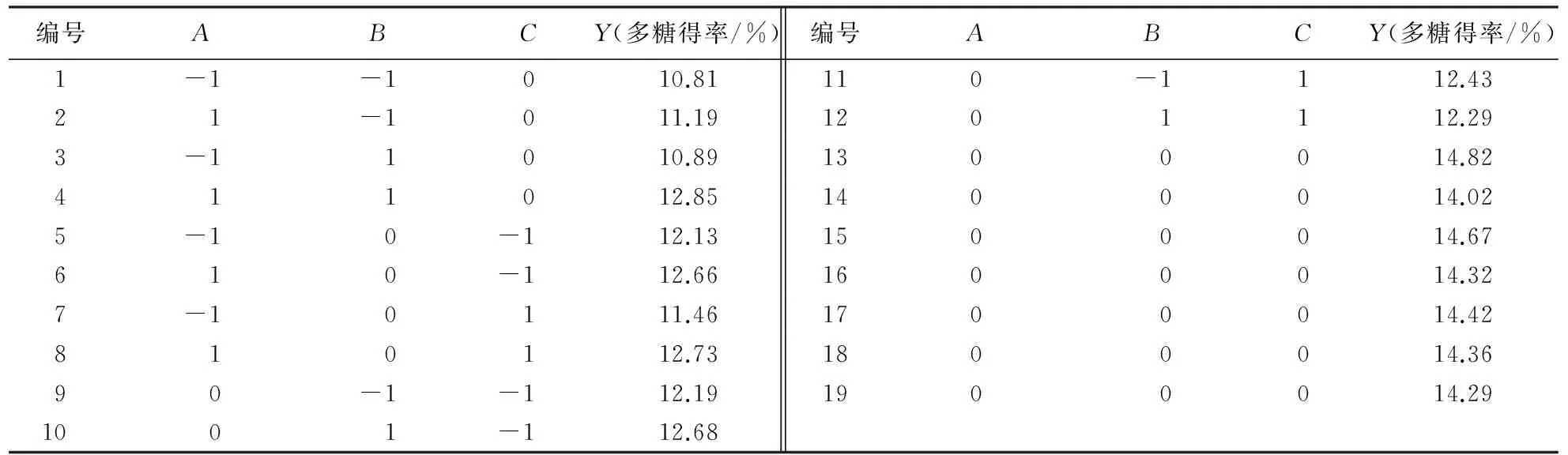
表2 莲子心多糖提取的响应面试验设计和结果Table 2 Response surface experimental design and polysaccharide yield from lotus plumula
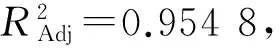

表3 二次回归模型的方差分析结果1)Table 3 Variance analysis of quadratic regression model

2.4 响应面的交互作用
由表3可知,各因素对莲子心多糖得率的影响程度大小为:A>B>C.A、B和C二次项系数均小于零,抛物面开口向下且有极大值点[22].
由图4可知:响应面坡度较陡,说明浸提温度和浸提时间对多糖得率的影响较大;响应面的等高线呈椭圆形,当液料比为50∶1,浸提温度为87~97 ℃,浸提时间为2.25~2.75 h时,多糖得率较高,说明二者的交互作用显著.由图5和6可知,响应面坡度平缓,说明浸提温度与液料比的交互作用、浸提时间与液料比的交互作用不显著.从图4~6可知,各图形直观地反映了各因素的交互作用对多糖得率的影响,这与方差分析的结果一致.
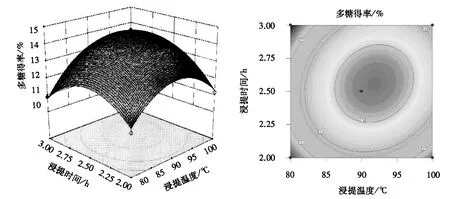
图4 浸提温度与浸提时间的交互作用对莲子心多糖得率影响的响应面和等高线Fig.4 Response surface and contour plot of extraction tempeture and time on the yield of lotus plumula
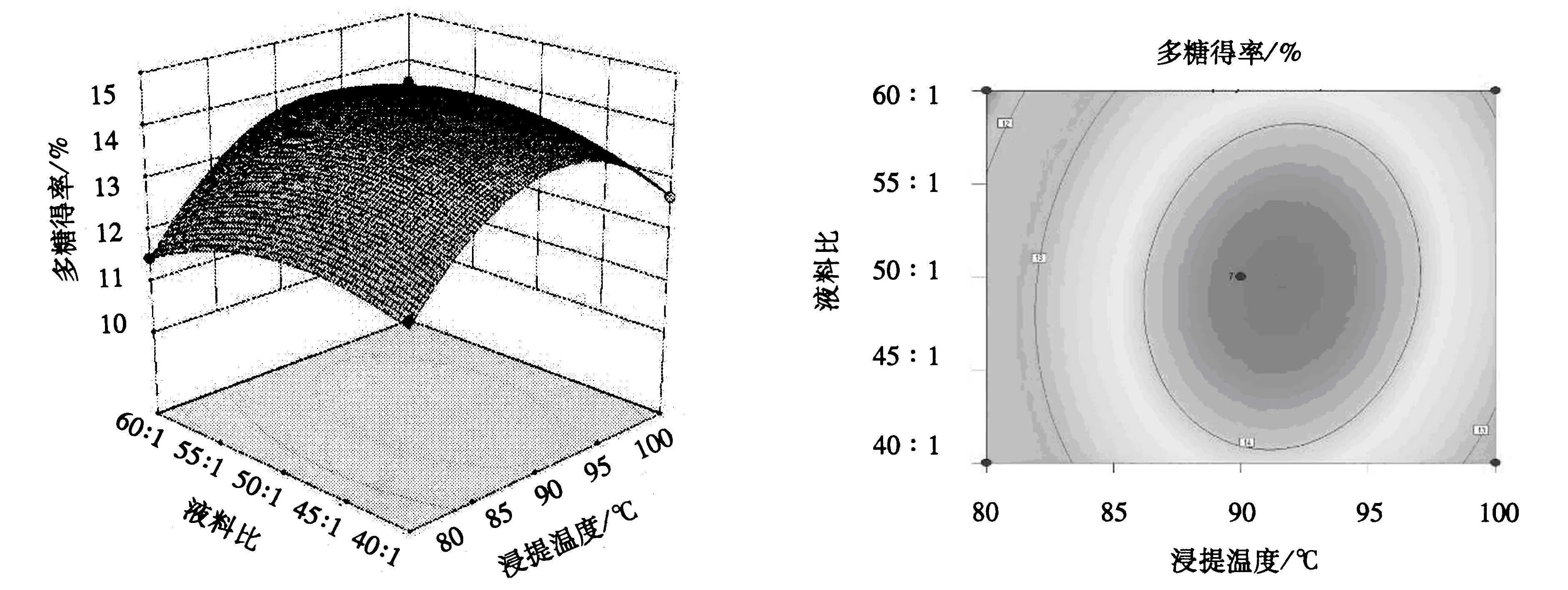
图5 浸提温度与液料比的交互作用对莲子心多糖得率影响的响应面和等高线Fig.5 Response surface and contour plot of extraction tempeture and liquid/material ratio on the yield of lotus plumula
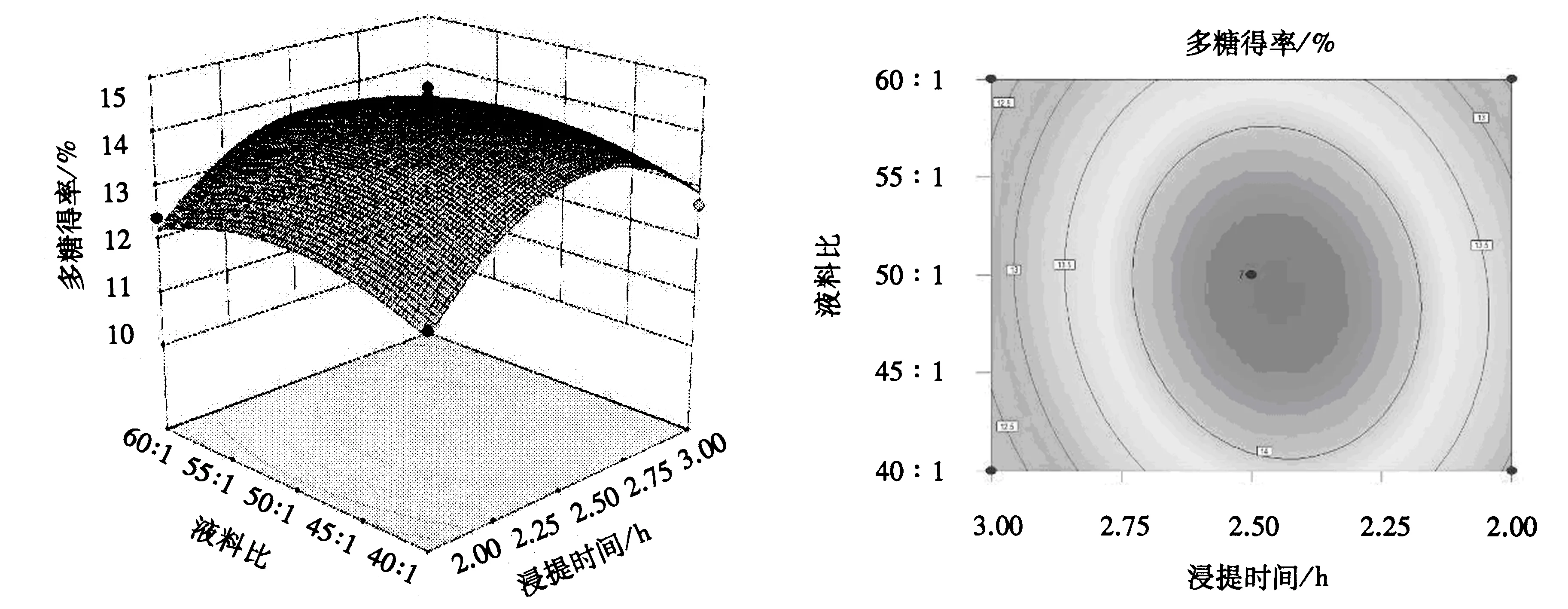
图6 浸提时间与液料比的交互作用对莲子心多糖得率影响的响应面和等高线Fig.6 Response surface and contour plot of extraction time and liquid/material ratio on the yield of lotus plumula
2.5 提取工艺的确定
通过Design-Expert 8.0.6软件分析可得莲子心多糖热水浸提的最佳工艺条件为:浸提温度91.77 ℃、浸提时间2.56 h、液料比49.33∶1,在此条件下,回归模型预测的多糖得率为14.48%.结合实际操作条件的需要,将最佳工艺条件优化为:浸提温度92 ℃、浸提时间2.6 h、液料比49∶1.在该条件下重复试验3次,多糖得率分别为14.43%、14.55%和14.49%,平均值为(14.49±0.06)%,与理论预测值基本一致,说明优化的工艺可行性强,可以用来预测莲子心多糖的得率.
2.6 环境扫描电镜观察

a、b、c分别为1 000、2 000、5 000倍镜下提取前的莲子心粉末;A、B、C分别为1 000、2 000、5 000倍镜下提取后的莲子心粉末.图7 提取前后莲子心粉末的环境扫描电镜图Fig.7 Scanning electron microscope of lotus plumula power
采用环境扫描电镜观察提取前后的莲子心粉末和莲子心多糖的微观形貌结构(图7、8).
从图7可以观察到,热水浸提前,即未经任何处理的莲子心粉末组织呈现出完整的块状和颗粒状,颗粒饱满,无折痕和裂痕,形状不规则,较为复杂[23].热水浸提后,莲子心粉末在1 000倍镜下可以观察到细胞不规则的收缩,其原因可能是:(1)提取时由于细胞内外的浓度差引起的细胞吸水及在加热的条件下细胞表面受热发生扭曲的共同作用,细胞涨破,细胞的内容物被释放出来,出现不规则褶皱,使细胞发生溃陷[24];(2)植物细胞壁是一种植物细胞初生壁,由纤维素、半纤维素、果胶以及一些蛋白质等以不同的比例结合在一起构成的,部分细胞还具有的次生壁以及在相邻两个植物细胞之间起连接作用的胞间层[25],O—糖苷键是由部分镶嵌着的包间层上可能为蛋白质的蛋白质残基上的羟基与纤维素,半纤维素和果胶大量碳水化合物结合而成[26],在长时间的水和热的作用下,O—糖苷键断裂,使细胞壁破裂,细胞的内容物释放出来;(3)在细胞壁的中间层,起支撑与连接作用的成分可能是蛋白质[27],在较高温度和水的作用下,蛋白质之间的相互作用,从而发生扭曲变构,彼此靠近凝集,细胞壁破裂,从而将细胞的内容物释放出来;(4)在较高的温度下破坏了细胞膜的完整性,致使细胞膜内的有效成分被溶剂提取[28].在2 000和5 000倍镜下可以更清楚地观察到细胞皱缩的程度及细胞壁保持的状态,细胞壁没有出现裂痕.

A、B、C分别为100、2000、5000倍镜下的莲子心多糖.图8 莲子心多糖的扫描电镜图Fig.8 Scanning electron microscope of lotus plumula
图8显示:在100倍镜下可以粗略地观察到多糖呈块状结构;在2 000倍镜下可以明显看到多糖呈连绵的山峰状和蜂窝状.产生连绵的山峰状的原因可能是由于多糖分子存在一定的聚集体,从而导致其规整性不强;而呈现蜂窝状的原因可能是因为多糖分子链间形成细微网络的多孔结构,且蜂窝状表面较紧密、平整,有较多的暗纹出现,表明多糖分子存在聚集体,此状态可能是由于提取时在大量的水和长时间热的作用下,大量多糖分子或分子基团聚集成不同式样的束所形成的.此外,多糖分子间存在大量不规则的交叉网络结构,表明多糖分子存在分支结构且分子间的相互作用较强[29].而在5 000倍镜下,虽然能更清楚看到连绵的山峰状和蜂窝状结构,但连绵的山峰状结构中有少量裂痕出现,说明多糖聚集体之间相互存在排斥力,分子间的作用力不够强.
2.7 红外光谱扫描
莲子心多糖红外光谱(图9)显示,扫描波长为4 000~400 cm-1时都有多糖的特征峰.3 431 cm-1处有糖分子内或分子间—OH的振动峰;2 928 cm-1处有—CH2—中C—H的伸缩振动峰和弯曲振动峰,存在一定的甲基和亚甲基结构;1 650 cm-1处有COO—的非对称伸缩振动峰;1 543 cm-1处有C—C骨架振动峰;1 448 cm-1处有COO—的对称伸缩振动峰;1 390 cm-1处有C—H的弯曲振动峰;1 010~1 100 cm-1处有1 083和1 048 cm-1两个吸收峰,为呋喃环;845 cm-1有吸收峰.表明莲子心多糖主要以α型糖苷键为主.

图9 莲子心多糖的红外光谱Fig.9 FT-IR spectra of lotus plumula
3 结论
莲子心多糖最佳的热水浸提工艺条件为:浸提温度92 ℃、浸提时间2.6 h、液料比49∶1,该条件下的多糖得率为(14.49±0.06)%,相比刘韶等[14]采用水煎煮法提取莲子心多糖,得率提高了354%.
环境扫描电镜观察显示:提取前后的莲子心细胞结构有明显的区别,表明热水浸提法能较好地将多糖从莲子心细胞中浸提出来,得到的多糖呈多孔网状结构;多糖存在结构聚集行为.红外光谱扫描显示,莲子心多糖主要以呋喃环和α型糖苷键为主.从多糖得率和微观结构两个方面探索提取方法对莲子心多糖的影响,可为莲子心多糖构效关系的研究提供参考.
[1] 季爱民,车瓯,徐峰,等.莲子心超临界CO2萃取物化学成分分析[J].中国药业,2006,15(2):31-32.
[2] ZHANG Y, ZENG H, WANG Y, et al. Structural characteristics and crystalline properties of lotus seed resistant starch and its prebiotic effects [J]. Food Chemistry, 2014,114(19):311-318.
[3] 曾建伟,吴锦忠,张书娟.莲子心药学研究进展[J].福建中医学院学报,2005,15(增刊):40-42.
[4] LIN J Y, LAI Y S, LIU C J, et al. Effects of lotus plumule supplementation before and following systemic administration of lipopolysaccharide on the splenocyte responses of BALB/c mice [J]. Food & Chemical Toxicology, 2007,45(3):486-493.
[5] 何锦婷,虞舜.莲子心的现代临床应用[J].长春中医药大学学报,2012,28(3):544-546.
[6] LIAO C H, LIN J Y. Purification, partial characterization and anti-inflammatory characteristics of lotus (NelumbonuciferaGaertn) plumule polysaccharides [J]. Food Chemistry, 2012,135(3):1 818-1 827.
[7] DONG Z X, ZHAO X, GU D F, et al. Comparative effects of liensinine and neferine on the human ether-a-go-go-related gene potassium channel and pharmacological activity analysis [J]. Cellular Physiology & Biochemistry, 2012,29(3-4):431-442.
[8] LIAO C H, LIN J Y. Purified active lotus plumule (NelumbonuciferaGaertn) polysaccharides exert anti-inflammatory activity through decreasing toll-like receptor-2 and -4 expressions using mouse primary splenocytes [J]. Journal of Ethnopharmacology, 2013,147(1):164-173.
[9] 俞远志,吴亚林,潘远江.莲子心多糖的提取、分离和抗氧化活性研究[J].浙江大学学报(理学版),2008,35(1):48-51.
[10] RUTHES A C, SMIDERLE F R, IACOMINI M. D-glucans from edible mushrooms: a review on the extraction, purification and chemical characterization approaches [J]. Carbohydrate Polymers, 2015,117:753-761.
[11] 刘颖,梁盈,林亲录,等.南瓜多糖的提取及其抗氧化活性研究进展[J].食品与机械,2014(3):239-243.
[12] KAMALJIT V, RAYMOND M, LLOYD S, et al. Applications and opportunities for ultrasound assisted extraction in the food industry—A review [J]. Innovative Food Science & Emerging Technologies, 2008,9(2):161-169.
[13] WANG Z B, PEI J J, MA H L, et al. Effect of extraction media on preliminary characterizations and antioxidant activities ofPhellinuslinteuspolysaccharides [J]. Carbohydrate Polymers, 2014,109:49-55.
[14] 刘韶,雷鹏,李新中,等.莲心多糖的提取工艺研究[J].中药材,2006,29(10):1 102-1 104.
[15] CHEN R, LI Y, DONG H, et al. Optimization of ultrasonic extraction process of polysaccharides fromOrnithogalumcaudatumAit and evaluation of its biological activities [J]. Ultrasonics Sonochemistry, 2012,19(6):1 160-1 168.
[16] 李敏杰,熊亚,韩何波.白灵菇多糖提取工艺优化[J].食品与机械,2014,30(5):225-228.
[17] ZHAO Z Y, ZHANG Q, LI Y F, et al. Optimization of ultrasound extraction ofAlismaorientalispolysaccharides by response surface methodology and their antioxidant activities [J]. Carbohydrate Polymers, 2015,119:101-109.
[18] 刘冬,叶红玲,李萍,等.沙门柏干酪青霉多糖提取工艺优化及其抗冻伤活性研究[J].食品与机械,2016,32(12):179-183.
[19] RAZA A, FENG L, XU X, et al. Optimization of ultrasonic-assisted extraction of antioxidant polysaccharides from the stem ofTrapaquadrispinosausing response surface methodology [J]. International Journal of Biological Macromolecules, 2016,94:335-344.
[20] 刘萍,祁兴普,刘靖,等.芋头多糖提取工艺优化及其体外结合脂类和胆酸盐能力研究[J].食品与机械,2016,32(10):132-136.
[21] 任佳丽,黄仁贵,李忠海.零余子粗多糖超声波辅助提取工艺优化[J].食品与机械,2016,32(9):149-153.
[22] 曾红亮,黄灿灿,常青,等.金柑多糖微波辅助提取工艺优化及抑菌效果[J].食品与机械,2016,32(9):154-160.
[23] 赵玉红,党媛,王振宇.提取方法对黑木耳多糖提取效果的影响[J].安徽农业科学,2014,42(30):10 664-10 668.
[24] 薛芳,颜瑞,王承明.超声辅助碱提取花生多糖的研究[J].食品科学,2008,29(8):158-163.
[25] 路倩倩.植物细胞壁的研究进展[J].农业与技术,2015,35(24):35-40.
[26] FUJII T, SHIMOI H, LIMURA Y. Structure of the glucan-binding sugar chain of Tip1p, a cell wall protein ofSaccharomycescerevisiae[J]. Biochimica et Biophysica Acta, 1999,1427(2):133-144.
[27] 傅海庆.桑黄多糖的研究进展[J].包装与食品机械,2008,26(5):32-36.
[28] 任涛.桑黄多糖研究[D].长春:吉林大学,2009.
[29] 曾红亮.金柑多糖结构表征及降血脂机理的研究[D].福州:福建农林大学,2015.
Optimizationofextractiontechnologyofpolysaccharidesfromlotusplumulabyresponsesurfacemethodology
CHEN Peilin1, CHEN Chuanjie1, ZHOU Yujia1, SHEN Jinye2, ZHANG Yi1, ZHENG Baodong1, ZENG Hongliang1
(1.College of Food Science; 2.College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
In order to investigate hot water extraction technology for extracting polysaccharides from lotus plumula, effects of extraction temperature, time, ratio of water volumn to raw material weight (liquid/material ratio) on the yield of polysaccharides were evaluated by response surface methodology. Moreover, microstructure of lotus powder before or after extraction were examined by environmental scanning electron microscope and lotus plumula was detected by infrared spectrum scanning. The results showed that the optimum extraction condition was to extract lotus plumula at 92 ℃ for 2.6 h under liquid/material ratio of 50∶1 (mL∶g). Under this condition, the yield of polysaccharides was up to (14.49±0.06)%, which was consistent with the predicted theoretical value. Environmental scanning electron microscope showed that lotus powder was very different from it before extraction. Also polysaccharide molecules aggregated and formed a porous network structure along with the extraction. Infrared spectrum scanning showed that polysaccharide of lotus seed was mainly composed of furan ring and alpha glycosidic bond, proving that polysaccharide was fully released from cell membrane after a long period of water immersion and thermal effect. Furthermore, response surface methodology was a potential method for optimizing extraction technology of lotus plumula.
lotus plumula; polysaccharides; response surface methodology; extraction technology
2017-07-31
2017-10-18
福建省科技创新领军人才项目(KRC16002A);福建省高等学校科技创新团队支持计划项目(闽教科[2012]03号);福建农林大学杰出青年科研人才计划项目(XJQ201714);福建农林大学发展基金项目(KFA17197A).
陈培琳(1994-),男,硕士研究生.研究方向:食品营养与化学.Email:634856574@qq.com.通讯作者曾红亮(1986-),男,硕士生导师.研究方向:食品营养与化学.Email:zhlfst@163.com.
TS255.1
A
1671-5470(2017)06-0708-08
10.13323/j.cnki.j.fafu(nat.sci.).2017.06.018
(责任编辑:施晓棠)
