鄂西红豆树种子的无菌萌发
2017-12-25何官榕张文春何碧珠冯丽贞兰思仁
何官榕, 张文春, 何碧珠, 冯丽贞, 兰思仁
(1.福建农林大学植物保护学院;2.福建农林大学园林学院;3.福建农林大学园艺学院,福建 福州 350002)
鄂西红豆树种子的无菌萌发
何官榕1, 张文春2, 何碧珠3, 冯丽贞2, 兰思仁2
(1.福建农林大学植物保护学院;2.福建农林大学园林学院;3.福建农林大学园艺学院,福建 福州 350002)
以成熟度为70%、100%的鄂西红豆树种子为外植体,研究不同消毒时间对不同成熟度种子无菌萌发的影响,并探讨浸种温度、种子破壳方式、种脐放置方式对100%成熟度种子无菌萌发的影响,旨在探讨鄂西红豆树种子萌发的最佳处理方式.结果表明:70%成熟度种子的萌发率为70.38%,100%成熟度种子的萌发率为68.52%,即尚未完全成熟的种子萌发率更高;成熟度70%、100%种子的最佳消毒时间均为12 min;100%成熟度种子在25 ℃恒温下浸种22 h,萌发效果最佳,萌发率达81.67%;100%成熟度种子在种脐处剪口破壳1/10,且种脐平放、种子露出培养基表面2/3的处理最佳,萌发率高达93.19%.
鄂西红豆树; 种子; 无菌萌发; 成熟度
鄂西红豆树(OrmosiahosieiHemsl. et Wils.)别名红豆树、乌樟丝、江阴红豆、何氏红豆,属豆科红豆属常绿或落叶乔木.鄂西红豆树胸径可达1 m,树冠挺拔,是优良的绿化与应用树种;心材栗褐色有光泽、坚硬耐腐朽、结构紧致、纹理美观,是雕刻工艺及高档装饰家具的上等优良用材[1];种子圆润、鲜红、腊质有光泽,常用于做手链等装饰品.陈艳伟[2]研究表明,红豆树种子除了含有蛋白质、脂肪、多糖等化合物外,还含有苷类、类黄酮和有机酸等物质,根和种子均可入药,主治眼疾、腹痛、闭经等.鄂西红豆树自然存量少、生长缓慢,受自然繁衍能力差、传播能力不强等生理特性的限制以及种子坚硬,种皮呈腊质状、透水性差,自然条件下自身萌发率极度低下等因素的影响[3],若没有进行人工处理1~2年仍不萌发.鄂西红豆树种群小,自然分布区域受限,主要分布在安徽、江苏、江西、福建等省区,在福建一般散生在海拔500 m以下的山谷林内、山坡、村庄沟河旁的区域[4-5].因此,加强珍稀树种鄂西红豆树的保护和繁育是该资源保存和推广应用的关键.
本试验采用成熟度分别为70%、100%的鄂西红豆树种子为外植体进行无菌萌发研究,旨在提高结实期种子的使用率,从而获得大量无性繁殖种苗,为鄂西红豆树规模化生产提供技术支持.
1 材料与方法
1.1 材料
鄂西红豆荚果采自福建福州北峰九峰村,选取当年结实,成熟度分别为70%、100%的荚果.成熟度为70%的荚果于11—12月采集,剥开荚果,种子的种皮呈淡米黄色略带红色斑点(图1A);成熟度为100%的荚果于翌年3—4月采集,荚果颗粒饱满、色泽均匀、无病虫害,此时的荚果外壳已完全成熟并开裂,露出种皮为鲜酱红色的种子(图1B).荚果采摘后用湿纱布包裹带回实验室,置4 ℃冰箱中保存备用.
培养基:以MS为基本培养基,添加1 mg·L-16-BA、0.5 mg·L-1KT、0.3 mg·L-1NAA、1.0 g·L-1活性炭、7.5 g·L-1琼脂、20 g·L-1蔗糖,pH为5.8.

A:成熟度70%;B:成熟度100%.图1 不同成熟度的鄂西红豆树种子Fig.1 Red bean with different maturity
1.2 试验设计
1.2.1 不同成熟度外植体的不同消毒时间处理 选取成熟度分别为70%、100%的荚果,用洗衣粉漂洗干净后剥开荚果,取出荚果内的种子置于流水下冲滴0.5~1 h,再用蒸馏水冲洗2~3次后置超净工作台上,用75%酒精消毒30 s,无菌水冲洗2~3次,用0.1%升汞对种子分别消毒8、10、12、14、16 min(废汞倒入棕色瓶中进行统一无害回收处理)后,无菌水冲洗3~4次,用无菌滤纸吸干种子表面的水分,待用.将消毒过的种子接种到培养基(MS基本培养基+1 mg·L-16-BA+0.5 mg·L-1KT+0.3 mg·L-1NAA+1.0 g·L-1活性炭+7.5 g·L-1琼脂+20 g·L-1蔗糖,pH为5.8)中.
试验于2016年11月22日和2017年3月7日分别对成熟度为70%和100%的种子进行接种,设5个消毒时间(8、10、12、14、16 min)处理,每个处理接种30瓶,每瓶接入2粒种子,试验重复3次.种子在(23±2) ℃下暗培养15 d后移至光照度逐渐递增的条件(0~2 000 lx)下培养,光照时间8 h·d-1.分别记录不同成熟度第一粒种子从接种到萌发所需时间及相应的消毒时间,并定期观察记录种子萌发和污染情况,接种30 d后统计萌发率,以探究不同消毒时间对不同成熟度种子无菌萌发的影响.
1.2.2 100%成熟度种子的不同恒温浸种处理 清洗后的100%成熟度种子采用恒温浸种,即用常温蒸馏水没过容器中的种子,再分别置于温度为25、35、45、55 ℃的恒温培养箱中浸泡22 h后取出,用蒸馏水冲洗3~4次后,置超净工作台用75%酒精消毒30 s,无菌水冲洗1~2次,再用0.1%升汞消毒12 min,无菌水冲洗3~4次,用无菌滤纸吸干种子表面的水分,待用.
将消毒过的种子接种到培养基(MS基本培养基+1 mg·L-16-BA+0.5 mg·L-1KT+0.3 mg·L-1NAA+1.0 g·L-1活性炭+7.5 g·L-1琼脂+20 g·L-1蔗糖,pH 5.8)中,每个处理接种30瓶,每瓶2粒,试验重复3次.种子在(23±2) ℃下暗培养15 d后移至光照度逐渐递增的条件(0~2 000 lx)下培养,光照时间8 h·d-1.记录第一粒种子萌发的处理温度并定期观察种子的萌发情况,30 d后统计萌发率,以探究不同恒温处理对种子无菌萌发的影响.
1.2.3 100%成熟度种子的不同破壳方式、种脐放置方式的处理 清洗后的100%成熟度种子设4个破壳方式处理,分别为A1(种子不破壳)、A2(种脐处剪口破壳1/10)、A3(种脐处剪口破壳1/2)、A4(种子全破壳)处理.每个处理的种子均浸泡在常温蒸馏水中,置25 ℃恒温培养箱中处理22 h后取出,用蒸馏水冲洗2~3次,待用.
将种子置于超净工作台上用75%酒精消毒30 s,无菌水冲洗2~3次,0.1%升汞消毒12 min,无菌水冲洗2~3次,用无菌滤纸吸干种子表面的水分后待用.用镊子将消毒过的种子接种至培养基(MS基本培养基+1.0 g·L-1活性炭+7.5 g·L-1琼脂+20 g·L-1蔗糖,pH 5.8)中.接种时对不同破壳方式的种子设3个种脐放置方式的处理,分别为B1(种脐朝上)、B2(种脐平放)、B3(种脐朝下)处理,3种处理的种子均露出培养基2/3.
表1中的12个处理分别接种10瓶,每瓶接种2粒种子,试验重复3次.种子在(23±2) ℃下暗培养15 d后移至光照度逐渐递增的条件(0~2 000 lx)下培养,光照时间8 h·d-1.定期观察种子的萌发情况,接种60 d后统计萌发率,以探究种子不同破壳方式、种脐放置方式对无菌萌发的影响.

表1 种子不同破壳方式及种脐不同放置方式的处理Table 1 Seed with different husk breaking method and umbilical incision placement
1.3 指标测定
接种后定期观察每一处理,分别记录种子的萌发情况和污染情况,统计萌发率,以胚根有明显的露白作为种子萌发的标志.萌发率/%=每组种子的萌发数/每组种子的接种数×100;污染率/%=每组种子的污染数/每组种子的接种数×100.
1.4 数据分析
数据以平均数±标准差表示,采用DPS 7.5软件对数据进行分析,采用Duncan新复极差法进行多重比较.
2 结果与分析
2.1 消毒时间对不同成熟度种子无菌萌发的影响
表2显示,不同成熟度种子采用不同消毒时间处理,萌发率存在显著差异,表明消毒时间对种子的无菌萌发具有一定的影响.70%、100%成熟度种子的萌发率均随着消毒时间的增加呈先增大后减小的趋势.当消毒时间从8 min增加到12 min时,萌发率均明显提高;消毒时间相同时,70%成熟度种子的萌发率均高于100%成熟度种子;消毒时间为12 min时,70%、100%成熟度种子的萌发率达到最高,分别为70.38%、68.52%,消毒效果最显著.消毒时间从12 min增加到16 min时,70%成熟度种子的萌发率均低于100%成熟度种子,且70%成熟度种子的萌发率递减趋势明显,消毒16 min时,萌发率锐减至38.48%,消毒效果差,表明消毒时间过长,可能对种子的内部结构造成伤害;消毒时间为16 min时,100%成熟度种子的萌发率减少趋势小,萌发率为60.21%,消毒效果比70%成熟度种子好.可见,成熟度高的种子可以进行较长时间的消毒,而成熟度低的种子由于未发育完全,种子生物活性被破坏,导致萌发率低,污染率增大.
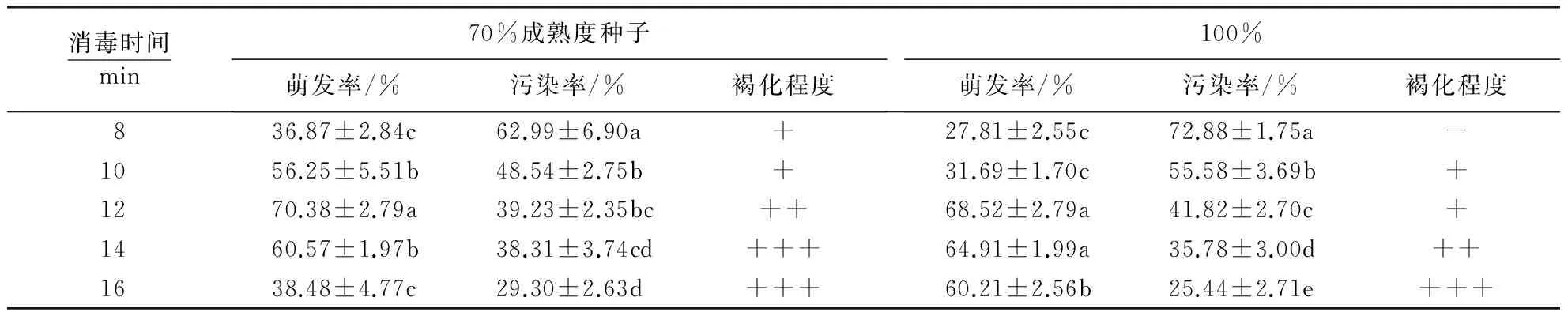
表2 消毒时间对不同成熟度种子无菌萌发的影响1)Table 2 Effect of disinfection time on germination rate of seed with different maturity
1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05);+++表示褐化程度严重;++表示褐化程度一般;+表示褐化程度较轻;-表示褐化程度轻.
不同成熟度种子污染率的变化趋势与萌发率不同.消毒时间短会导致消毒不彻底,污染率增大;随着消毒时间的增加,两种成熟度种子的污染率均呈递减的趋势,但褐化程度随着消毒时间的增加而增大.随着消毒时间的增加,杀菌能力增强,但对种子的伤害也逐渐增大.70%成熟度种子的褐化程度更大,与其酶活性增强有关.当消毒时间为16 min时,70%、100%成熟度种子的污染率均达到最低值,分别为29.30%、25.44%,褐化程度均最为严重.对于100%成熟度种子而言,各消毒时间处理的污染率差异显著;对于70%成熟度种子而言,消毒时间为10和12 min、12和14 min、14和16 min的污染率差异不显著,但消毒时间为14和16 min时,种子褐化程度较10和12 min严重.可见,消毒时间过短或过长均不利于种子的无菌萌发;消毒时间为12 min时,种子萌发状态最好,无死亡,萌发率最高(图2A、2B).

A:70%成熟度种子;B:100%成熟度种子.图2 不同成熟度种子消毒12 min芽的生长情况Fig.2 Growth status of bud with different maturity disinfected for 12 min
2.2 不同恒温浸种处理对种子无菌萌发影响
本试验中,接种后第一粒种子萌发的处理温度为35 ℃.表3显示,不同恒温处理对种子萌发率的影响差异显著.接种30 d后,随着浸种温度的升高,种子的萌发率逐渐降低.当种子在25 ℃恒温下浸种22 h时,无菌萌发效果最好,萌发率达到81.67%,芽长4.46 cm,生长状态最好;当种子在35 ℃恒温下浸种22 h时,萌发效果较好,萌发率为63.33%,芽长2.47 cm;当种子在45 ℃恒温下浸种22 h时,萌发效果一般,萌发率为46.67%,芽长1.70 cm;当种子在55 ℃恒温下浸种22 h时,萌发效果最差,萌发率为0%,但种子还有生命迹象.可见,种子在25~45 ℃恒温下浸种,均能促进种子萌发,但在55 ℃恒温下种子不萌发.在35 ℃、45 ℃恒温下浸种,芽长无显著差异,但35 ℃恒温处理的芽最先萌发,生长状态也优于45 ℃恒温处理.不同恒温浸种处理的种子萌发时间不一致,25 ℃恒温处理的种子整体生长状态最好(图3A).
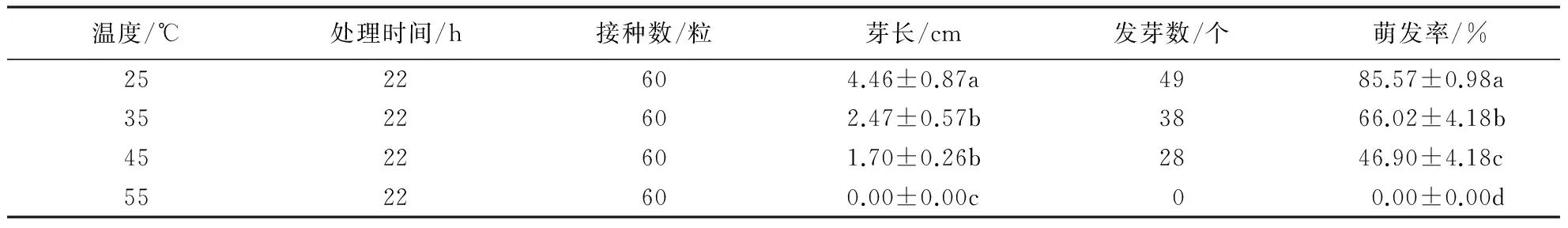
表3 不同恒温浸种处理对种子无菌萌发的影响1)Table 3 Effect of immersion temperature on seed germination rate
1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).

A:25 ℃恒温浸种22 h处理;B:种脐处剪口破壳1/10、种脐平放且种子露出培养基2/3的处理.图3 100%成熟度种子不同处理芽的生长情况Fig.3 Growth status of 100% matured seed under different treatments
2.3 种子破壳方式、种脐放置方式对种子无菌萌发的影响
表4显示,种子破壳方式、种脐放置方式对种子无菌萌发的影响显著,种子萌发时间不一致.种子破壳方式相同时,种脐平放的萌发率最高,其他依次为种脐朝下放置、种脐朝上放置;种脐放置方式相同时,种脐处剪口破壳1/10处理的萌发率最高,其他依次为种脐处剪口破壳1/2、种子不破壳、种子全破壳.其中,A2B2处理的萌发率高达93.19%,萌发效果最好,芽、叶的生长状态最佳.种子萌发率从高到低的处理依次为A2B2、A2B3、A3B2、A1B2、A2B1、A3B3、A3B1、A1B3、A1B1、A4B2、A4B3、A4B1.A4B1处理的萌发率为0%,种子无萌发趋势,但有生命迹象.A2B2、A2B3、A3B2处理的萌发率差异不显著,但A2B2处理芽、叶的生长状态最佳;A2B3处理的萌发率为85.35%,低于A2B2处理,这可能由种脐朝下放置完全接触到培养基,而培养基湿度大,水分含量多导致.A1B2、A2B1、A3B3处理的萌发率差异不显著,但A3B3处理芽、叶的生长状态最好,其次为A1B2处理,A3B3处理最差,这可能由种脐朝上放置,不能与培养基直接接触,种子萌发没有得到充分的养分导致.全破壳处理的种子,无论种脐如何放置,萌发率都极低,这可能是因为种皮复杂的成分影响种子的萌发.可见,种脐处剪口破壳1/10与种脐平放的组合处理,种子的萌发效果最佳,芽、叶的生长状态最好(图3B),这是由于种子剪口小,升汞残留少的缘故.

表4 种子不同破壳方式、种脐不同放置方式对无菌萌发的影响1)Table 4 Effect of seed husk breaking method and umbilical incision placement on sterile germination rate
1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
3 讨论
3.1 外植体的选择
汪秋[6]研究表明,种子的成熟度越高,储藏的营养物质越多,种子发育越完全,但成熟度高的种子虽然发育完全,由于受到种皮腊质状及进入休眠状态的影响,导致萌发率低下.种皮的透水性、种子的成熟度和休眠期是限制种子发芽的三大因素[5].鄂西红豆树种子坚硬,种皮表面富有凹凸不平的鳞片状腊质,导致种皮透水性差,不易萌发,具有明显的休眠现象.本试验结果与汪秋[6]的研究结果相符.鄂西红豆树完全成熟的种子受坚硬的种皮和休眠状态的影响,萌发迟缓,萌发率较70%成熟度种子低;70%成熟度种子处于黄熟前期,种皮薄,生活力和酶活性强.王元裕等[7]认为,双子叶植物未成熟的幼胚为正常的胚胎发育、胚体提供了充足的活性营养体.通过合理的培养基成分配比并选择适当的成熟期,能够迅速诱导种子萌发形成幼苗.但接种后发现70%成熟度种子的褐化现象更严重,在种子萌发前5~10 d转接一次可有效抑制褐化程度.相似的,范辉华等[8]以鄂西红豆树幼枝顶端带芽的茎段为外植体,萌发率为58.33%,比老枝萌发率提高了42.54%;崔秋华[9]对齿瓣石斛组织快繁的研究中也得出了相似的结论.崔秋华[9]以6~7、8~9、10~12个月胚龄的齿瓣石斛种子为外植体,发现种子的最佳萌发胚龄为8~9个月,此胚龄的种子成苗快,污染少.李江等[10]研究表明,不同成熟度的种子,其活力存在显著性差异,种子的采集时间对种子萌发率有显著影响.本试验中,鄂西红豆树成熟度为70%的荚果于11—12月采摘,成熟度为100%的荚果于翌年3—4月采摘.
郑天汉等[11]认为,鄂西红豆树树体高大,荚果大多挂在树冠顶部,宜在12月上中旬用竹竿敲击果枝,使种子震落,此时获得的种子完全成熟,其采摘时间与本试验不一致,这与不同地区、不同海拔,种子成熟时期不同有关.本试验在采摘荚果的过程中,发现完全成熟的种子易被鸟食、虫蛀,出现霉变、褐化、种脐变黑、败育等现象.
因此,生产上应根据实际情况适时采种.何碧珠等[12]以成熟度为80%的鄂西红豆树种子为外植体,萌芽率达75%~85%.可见,成熟度为70%~80%的种子能有效提高无菌萌发率.对未成熟的种子进行诱导萌发,打破传统的繁育概念,对于珍贵树种的繁育尤为重要,能有效促进鄂西红豆树种苗的规模化繁育生产.
3.2 消毒时间的选择
由于种子在无菌萌发的过程中受种皮、消毒时间、消毒剂类型等因素的影响,使种子萌发率低或不能萌发[13-14].本试验结果表明,鄂西红豆树种子的无菌萌发率受消毒时间的影响而参差不齐.熊海浪等[15]认为,外植体进行消毒时必须权衡两个重要因素,即外植体染菌和活性保持,消毒时间过长会伤及种子内的胚芽,诱导率极低,处理时间过短,则种子污染率高,此结果与本试验结果一致.本试验结果表明,70%成熟度种子的消毒时间不宜过长.乔栋等[16]认为,幼嫩种子生长时间不长,杂物、细菌等附着物较少,较容易灭菌.吕冰[17]研究不同消毒时间对海杧果嫩叶、茎段成活率的影响,发现消毒时间长短对外植体成活率的影响极显著,消毒时间过长会导致外植体褐变而死亡.本试验综合考虑萌发率、污染率和褐化程度3个指标,认为成熟度为70%、100%的鄂西红豆树种子最适宜的消毒时间为12 min.
3.3 浸种温度的选择
王玉峰[18]认为,适宜的浸种温度能促进种子吸水、种皮软化,加强酶促反应,消除种子中的萌发抑制物质,从而促进种子萌发.鄂西红豆树种子坚硬,种皮腊质状导致透水性差,自然条件下的萌发率极低.因此,本试验对种子进行不同恒温浸种处理,研究种子适宜的浸种温度.结果表明,鄂西红豆树种子在25 ℃恒温下浸种,萌发率最高;而王运昌等[3]认为,高温浸泡红豆树种子会破坏、溶解表皮腊质类物质,使种皮通透性增强,随着浸种水温的升高,种子的萌发率也提高,此结果与本试验结果不同,可能是因为不同种类种子中的相关酶活性的最适温度不同,从而导致最适萌发温度差异较大[19].
3.4 种子破壳方式、种脐放置方式的选择
有些消毒剂的毒性较大或难以去除,对外植体具有毒害作用.如常用的升汞会在外植体上残留,影响外植体的存活,还严重污染环境[20-21].种子剪口破壳范围越大,升汞残留越多,接种时细菌感染的面积也越大,从而影响种子的萌发.因此,需要用无菌水多次冲洗以减少升汞残留.石江华等[22]认为,植物根系的向地性对养分吸收很重要,介质中养分的有效性对根系的向地性同样具有十分重要的调节作用.种脐朝上放置(种子露出培养基2/3),未能直接接触培养基,胚根吸收不到足够的营养物质,无法突破种皮得以萌发.张艳杰等[20]研究表明,红豆杉的种皮、胚乳均含有发芽抑制物质,种胚和种皮的甲醛浸提物均能抑制种子萌发.本试验结果表明:在种脐处剪口破壳1/10且接种时种脐平放在培养基上,种子萌动快;种子全破壳、不破壳且种脐朝放置,种子萌动慢、生长参差不齐甚至不萌动.
4 结论
鄂西红豆树成熟种子在消毒12 min,且在25 ℃恒温下浸种22 h的基础上,将种脐处剪口破壳1/10,接种时种脐平放在培养基上培养(种子露出培养基2/3),70%成熟度种子的萌发率可达70.38%.
[1] 谢世波.鄂西红豆古树、初果树种子不同水温处理发芽对比试验[J].防护林科技,2016(8):53-54.
[2] 陈艳伟.红豆树与木荚红豆种子生物学特性及贮藏生理生态[D].贵阳:贵州大学,2016.
[3] 王运昌,陈聪,王德州,等.不同催芽方式对红豆树种子萌发的影响[J].林业与环境科学,2015,31(3):65-68.
[4] 汤良智.鄂西红豆树育苗技术及苗高生长规律研究[J].福建林业科技,2013(3):128-130.
[5] 郑天汉,汤文彪,陈清根,等.红豆树开花结实规律及种子发芽试验[J].林业工程学报,2006,20(6):38-41.
[6] 汪秋.不同成熟度和不同处理对合欢种子萌发率的影响[J].大观周刊,2012(2):99.
[7] 王元裕,周碧英,高士贤,等.柑桔胚培养技术的研究——Ⅱ、多胚性品种未熟幼胚的早期离体培养[J].园艺学报,1981(1):13-18.
[8] 范辉华,李朝晖,张蕊,等.红豆树的组织培养技术[J].福建林业科技,2011,38(3):100-102.
[9] 崔秋华.齿瓣石斛快繁研究[D].北京:中国林业科学研究院,2012.
[10] 李江,邵登魁,李莉,等.超干贮藏对不同成熟度鸡腿葱种子发芽活力的影响[J].北方园艺,2013,9(11):1-5.
[11] 郑天汉,兰思仁,江希钿.红豆树研究[M].北京:中国林业出版社,2013:5-6.
[12] 何碧珠,郜祥雄,彭东辉,等.鄂西红豆离体培养及植株再生研究[J].西北农林科技大学学报(自然科学版),2015,43(12):49-57.
[13] 莫良玉,吴良欢,陶勤南.植物有机营养研究中供试种子组合灭菌方法比较[J].浙江大学学报(农业与生命科学版),2000,26(6):643-646.
[14] 朱艳蕾,安登第,曾献春.银沙槐种子表面消毒技术及无菌萌发条件研究[J].新疆师范大学学报(自然科学版),2014,33(3):17-20.
[15] 熊海浪,易继财,张宗申.滇重楼种子萌发及组织培养研究[J].广东农业科学,2011(21):47-49.
[16] 乔栋,韦小丽,李群.珍稀树种花榈木组培不同外植体的无菌繁殖体系构建[J].西南农业学报,2016,29(7):1 719-1 723.
[17] 吕冰.海杧果繁殖及混交技术的研究[D].海口:海南师范大学,2014.
[18] 王玉峰.温度对植物种子萌发机制的影响[J].防护林科技,2015(6):76-78.
[19] 刘小金,徐大平,杨曾奖,等.温度对越南黄花梨种子萌发的影响[J].林业科学研究,2014(5):707-709.
[20] 张艳杰,鲁顺保,高捍东.南方红豆杉种子不同溶剂提取液对白菜种子萌发及幼苗生长的化感效应[J].中国农学通报,2010,26(9):190-194.
[21] 林妃,李敬阳,常胜合,等.花梨木组织培养外植体消毒方法初步探讨[J].基因组学与应用生物学,2013,32(4):522-525.
[22] 石江华,廖红,严小龙.植物根系向地性感应的分子机理与养分吸收[J].植物学通报,2005(5):13-21.
AsepticgerminationofOrmosiahosiei
HE Guanrong1, ZHANG Wenchun2, HE Bizhu3, Feng Lizhen2, LAN Siren2
(1.College of Plant Protection; 2.College of Landscape; 3.College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
To investigate the optimum germination method forOrmosiahosiei,O.hosieiwith 70% and 100% maturity were disinfected for different durations, also effects of soaking temperature, seed husk breaking method and umbilical incision placement were investigated. The results showed that germination rate was 70.38% when seed was 70% matured while it was 68.52% for fully matured seed. Disinfecting for 12 min was the best for seed of both maturity stages. Germination rate was increased to 81.67% when seed was soaked under 25 ℃ for 22 h. And germination rate was maximized at 93.19% when hilum was 1/10 exposed and laid falt, and 2/3 above the substrate.
Ormosiahosiei; pod seeds; sterile germination; grade of maturity
2017-08-05
2017-09-20
中央财政林业科技推广示范项目(闽[2015]TG18);财政厅补助项目(K8112014A).
何官榕(1965-),男,实验师.研究方向:植物生物技术及资源保存.Email:823028661@qq.com.通讯作者兰思仁(1963-),男,教授,博士生导师,博士.研究方向:园林植物资源.Email:lsr9636@163.com.
S722.3+7
A
1671-5470(2017)06-0623-07
10.13323/j.cnki.j.fafu(nat.sci.).2017.06.005
(责任编辑:施晓棠)
