鲢鱼鱼皮蛋白肽的制备与抗氧化活性评价
2017-12-25宋思佳刘怀高罗永康
宋思佳, 吕 健, 刘怀高, 罗永康
(1中国农业大学食品科学与营养工程学院,北京,100083;2国肽生物科技(北京)有限公司,北京,100011)
鲢鱼鱼皮蛋白肽的制备与抗氧化活性评价
宋思佳1, 吕 健1, 刘怀高2, 罗永康1
(1中国农业大学食品科学与营养工程学院,北京,100083;2国肽生物科技(北京)有限公司,北京,100011)
为制备抗氧化活性良好的鲢鱼鱼皮蛋白肽,采用胰蛋白酶、碱性蛋白酶、菠萝蛋白酶和木瓜蛋白酶等4种常见的商业酶对鲢鱼鱼皮进行酶解,测定酶解物的ABTS自由基清除力和Fe2+螯合力来评价其抗氧化活性,并用超滤及凝胶层析对酶解物进行分离,以期得到活性更好的酶解物分离组分。酶解后产物的抗氧化活性均有所提高,其中碱性蛋白酶酶解2 h产物活性较强。对此酶解物用截留分子量为10 kDa、5 kDa和3 kDa的中空纤维超滤膜进行超滤,得到的4个组分中,分子量越小的组分抗氧化活性越强。分子量小于3 kDa的组分经Sephadex G-15凝胶层析得到3个组分,其中分子量最大的组分活性较好,在0.51 mg/mL质量浓度下测定其ABTS自由基清除率和Fe2+螯合力分别为(79.65±0.87)%和(93.40±0.20)%。该研究成果对鲢鱼鱼皮抗氧化肽的开发具有较好的指导作用。
鲢鱼鱼皮;酶解;抗氧化活性;超滤;凝胶层析
抗氧化剂研究对人体健康和食物品质保持具有重要意义[1-3]。合成抗氧化剂活性强,但存在一定的副作用,如丁基羟基苯甲醚(BHA)会诱导DNA损伤[4],威胁人体健康,寻找安全有效的天然抗氧化剂已成为研究热点。国内外大量研究表明,鱼皮蛋白可以作为一种良好的活性肽来源,具有包括抗氧化活性在内的多种生物活性。如酶解绿鳍马面鲀鱼皮,其产物具有较好的DPPH·、HO·和O2-·清除能力[5];用碱性蛋白酶和风味蛋白酶酶解史氏鲟鱼皮,酶解物可作为抗氧化剂和冷冻保护剂加入绞碎的鱼肉中[6];酶解斑鱵皮胶原蛋白,发现酶解物兼具较好的抗氧化、抗菌及血管紧张素转化酶(ACE)抑制活性[7]。
鲢鱼(Hypophthalmichthysmolitrix)是我国主要养殖淡水鱼之一,2016年全国养殖产量达450万 t,位居淡水鱼类产量第二[8]。因缺乏有效的加工利用手段,其加工过程中会产生大量鱼皮下脚料,如果不加以利用会造成资源浪费[9]。用鲢鱼鱼皮生产生物活性肽,不仅可提高鱼皮的经济价值,还能在一定程度上减少资源浪费与环境污染。本文以鲢鱼鱼皮为原料制备抗氧化活性肽。选用碱性蛋白酶、菠萝蛋白酶、木瓜蛋白酶、胰蛋白酶4种来源与酶学特性均不同的商业蛋白酶进行酶解,测定酶解物的ABTS自由基清除力及Fe2+螯合力,分析抗氧化活性与蛋白酶种类及酶解时间的关系,挑选出活性较佳的酶解物,用超滤及凝胶层析技术对其进行分离纯化,以期得到活性更强的分离组分,为鲢鱼鱼皮的综合利用提供参考。
1 材料与方法
1.1 材料与试剂
鲢鱼鱼皮由武汉梁子湖水产品加工有限公司提供,胰蛋白酶来自丹麦诺维信公司,Alcalase 2.4 L、木瓜蛋白酶、菠萝蛋白酶来自南宁庞博生物工程有限公司,2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、菲咯嗪来自美国Sigma公司,其余化学试剂均为国产分析纯。
1.2 仪器与设备
仪器设备包括:TGL-16A冷冻离心机(长沙平凡仪器仪表有限公司),FE-20 pH计(上海梅特勒-托利多仪器有限公司),FD-1PF冷冻干燥机(北京德天佑科技发展有限公司),UNICO-2800A紫外-可见分光光度计(尤尼柯(上海)仪器有限公司),CLW-002中空纤维超滤膜组件、3 kDa超滤膜、5 kDa超滤膜、10 kDa超滤膜(北京旭邦膜设备有限公司),BS-100A自动部分收集器、HL-2B恒流泵(上海青浦沪西仪器厂),Sephadex G-15(美国Pharmacia公司),Waters 600高效液相色谱、Waters 2707自动进样器、XBridge C18高效液相色谱分析柱(美国Waters公司)。
1.3 方法
1.3.1 鲢鱼鱼皮酶解物制备
冷冻鱼皮在室温下流水解冻,去除残留鱼鳞及鱼肉并剪碎,鱼皮按1∶4(质量/体积,w/V)加入去离子水,在90℃下加热20 min对鲢鱼鱼皮内源酶进行灭活,用匀浆机2 000 r/min 均质1 min,制得匀浆液。将匀浆液加热至各蛋白酶的最适作用温度,用2 mol/L NaOH和1 mol/L HCl调节至各蛋白酶的最适pH,按5 000 U/g蛋白比例加入菠萝蛋白酶、碱性蛋白酶、木瓜蛋白酶和胰蛋白酶,酶活参考国家标准GB/T 23527—2009[10]测定,结果见表1。各蛋白酶的酶解物均在0.25 h、0.5 h、1 h、2 h、3 h、4 h这6个时间点取样,快速取样后再在90℃下加热20 min灭酶,5 000 g离心20 min后吸除上层油脂,取其余上清液进行冷冻干燥,得到酶解物冻干粉。
表1选用蛋白酶的最适作用条件及酶活力
Tab.1 The optimum conditions and enzyme activity for the selected proteases

蛋白酶种类酶活实测值kU/g温度/℃pH菠萝蛋白酶180506.5碱性蛋白酶500507.5木瓜蛋白酶320556.5胰蛋白酶890507.5
1.3.2 鲢鱼鱼皮酶解物抗氧化活性测定
(1)酶解物ABTS自由基清除力测定。参照相关方法[11]并略作修改,将2.45 mmol/L K2S2O8溶液和7 mmol/L ABTS溶液1∶1等体积混合,室温下避光放置12~16 h制得ABTS反应液,用0.2 mol/L pH 7.4的磷酸盐缓冲液将0.8 mL的ABTS反应液稀释到734 nm下、吸光值0.68~0.72备用。配置5 mg/mL的酶解物溶液,取0.04 mL与4 mL ABTS反应液混合均匀,常温避光反应1 h,测定其在734 nm下的吸光值,用去离子水做空白对照,根据以下公式计算酶解物ABTS自由基清除能力:
B= (1-A/C)×100
(1)
式中:B—ABTS自由基清除率,%;A—酶解物样品在734 nm下的吸光值;C—空白对照在734 nm下的吸光值。
(2)酶解物Fe2+螯合力测定。根据Siu等[12]的方法,配置5 mg/mL的鲢鱼鱼皮酶解物样品溶液,将1 mL样品溶液与3.7 mL无水乙醇和0.1 mL 2 mmol/L FeCl2溶液均匀混合后,加入0.2 mL 5 mmol/L的菲咯嗪溶液,室温下反应10 min,测定反应液在562 nm下的吸光值,用去离子水做空白对照,根据以下公式计算酶解物Fe2+螯合力:
F= (1-D/E)×100
(2)
式中:F—Fe2+螯合力,%;D—酶解物样品在562 nm下的吸光值;E—空白对照在562 nm下的吸光值。
1.2.3 鲢鱼鱼皮酶解物的分离纯化
(1)酶解物超滤分离。参考Power等[13]的方法,采用中空纤维膜超滤设备对抗氧化活性最佳的酶解产物初步分离,所用超滤膜的截留分子量分别为3 kDa、5 kDa和10 kDa,超滤过程中酶解物浓度30 mg/mL,流速1.2 mL/min,得到分子量大小不同的4个组分:F1(分子量>10 kDa)、F2(10 kDa>分子量>5 kDa)、F3(5 kDa>分子量>3 kDa)和F4(分子量<3 kDa)。测定超滤后组分的ABTS自由基清除力及Fe2+螯合力,对活性强的组分进行继续分离。
(2)Sephadex G-15凝胶层析分离。选用Sephadex G-15凝胶层析对超滤得到的小于3 kDa组分作进一步分离,参考舒一梅等[14]的方法对凝胶填料粉进行预处理,用去离子水将超滤后活性最强组分配置成10 mg/mL溶液,经0.45 μm滤膜过滤,进样6 mL,以去离子水为洗脱液,流速1 mL/min,在280 nm下检测样品的吸光值,用收集器收集得到的组分,并测定其ABTS自由基活性。
1.4 数据处理
所有实验数据均是重复测定3次得到,用平均值±标准差来表示,采用SAS 9.0软件进行显著性分析,Excel 2016软件绘制数据图。
2 结果与分析
2.1 蛋白酶种类及酶解时间对ABTS自由基清除力的影响
清除ABTS自由基能力和Fe2+螯合力是常用的体外评价物质抗氧化活性的指标[15]。如图1所示,4种蛋白酶在各自最适条件下酶解鲢鱼鱼皮蛋白4 h。结果表明,酶解产物ABTS自由基清除能力均随着酶解时间的延长而增大,在前1 h内快速增长,2~4 h内仍在增大只是增长幅度变小。在整个酶解过程中,碱性蛋白酶水解产物的ABTS自由基清除能力一直高于其他蛋白酶酶解产物(P<0.05)。蔡路昀等[16]用碱性蛋白酶酶解草鱼鱼皮2 h所得的产物也具有较好的ABTS自由基清除能力。碱性蛋白酶酶解4 h后产物的ABTS自由基清除能力最强,为(28.70±0.23)%。
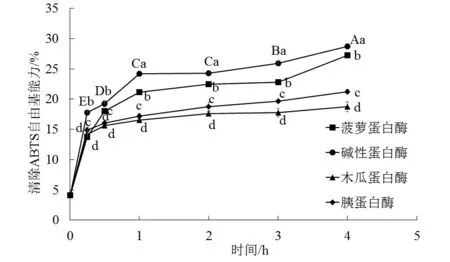
图1 酶解时间对鲢鱼鱼皮蛋白酶解产物 清除ABTS 自由基的影响
Fig.1 Effects of hydrolysis time on ABTS free radical-scavenging activity of the hypophthalmichthys molitrix skin protein hydrolysate
2.2 蛋白酶种类及酶解时间对Fe2+螯合力的影响
如图2所示,Fe2+螯合力较酶解前均显著增大,在0~1 h内快速增长,1 h后菠萝蛋白酶酶解物Fe2+螯合力仍在增加,但增幅不及之前,其他蛋白酶解物在1 h后活性基本不变,胰蛋白酶酶解物的Fe2+螯合力显著高于其他酶解物(P<0.05)。Wu等[17]用胰蛋白酶对太平洋鳕鱼皮明胶进行酶解,分离得到3个活性较好的Fe2+螯合肽,并发现均与Fe2+1∶1结合。本研究中,虽然胰蛋白酶酶解物的Fe2+螯合力最大,为(89.77±0.61)%,但碱性蛋白酶酶解物的ABTS自由基清除力和Fe2+螯合力均较高,综合这两项指标,考虑选择碱性蛋白酶酶解2 h产物进行下一步超滤分离实验,其水解度为(21.79±0.08)%,也显著高于其他蛋白酶酶解物(P<0.05)。Klompong等[18]用碱性蛋白酶酶解黄斑纹鲹鱼肉蛋白,得出酶解物抗氧化活性与其水解度相关,与本研究结果一致。水解度较大的碱性蛋白酶解产物与其它3种蛋白酶解物相比,抗氧化活性更强,这可能是由于经蛋白酶切割后,水解度大的酶解物中暴露出肽链中抗氧化氨基酸侧链及产生抗氧化氨基酸序列的几率更大。
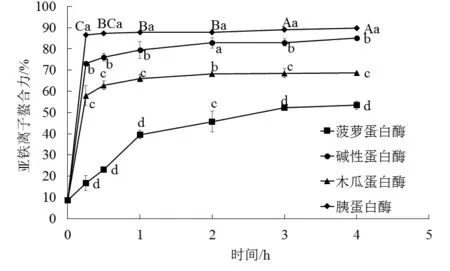
图2 酶解时间对鲢鱼鱼皮蛋白酶解产物 亚铁离子螯合力的影响
Fig.2 Effects of hydrolysis time on ferrous ion-chelating activity of the hypophthalmichthys molitrix skin protein hydrolysate
2.3 超滤分离及组分的抗氧化活性测定
碱性蛋白酶酶解2 h后产物经中空纤维膜超滤分离得到分子量大小不同的4个组分。各组分清除ABTS自由基能力排序如下:F4>F3>F2>F1,差异显著(P<0.05)(图3A)。其中,碱性蛋白酶酶解2 h后产物与F3组分的无显著性差异(P>0.05)。Chueng等[19]研究鳕鱼酶解物超滤后产物的ABTS自由基清除力也得到了相同的趋势,说明多肽组分的分子量大小对其ABTS清除力具有重要影响。超滤前酶解物与超滤后得到的4个组分Fe2+螯合力均大于80%,按Fe2+螯合力排序:F4>F2>酶解产物>F1,差异显著(P<0.05),F2与F3组分的Fe2+螯合力差异不显著(P>0.05)(图3B)。此结果表明,肽段分子量大小影响其抗氧化活性,分子量越小的组分,其ABTS自由基清除能力及Fe2+螯合力越强,因此选择组分F4进行后续的凝胶层析分离。郑捷等[20]对不同分子量真鲷鱼骨多肽抗氧化活性的研究也得到了类似的结果,分子量越小的超滤组分,其各项抗氧化指标均越强。

图3 酶解产物及其超滤后4个组分清除ABTS自由基能力(A),亚铁离子螯合力(B)
Fig.3 ABTS radical scavenging activity ( A) and ferrous ion-chelating activity ( B) of hypophthalmichthys molitrix skin protein hydrolysate and the four ultrafiltration fractions
2.4 Sephadex G-15凝胶层析分离及其组分的抗氧化活性测定
凝胶层析过程中大分子物质先被洗脱出来,小分子在后[21]。组分F4经凝胶层析分离后得到的3个组分按洗脱时间由短到长分别是F4-1、F4-2、F4-3,其分子量大小关系则为:F4-1>F4-2>F4-3。测定结果如图4所示。清除ABTS自由基能力大小排序为:F4-1>F4-2>F4-3(P< 0.05),F4-3的Fe2+螯合力显著高于F4-1和F4-2(P<0.05),分别为(94.92±0.32)%、(93.40±0.74)%和(93.15±0.10)%,但F4-1和F4-2无显著性差异(P>0.05)。F4-1的Fe2+螯合力仅比F4-3低不到2%,而ABTS自由基清除力几乎是F3的两倍。综合两个指标来看,凝胶层析所得组分的抗氧化活性较好的组分是F4-1。活性最佳组分并非分子量最小组分,说明多肽的生物活性并不全由分子量大小决定,可能还需考虑肽的氨基酸组成与排列,以及重要氨基酸的位置[22]。

图4 凝胶层析图谱(A)及凝胶层析后3个组分清除ABTS自由基能力(B)和亚铁离子螯合力(C)
Fig.4 The gel chromatography atlas( A) ,and the ABTS radical scavenging activity ( B) , and ferrous ion-chelating activity ( C) of the 3 fractions from the gel filtration
3 结论
用菠萝蛋白酶、木瓜蛋白酶、碱性蛋白酶和胰蛋白酶对鲢鱼鱼皮蛋白进行酶解,得到的产物抗氧化活性较未酶解鱼皮蛋白均有所提高。其中,碱性蛋白酶解2 h产物的抗氧化活性相对较强,在质量浓度为5 mg/mL条件下测得ABTS自由基清除率为(28.70±0.23)%,Fe2+螯合力为(85.03±0.67)%。采用中空纤维超滤设备对其进行超滤分离,得到的组分分子量越小,抗氧化活性越强,即分子量小于3 kDa的组分F4的清除ABTS自由基能力及亚铁离子螯合力均为最强,分子量大于10 kDa的组分F1各项活性均为最差。最后将F4经凝胶层析继续分离,得到抗氧化活性较强的组分F4-1,在0.51 mg/mL的浓度下测定其ABTS自由基清除率和Fe2+螯合力分别为(79.65±0.87)%和(93.40±0.20)%。研究表明,鲢鱼鱼皮蛋白是一种良好的抗氧化肽来源,利用超滤及凝胶层析技术分离能得到活性更好的组分,但该组分中性肽序列鉴定还需要进行进一步的研究。
□
[1] FRANSEN M,NORDGREN M,WANG B,et al. Role of peroxisomes in ROS/RNS-metabolism: implications for human disease[J]. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease,2012,1822(9): 1363-1373.
[2] PRYOR W A. Free radical biology: xenobiotics,cancer,and aging[J]. Annals of the New York Academy of Sciences,1982,393(1): 1-22.
[3] NAJAFIAN L,BABJI A S. A review of fish-derived antioxidant and antimicrobial peptides: their production,assessment,and applications[J]. Peptides,2012,33(1): 178-185.
[4] SILA A,BOUGATEF A. Antioxidant peptides from marine by-products: Isolation,identification and application in food systems. A review[J]. Journal of Functional Foods,2016,21: 10-26.
[5] CHI C F,WANG B,HU F Y,et al. Purification and identification of three novel antioxidant peptides from protein hydrolysate of bluefin leatherjacket (Navodonseptentrionalis) skin[J]. Food Research International,2015,73: 124-129.
[6] NIKOO M,BENJAKUL S,XU X. Antioxidant and cryoprotective effects of Amur sturgeon skin gelatin hydrolysate in unwashed fish mince[J]. Food Chemistry,2015,181: 295-303.
[7] ABDELHEDI O,NASRI R,MORA L,et al. Collagenous proteins from black-barred halfbeak skin as a source of gelatin and bioactive peptides[J]. Food Hydrocolloids,2017,70: 123-133.
[8] 农业部渔业局.中国渔业统计年鉴[M]. 北京:中国农业出版社,2017: 25.
[9] 张强,王倩倩,陆剑锋,等.不同方法提取鲢鱼皮胶原蛋白的理化特性比较[J]. 现代食品科技,2014(5): 104-110.
[10] GB/T 23527-2009.蛋白酶制剂[S].
[11] JING C L,DONG X F,TONG J M. Optimization of Ultrasonic-Assisted Extraction of Flavonoid Compounds and Antioxidants from Alfalfa Using Response Surface Method[J]. Molecules,2015,20(9): 15550-15571.
[12] SIU K C,CHEN X,WU J Y. Constituents actually responsible for the antioxidant activity of crude polysaccharides isolated from mushrooms[J]. Journal of Functional Foods,2014,11(21): 548-556.
[13] POWER O,FERNNDEZ A,NORRIS R,et al. Selective enrichment of bioactive properties during ultrafiltration of a tryptic digest of β-lactoglobulin[J]. Journal of Functional Foods,2014,9:38-47.
[14] 舒一梅,李诚,付刚,等.凝胶层析法分离猪股骨降血压肽及其体外稳定性[J]. 食品科学,2014,35(24): 100-104.
[16] 蔡路昀,冷利萍,李秀霞,等.草鱼鱼皮不同分子量肽段体外抗氧化性能的研究[J]. 食品工业科技,2017(12): 58-64.
[17] WU W,LI B,HOU H,ZHANG H,ZHAO X,et al. Identification of iron-chelating peptides from Pacific cod skin gelatin and the possible binding mode[J]. Journal of Functional Foods,2017(35): 418-427.
[18] KLOMPONG V,BENJAKUL S,KANTACHOTE D,et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroidesleptolepis) as influenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry,2007,102(4):1317-1327.
[19] CHEUNG I W Y,CHEUNG L K Y,TAN N Y,et al. The role of molecular size in antioxidant activity of peptide fractions from Pacific hake (Merlucciusproductus) hydrolysates[J]. Food Chemistry,2012,134(3): 1297-1306.
[20] 郑捷,李素,胡爱军,等.不同分子量真鲷鱼骨多肽抗氧化活性的研究[J]. 食品工业科技,2014,35(2):108-111.
[21] 鲁战会,李里特,张泽俊,等. 凝胶层析法及其在米面类制品研究开发中的应用[J]. 食品科学,2004,25(S1): 145-148.
[22] 苏海玲,韩涛.多肽生物活性与其结构的关系[J]. 中国食物与营养,2012,18(6): 21-25.
PreparationofHypophthalmichthysmolitrixskinproteinpeptidesandtheevaluationoftheantioxidantactivity
SONGSijia1,LUVJian1,LIUHuaigao2,LUOYongkang1
1CollegeofFoodScienceandNutritionalEngineering,ChinaAgriculturalUniversity,Beijing100083,China;2GuotaiBiotechnology(Beijing)Co.,Ltd.,Beijing100011,China)
In order to prepare theHypophthalmichthysmolitrixskin peptides with good antioxidant activity,theHypophthalmichthysmolitrixskin was hydrolyzed by using of the four common commercial enzymes,namely,trypsin,Alcalase 2.4L,bromelain and papain;ABTS radical scavenging activity and ferrous ion-chelating activity were determined;and the hydrolyzates were separated by ultrafiltration and gel chromatography to obtain better hydrolyzate separation fractions. The results showed that the antioxidant activity of the protein hydrolysate increased,among which the antioxidant activity of the protein hydrolysate after a 2-hour enzymolysis had a stronger antioxidant activity. An ultrafiltration was carried out to the hollow fiber ultrafiltration membranes with the cut-off molecular weight of 10 kDa,5 kDa and 3 kDa. Among the 4 fractions after the ultrafiltration,the smaller the molecular weight was,the stronger the antioxidant activity was. The fraction with a molecular weight less than 3 kDa was separated into 3 sub-fractions by Sephadex G-15 gel chromatography,among which the larger the molecular weight was,the stronger the antioxidant activity was,whose ABTS radical scavenging ability (79.65±0.87)% and Fe2+chelating capacity (93.40±0.20)% were determined at the concentration of 0.51 mg/mL. This study provided a theoretical reference for the exploitation and utilization of antioxidant peptides fromHypophthalmichthysmolitrixskin.
Hypophthalmichthysmolitrixskin;enzymatic hydrolysis;antioxidant activity;ultrafiltration;gel chromatography
10.3969/j.issn.1007-9580.2017.06.007
2017-09-19
国家重点研发计划(No. 2017YFD0400200);农业部现代农业产业技术体系项目(大宗淡水鱼类)(CARS-45)
宋思佳(1995—),女,硕士研究生,研究方向:水产生物活性肽。E-mail: songsijia2@cau.edu.cn
罗永康(1963—),男,教授,博士生导师,研究方向:水产品加工技术。E-mail:luoyongkang@cau.edu.cn
TS254.9
A
1007-9580(2017)06-037-06
