换水率和密度对刺参生长和水质的影响
2017-12-25王光玉姜佳惠
王光玉, 姜佳惠, 祝 楠, 陈 雷
(哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209)
换水率和密度对刺参生长和水质的影响
王光玉, 姜佳惠, 祝 楠, 陈 雷
(哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209)
为探究日换水率(0、10%、20%、30%和100%)和养殖密度[0.980±0.008、1.760±0.005、2.810±0.007和(3.640±0.006) kg/m3]对刺参(Apostichopusjaponicus)生长率和养殖水质的影响,养殖试验首先在非循环水养殖条件下,测定各组刺参综合特定生长率(ISGR)及养殖水体中氨氮及亚硝酸盐氮质量浓度。结果显示,日换水率为10%和20%处理组的ISGR分别达到每天(1.330±0.161)%和(1.410±0.182)%,显著高于其他处理组;密度养殖试验证明,随着养殖密度的增加,ISGR逐渐降低,分别达到每天(0.610±0.500)%,(0.570±0.030)%,(0.560±0.045)% 和(0.320±0.040)%,各组换水率及养殖密度组水体中氨氮及亚硝酸盐氮均在安全浓度范围内波动;养殖结果显示,循环水养殖试验组刺参的ISGR高于非循环水养殖组,可达(0.130±0.007)%,且氨氮及亚硝酸盐氮质量浓度在0.020 mg/L以下,而非循环水养殖的分别积累到(0.600±0.015)mg/L和(0.076±0.002)mg/L。研究表明,在换水率15%,养殖密度(2.810±0.007)kg/m3的循环水养殖条件下,可以保证水体水质稳定,刺参生长良好。
刺参;循环水养殖;换水率;养殖密度;水质
刺参(Apostichopusjaponicus)在辽宁、山东、河北等北方沿海地区广泛养殖,具有较高营养价值[1-2]。刺参池塘养殖、近海底播养殖、网箱养殖、潮间带围塘养殖、大棚养殖等蓬勃发展,但外界环境对其负面影响也逐渐增加[3]。如富营养化导致的海水水质变化,近海污染导致底泥重金属浓度超标,台风、赤潮、暴雨、大雪等恶劣天气都对成参养殖产生不利影响;适合刺参生长的水温为13-18℃,使得刺参的生长周期较长,加剧了养殖风险。保证刺参在最适条件下养殖、少受或不受外界环境影响,对食用刺参养殖的发展具有重要意义。
循环水养殖具有节水、节能、精细化控制养殖过程的特点[4]。刺参循环水养殖的主要目的是解除刺参的夏眠现象,消除自然环境下海水水质对刺参的影响,在最适条件下进行成参养殖。循环水养殖受外界环境干扰少,可降低高密度养殖带来的环境承载问题和养殖动物病害风险[5]。本试验研究了换水率和养殖密度对刺参生长和水质的影响,为刺参室内循环水养殖提供实践经验。
1 材料与方法
1.1 材料
试验用刺参状态良好、健康,体质量在(35.0~40.0)g之间,购自山东省威海市威海日鑫水产科技开发有限公司。试验用发酵饵料的主要原料为海带渣,购自荣成凯普生物工程有限公司。辅料为海带粉、马尾藻粉、贝壳粉等,均购自市场。发酵饵料所用微生态制剂购自威海四合生物科技股份有限公司,主要是海水培养的乳酸菌、酵母菌和芽孢杆菌。将发酵原料与微生态制剂混合均匀后置于(33±1)℃下发酵5 d[6],发酵后烘干、粉碎、保存备用。
试验在循环水养殖系统中进行。该系统由10个养殖池(0.97 m×0.77 m×0.25 m)、沉淀蓄水池、水处理系统、紫外杀菌器和自动控制系统组成。水处理系统中的牡蛎壳过滤器和泡沫蛋白分离器可去除水中的固体悬浮物;水温和水流由水处理系统调控。循环水养殖时,水流依次经过上述各单元,进行循环使用。非循环(流水式)养殖时,养殖池每天交换一定量的海水进行养殖。
1.2 方法
1.2.1 换水率、刺参生长速率和水质测定
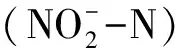
1.2.2 换水率15%的循环水刺参养殖试验
以非循环水养殖为对照,比较循环水养殖刺参的生长状况和水质变化。试验在6个养殖池内进行,1~3号池为循环水养殖,4~6号为非循环水养殖,共持续21 d。循环水养殖池内海水由池内高位排水口排出后进入蓄水池,再流经牡蛎壳、蛋白质过滤器及控温系统后重新流回养殖池内。试验期间每天清除底部残饵和粪便并补充新鲜海水,换水率平均15%。给刺参投喂发酵饲料,日投喂量为刺参总重的2%。每天投饵后均进行非循环养殖,第2天早上待饵料沉降后试验组开启循环水系统,每天运行8 h以上,试验共持续12 d。
1.2.3 养殖密度与刺参生长、水质测定
试验共设4个密度组:(3.640±0.006)、(2.810±0.007)、(1.760±0.005)和(0.980±0.008)kg/m3,每个处理设置2个重复。试验期间,每天用虹吸管吸除养殖池底部的粪便和残饵,换水率为15%,补充与排水量相同的新鲜海水。每天投喂发酵饲料一次,投喂量为刺参重量的1.5%,试验持续28 d。
1.2.4 刺参的循环水养殖试验
试验共设2组,其中试验组重复6次,对照组(非循环水养殖)重复3次,试验期间每天补充新海水,换水率均为15%,养殖密度(2.810±0.007) kg/m3。饲喂发酵饵料,每天将饵料与占刺参总重2倍饵料重量的微生态制剂混合8 h后进行投喂,投喂量为刺参总重的1.5%。每天投喂后两组都进行非循环养殖,第2天待饲料沉降后开启循环水系统,保证系统每天运行8 h以上,试验共持续28 d。试验期间,循环水系统每天运行8~10 h,试验共持续24 d。
1.2.5 养殖条件控制
上述4个试验分别依次进行,试验期间,由控温设备保持水温(16±1) ℃,24 h连续充氧,水中溶氧保持在5.0 mg/L以上,pH7.5~8.5,盐度28~32。
1.2.6 实验数据测定与处理
试验期间,每7 d称量各组刺参的体质量,每组共6个,生长数据取平均值和标准差,计算特定生长率(SGR)和综合特定生长率(ISGR)。喂食后取样,于干滤纸上静置30 s,待其体腔内的水尽量排空后用感量为0.01 g的电子天平进行称重。刺参的SGR和ISGR的计算公式如下:

(1)

(2)
式中:Wn—当次刺参的总重量,g;Wn-1—前次刺参的总重量,g;t—饲养时间,d;n—取样次数,次。
按照《海洋监测规范》测定养殖水质,用靛酚蓝分光光度法测定氨态氮[7],萘乙二胺分光光度法测定亚硝酸盐氮[8],用酸度计测定pH,用温度计测定温度,用盐度计测定盐度。试验数据用平均数±标准差表示,用SPSS 22.0软件进行数据统计分析。使用OriginPro8.0软件进行数据作图,柱状图中用字母标记法标记差异显著性。
2 结果与分析
2.1 换水率对刺参生长和水质的影响
由图1可知,日换水率为10%和20%组的ISGR最高,分别为每天(1.330±0.161)%和(1.410±0.182)%,两组之间没有明显差异(P>0.05),但明显高于其他组(P< 0.05)。而换水率100%的第5组ISGR低于其他试验组,说明全换水并不是促进刺参生长的最好办法。

图1 不同日换水率对刺参的综合特定生长 速率的影响结果
Fig. 1 Effects of different water exchange rates on the integrated specific growth rate of Apostichopus japonicus
由图2和图3可知,不同日换水率水体中组亚硝酸盐氮浓度的变化基本一致,换水率越高,水质中的亚硝酸盐氮和氨氮浓度越低。

图2 不同日换水率对水体中亚硝酸盐氮含量的 影响结果
Fig. 2 Effects of different water exchange rates on nitrite concentration in water

图3 不同日换水率对水体中氨氮含量的影响结果
Fig. 3 Effects of different water exchange rates on ammonia concentration in water
换水率为10%、20%、30%试验组之间氨氮和亚硝酸盐氮浓度差异并不显著(P>0.05),各组均处于安全浓度(0.50 mg/L)范围内,对刺参的生长没有显著影响。因此,选取刺参生长率最高的两个中间日换水率即15%作为循环水养殖的换水率较为合适。
2.2 换水率15%下循环水养殖刺参试验
非循环水养殖(对照组)每天的ISGR为(0.700 ± 0.060)%,循环水每天的ISGR为(0.320± 0.032)%(图4)。

图4 非循环水和循环水养殖组刺参的 综合特定生长率
Fig. 4 The integrated specific growth rate of Apostichopus japonicus cultured in non- recirculating water and recirculating water
循环水养殖组刺参的ISGR低于非循环水养殖组。但循环水养殖中刺参的摄食率比对照组高,残饵的剩余率低,粪便形态更粗壮,养殖水体更加清澈。
试验期间,养殖水中亚硝酸盐氮、氨氮浓度变化见图5和图6。

图5 非循环水和循环水养殖条件下水体中 亚硝酸盐氮浓度变化
Fig. 5 Changes of nitrite concentration in non-recirculating and recirculating water for Apostichopus japonicus aquaculture

图6 非循环水和循环水养殖条件下水体中的 氨氮浓度变化
Fig. 6 Changes of ammonia concentration in non-recirculating and recirculating water for Apostichopus japonicus aquaculture
发酵饲料可降低养殖水体中氨氮和亚硝酸盐氮浓度,明显改善水质。开始阶段非循环水养殖水体中亚硝酸盐氮浓度高于循环水养殖,随着养殖的进行,浓度逐渐降低。非循环水养殖水体中氨氮浓度始终上升,显著高于循环水系统氨氮数据(P< 0.05)。
2.3 不同放养密度下刺参的生长
图7表明,初始密度为3.640±0.006、2.810±0.007、1.760±0.005和(0.980±0.008 )kg/m3时,刺参的ISGR分别为每天(0.320±0.040)%、(0.560±0.045)%、(0.570±0.030)%和(0.610±0.050)%,养殖密度与ISGR成负相关,密度越大,ISGR越低。在循环水养殖中,密度(2.810±0.007)kg/m3相对较大,ISGR相对也较大,比较适合循环水养殖。

图7 不同密度下刺参的综合特定生长率
由图8和图9看出,不同密度对养殖水体内亚硝酸盐氮浓度的影响规律基本相同。试验期间,最高密度组水中所积累的亚硝酸盐氮浓度为(0.047 ±0.001)mg/L;氨氮浓度也逐渐升高,最大养殖密度(3.640±0.006)kg/m3组28 d后水中氨氮积累量最终达到(0.191±0.005)mg/L。

图8 不同密度对亚硝酸盐氮浓度的影响

图9 不同密度对氨氮浓度的影响
2.4 循环水养殖刺参试验结果
2种养殖方式的ISGR见图10。

图10 非循环水和循环水养殖中刺参的 综合特定生长率
Fig. 10 The integrated specific growth rate of Apostichopus japonicus cultured in non-recirculating and recirculating water
循环水养殖组的ISGR高于非循环水养殖组,每天的ISGR分别为(0.130±0.007)%和(0.010±0.004)%,说明可以运用循环水系统养殖刺参。两种养殖方式的特定生长率变化见图11。1周后2种养殖方式下刺参均增重,2周后出现了负增长,3周后,2种养殖方式恢复增重,保持相对平稳的增长率,循环水养殖增重比非循环水的增重快。

图11 非循环水和循环水养殖中刺参特定 生长率的变化
Fig. 11 The specific growth rate of of apostichopus japonicus cultured in non-recirculating and recirculating water
两种养殖模式的水质变化表明,发酵饲料能很好控制氨氮和亚硝酸盐氮浓度,且能维持稳定水平;在非循环水养殖中,氨氮和亚硝酸盐氮不断积累,第24 天亚硝酸盐氮浓度已达(0.076±0.002) mg/L,氨氮浓度最高达(0.600±0.015)mg/L(图12和图13)。可以看出,循环水养殖比非循环水养殖具有显著优势。
图12 非循环水养殖和循环水养殖条件下水体中 的亚硝酸盐氮浓度变化
Fig.12 Changes of nitrite concentration in non-recirculating and recirculating water for Apostichopus japonicus aquaculture

图13 非循环水养殖和循环水养殖条件下水体中的 氨氮浓度变化
Fig.13 Changes of ammonia concentration in non-recirculating and recirculating water for Apostichopus japonicus aquaculture
3 讨论
3.1 不同日换水率对刺参生长的影响
养殖过程中换水可以改善养殖生物的环境条件,尽量维持海水的理化性质。换水量过大会增加养殖成本,过小则排泄物及残饵积累在水中,难以保持良好的水质而影响刺参生长。因此,合适的换水率对刺参养殖非常重要[9]。沈加正等[10]利用循环水养殖系统高密度饲养罗非鱼(Oreochromisniloticus),发现总换水率为10%~20% ,氨氮和亚硝酸盐质量浓度可以保持在安全范围内,这与本文的结论相吻合。本文中换水率为10%和20%试验组刺参的ISGR较高,分别达到每天1.33 %和每天1.41 %,明显高于其他换水率。李晓莉等[11]的海鲫(Embiotocajacksoni)试验发现,氨氮、硝态氮、活性磷酸盐浓度均随水交换率的增大而降低,10%和15%是合适的换水率。综合考虑养殖生物的生长、水质及换水成本,循环水刺参养殖的换水率15%较为适宜。
循环水养殖能加速水系统的物质循环和能量流动,使养殖水的氨氮及亚硝酸盐氮浓度一直保持在较低水平[12]。然而,刺参在非循环水养殖中的ISGR比循环水养殖高,其原因可能是循环水养殖系统水处理单元中的牡蛎壳过滤器、泡沫蛋白质分离器等截留了水体中的微生物、藻类和有机质,使养殖水中的营养成分不丰富,紫外杀菌器也有一定作用。因此在循环水养殖刺参中应添加活性益生菌,以增加水体中微生物的数量。
3.2 不同养殖密度对刺参生长的影响
近年来,有关不同养殖密度对水产养殖效果的研究较多。刺参养殖密度与刺参的大小密切相关。王吉桥等[13]发现刺参的终末体质量随放养密度的增加而降低;同一密度下刺参的生长和成活率与放养规格呈负相关。吴艳庆等[14]发现在育苗期低密度养殖大规格参苗可以保证较高的生存率和净生产率。Dong等[15]认为在养殖密度为20 头/100 L时刺参的特定比生长率达最高(1.460 %)。本试验选取初始体质量在(35.0~40.0)g的刺参,密度也相应提高,结果显示特定比生长率随着刺参养殖密度的增加而逐渐降低,这与Tolon[16]、Serang等[17]的研究结果相似。
本试验结果表明,在循环水系统中亚硝酸盐氮和氨氮浓度一直保持在平稳的低水平,循环水养殖可以较好地控制养殖水质。Pei等[18]研究表明随着饲养密度的增加,养殖个体间相互制约程度加强,导致刺参体质量的变异系数显著增加。Xia等[19]发现随着放养密度的增加,刺参粗蛋白、粗脂肪的表观消化率下降,生长代谢所需要的能量随放养密度的增加而上升。结果表明,拥挤压力通过抑制生长能量的积累,加速刺参的能量消耗来改变能量分配,这一结果与Zhang等[20]的研究结果相一致。
3.3 提高养殖区微生物有利于刺参生长速率
水处理系统中的尼龙丝挂网和牡蛎壳等填料对微生物有良好的吸附功能[21],附着的微生物利用养殖水体中的有机质生长繁殖、净化水质。刺参肠道正常菌群及其代谢产物能促进某些营养成分的吸收,提高肠道内消化酶活性,促进新陈代谢[22]。在基础饵料中添加酵母菌、微生态制剂等可以显著提高刺参消化酶活性,改善肠道微生物群落结构[23],促进刺参生长繁殖[24],有效改善养殖水质[25]。本试验中饲喂的发酵饵料中营养成分丰富,含有微生物的代谢物,但在加工粉碎过程中过高的温度造成微生物大量死亡,后期通过添加微生态制剂,增加了刺参肠道微生物的数量,促进消化酶的产生和活性,利于提高刺参的生长速率。
4 结论
试验证明,在饲喂发酵饵料条件下,采用循环水养殖模式的水体水质可以得到稳定控制,刺参生长状态良好。在保证水质满足刺参健康生长的条件下,15%日换水率较为合理;在养殖密度为(0.980±0.008~3.640±0.006) kg/m3的范围内,刺参的特定生长率随着养殖密度增加而降低,考虑实际养殖成本,养殖密度为(2.810±0.007)kg/m3最适宜刺参循环水养殖。
□
[1] 唐贤明,杨守国,顾志峰.仿刺参在海南地区的苗种培育与养成[J].基因组学与应用生物学,2017,36(1):183-189.
[2] 王斌,胡亮,程振远,等.仿刺参不同组织液的抗菌活性[J].大连海洋大学学报,2010,25(6):523-527.
[3] 杜佗,李彬,王印庚,等.刺参(Apostichopusjaponicus)大水面养殖池塘环境中优势益生菌筛选及其特性分析[J].渔业科学进展,2017,38(3):180-187.
[4] 王峰,雷霁霖,高淳仁,等.国内外工厂化循环水养殖研究进展[J].中国水产科学,2013,20(5):1100-1111.
[5] 王路平,吴垠,班红琴,等.微生态制剂对刺参幼参在封闭式循环养殖系统中的应用研究[J].中国微生态学杂志,2009,21(6):497-499,504.
[6] 郝继浦.利用海带渣和啤酒糟生产刺参饵料的研究[D].威海:哈尔滨工业大学,2014.
[7] 李小卫,江雨秦.靛酚蓝分光光度法测定海水中的氨型氮的方法探究[J].当代化工研究,2017(1):159-160.
[8] 田良.仿刺参消化道中产酶菌株的筛选鉴定及其在仿刺参饲料中的应用[D].厦门:集美大学,2015.
[9] 卢超超,孙永军,高勤峰,等.不同换水频率对刺参养殖池塘底泥环境的影响[J].海洋湖沼通报,2014,38(4):59-66.
[10] 沈加正,史明明,阮贇杰,等.变速流操作调控循环水养殖系统水质效果研究[J].农业机械学报,2016,47(7):309-314.
[11] 李晓莉,张世羊,陶玲,等.基于生物塘处理的不同水交换率对池塘水质及鲫鱼生长的影响[J].水处理技术,2012,38(12):85-89.
[12] 张业韡,吴凡,陈翔,等.基于易控的工业化循环水养殖系统[J].渔业现代化,2017,44(1):21-25.
[13] 王吉桥,董恩东,张玉满,等.土池网箱育苗中放养密度对刺参生长及成活的影响[J].水产科学,2011,30(10):621-625.
[14] 吴艳庆,张玉祥,杜荣斌,等.不同规格和投苗密度对仿刺参池塘网箱保苗效果的影响[J].水产科学,2016,35(6):633-638.
[15] DONG S L,LIANG M,GAO Q F,et al.Intra-specific effects of sea cucumber(Apostichopusjaponicus) with reference to stocking density and body size[J].Aquaculture Research,2010,41(8):1170-1178.
[16] TOLON T,EMIROGLU D,GUNAY D,et al.Effect of stocking density on growth performance of juvenile sea cucumberHolothuriatubulosa(Gmelin,1788)[J].Aquaculture Research,2017,48(8):4124-4131.
[17] SERANG A M,RAHANTOKNAM S P T,TOMATALA P.Effect of different stocking densities on growth and survival rates of sea cucumberHolothuriascabraseedlings [J].Aquaculture Indonesiana,2016,17(1):30-34.
[18] PEI S,DONG S,WANG F,et al.Effects of density on variation in individual growth and differentiation in endocrine response of Japanese sea cucumber(Apostichopusjaponicus,Selenka)[J]. Aquaculture,2012,356-357(4):398-403.
[19] XIA B,REN Y C,WANG J Y,et al.Effects of feeding frequency and density on growth,energy budget and physiological performance of sea cucumber(Apostichopusjaponicus)[J]. Aquaculture,2017,466:26-32.
[20] ZHANG S,LIU S L,ZHANG L B,et al.Effect of stocking density on key growth traits of a fast-growing and heat-resistant strain of sea cucumber(Apostichopusjaponicus)[J]. Aquaculture Research,2016,47(11):3636-3643.
[21] 邓德波,马英,徐春燕,等.鳗鲡养殖循环水处理系统细菌的组成及其数量[J].集美大学学报(自然科学版),2010,15(5):321-326.
[22] 樊英,李乐,于晓清,等.免疫增强剂对仿刺参肠道微生物的影响[J].中国农学通报,2015,31(2):91-96.
[23] 聂琴,杨凡,万龙飞,等.饲料中添加酵母对刺参肠道消化酶活性和肠道微生物的影响[J].中国饲料,2014(17):42-44.
[24] 阳钢.几种微生态制剂对刺参(Apostichopusjaponicus)养殖水体及刺参肠道菌群结构的影响[D].青岛:中国海洋大学,2012.
[25] 董春光,杨爱国,孙秀俊,等.枯草芽孢杆菌(Bacillussubtilis)在刺参养殖中的益生作用[J].渔业科学进展,2015,36(3):109-115.
EffectsofwaterexchangerateandstockingdensityongrowthofApostichopusjaponicusandwaterquality
WANGGuangyu,JIANGJiahui,ZHUNan,CHENLei
(SchoolofMarineScienceandTechnology,HarbinInstituteofTechnology,Weihai,264209,China)
In order to investigate the effects of water exchange rate(0,10%,20%,30% and 100%) and stocking density(0.980±0.008,1.760±0.005,2.810±0.007 and(3.640±0.006)kg / m3) on growth ofApostichopusjaponicusand water quality,An aquaculture experiment was carried out in the non-recirculating water to determine the integrated special growth rate(ISGR) forApostichopusjaponicusin various groups and the concentrations of ammonia and nitrite in the water.The results showed that the ISGR for the treatment groups with water exchange rate of 10% and 20% was (1.330±0.161)% and (1.410±0.182)% per day respectively,which was significantly higher than that of other treatment groups.As the stocking density being ineread,the ISGR reduced gradually with a result(0.610±0.500)%,(0.570±0.030)%,(0.560±0.045)% and (0.320±0.040)%)respectively.The concentration of ammonia and nitrite in each group fluctuated within the safe concentration range.The results showed that the ISGR ofApostichopusjaponicuscultured in the recirculating water was(0.130±0.007)%,higher than that in the non-recirculating water,and the concentration of ammonia and nitrite was controlled below 0.02 mg/L in the recirculating aquaculture group,which was higher than that of the non-recirculating aquaculture group.The Ammonia and nitrite nitrogen accumulated in the recirculating water group were (0.600±0.015)mg/L and (0.076±0.002)mg/L,respectively.The results showed that the water quality was stable and the growth ofapostichopusjaponicuswas fast with an exchange rate of 15% and stocking density of (2.810±0.007 )kg / m3in the rerecirculating water.
Apostichopusjaponicus;recirculating aquaculture;water exchange rate;stocking density;water quality
10.3969/j.issn.1007-9580.2017.06.010
2017-11-23
哈尔滨工业大学威海校区学科建设引导基金项目(WH20150204和WH20160205)
王光玉(1972—),男,副教授,研究方向:海洋生物学。E-mail:wanggy18_2007@163.com
陈雷(1974—),女,副教授,研究方向:海洋微生物学。E-mail:chenleihit@163.com
P735
A
1007-9580(2017)06-055-07
