三种因素对海水生物流化床启动期间营养盐去除及amoA基因表达的影响
2017-12-25宋协法王学超董登攀
宋协法, 王学超, 董登攀
(中国海洋大学,山东 青岛 266003)
三种因素对海水生物流化床启动期间营养盐去除及amoA基因表达的影响
宋协法, 王学超, 董登攀
(中国海洋大学,山东 青岛 266003)

循环水养殖;生物流化床;生物过滤功能启动;营养盐;功能基因
生物滤池作为封闭式循环水养殖系统的核心单元,是控制养殖用水质量、维持养殖系统稳定运行的关键[1]。常见的生物过滤器有浸没式生物过滤器、滴流式生物过滤器、生物转盘、生物转筒、念珠式生物过滤器、生物流化床等,其中生物流化床由于其能提供良好的传质效果、较高的TAN处理效率、相对较小的占地面积以及巨大的比表面积等,被认为是最先进的生物反应器类型之一[2-3]。生物流化床作为一种新型高效的生物滤器,已广泛应用于美国等发达国家养殖企业的循环水养殖系统中[3-5]。国内外学者针对生物流化床开展了一系列研究。Iván等[3]、张海耿等[6]和朱兴一[7]均将生物流化床应用于罗非鱼循环水系统,评价其对含氮废物的去除效果,结果均显示其可有效净化养殖水体,出水水质符合罗非鱼养殖需求。
生物过滤器启动过程的快慢,启动完成后系统的处理效果及稳定性,不仅直接关系到养殖成本高低,也是循环水养殖成功的前提和必要条件。柳瑶等[8]以实验室规模的旋转式生物流化床为研究对象,采用自然生物过滤功能启动法,探究海水与淡水生物滤池过滤功能的启动。张海耿等[9]将流化床应用于小型鲟鱼循环水养殖系统,探讨自然生物过滤功能启动方式和添加微生态制剂方式下该滤器的生物过滤功能启动时间及运行效果。但是,目前对海水生物流化床生物过滤功能启动的影响因素及稳定性的研究还存在不足。温度、膨胀率和初始总氨氮(TAN)浓度是生物流化床运行期间的重要参数,pH、溶氧(DO)和盐度(SAL)也是维持水体理化性质的重要保证,生物流化床运行参数不同,微生物生存的环境以及生长的快慢也会不同,生物过滤功能的启动过程也可能不同。因此,研究生物流化床生物过滤功能的启动和微生物功能基因表达有助于扩大生物流化床的应用范围,提高生物过滤功能的启动以及提高水处理效率。
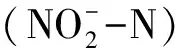
1 材料与方法
1.1 模拟养殖污水处理系统
实验室规模的生物流化床海水养殖废水处理系统由水泵、养殖池、生物流化床、沉淀池及温控设备组成(图1)。其中,床体高度134 cm,床体直径19 cm,进水管直径2 cm,出水管直径10 cm,布水腔底部直径29 cm。

图1 养殖污水处理系统
1.2 试验材料
1.2.1 滤料
石英砂是国外最常采用的生物流化床填料[4],实验选择的石英砂粒径0.35~0.65 mm,密度286 kg/m3,在生物流化床中的填充高度40 cm,体积约11 L,填充率30%。
1.2.2 人工配置海水养殖废水
本试验的养殖废水通过从鱼池中收集的残饵粪便进行配置。残饵粪便取自山东东方海洋科技股份有限公司的大西洋鲑循环水养殖系统,经自然风干后于烘箱内65 ℃烘干12 h,烘干后的残饵粪便使用研磨机粉碎;配水时取500 g溶于少量水后发酵3 d,经300目筛绢过滤,将浸出液倒入体积约75 L的水桶中混匀,弃去残渣,测定水质指标后按照比例用来自青岛近海沙滤海水的净海水稀释作为试验用水[10]。
1.3 试验设计


表1 试验参数设置表
1.4 试验指标与分析方法
1.4.1 样品采集
在生物流化床运行期间,每天在流化床床体、养殖池及蓄水池取水样。水样取出后及时测定营养盐浓度。每10 d在无菌条件下在流化床上、中、下3个取样点采集石英砂样品,混匀后冻存于-80 ℃冰箱中。
1.4.2 水质测定方法

TAN的去除效果用去除率A来表示:
A=100%×(Ct—C0)/C0
(1)
式中:A—TAN去除率,%;C0—TAN初始质量浓度,mg/L;Ct—t时溶液中的TAN质量浓度,mg/L。
1.4.3 DNA提取和PCR扩增
在生物流化床运行期间,每10 d在流化床的上、中、下3个取样点采集石英砂样品,混匀后冻存于-80℃冰箱中。样品DNA的提取采用Fast DNA SPIN Kit for soil (MP Biomedicals,Illkirch,France) 按照操作说明进行提取,提取后的DNA通过核酸蛋白检测仪(NANODROP2000,Thermo,USA)测量核酸的浓度及纯度。以amoA-1F(5’-GGG GTT TCT ACT GGT GGT)和amoA-2R(5’-CCC CTC KGS AAA GCC TTC TTC)[11]为引物扩增amoA基因片段,片段长度491bp。反应程序为:95℃预变性5 min;35个循环包括94℃变性30 s,58℃退火 45 s,72℃延伸 45 s;72℃延伸10 min。
1.4.4 实时荧光定量PCR标准品的制备
将纯化好的PCR产物与T-载体(TAKARA)连接,参照相关文献[12]制备标准品。
1.4.5 实时荧光定量PCR
采用特异性引物amoA-1F和aomA-2R对氨氧化细菌(Ammonium-oxidizing bacteria,AOB)的amoA功能基因进行qRT-PCR扩增。反应在Mastercycler ep realplex 实时定量PCR仪(Eppendorf,Germany)上进行,采用试剂盒(SYBR®Premix Ex Taq kit,TaKaRa,Japan)进行反应,每个反应做3个重复,反应体系见表2。

表2 PCR反应体系
实时定量的程序为:95 ℃ 900 s;95 ℃ 15 s,63 ℃ 30 s,72 ℃ 30 s,40个循环。熔解曲线程序:95 ℃ 15 s,63 ℃ 15 s,15 min,95 ℃ 15 s。
2 结果
2.1 温度对营养盐去除率及功能基因表达的影响
不同温度下的TAN去除率变化趋势类似,呈现先逐渐升高的趋势(图2)。在15℃、20℃和25℃处理下,TAN去除率分别在第23天、17天和17天达到90%。相对于20和25℃两个处理,在温度为15℃时TAN去除率在前10 d内增长缓慢并伴有小幅波动,且达到稳定所需要的时间最长。
随着试验的进行,3种温度处理下氨氧化细菌amoA的数量均呈上升趋势(图3)。在同次取样时间点下,氨氧化细菌amoA的数量随着温度的升高而升高。结合不同温度下TAN去除率的变化,发现在整个实验过程中氨氧化细菌amoA基因数量的变化与TAN去除率的变化相一致。

图2 不同温度对生物流化床TAN去除率和质量浓度变化的影响

图3 不同温度对生物流化床内amoA基因数量变化的影响
Fig.3 The effect of different temperatures on the amount of amoA gene in cyclo-bio fluidized sand biofilters
2.2 不同初始TAN浓度处理下生物流化床的生物过滤功能启动情况


图4 生物流化床中不同TAN浓度对TAN去除率和浓度变化的影响
Fig.4 The effect of different ammonia concentrations on the removal effeiency of ammonia and the concetration of nitrate in cyclo-bio fluidized sand biofilters
如图5所示,随着试验的进行,3种初始TAN浓度下AOB的amoA数量均随着时间增长而增多,在相同的时间下,AOBamoA的数量随着初始TAN浓度的升高而升高。结合在不同TAN初始浓度下TAN去除率的变化,发现在整个实验过程中氨氧化细菌的amoA基因数量与TAN去除率有相似的变化趋势。
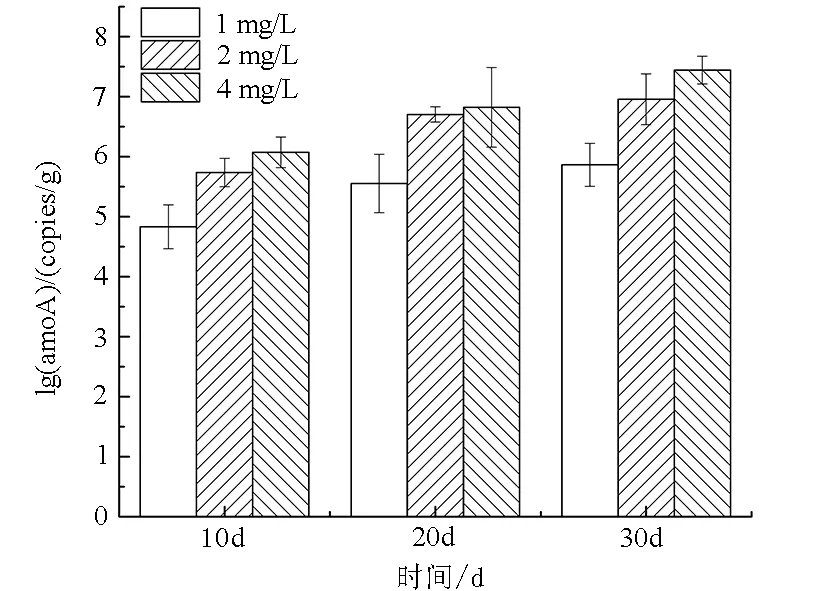
图5 不同TAN浓度对生物流化床内amoA 基因数量变化的影响
Fig.5 The effect of different ammonia concentrations on the amount of amoA gene in cyclo-bio fluidized sand biofilters
2.3 不同膨胀率下生物流化床的生物过滤功能启动情况
如图6所示,在膨胀率为100%和150%时,TAN去除率的变化趋势相似;在膨胀率为50%时,TAN去除率增长较慢,并且最后TAN去除率只达到了80%,其他两个膨胀率下TAN去除率均达到了100%。膨胀率为100%和150%时,TAN去除率达到90%分别需要13 d和12 d,到达稳定的时间分别为20 d和19 d,差别不明显。
如图7所示,从整体趋势来看,3种膨胀率下AOBamoA数量均随着时间增长而增多,在相同的时间下AOBamoA数量随着膨胀率的升高而升高。结合不同膨胀率下TAN去除率的变化发现,在整个实验过程中,AOBamoA基因数量与TAN去除率的变化呈相似趋势。
图6 生物流化床中不同膨胀率对和TAN去除率的影响
Fig.6 The effect of different expansion rates on the removal effciency of ammonia and the concentration of nirate in eyclo-bio fluidized sand biofilters
3 讨论
3.1 温度对营养盐去除率及功能基因表达的影响
硝化细菌是生物硝化脱氨中起主要作用的微生物,直接影响硝化效果和生物脱氨效率。环境温度对硝化细菌的生长影响较大,大多数硝化细菌适宜生长的温度为10℃~38 ℃,当温度低于10 ℃时,硝化细菌的活性较低,TAN的转化会受到影响[13]。高于20 ℃时硝化细菌的活性较高,但高于38℃时硝化作用会消失[14]。因此,选取合适的反应温度是提高生物滤器硝化脱氮效率的重要前提。


图7 不同膨胀率对生物流化床内amoA 基因数量变化的影响
Fig.7 The effect of different expansion rates on the amount of amoA gene in cyclo-bio fluidized sand biofilters
生物滤器是循环水养殖的重要环节,生物滤器上附着硝化细菌,尤其是AOB直接决定其处理效率的高低[17]。本研究发现,随着温度的升高生物流化床内AOBamoA数量呈增长趋势,在25℃下菌群密度最大,说明多数AOB是嗜温菌,在一定范围内,随着温度的升高,AOB的生长速率升高、活性增强,表现为生物流化床对TAN的良好去除效果。该研究与窦娜莎[18]的研究结果相似,其发现曝气生物滤池内AOB菌群密度随温度升高而增大,与污染物的去除率变化趋势一致。
3.2 初始TAN浓度对营养盐去除率及功能基因表达的影响
TAN浓度本身会影响硝化反应,被认为是设计和管理生物滤器最重要的影响因素[19]。本实验研究发现,随着初始TAN浓度的升高,TAN去除率的增速也加快,在初始TAN浓度为4 mg/L时,系统达到TAN近似完全去除所用时间最短。朱兴一[7]研究发现随TAN浓度的增加,TAN去除率逐渐上升,当进水TAN浓度为10 mg/L时,TAN的去除率达到最大值。有研究指出,当TAN浓度超过3 mg/L时,积累的TAN会抑制硝化反应[20]。但本试验发现,在实验室规模循环水系统下,当初始TAN浓度提高到4 mg/L时,仍然能保持较好的TAN去除率。原因可能是:一方面,本实验选用的生物流化床填料具有巨大的比表面积,能够达到较高的水处理效率;另一方面,实验室规模循环水系统容积较小,在相同的时间内循环的次数较多。
本研究发现初始TAN浓度升高,amoA基因数量有较明显的增加。Mota等[21]和杨小丽等[22]的研究也发现随着TAN浓度的增加,amoA基因数量增多,氨氧化细菌比例随之增大。
3.3 膨胀率对海营养盐去除率及功能基因表达的影响
膨胀率是生物流化床特有的操作参数。膨胀率不同,水流流速不同,也就导致单位体积TAN的转换率(VTR)不同。这与生物滤器中的水力停留时间(HRT)对营养盐处理的原理相似。适宜的膨胀率能保持滤料与底物的充分接触,为滤料表面的微生物提供充足溶氧和营养物质,从而对营养盐保持较好的去除效果[23]。因此,选取适宜的膨胀率是生物流化床乃至循环水系统稳定运行的关键。本研究发现在选取50%、100%和150%膨胀率参数下,生物流化床均显示出良好的硝化性能,但在膨胀率为150%时TAN去除率比100%时的提升不大,但仍有较好的硝化性能。原因可能是在膨胀率150%时,滤料在启动过程中有一定的流失[4]。柳瑶等[8]研究旋转式生物流化床启动时发现污水处理效率随膨胀率增大而提高,膨胀率为100%时处理效率最高。Pujol等[24]也认为适当提高流速会对硝化作用有积极的促进作用。本研究同时发现,在膨胀率为100%和150%时,amoA基因数量无明显差异,可能原因是在生物流化床启动期间,TAN浓度保持不变,amoA基因数量也随着生物流化床的启动逐渐达到稳定。
4 结论
本试验条件下,在水温为25 ℃时生物流化床挂膜完成所需时间最短,为23 d,并且amoA基因数量增速最快。在初始TAN浓度为4 mg/L时生物流化床挂膜完成所需时间最短,为21d,amoA基因数量也会随着初始TAN浓度升高而增加。在膨胀率为100%和150%时生物流化床启动完成所需时间无明显差异,但明显短于膨胀率为50%时的生物流化床启动完成所需的时间。在膨胀率为100%和150%时,amoA基因数量无明显差异。
□
[1] LIU H,CHE X,ZHANG Y. Performance of sequencing microbead biofilters in a recirculating aquaculture system[J]. Aquacultural Engineering,2013,52(52): 80-86.
[2] TSUKUDA S,CHRISTIANSON L,KOLB A,et al. Heterotrophic denitrification of aquaculture effluent using fluidized sand biofilters[J]. Aquacultural Engineering,2015,64:49-59.
[4] SUMMERFELT S T. Design and management of conventional fluidized-sand biofilters[J]. Aquacultural Engineering,2006,34(3):275-302.
[5] SUMMERFELT S T,WILTON G,ROBERTS D,et al. Developments in recirculating systems for Arctic char culture in North America[J]. Aquacultural Engineering,2004,30(1/2): 31-71.
[6] 张海耿,张宇雷,张业韡,等.循环水养殖系统中流化床水处理性能及硝化动力学分析[J].环境工程学报,2014,8(11):4743-4751.
[7] 朱兴一.三相生物流化床循环水高密度养殖尼罗罗非鱼的研究[D].杭州:浙江大学,2006.
[8] 柳瑶,宋协法,雷霁霖,等.循环水养殖旋转式生物流化床生物过滤功能[J].农业工程学报,2015,31(3): 249-254.
[9] 张海耿,张宇雷,宋红桥.低温工况下流化床生物滤器的启动方式实验[J].水处理技术,2015(1): 94-98.
[10] 张延青,陈江萍,沈加正,等.海水曝气生物滤器污染物沿程转化规律的研究[J].中国环境科学,2011,31(11): 1808-1814.
[11] ROTTHAUWE J H,WITZEL K P,LIESACK W. The ammonia monooxygenase structural geneamoAas a functional marker: molecular fine-scale analysis of natural ammonia-oxidizing populations.[J]. Applied & Environmental Microbiology,1997,63(12): 4704-4712.
[12] 李丽,赵成萍,李宏,等.质粒制备绝对定量PCR标准曲线方法的建立[J].农业生物技术学报,2011,19(6): 1157-1162.
[13] 张雷,苗月,姜安玺.耐低温硝化细菌固定化技术及脱氮效果[J].化工进展,2010,29(8): 1567-1570.
[14] ELDEAN A,RAMADAN K. Removal of ammonia and phenol from industrial waste water[J]. Eleventh International Water Technology Conference,2007,11:949-971.
[15] 王春荣,王宝贞,王琳. 温度及氨氮负荷对曝气生物滤池硝化作用的影响[J]. 城市环境与城市生态,2004(4):24-27.
[16] 山形阳一,梅志平.循环过滤设备的维护和管理[J].水产科技情报,1991(2): 58-60.
[17] 宋协法,黄志涛,彭磊.封闭循环水产养殖系统中三种生物滤池除TAN效果的比较[J]. 渔业现代化,2007,34(1): 1-4.
[18] 窦娜莎.曝气生物滤池处理城市污水的效能与微生物特性研究[D]. 青岛:中国海洋大学,2013.
[19] CHEN S,LING J,BLANCHETON J P. Nitrification kinetics of biofilm as affected by water quality factors[J]. Aquacultural Engineering,2006,34(3): 179-197.
[20] CARRERA J,VICENT T,LAFUENTE J. Effect of influent COD/N ratio on biological nitrogen removal (BNR) from high-strength ammonium industrial wastewater[J]. Process Biochemistry,2004,39(12): 2035-2041.
[21] PENGTHAMKEERATI P,MOTAVALLI P P,KREMER R J. Soil microbial activity and functional diversity changed by compaction,poultry litter and cropping in a claypan soil[J].Applied Soil Ecology,2011,48(1): 71-80.
[22] 杨小丽,王世和,卢宁. 一体式MBR控制膜污染的最佳曝气强度及影响因素[J]. 水处理技术,2006,32(5): 17-19.
[23] 张海耿,张宇雷,张业韡,等. 循环水养殖系统中流化床生物滤器净水效果影响因素[J]. 环境工程学报,2013,7(10):3849-3855.
[24] PUJOL R,LEMMEL H,GOUSAILLES M. A keypoint of nitrification in an upflow biofiltration reactor[J]. Water Science & Technology,1998,38(3): 43-49.
EffectofthethreefactorsonnutrientremovalandexpressionofamoAgeneduringthestart-upperiodofseawatercyclo-biofluidizedsandbiofilters
SONGXiefa,WANGXuechao,DONGDengpan
(OceanUniversityofChina,Qingdao266003,China)
Under laboratory scale,with the cyclo-bio fluidized sand biofilter (CB-FSB) as the research object,the changes of the removal performance of ammonia-nitrogen and the nitrite-nitrogen,and the amount ofamoAgene during the start-up period of cyclo-bio fluidized sand biofilter (CB-FSB) under different initial ammonia-nitrogen concentrations,water temperatures and filter expansion rates were studied in this paper. The experimental results showed that the time required for the start-up of cyclo-bio fluidized sand biofilter (CB-FSB) was shortened with the increasing of water temperature. The time required for the start-up of CB-FSB were 27,25,and 23 days at 15℃,20℃ and 25 ℃,respectively. The time required for the start-up of CB-FSB was shortened with the increasing of the initial ammonia nitrogen concentration. The time required for the start-up of CB-FSB were 24,22,21 days at 1 mg/L,2 mg/L and 4 mg/L,respectively. There was no significant difference between 100% and 150% filter expansion rates for the start-up of CB-FSB,which was 21 days and 20 days,respectively. They were better than that with 50% expansion rate. The time required for the start-up of CB-FSB with 50% expansion rate was 27 days. The amount ofamoAgene was related to the change of nitrite-nitrogen removal rate and increased with the increasing of initial ammonia-nitrogen concentration. The amount ofamoAgene reached the peak at 4mg/L of ammonia-nitrogen concentration,which was 2.76 × 107copies/g.
recirculating aquaculture;stat-up of cyclo-bio fluidized sand biofilters;nutrient salt;function gene
10.3969/j.issn.1007-9580.2017.06.005
2017-09-04
国家科技支撑计划项目(2011BAD13B04)
宋协法(1964—),男,教授,博士,研究方向:设施渔业和养殖污水处理。E-mail:yuchuan@ouc.edu.cn
S959
A
1007-9580(2017)06-024-06
