固定化酶催化制备乙酸正丁酯及动力学
2017-12-22王洪海李旭李春利刘文静
王洪海,李旭,李春利,刘文静
(河北工业大学化工节能过程集成与资源利用国家地方联合工程实验室,天津 300130)
固定化酶催化制备乙酸正丁酯及动力学
王洪海,李旭,李春利,刘文静
(河北工业大学化工节能过程集成与资源利用国家地方联合工程实验室,天津 300130)
酯交换反应可用南极假丝酵母脂肪酶B(CALB)作催化剂,采用溶胶-凝胶法固定脂肪酶CALB得到的催化剂颗粒可用于乙酸乙酯和正丁醇的酯交换反应。首先探究了固定化酶的稳定性和重复使用性,然后在间歇反应釜内进行反应动力学实验,考察了转速、催化剂用量、酯醇比、温度等因素对反应的影响,确定了适宜的操作条件。在328.15~343.15 K下,将实验数据拟合得到反应的动力学方程,通过实验值与计算值的比较,验证此宏观动力学方程合理,可用于模拟计算。
催化剂;生物催化;动力学;酶;固定化
引 言
乙酸正丁酯,简称乙酸丁酯,是具有果香气味的液体,是优良的有机溶剂、分析试剂和萃取剂,也应用于香料工业。随着环境问题日益突出,人们更倾向于用乙酸正丁酯替代甲苯、二甲苯、酮类等溶剂,因而乙酸正丁酯具有很广阔的应用前景[1-2]。
工业上普遍采用酸性催化剂合成乙酸正丁酯,由醋酸和丁醇直接酯化反应。但这种方法有很多缺点,如副产物多、转化率低、设备腐蚀问题等[3]。因此人们研究了新型催化剂来替代浓硫酸,如固体酸[4]和杂多酸[5]等酸性催化剂、分子筛和离子交换树脂等负载型催化剂[6]、离子液体催化剂[7]等。这些催化剂虽然解决了设备腐蚀、副反应少等缺点,但是仍存在反应转化率不高和环境污染的问题。因此开发一种生产效率高、环境友好型催化剂和生产工艺显得尤为重要。
生物酶催化剂与化学催化剂相比具有活性大、选择性高、反应条件温和、对环境无污染的优点,但是仍存在使用后无法回收、与产物混合造成后续分离困难、活性和稳定性受温度和pH影响的问题。而酶的固定化解决了以上问题使其可方便用于催化反应。但是,反应最终的转化率往往会受热力学和动力学的限制[8-9]。因此,如果将固定化酶催化剂与反应精馏相结合,即通过移除生成物的方法有望达到提高反应的转化率与分离效率的目的[10-11]。目前,将生物酶催化与反应精馏相结合的研究还处于起步
阶段[12-15]。
本文提出通过凝胶-溶胶的方法固定液态南极假丝酵母脂肪酶B(CALB),用于乙酸乙酯-正丁醇体系酯交换反应,重点探究固定化酶催化酯交换反应的较适宜条件,得出动力学方程,为接下来模拟计算和开发耐高温生物酶催化剂及酶催化反应精馏打下理论基础。
1 实验材料和方法
1.1 材料
CALB发酵液(所含蛋白质量分数为6%),购买于诺维信公司。乙醇(EtOH)、乙酸乙酯(EtAC)、正丁醇(BuOH)、乙酸丁酯(BuAC)、甲醇(MeOH)、聚乙二醇(PEG 400)、乙腈、甲基三甲氧基硅烷(MTMS)均购买于天津市大茂化学试剂厂。氟化钠购买于天津市风船化学试剂科技有限公司。正硅酸甲酯(TMOS)购买于天津希恩思生化科技有限公司。所有化学试剂均为分析纯。
1.2 CALB固定化
本文采用溶胶-凝胶包埋法[16-17]固定 CALB液体,在已知文献的基础上进行了优化[18]。需要配制交联剂和溶剂。交联剂的配制:将质量比为 1:3:3的正硅酸甲酯、甲基三甲氧基硅烷和甲醇混合,然后在冰水浴中搅拌。溶剂的配制:将质量比为1:4:9:15 的聚乙二醇、氟化钠(1 mol·L-1)、去离子水、CALB液体混合。交联剂与溶剂的质量比为3:2。将溶剂倒入交联剂内,为避免反应放热对酶的损害,在冰水浴中搅拌 3 min,然后移至室温即得到含有CALB的溶胶。
凝胶颗粒的制备方法:溶胶在室温下干燥,约20 min即可得到CALB凝胶固体,用研钵将凝胶研磨成直径为1~1.5 mm小颗粒,可作为酯交换反应催化剂进行反应动力学探究。
1.3 动力学实验
选用乙酸乙酯和正丁醇为反应物,反应生成乙酸丁酯和乙醇。为得到在CALB催化作用下的酯交换反应动力学参数,在间歇搅拌釜中进行了此反应动力学实验。实验采用水浴加热,冷却水冷凝。实验操作过程如下:首先将所需量的反应物乙酸乙酯和正丁醇分别水浴加热到指定温度,然后将二者加入间歇搅拌釜中混合,再加入所需质量的固定化CALB颗粒,密封。打开搅拌器开始反应,每隔30 min进行取样分析。当分析结果显示间歇搅拌釜内各组分浓度趋于稳定时,停止反应。
1.4 分析方法
1.4.1 气相色谱 实验所需分析的样品都经气相色谱进行分析。色谱条件:毛细柱OV1701,50 m×0.32 mm×0.5 μm,氢火焰FID检测器,柱温140℃,进样温度200℃,检测室温度210℃,进样量为0.2 μl。色谱工作站为N2000,数据处理采用校正归一法,相对校正因子见表1。

表1 相对校正因子Table 1 Data of correction factor
1.4.2 酶活力测定 用乙酸乙酯和正丁醇的转酯反应作为酶活性测试方法。实验条件为乙酸乙酯和正丁醇摩尔比为 1:1,反应温度为 60℃,转速为 300 r·min-1。反应后所测样品和乙腈混合后在离心机离心1.5 min,然后用气相色谱进行分析。定义每分钟催化消耗 1 μmol乙酸乙酯所需的酶质量为一个活力单位(U)。固定化脂肪酶活性所占同等质量的游离脂肪酶活性的比例作为固定化脂肪酶的相对活性,并定义相同质量的游离脂肪酶活性为100%[19]。
2 实验结果与讨论
2.1 固定化CALB特性
经上述方法测试得游离酶 CALB的活性为(510±17)U·g-1,固定化凝胶颗粒 CALB 的酶活性为(484±12) U·g-1,此结果表明用溶胶-凝胶法固定后酶活性并没有明显损失。
2.1.1 固定化CALB的稳定性 为了确定固定化酶的长期稳定性,将固定化酶放置于25℃的干燥环境中,每间隔5 d对其进行酶活性的测试,其相对活性随时间的变化如图1所示。从图中可以看出,固定化酶的活性并未出现明显的损失,40 d后其相对活性仍为92%,说明此固定化方法优良。
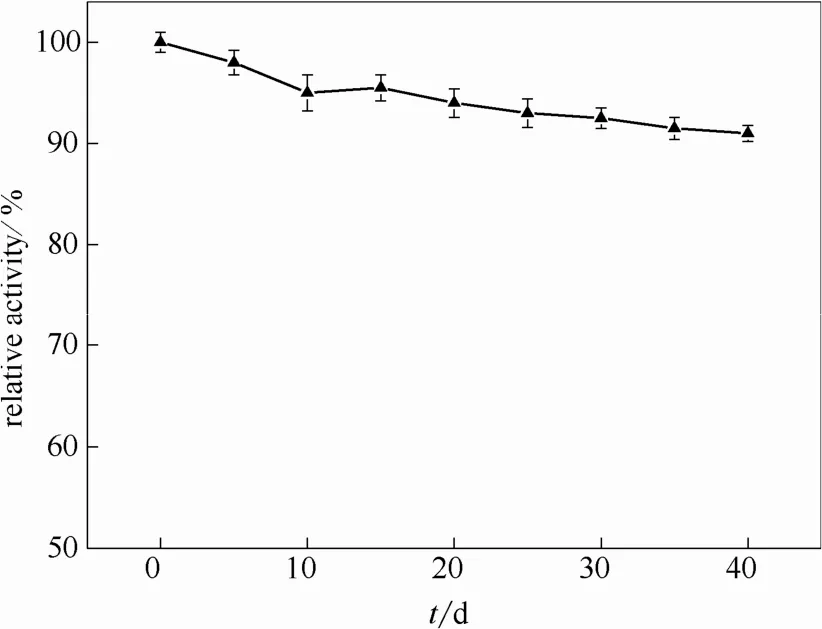
图1 固定化酶CALB的稳定性Fig.1 Long-term stability of CALB immobilized
2.1.2 固定化CALB的重复使用性 为了确定固定化酶CALB的重复使用性,采用分批式反应的方法,方法和条件同1.4.2节,反应体系温度定为70℃,当底物转化率达到50%时停止反应,用磷酸缓冲液洗涤固定化酶3次并干燥后加入到预热好的下一批次的反应液中进行反应,每次固定化酶的相对活性随反应次数的实验结果如图2所示。从图中可以看出,70℃下固定化酶CALB活性略有下降,但仍能在重复使用10次之后保持90%的相对活性,且活性降低趋于平稳,说明重复使用性很好。
2.2 反应动力学研究
2.2.1 外扩散影响的消除 反应动力学数据的测定需要在消除外扩散影响的前提下进行,实验可以通过增大搅拌速率来消除外扩散的影响。当搅拌速率增大,而正丁醇的最大转化率不再变化时,即认为消除了外扩散影响。在温度为 65℃、醇酯摩尔比1:1、催化剂质量为正丁醇质量 5%的条件下,测定正丁醇转化率随搅拌速率的影响,结果如图3所示。从图中可以看出,当转速由200 r·min-1增大到300 r·min-1时,正丁醇的转化率有明显提高;当搅拌速率继续增大至400 r·min-1,正丁醇的转化率变化不大。考虑到过大的搅拌速率不仅会增加能耗,而且也会增大对设备及催化剂颗粒的磨损,因此搅拌速率选择 300 r·min-1。
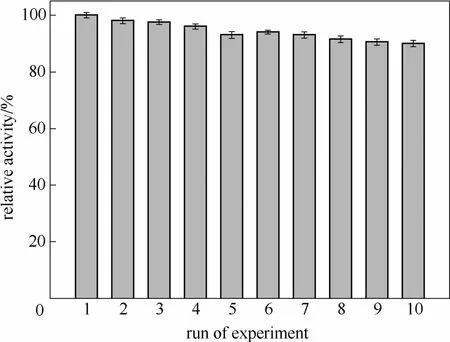
图2 固定化酶CALB的重复使用性Fig.2 Relative activity of CALB after repeated use
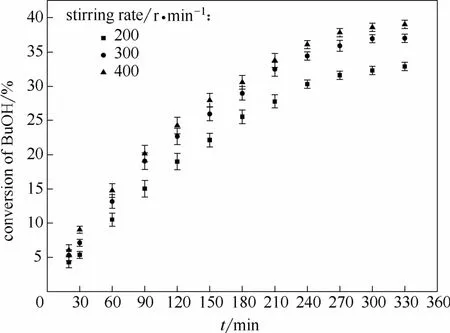
图3 搅拌速率对正丁醇转化率的影响Fig.3 Effect of stirring rate on conversion of n-butanol
2.2.2 催化剂用量的影响 催化剂的用量对反应影响较大,用量过少会使反应速率减小,导致反应时间增长,催化剂过量又会造成资源的浪费。为了探究合适的催化剂用量对反应的影响,进行了如下实验:温度为65℃、醇酯摩尔比1:1,搅拌速率为300 r·min-1,催化剂用量分别为正丁醇质量的5%、10%、15%。对实验结果分析作图,见图 4。可以看出,当催化剂用量由 5%增至 10%时,反应达到平衡的时间明显缩短;继续增加催化剂用量至15%时,反应速率并未有明显提升。因此催化剂用量选定为正丁醇质量的10%。
2.2.3 酯醇摩尔比的影响 反应物的用量对酯交换转化率起到决定性影响。为探究两种反应物的进料配比进行了以下实验。
(1)正丁醇过量
在温度为65℃,催化剂用量为乙酸乙酯质量的10%,搅拌速率为300 r·min-1的情况下,正丁醇与乙酸乙酯的摩尔比分别为 1:1、1.25:1、1.5:1 时进行了3组平行实验。催化剂用量对乙酸乙酯的转化率影响如图5所示。从图中可以看出当正丁醇过量后,乙酸乙酯的转化率未上升反而出现下降,表明增加正丁醇用量对固定化CALB的催化效果有抑制作用[20]。
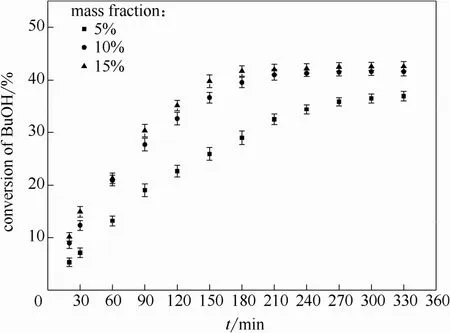
图4 催化剂用量对正丁醇转化率的影响Fig.4 Effect of catalyst dosage on conversion of n-butanol
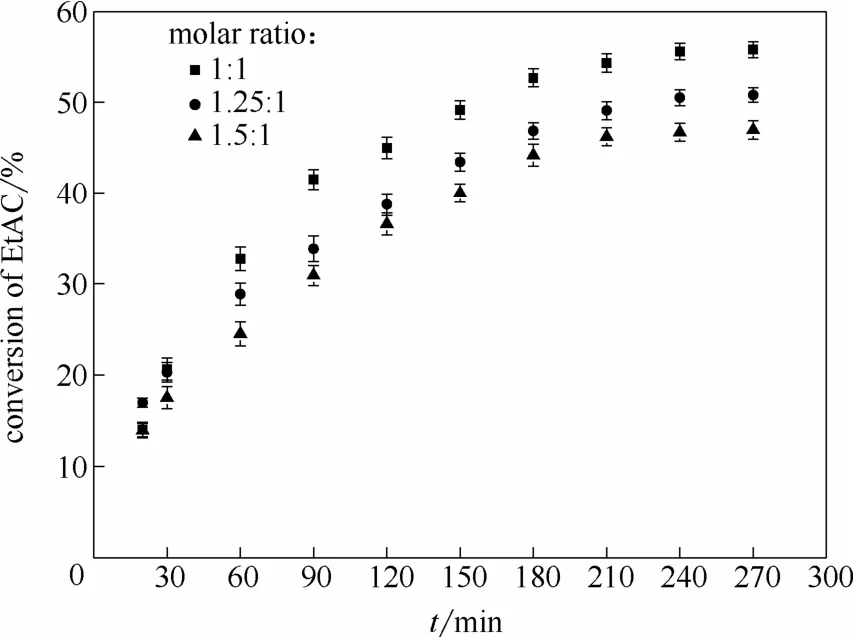
图5 进料醇酯比对乙酸乙酯转化率的影响Fig.5 Effect of initial molar ratio on conversion of ethyl acetate
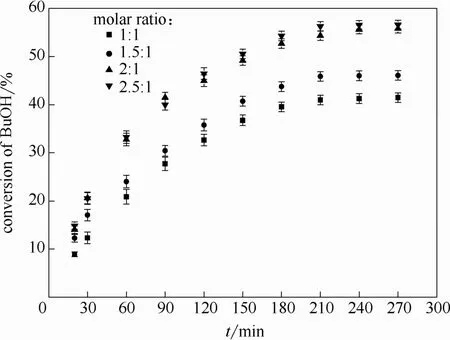
图6 进料酯醇比对正丁醇转化率的影响Fig.6 Effect of initial molar ratio on conversion of n-butanol

图7 温度对正丁醇转化率的影响Fig.7 Effect of temperature on conversion of n-butanol
(2)乙酸乙酯过量
在温度为 65℃、催化剂用量为正丁醇质量的10%,搅拌速率为300 r·min-1的情况下,乙酸乙酯与正丁醇摩尔比分别为 1:1、1.5:1、2:1、2.5:1 时进行了3组平行实验,催化剂用量对正丁醇的转化率影响如图6所示。从图中可以看出随着乙酸乙酯量的增加,正丁醇的转化率也随之增加,当酯醇摩尔比为2:1时,再增大乙酸乙酯的量正丁醇转化率变化不明显,因此选择酯醇摩尔比为2:1。
2.2.4 温度的影响 温度是影响化学反应平衡的一个重要因素,升高温度有利于加快反应速率,但是CALB长时间在高温条件下活性容易受损。为探究酯交换反应的最适温度,在催化剂用量为正丁醇质量的10%、搅拌速率为300 r·min-1、酯醇摩尔比为2:1的条件下,反应温度分别为55、60、65、70℃时探究温度对正丁醇转化率的影响,实验结果如图7所示。从图7中可以看出,随着反应温度升高,正丁醇转化率也升高。当温度为70℃时,转化率最大为61%。实验中当温度继续上升严重损伤酶的活性,因此温度上限选择70℃。
在328.15、333.15、338.15、343.15 K下得到反应平衡时各物质的平衡摩尔组成,可根据式(1)得到各个温度下的反应平衡常数
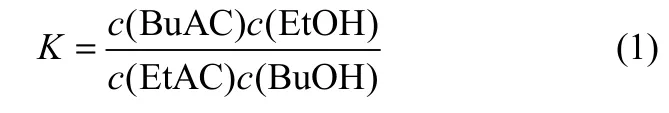
根据平衡常数与反应温度的关系可得到图 8,由图8可得到二者之间的关系为
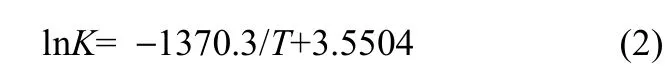
图中的点根据Van’t Hoff方程计算反应焓变,可得标准反应焓变为ΔH=11.39 kJ·mol-1,证明反应为吸热反应,同时根据图8的变化趋势也证实了该反应为吸热反应。
2.2.5 与传统催化剂的比较 催化剂作为影响反应的重要因素,常用的酯交换反应催化剂有阳离子树脂、分子筛、无机催化剂等,文献中对不同种类催化剂的性能进行了深入研究,结果显示无机催化剂Si-3的催化性能最佳[1]。进行了传统催化剂Si-3与固定化CALB的催化性能的实验研究。在Si-3与固定化酶各自最优条件下进行反应,Si-3催化正丁醇能达到的最高转化率为50%,本文固定化酶催化正丁醇的转化率能达到60%。表明固定化CALB催化酯交换反应有良好的性能。

图8 反应温度对平衡常数的影响Fig.8 Effect of reaction temperature on equilibrium constant
2.3 动力学方程的拟合
该酯交换反应为可逆二级反应[21],反应速率可描述为
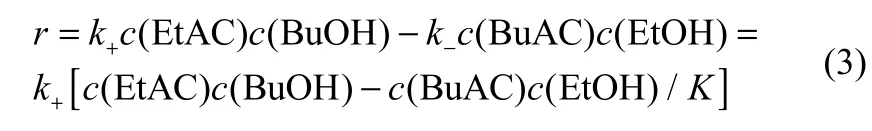
根据动力学模型,将实验数据进行线性回归拟合,得到反应的Arrhenius点,见图9。
由此可得到该酯交换反应的Arrhenius方程为

根据 Arrhenius方程线性回归拟合可以得到相应的动力学参数,数值见表2。

图9 反应速率常数与温度的关系Fig.9 Relation of reaction rate constant and temperature

表2 拟均相模型的动力学参数Table 2 Kinetic parameters
最终得到乙酸乙酯和正丁醇反应的动力学方程
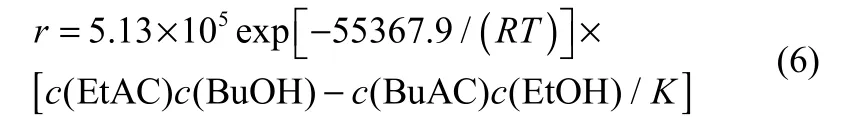
其中
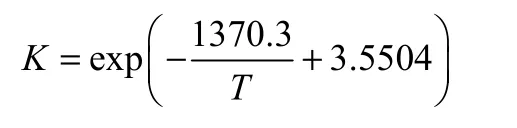
3 结 论
(1)固定化酶CALB的活性与稳定性好,25℃下将固定化酶CALB保存40 d后活性无明显损失,说明此固定化方法合适。
(2)根据动力学实验得出乙酸乙酯和正丁醇酯交换反应的最适条件:转速300 r·min-1、催化剂用量为正丁醇质量的10%、反应温度70℃、酯醇摩尔比为2:1,且正丁醇过量会抑制CALB的催化活性。
(3)对测得的动力学数据进行拟合,得到乙酸乙酯和正丁醇酯交换反应的动力学方程。
符 号 说 明
A——指前因子,L·mol-1·min-1
c——浓度,mol·L-1
Ea——活化能,J·mol-1
K——反应平衡常数
k——反应速率常数,L·mol·min-1
R——气体常数,J·mol-1·K-1
r——反应速率,mol·L-1·min-1
T——反应温度,K
下角标
+——正反应方向
-——逆反应方向
[1]李柏春,耿春霞,张文林,等.酯交换法制备乙酸正丁酯动力学研究[J].化学工程,2016,44(4):59-63.LI B C,GENG C X,ZHANG W L,et al.Kinetics ofn-butyl acetate prepared by trans-esterification[J].Chemical Engineering,2016,44(4):59-63.
[2]STEINIGEWEG S,GMEHLING J.n-Butyl acetate synthesisviareactive distillation:thermodynamic aspects,reaction kinetics,pilot-plant experiments,and simulation studies[J].Industrial &Engineering Chemistry Research,2002,41(22):5483-5490.
[3]SUWANNAKARN K,EDGAR LOTERO A,JR J G G.Solid Brønsted acid catalysis in the gas-phase esterification of acetic acid[J].Ind.Eng.Che.Res.,2007,46(46):7050-7056.
[4]HU X,ZHOU Z,SUN D,et al.Esterification of fatty acid by zirconic catalysts[J].Catalysis Letters,2009,133(90):90-96.
[5]韩越,陈曦,王俊,等.杂多酸 H3PW6Mo6O40超声催化合成乙酸正丁酯[J].精细化工中间体,2010,27(4):382-386.HAN Y,CHEN X,WANG J,et al.Synthesis ofn-butyl acetate catalyzed by heteropolyacids H3PW6Mo6O40under ultrasound irradiation[J].Fine Chemical Intermediates,2010,27(4):382-386.
[6]TIAN Z,DENG Q,YIN Y L,et al.Preparation of SBA-15 molecular sieve modified with lanthanum-and its catalytic activity in synthesis ofn-butyl acetate[J].Petrochem.Tech.,2008,37(7):667-671.
[7]林文俊,钟丽娜,陈艳秋,等.季铵盐型离子液体催化合成乙酸正丁酯[J].化工学报,2011,62(S2):74-79.LIN W J,ZHONG L N,CHEN Y Q,et al.Quaternary ammonium acidic ionic liquids as esterification catalyst for synthesis ofn-butyl acetate[J].CIESC Journal,2011,62(S2):74-79.
[8]GORAK A,STANKIEWICZ A.Intensified reaction and separation systems[J].Annual Review of Chemical & Biomolecular Engineering,2011,2(1):431.
[9]HARMSEN G J.Reactive distillation:the front-runner of industrial process intensification:a full review of commercial applications,research,scale-up,design and operation[J].Chem.Eng.Pro.,2007,46(9):774-780.
[10]陈梦琪,于娜,刘育良,等.反应精馏隔壁塔生产乙酸正丁酯的优化与控制[J].化工学报,2016,67(12):5066-5081.CHEN M Q,YU N,LIU Y L,et al.Optimization and control of reactive dividing wall column for production ofn-butyl acetate[J].CIESC Journal,2016,67(12):5066-5081.
[11]李柏春,韩雪萍,张文林,等.反应精馏制备丁酸酐的过程模拟和实验研究[J].化学工程,2017,(5):72-78.LI B C,HAN X P,ZHANG W L,et al.Simulation and experimental research on butyric anhydride synthesis by reactive distillation [J].Chemical Engineering,2017,(5):72-78.
[12]BECHTOLD M,PANKE S.In situproduct recovery integrated with biotransformations[J].PLOS Computational Biology,2009,1(2):101-105.
[13]WIERSCHEM M,BOLL S,LUTZE P,et al.Evaluation of the enzymatic reactive distillation for the production of chiral compounds[J].Chemie Ingenieur Technik-CIT,2016,88(1/2):147-157.
[14]HEILS R,JENSEN J H,WICHERT S,et al.Enzymatic reactive distillation:kinetic resolution of rac-2-pentanol with biocatalytic coatings on structured packings[J].Industrial & Engineering Chemistry Research,2015,54(38):9458-9467.
[15]KÜHN S,SLUYTER G,CHRISTLIEB M A,et al.In situseparation of chiral target compound (S)-2-pentanol in biocatalytic reactive distillation[J].Industrial & Engineering Chemistry Research,2017,56(22):6451-6461.
[16]REETZ M T,ZONTA A,SIMPELKAMP J.Efficient immobilization of lipases by entrapment in hydrophobic sol-gel materials[J].Biotechnology & Bioengineering,1996,49(5):527.
[17]REETZ M T,ZONTA A,SIMPELKAMP J.Characterization of hydrophobic sol-gel materials containing entrapped lipases[J].Journal of Sol-Gel Science and Technology,1996,7(1/2):35-43.
[18]王洪海,李旭,姜艳军,等.一种反应精馏用酶催化填料及其涂步方法和应用:201710288197.7[P].2017.WANG H H,LI X,JIANG Y J,et al.An enzyme coating method and application of reactive distillation packing:201710288197.7[P].2017.
[19]蔡宏举,王满意,周鑫,等.大孔载体制备及其固定化脂肪酶[J].化工学报,2007,58(6):1529-1534.CAI H J,WANG M Y,ZHOU X,et al.Preparation of macroporous carrier for immobilization of lipase[J].Journal of Chemical Industry and Engineering(China),2007,58(6):1529-1534.
[20]STROMPEN S,WEISS M,INGRAM T,et al.Kinetic investigation of a solvent-free,chemoenzymatic reaction sequence towards enantioselective synthesis of a β-amino acid ester[J].Biotechnology& Bioengineering,2012,109(6):1479-1489.
[21]WANG H X,WU C M,BU X W,et al.A benign preparation of sec-butanolviatransesterification from sec-butyl acetate using the acidic imidazolium ionic liquids as catalysts[J].Chem.Eng.Journal,2014,246(12):366-372.
date:2017-07-10.
Prof.LI Chunli,lichunli_hebut@126.com
supported by the Science and Technology Research and Development Plan of Hebei Province,China (16214505D).
Kinetics ofn-butyl acetate prepared by immobilized enzyme
WANG Honghai,LI Xu,LI Chunli,LIU Wenjing
(National-Local Joint Engineering Laboratory for Energy Conservation of Chemical Process Integration and Resources Utilization,Hebei University of Technology,Tianjin300130,China)
Candida antarcticalipase B(CALB) is immobilized by entrapment in a hydrophobic silica xerogel.Firstly,the stability and reuse of immobilized enzymes are investigated and can be stored for at least 40 d at 25℃without any significant loss of enzyme activity.Then,the transesterification of ethyl acetate withn-butanol in the presence of immobilized CALB is considered in a batch stirred tank reactor.The reaction kinetics is experimentally determined for different stirring rate,catalyst dosage,concentration and temperature.The suitable operating conditions are determined and a pseudo homogeneous kinetic model is established.The calculation data are in better agreement with the experimental data which shows that the kinetic equations are reasonable and suitable for simulation calculation.
catalyst; biocatalysis; kinetics; enzyme; immobilization
TQ 031.2; Q 503
A
0438—1157(2017)12—4685—06
10.11949/j.issn.0438-1157.20170881
2017-07-10收到初稿,2017-09-26收到修改稿。
联系人:李春利。
王洪海(1974—),男,教授。
河北省科技计划项目(16214505D)。
