反气相色谱法与汉森溶解度参数软件测定原煤的三维溶解度参数
2017-12-22潘薪羽赵丽马空军王强
潘薪羽,赵丽,马空军,王强
(1新疆大学理化测试中心,新疆 乌鲁木齐 830046;2新疆大学化学化工学院,煤炭清洁转化与化工过程自治区重点实验室,新疆 乌鲁木齐 830046)
反气相色谱法与汉森溶解度参数软件测定原煤的三维溶解度参数
潘薪羽1,2,赵丽1,2,马空军2,王强1,2
(1新疆大学理化测试中心,新疆 乌鲁木齐 830046;2新疆大学化学化工学院,煤炭清洁转化与化工过程自治区重点实验室,新疆 乌鲁木齐 830046)
采用反气相色谱法(IGC)研究原煤在温度433.15、443.15、453.15、463.15和473.15 K时的三维溶解度参数(HSP),并使用外推法得到原煤室温(298.15 K)时HSP的色散力分量(δd)、极性力分量(δp)、氢键力分量(δh)以及校正溶解度参数(δt)分别为δd=20.83(J·cm-3)1/2,δp=11.95(J·cm-3)1/2,δh=11.08(J·cm-3)1/2,δt=26.44(J·cm-3)1/2。同时,采用汉森三维溶解度参数软件(HSPiP)模拟原煤在室温下的HSP,得到δd=19.92(J·cm-3)1/2,δp=11.18(J·cm-3)1/2,δh=11.47(J·cm-3)1/2,δt=25.56(J·cm-3)1/2。IGC与HSPiP得出的数据一致,研究结果为煤的热力学性质研究及其溶胀剂的选择等应用提供了参考。
煤;热力学性质;溶解度参数;反气相色谱技术;汉森三维溶解度参数软件
引 言
煤经溶胀后可改善煤化产品质量并提高液化转化率[1-2],但煤作为一种复杂的交联体系,其溶胀(溶解)过程表征及机理阐述一直以来都是该领域研究的难题。于是,传统上用于表征聚合物与溶剂间相互作用[3-4]的溶解度理论就被引入用来理解煤在溶剂中的溶胀(溶解)行为[5]。一些研究[6-7]使用Hildebrand一维溶解度参数来推断煤的溶解性,但该方法由于采用非极性、非交联系统的相互作用体系,对实际体系判断存在较大误差[8]。Baltisberger等[9]使用二维溶解度参数解释煤中氢键、π-π键和分散力的相互作用。期间,材料在溶解过程中存在各种附加影响因素使得多维溶解度概念逐步形成[10-11]。Hansen[10]将溶解度理论扩充至三维,由分散力(δd)、极性力(δp)和氢键力(δh)3种类型构成Hansen溶解度参数(HSP)。
原煤溶解度参数测定方法传统上有溶胀法、基团贡献计算法等,Weinberg等[7]采用溶胀法测定了煤的溶解度参数范围为 7.0~23.4 (J·cm-3)1/2。Hombach[6]采用基团贡献计算法测定了 6种煤的溶解度参数。Painter等[12]分别采用溶胀法和基团贡献计算法测定了伊利诺伊6号煤的溶解度参数。然而,上述方法均存在耗时耗力、误差大等缺点。IGC是利用已知物化性质的探针分子来研究待测材料的热力学性质的方法,由于其所采用设备简单、操作简便、数据量大,广泛应用于聚合物、氧化物、木质素、离子液体等的热力学性质研究[13-16]。在IGC法中,将待分析样品作为固定相装入色谱柱中,将一定量低浓度的性质已知的挥发性溶剂的蒸气或液体(探针分子)通过惰性载气带入柱中,使其通过色谱固定相。待测样品的性质可以通过分析已知性质探针溶剂与固定相之间的保留参数计算得出。测试出探针分子与固定相的相互作用。此外,材料的三维溶解度参数还可以通过 Hansen三维溶解度参数软件(HSPiP)模拟确定,该软件由 Charles M.Hansen 发明,采用溶剂对材料的溶胀效果来模拟计算其三维溶解度参数,并对溶剂选择及溶剂相容性进行指导[17]。
鉴于原煤溶解度参数对于选择合适的煤溶胀剂具有较强的指导作用,及煤溶胀处理在提高煤液化效率等方面的重要作用,研究拟采用 IGC和HSPiP模拟测定煤的三维溶解度参数,为煤溶胀及煤液化相关研究工作提供参考。
1 实验部分
1.1 原料及试剂
选用新疆伊犁烟煤为研究对象。将原煤粉碎至120~150 μm,使用HCl和HF对粉碎后原煤进行脱灰处理后,置于80℃条件下真空干燥2 h,避光封存备用。煤质分析结果见表1。
实验所用正戊烷(n-C5)、正己烷(n-C6)、正庚烷(n-C7)、正辛烷(n-C8)、正壬烷(n-C9)、正癸烷(n-C10)、十一烷(n-C11)、十二烷(n-C12)、甲醇、乙醇、丙醇、异丙醇、丁醇、异丁醇、仲丁醇、叔丁醇、二氯甲烷、三氯甲烷、四氯化碳、乙醚、丁醚、环己烷、苯、甲苯、邻二甲苯、间二甲苯、对二甲苯、乙苯、丙苯、丁苯、己烯、辛烯、丙酮、丁酮、戊酮、环己酮、1,4-二氧六环、环氧丙烷、乙腈、噻吩、四氢呋喃、甲酸甲酯、乙酸甲酯、乙酸乙酯、丙酸甲酯、丙酸乙酯均为分析纯,购于天津市百世化工有限公司,使用前未经过纯化。

表1 原煤的工业分析与元素分析Table 1 Proximate and ultimate analyses of raw coal
1.2 仪器与方法
1.2.1 IGC方法仪器及实验条件 使用HCl和HF对原煤进行脱灰,将脱灰煤样使用抽吸法装入长度为120 cm、内径为1 mm的不锈钢柱,在260℃的条件下老化10 h。
采用配有热导池检测器的QP-2010气相色谱仪(日本岛津公司),载气为高纯氮气(99.999%),流速为5 ml·min-1,载气流速由皂膜流量计标定。气化室温度及检测器温度均为 250℃。色谱柱温度分别为160、170、180、190和200℃,进样量为0.2 μl,重复进样 3次得到保留时间,取平均值用于计算。
1.2.2 IGC方法分析HSP的原理 采用IGC测定煤 HSP的方法,是将煤作为固定相填充到色谱柱中,用已知性质有机小分子化合物作为探针,将探针分子气化后通过色谱柱,测试探针分子在不同温度、不同载气流速条件下的保留时间,测定3次取平均值计算煤HSP[18]。比保留体积(Vg0)用来表征探针溶剂的洗脱行为,通过式(1)计算[19-20]

式中,tr为探针溶剂的保留时间;t0为死时间;tr-t0为净保留时间;Pw表示室温下水的饱和蒸气压;F为载气流速;Ta为室温;m为固定相中煤的质量;Pi和Po分别代表色谱柱进口与出口的压力。
根据 Flory-Huggin理论,无限稀释状态下溶剂1在固定相2中的相互作用参数可通过式(2)得出[21-22]
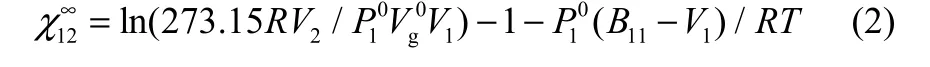
式中,R为气体常数;T为柱温;V2为色谱固定相中待测物的比体积;V1为探针溶剂的摩尔体积;P10为探针溶剂在气相状态下的饱和蒸气压,可通过lgP01=A-B/(t+C)计算所得,其中t是柱温,A、B、C均为常数;B11是探针溶剂的第二Virial系数,可 通 过 B11/Vc=0.430-0.886(Tc/T)-0.694(Tc/T)2-0.0375(n-1)(Tc/T)4.5计算得到,其中Vc和Tc是溶剂的临界摩尔体积和临界温度,n是溶剂的有效碳原子数。
溶解度参数是物质内聚能密度的平方根,是物质固有性质。探针溶剂溶解度参数δ1可通过式(3)计算[23-24]
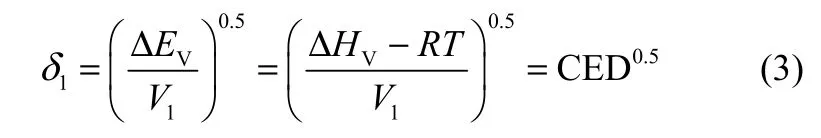
式中,CED是内聚能密度;ΔHV是溶剂蒸发焓;ΔEV是内聚能。
煤的一维溶解度参数δ2可通过式(4)计算[25-26]
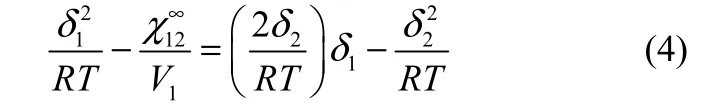
式中,探针溶剂溶解度参数δ1可从物理化学手册[27]中查询得到,根据式(4),左侧对δ1作图可得到一条直线,从斜率2δ2/(RT)或截距可计算出δ2。
煤的 HSP各分量可以根据式(4)中不同探针溶剂组的直线斜率进行计算,计算式如下

式中,mn-alkanes,m1,m2分别为正构烷烃系列、芳烃系列、醇系列利用对δ1作图得到的直线斜率。
1.2.3 HSPiP方法实验条件 煤溶胀度测定采用体积法测定[19]。取2 g干燥煤样置于离心管中,在室温下以4000 r·min-1离心20 min后,测量煤的初始高度h1。加入10 ml溶剂,边加溶剂边搅拌使煤和溶剂充分接触。
垂直静置24 h后,再次将离心管以4000 r·min-1离心20 min,得到溶胀煤,测量煤层高度h2。溶胀度(Q)计算式为Q=h1/h2。Q>1的记为“1”,Q=1的记为“0”。将记录的数据录入由Hansen团队开发的软件HSPiP,软件根据录入数据绘制“Hansen三维溶剂球”,模拟计算结果使所有溶剂和原煤的HSP均分布在球中,其中心位置即为模拟计算所得的最优原煤三维溶解度参数。
1.2.4 HSPiP方法实验原理 相对能量差(RED)用来确定所选有机溶剂对原煤的溶胀性,由式(8)计算得到

式中,R0是模拟计算优化后的“Hansen三维溶解球”半径;Ra为有机溶剂与聚合物在“Hansen三维溶解球”中的距离,Ra由式(9)确定。
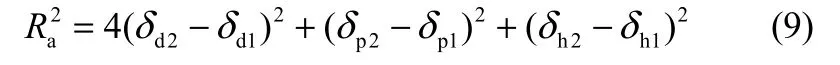
式中,下角标“1”为有机溶剂的相关参数;“2”为聚合物的相关参数。理论上计算得到最小 RED的溶剂即为溶胀原煤的最佳溶剂。
2 结果与讨论
2.1 IGC测定原煤三维溶解度参数
采用 IGC不能直接得到室温煤三维溶解度参数,而研究报道多为室温时HSP。为了便于比较,采用外推法[29]得到室温煤的 HSP 为26.44(J·cm-3)1/2,各分量为δd=20.83(J·cm-3)1/2,δp=
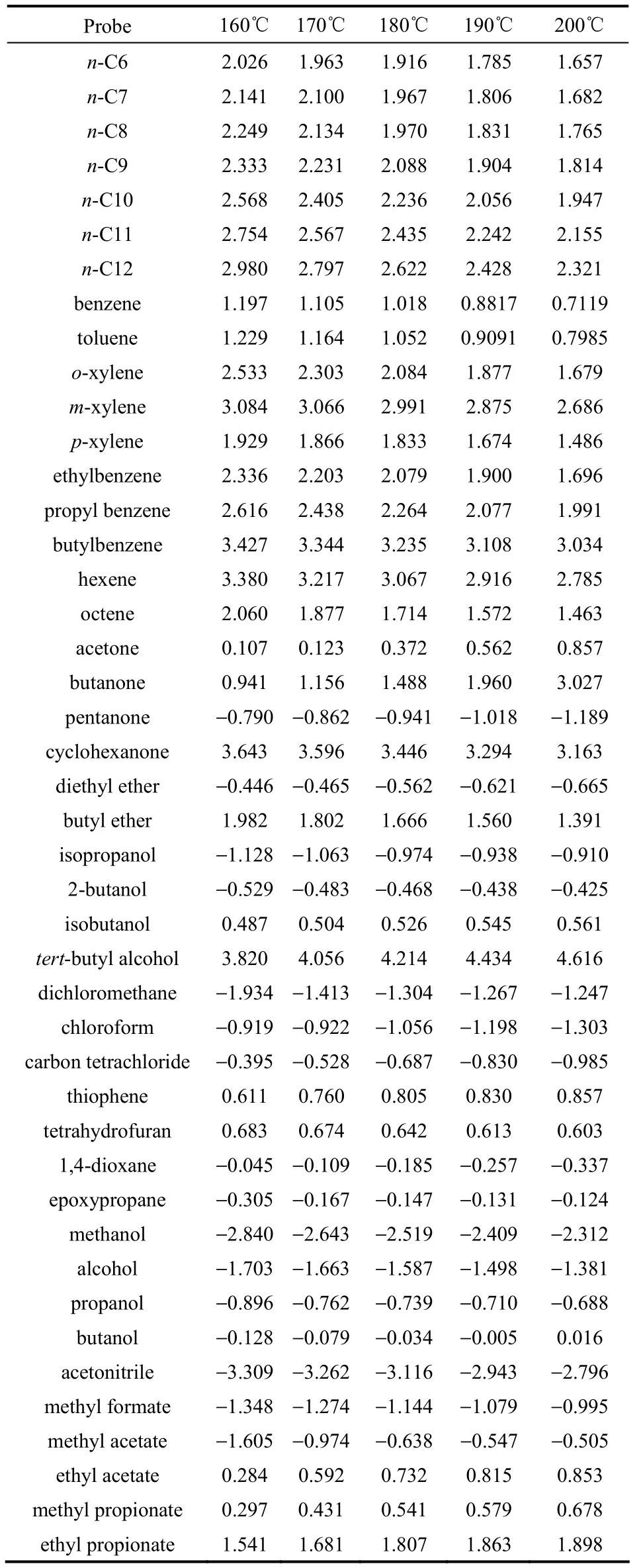
表2 不同温度原煤与探针溶剂的相互作用参数Table 2 Interaction parameter between probes and raw coal at various temperatures
2.2 HSPiP软件模拟原煤的三维溶解度参数
表4为不同溶剂对原煤的溶胀度,将溶胀度数据输入HSPiP软件,软件系统自动计算所输入的溶胀度数据,并得出原煤三维溶解度参数和对应的三维图和二维图,如图2所示,其中三维坐标轴分别为色散力、极性力和氢键力溶解度参数分量。模拟结果的DATA FIT的值越接近于1,说明实验结果越精确,即所有良溶剂都在溶解度参数球内,不良溶剂都在球外。R0表示能溶解原煤Ra的最大值,理论上当有机溶剂的RED大于1时,表明此溶剂在室温下为原煤不良溶剂。

图1 不同温度时对 δ1作图Fig.1 Relation between δ1 and
图2中体积最大球体(绿色)代表原煤溶解度参数球,较小实心球体(蓝色)代表良溶剂,位于原煤溶解度参数球内;较小实心正方体(红色)代表不良溶剂,位于原煤的溶解度参数球外。由原煤溶胀实验和Hansen软件模拟原煤在室温下的HSP为 25.56(J·cm-3)1/2,各分量为δd=19.92(J·cm-3)1/2,δp=11.18(J·cm-3)1/2,δh=11.47(J·cm-3)1/2,R=9.3,DATA FIT=0.951。结果与采用 IGC 方法测定的δd=20.83(J·cm-3)1/2,δp=11.95(J·cm-3)1/2,δh=11.08(J·cm-3)1/2,δt=26.44(J·cm-3)1/2相一致。

表3 斜率以及原煤的HSPTable 3 Slope and HSP of raw coal

表4 原煤溶胀度数据Table 4 Swelling ratio for raw coal
Dw[30]采用基团贡献计算法测定了煤的溶解度参数的范围为 11~12 (cal·cm-3)1/2[22.5~24.55(J·cm-3)1/2]。Weinberg 等[7]采用溶胀法测定了煤的溶解度参数的范围为 14.3~47.9 MPa0.5[7.0~23.4(J·cm-3)1/2]。Painter 等[12]分别采用溶胀法和基团贡献计算法测定了伊利诺伊6号煤的溶解度参数,两种方法得出的结果均为 11.4 (cal·cm-3)1/2[23.3(J·cm-3)1/2]。本实验得出的溶解度参数与文献值相近,说明使用IGC测定和HSPiP软件模拟均可得到准确的溶解度参数值。

图2 原煤的三维溶解度参数球及对应的二维参数Fig.2 Three-dimensional solubility sphere and relevant two-dimensional graphs of raw coal
3 结 论
采用IGC测定和HSPiP软件模拟均可获得室温下原煤的三维溶解度参数,两种方法所得的测定结果基本一致,说明这两种方法均可以准确可靠地测定煤三维溶解度参数。IGC方法测定数据量较大,过程稍繁复,需要时间较长,但可以同时得到不同温度下的煤三维溶解度参数,同时可以获得相互作用参数等热力学数据。HSPiP方法过程简单快速易于推广,但一次仅能测定一个温度下的煤三维溶解度参数。本文通过对原煤三维溶解度参数测定方法研究,将两种方法进行综合,能够得到一种更为有效的选择煤溶胀剂的途径,减少不必要的溶胀实验探索。
[1]JOSEPH J T.Liquefaction behaviour of solvent-swollen coals[J].Fuel,1991,70(2):139-144.
[2]SHUI H,WANG Z,CAO M.Effect of pre-swelling of coal on its solvent extraction and liquefaction properties[J].Fuel,2008,87(13):2908-2913.
[3]ZHANG Y,GANGWANI K K,LEMERT R M.Sorption and swelling of block copolymers in the presence of supercritical fluid carbon dioxide[J].The Journal of Supercritical Fluids,1997,11(1):115-134.
[4]ERTAS D,KELEMEN S R,HALSEY T C.Petroleum expulsion (Ⅰ):Theory of kerogen swelling in multicomponent solvents[J].Energy &Fuels,2006,20(1):295-300.
[5]JONES M B,ARGASINSKI J K.Predictors of solvent effectiveness for dissolution of coal preasphaltenes[J].Fuel,1985,64(11):1547-1551.
[6]HOMBACH H P.General aspects of coal solubility[J].Fuel,1980,59(7):465-470.
[7]WEINBERG V L,YEN T F.‘Solubility parameters’ in coal and coal liquefaction products[J].Fuel,1980,59(5):287-289.
[8]REDELIUS P.Solubility parameters and bitumen[J].Fuel,2000,79(1):27-35.
[9]BALTISBERGER R,WOOLSEY N,SCHWAN J,et al.Solubility parameter relationships between lignite derived asphaltenes and preasphaltenes[J].American Chemical Society Advances in Fuel Chemistry Division Preprints,1984,29:43-55.
[10]HANSEN C M.Hansen Solubility Parameters:a User’s Handbook[M].CRC Press,2007:2-6.
[11]HUGHES J M,AHERNE D,COLEMAN J N.Generalizing solubility parameter theory to apply to one- and two-dimensional solutes and to incorporate dipolar interactions[J].Journal of Applied Polymer Science,2013,127(6):4483-4491.
[12]PAINTER P C,GRAF J,COLEMAN M M.Coal solubility and swelling(Ⅰ):1.Solubility parameters for coal and the Floryχparameter[J].Energy & Fuels,1990,4(4):379-384.
[13]BUCKTON G,DOVE J W,DAVIES P.Isothermal microcalorimetry and inverse phase gas chromatography to study small changes in powder surface properties[J].International Journal of Pharmaceutics,1999,193(1):13-19.
[14]CORDEIROA N,ORNELAS M,ASHORI A,et al.Investigation on the surface properties of chemically modified natural fibers using inverse gas chromatography[J].Carbohydrate Polymers,2012,87(4):2367-2375.
[15]DIECKMANN F,KLINGER C,UHLMANN P,et al.Surface properties of polyamidines investigated by inverse gas chromatography[J].Polymer,2001,42(8):3463-3466.
[16]KOŁODZIEJEK J,GŁÓWKA E,HYLA K,et al.Relationship between surface properties determined by inverse gas chromatography and ibuprofen release from hybrid materials based on fumed silica[J].International Journal of Pharmaceutics,2013,441(1):441-448.
[17]LIU G Y,HOCH M,LIU S S,et al.Quantitative exploration of the swelling response for carbon black filled hydrogenated nitrile rubber with three-dimensional solubility parameters[J].Polymer Bulletin,2015,72(8):1961-1974.
[18]倪海月,任世学,方桂珍,等.反气相色谱法与 Hansen溶解度参数法测定聚乙烯醇溶解度参数及相关热力学性质[J].色谱,2016,34(9):933-939.NI H Y,REN S X,FANG G Z,et al.Determination of solubility parameters and the related thermodynamic properties of polyvinyl alcohol using inverse gas chromatography and Hansen solubility parameters[J].Chinese Journal of Chromatography,2016,34(9):933-939.
[19]MUTELET F,BUTET V,JAUBERT J N.Application of inverse gas chromatography and regular solution theory for characterization of ionic liquids[J].Industrial & Engineering Chemistry Research,2005,44(11):4120-4127.
[20]WANG J,ZHANG Z,YANG X,et al.Determination of solubility parameter for dicationic ionic liquid by inverse gas chromatography[J].Chinese Journal of Chromatography,2009,27(4):480-483.
[21]KAYA I S,İLTER Z,ŞENOL D.Thermodynamic interactions and characterisation of poly[(glycidyl methacrylate-co-methyl,ethyl,butyl) methacrylate]by inverse gas chromatography[J].Polymer,2002,43(24):6455-6463.
[22]NIEDERER B,LE A,CANTERGIANI E.Thermodynamic study of two different chewing-gum bases by inverse gas chromatography[J].Journal of Chromatography A,2003,996(1/2):189-194.
[23]OHTA M,OGUCHI T,YAMAMOTO K.Evaluation of solubility parameter to predict apparent solubility of amorphous and crystalline cefditoren pivoxil[J].Pharmaceutica Acta Helvetiae,1999,74(1):59-64.
[24]YAZICI O,SAKAR D,CANKURTARAN O,et al.Thermodynamical study of poly(n-hexyl methacrylate) with some solvents by inverse gas chromatography[J].Journal of Applied Polymer Science,2011,122(3):1815-1822.
[25]BOUTBOUL A,LENFANT F,GIAMPAOLI P,et al.Use of inverse gas chromatography to determine thermodynamic parameters of aroma-starch interactions[J].Journal of Chromatography A,2002,969(1/2):9-16.
[26]PRICE G J,SHILLCOCK I M.Inverse gas chromatographic measurement of solubility parameters in liquid crystalline systems[J].Journal of Chromatography A,2002,964(1):199-204.
[27]BARTON A F M.CRC Handbook of Solubility Parameters and Other Cohesion Parameters[M].2nd ed.CRC Press,1991:123-138
[28]GUILLET J E,ROMANSKY M,PRICE G J,et al.Studies of polymer structure and interactions by automated inverse gas chromatography[M]// Inverse Gas Chromatography.American Chemical Society,1989:20-32.
[29]YOO B,AFZAL W,PRAUSNITZ J M.Solubility parameters for nine ionic liquids[J].Industrial & Engineering Chemistry Research,2012,51(29):9913-9917.
[30]DW V K.Chemical structure and properties of coal (ⅩⅩⅦ):Coal constitution and solvent extraction[J].Fuel,1966,45:229.
date:2017-05-12.
Prof.WANG Qiang,xjuwq@sina.com
supported by the National Natural Science Foundation of China(21366029,21566036).
Determination of three-dimensional solubility parameters using IGC and HSPiP
PAN Xinyu1,2,ZHAO Li1,2,MA Kongjun2,WANG Qiang1,2
(1Center for Physical and Chemical Analysis,Xinjiang University,Urumqi830046,Xinjiang,China;2Key Laboratory of Coal Cleaning Conversion and Chemical Engineering Process,Xinjiang Uyghur Autonomous Region,College of Chemistry and Chemical Engineering,Xinjiang University,Urumqi830046,Xinjiang,China)
The three-dimensional solubility parameters(HSP) of raw coal were determined by inverse gas chromatography (IGC) in the temperature range 433.15 to 473.15 K.The HSP concept was applied to determine components (δd,δpandδh) of corrected solubility parameter (δt),and the HSP of raw coal was derived asδd=20.83(J·cm-3)1/2,δp=11.95(J·cm-3)1/2,δh=11.08(J·cm-3)1/2andδt=26.44(J·cm-3)1/2by extrapolation method at room temperature (298.15 K),the HSP of raw coal that was measured asδd=19.92(J·cm-3)1/2,δp=11.18(J·cm-3)1/2,δh=11.47(J·cm-3)1/2andδt=25.56(J·cm-3)1/2by the HSPiP method at room temperature.The results are consistent through two approaches.The results of the study provide a reference for the study of the thermodynamic properties of coal and the choice of its swelling agent.
coal; thermodynamic properties; solubility parameters; inverse gas chromatography; HSPiP
TQ 511
A
0438—1157(2017)12—4494—06
10.11949/j.issn.0438-1157.20170609
2017-05-12收到初稿,2017-09-09收到修改稿。
联系人:王强。
潘薪羽(1992—),女,硕士研究生。
国家自然科学基金项目(21366029,21566036)。
