氢氟烃在离子液体[HMIM][PF6]中的扩散系数和亨利常数
2017-12-22刘向阳潘培彭三国何茂刚贺永东
刘向阳,潘培,彭三国,何茂刚,贺永东
(1西安交通大学热流科学与工程教育部重点实验室,陕西 西安 710049;2新疆大学物理科学与技术学院,新疆 乌鲁木齐 830000)
氢氟烃在离子液体[HMIM][PF6]中的扩散系数和亨利常数
刘向阳1,潘培1,彭三国1,何茂刚1,贺永东2
(1西安交通大学热流科学与工程教育部重点实验室,陕西 西安 710049;2新疆大学物理科学与技术学院,新疆 乌鲁木齐 830000)
氢氟烃+离子液体是一种非常有潜力的吸收式制冷循环工质对。利用压力衰减法测量了303.15~343.15 K范围内6种氢氟烃(R32、R125、R161、R143a、R1234yf、R152a)在离子液体1-已基-3-甲基咪唑六氟磷酸盐([HMIM][PF6])中的扩散系数和亨利常数。结果表明:6种氢氟烃在[HMIM][PF6]中的扩散系数和亨利常数均随着温度的升高而增大。在6种氢氟烃中,因R32在[HMIM][PF6]中具有较大的溶解度和扩散系数,所以 R32+[HMIM][PF6]较适合作为吸收式制冷循环的工质对。最后,采用 Arrhenius方程对 6种氢氟烃在[HMIM][PF6]中的扩散系数和亨利常数进行了关联,计算结果与实验数据的平均绝对相对偏差分别小于2.5%和6.0%。
压力衰减法;扩散系数;亨利常数;离子液体;氢氟烃
引 言
随着经济的快速发展,能源需求问题日益突出。化石燃料的大量消耗造成了严重的环境污染问题,工业生产中大量的余热和废热未加利用直接排放到大气中。因此,研究低品质能量驱动的吸收式制冷循环引起了能源领域研究者的广泛兴趣[1-3]。为了提高吸收式制冷循环的效率,选择合适的制冷剂——吸收剂工质对显得尤为重要。目前,使用最广泛的工质对是NH3-H2O和LiBr-H2O,但是它们有诸多缺点,如有毒性、腐蚀性、易结晶且需要负压操作等。
离子液体作为一种新型的吸收剂,是由体积较大的有机阳离子和无机或有机阴离子组成,在室温及其附近(<100℃)呈液态,具有极低的饱和蒸气压、良好的热稳定性以及较高的溶解能力。氢氟烃(HFC)具有较低的沸点、良好的化学稳定性和友好的环境性。离子液体和HFC的这些优点可以有效地克服NH3-H2O和LiBr-H2O工质对的不足,被认为是非常有潜力的吸收式制冷循环工质对[4-6]。
HFC+离子液体工质对的热力学性质和动力学性质对制冷循环效率的提高起着至关重要的作用,特别是HFC在离子液体中的溶解度和扩散系数。目前,国际上关于HFC在离子液体中溶解度的研究较多,例如,Ren等[7]测量了 R134a在离子液体[HMIM][Tf2N]中的溶解度;Sousa等[8-9]研究了R-23、R32和 R-41在不同离子液体中的溶解度;Shiflett等[10-14]测量了 R-1141、R-134、R-134a、R161、R32、R-41、R125、R143a、R-23、R152a 在不同离子液体中的溶解度数据;本课题组[15-18]也做了诸多这方面的工作,研究了R32、R125、R161、R143a、R1234yf、R152a、R-134a、R1234ze(E)在离子液体[HMIM][Tf2N]和[P(14)666][TMPP]中的溶解度。但HFC在离子液体中扩散系数的研究还较为匮乏,只有 Shiflett等[11-13]研究了 R32、R-23、R125、R-134a、R143a和R152a在不同离子液体中的扩散系数。国际上已有学者报道了HFC制冷剂在阴离子为[BF4]、[TfO]、[Tf2N]离子液体中的溶解度。研究结果显示,离子液体阴离子中氟原子对 HFC制冷剂的溶解度影响较大,为了进一步验证氟原子对HFC制冷剂溶解度的影响,选取[HMIM][PF6]作为研究对象。基于此,本文对 303.15~343.15 K范围内 R32(CH2F2)、R125(CHF2CF3)、R161(C2H5F)、R143a(CF3CH3)、R1234yf(CF3CFCH2)、R152a(CHF2CH3)在离子液体[HMIM][PF6]中的扩散系数和亨利常数进行了测量。目前,气体在离子液体中扩散系数的测量方法较多,主要有重量法[10-14]、石英弹簧法[19]、延迟时间法[20]、动态光散射法[21]、压力衰减法[22-24]等,其中压力衰减法实验装置简单、成本较低、操作方便,可同时测量气体在离子液体中的扩散系数和亨利常数。因此,采用这种方法开展了测量工作。为了方便工程应用,采用Arrhenius方程对实验数据进行了关联。
1 实验方法
1.1 实验材料
测量所用的 HFC购买于浙江中龙制冷剂有限公司,纯度均高于 99.9%(质量)。离子液体[HMIM][PF6]购买于上海成捷试剂有限公司,纯度高于99.0%(质量)。在使用前置于393 K的真空干燥箱中24 h,以去除离子液体中的挥发性物质。

图1 实验系统Fig.1 Schematic diagram of experimental system
1.2 实验装置
实验系统主要包括:气瓶、真空泵、磁力搅拌器、气体腔、扩散腔和温度压力测量系统,如图 1所示。实验开始前,通过称重法标定气体腔和扩散腔的体积(包括连接的管路和阀门的体积),分别为48.99和20.12 ml。气体腔和扩散腔的温度通过恒温槽控制,恒温槽的精度为0.05 K。恒温槽内的温度由Fluke 5608铂电阻温度计进行测量,精度为0.02 K。气体腔和扩散腔内气体的压力由Keller 33X压力传感器进行测量,量程为0~1 MPa,精度为满量程的0.01%。温度和压力的数据通过吉时利2700万用表和Labview软件建立的实时数据采集系统采集并保存。
1.3 实验步骤和原理
实验时,首先利用精密天平称取一定质量的离子液体放于扩散腔内,并打开所有阀门,用真空泵对整个实验系统抽真空,然后关闭所有阀门。打开阀门1和阀门3,从气瓶放入一定量的待测气体到气体腔中,关闭阀门,待气体腔内的压力和温度稳定后,打开阀门4并迅速关闭。则进入扩散腔内待测气体的量可由式(1)计算
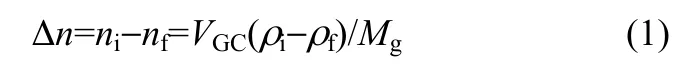
式中,Δn为进入扩散腔内气体的量;VGC为气体腔的体积;ni和nf分别为打开阀门4前后气体腔内气体的量;ρi和ρf分别为恒定温度和压力下,打开阀门4前后气体腔内气体的密度,其可以通过REFPROP 9.1软件计算得到;Mg为气体的摩尔质量。
气体进入扩散腔 20 min以后,打开磁力搅拌器,加速气体在离子液体中的扩散进程。待扩散腔内气体的压力不再改变时,则达到了溶解平衡,此时溶解到离子液体中气体的量可以由式(2)计算
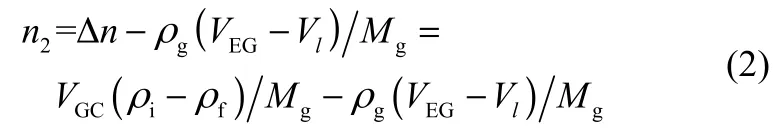
式中,ρg为扩散腔内待温度压力稳定后气体的密度;VEG为扩散腔的体积;Vl为扩散腔中离子液体的体积。则气体在离子液体中溶解度的计算式如下

式中,nl为离子液体的量。在气体溶解度较低的情况下,压力和溶解度呈正比,亨利常数H可以由式(4)计算

式中,f是气体的逸度,可通过REFPROP 9.1软件计算得到。
在扩散的前20 min,即磁力搅拌器未开启之前,基于半无限扩散模型利用压降数据计算气体在离子液体中的扩散系数,根据Fick第二定律,一维的扩散过程可以由式(5)描述[25]

式中,C为t时刻气体在离子液体中的浓度;D为扩散系数,可以认为是一个常数;z为扩散方向。
低压下,离子液体表面的浓度Cz=0满足如下关系式

式中,k为比例常数;Cz=t=0为初始时刻离子液体表面的浓度,Cz=0可以通过式(7)计算得到
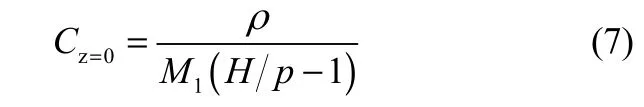
式中,ρ为离子液体的密度,Ml为离子液体的摩尔质量。
根据边界条件和初始条件,t时刻单位面积内离子液体中气体的溶解量可由式(8)表示
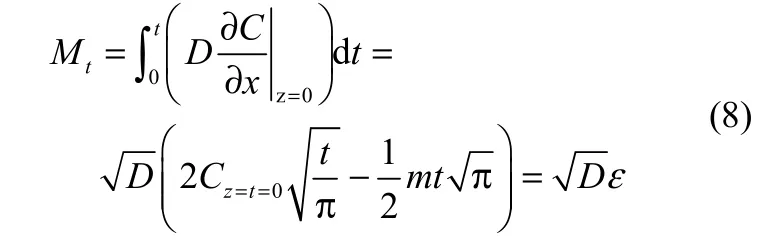
扩散系数D可以由实验数据拟合得到。
1.4 实验不确定度分析
本文中温度和压力的扩展不确定度U可由式(9)表示
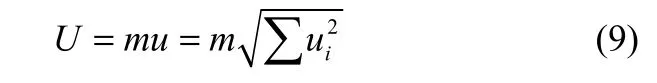
式中,ui是各个影响因素的标准不确定度,u是总的合成标准不确定度,m是置信因子。本文中m=2,置信度为95%。温度的不确定度主要来源于温度计、恒温槽和数据采集系统。经计算,温度的扩展不确定度为0.1 K。气体在离子液体中达到溶解平衡时,扩散腔中的压力不再变化,这时扩散腔中的压力称为平衡压力(peq),其不确定度主要来源于压力传感器和数据采集系统。经计算,平衡压力的扩展不确定度小于0.1 kPa。扩散过程中扩散腔的压力是不断下降的,为了表征测量所得扩散系数所处的压力状态,定义从扩散开始至扩散结束所采集压力的平均值为平均压强(pavg)。平均压强的不确定度用所采集压力数据的方差进行计算。经计算,平均压强的扩展不确定度小于8.6 kPa。
溶解度的不确定度主要来源于式(2)和式(3)中的物理量,包括气体腔容积、扩散腔容积、离子液体体积、气体腔气体的初始和最终密度、扩散腔中气体密度和离子液体的量,其标准不确定度计算式为
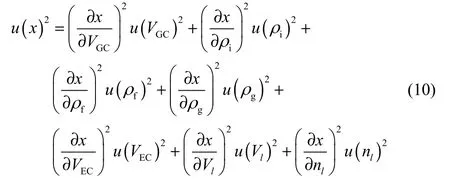
式中,u(VGC)是气体腔容积的标准不确定度,u(VEC)是扩散腔容积的标准不确定度,u(Vl)是离子液体体积的标准不确定度,u(ρi)、u(ρf)是气体腔气体的初始和最终密度的标准不确定度,u(ρg)是扩散腔中气体密度的标准不确定度,u(nl)是离子液体的量的标准不确定度。考虑随机误差,溶解度的相对扩展不确定度Ur=mu(x)/x小于4.0%。
由式(4)可知,亨利常数的影响因素有溶解度和压力,其扩展不确定度计算式为

经计算,亨利常数的相对扩展不确定度小于4.0%。
对于线性函数y=ax+b,斜率a、截距b的标准不确定度用式(12)计算
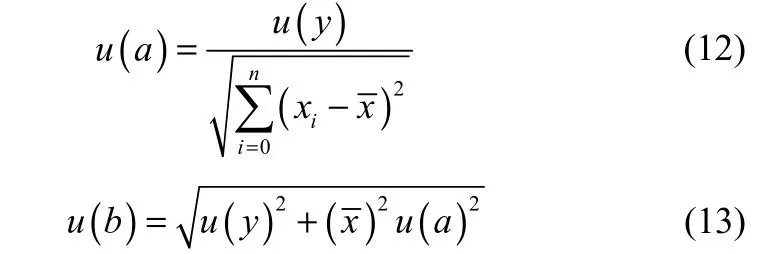
式中,u(y)是因变量y的标准不确定度,是变量xi的平均值,计算式为

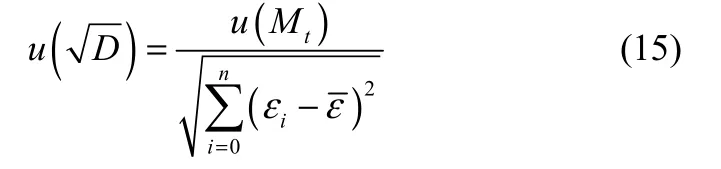
式中,u(Mt)是Mt的标准不确定度,计算式为
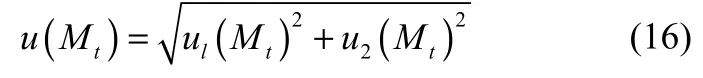
式中,ul(Mt)是由随机误差引起的标准不确定度,u2(Mt)是由实验装置引起的标准不确定度。扩散系数的合成标准不确定度用式(17)计算

式中,ul(D)是由随机误差引起的标准不确定度,u2(D)是由实验装置引起的标准不确定度。扩散系数D的相对扩展不确定度的计算式如下

根据式(18),半无限体积模型中扩散系数的扩展不确定度小于9.0%。
2 结果和讨论
该实验系统测量气体在离子液体中亨利常数的可靠性在以前的工作中已得到验证[15-18],而为了验证气体在离子液体中扩散系数测量的可靠性,本文测量了283.15、298.15和313.15 K下CO2在离子液体[HMIM][Tf2N]中扩散系数,并与Moganty等[26]的实验数据进行了比较,实验值与文献值吻合良好,实验测量结果都在文献数据的误差范围之内,验证结果如表1所示。

表1 实验结果和文献值的比较Table 1 Comparison of experimental results and literature values
本文采用上述实验方法测量了 6种氢氟烃R32、R125、R161、R143a、R1234yf、R152a 在[HMIM][PF6]中的扩散系数和亨利常数,结果如表2所示。HFC在离子液体中扩散系数的数量级为10-10~10-11m2·s-1,与文献中的结果一致[19-24]。而气体在水、醇和烷烃等传统溶剂中扩散系数的数量级为10-8~10-9m2·s-1,比气体在离子液体中的扩散系数小 1~2个数量级,该现象可通过 Stokes-Einstein方程解释

式中,R为气体常数;T为热力学温度;η为溶剂的黏度;r为溶质分子的半径。从式(19)可以看出,在温度一定时,溶剂的黏度越大,溶质在溶剂中的扩散系数越小,而离子液体的黏度比传统溶剂大得多,一般高1~2个数量级。如[HMIM][PF6]在常压下303.15 K时的黏度为348 mPa·s[27],而水在相同温度和压力下的黏度仅为0.798 mPa·s[28]。
图2和图3给出了6种HFC在[HMIM][PF6]中的扩散系数和亨利常数,从图中可以看出,扩散系数和亨利常数都随着温度的增加而增加,较高的扩散系数意味着制冷剂在吸收剂中的扩散速率较快,而亨利常数越大,吸收剂对制冷剂的溶解能力越差。
从图2中可以看出,6种HFC在[HMIM][PF6]中扩散系数的大小顺序为R32>R125>R143a>R161>R1234yf>R152a。从图 3可以看出,6种 HFC在[HMIM][PF6]中亨利常数的大小顺序为 R125>R143a>R1234yf>R32>R161>R152a,并 且 R125 、R143a、R1234yf的亨利常数明显大于R32、R161、R152a。从这6种HFC在[HMIM][PF6]中扩散系数和亨利常数的大小顺序可以看出,扩散系数和亨利常数之间没有明显的关系。另外,对于这6种HFC,亨利常数越大,它们在[HMIM][PF6]中的溶解度对温度越敏感。为了提高制冷循环的性能,在选择工质对时,制冷剂在吸收剂中不仅要具有较高的溶解度,同时也要具有较好的扩散能力。本文研究的 6种 HFC中,R32具备这种特性,它在离子液体[HMIM][PF6]中的扩散系数是最大的,而且它在离子液体[HMIM][PF6]中的溶解度与 R161和 R152a的溶解度相差不大,明显高于另外3种HFC。图3还显示了R134a在[HMIM][PF6]中的亨利常数[7],其亨利常数随温度的变化规律与本文实验数据是一致的。通过分析发现,这 7种制冷剂在[HMIM][PF6]中的溶解度并不随其摩尔质量和偶极矩的增大而增大,说明HFC与[HMIM][PF6]之间不但存在van der Waals作用力,应该还存在H—F氢键力。
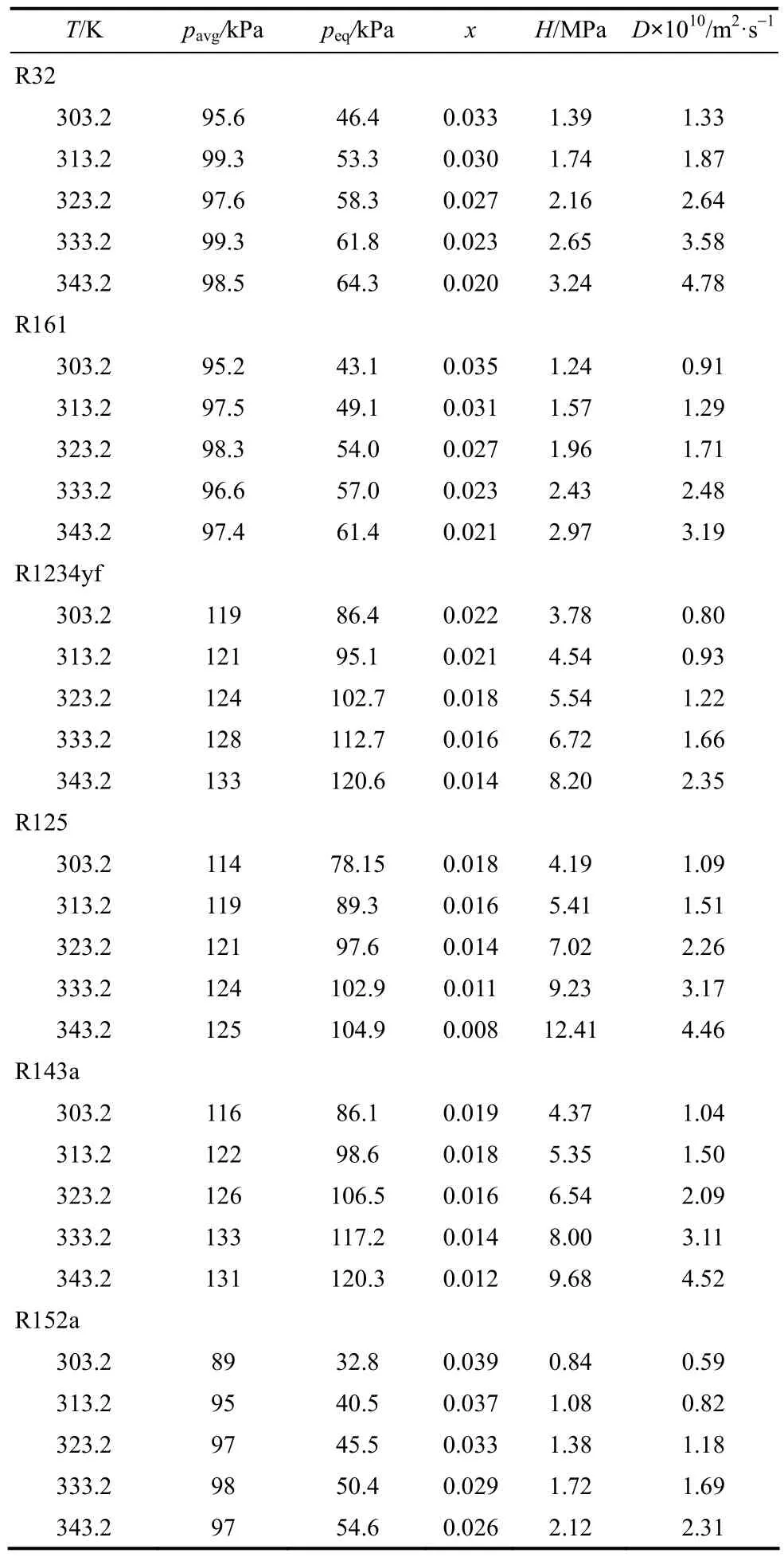
表2 6种氢氟烃在[HMIM][PF6]中的扩散系数和亨利常数Table 2 Diffusion coefficients D and Henry’s constants H of six hydrofluorocarbons in [HMIM][PF6]

图2 扩散系数与温度的变化关系Fig.2 Diffusion coefficients as function of temperature
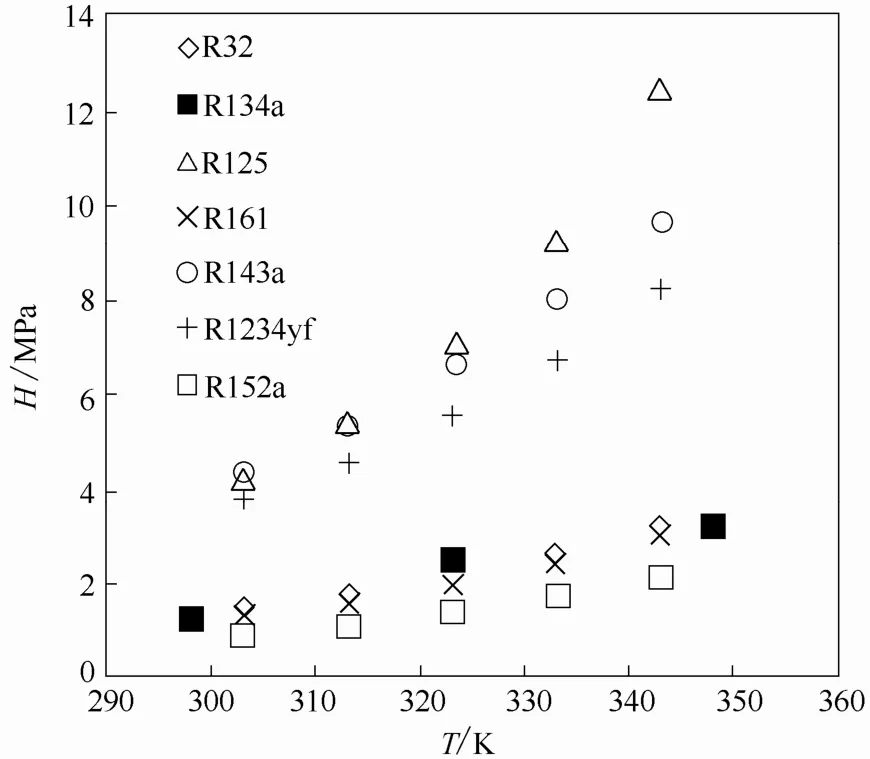
图3 HFCs在[HMIM][PF6]中亨利常数随温度的变化关系Fig.3 Henry’s constants of HFCs in [HMIM][PF6]as function of temperature
为了分析[HMIM][PF6]阳离子对HFC在其中溶解度的影响,在图4中比较了R125、R143a、R161和 R152a 在[HMIM][PF6]、[BMIM][PF6][11-12,29]中的溶解度。由图4可见,4种 HFC在[BMIM][PF6]中的溶解度均低于在[HMIM][PF6]中的溶解度,这主要因为[HMIM][PF6]中阳离子的烷基链较长,摩尔质量较大,产生了较大van der Waals 作用力。
为了分析[HMIM][PF6]的阳离子对HFC在其中扩散系数的影响,在图5中比较了R32、R125、R143a和 R152a 在[HMIM][PF6]、[BMIM][PF6][11-12,29]中的扩散系数。由图 5可见,尽管[HMIM][PF6]的黏度大于[BMIM][PF6],4种 HFC 在[BMIM][PF6]中的扩散系数均低于在[HMIM][PF6]中的扩散系数,原因应该是[HMIM][PF6]对HFC具有较高的溶解度,HFC的溶解较大程度地降低了其黏度。
为探究[HMIM][PF6]中阴离子对HFC溶解度的影响[30],比较了R32在[HMIM][PF6]、[HMIM][TfO]、[HMIM][BF4]和[HMIM][Tf2N]中的亨利常数,如图6所示。由图可见,[HMIM][Tf2N]对R32的溶解度远高于其他3种离子液体,而R32在其他3种离子液体的溶解度并不随其摩尔质量和氟原子个数的增加而增大,这应该是氢键作用造成的。
为了分析[HMIM][PF6]中阴离子对HFC扩散系数的影响[30],比较了 R32在[HMIM][PF6]、[HMIM][TfO]、[HMIM][BF4]和[HMIM][Tf2N]中的扩散系数,如图7所示。由图可见,[HMIM][TfO]对R32的扩散系数远高于其他3种离子液体,但是它的黏度是高于[HMIM][Tf2N]的,这种现象可能是由于HFC溶解造成了离子液体黏度的变化,也有可能是缔合作用造成的。
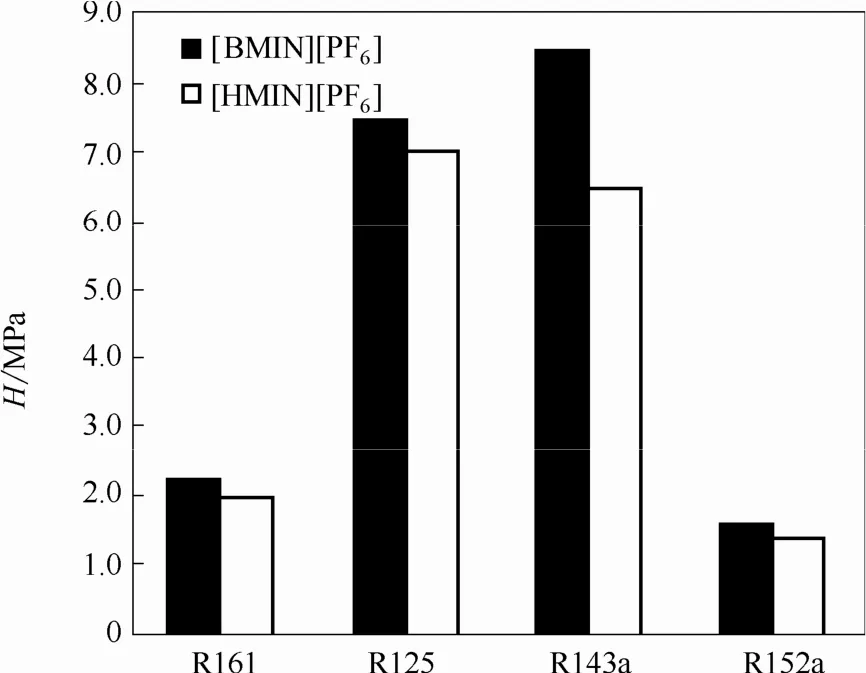
图4 323.15 K时HFCs在[HMIM][PF6]、[BMIM][PF6]中亨利常数的比较Fig.4 Henry’s constants of hydrofluorocarbons in[HMIM][PF6]and [BMIM][PF6]at 323.15 K
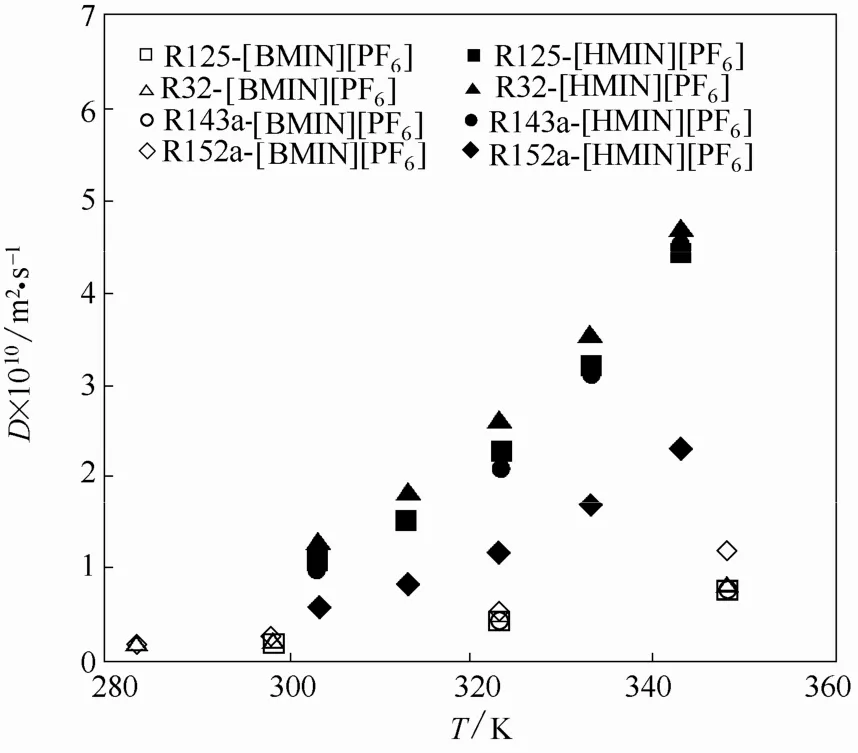
图5 HFCs在[HMIM][PF6]和[BMIM][ PF6]中的扩散系数Fig.5 Diffusion coefficients of HFCs in [HMIM][PF6]and[BMIM][ PF6]

图6 R32 在[HMIM][PF6]、[HMIM][TfO]、[HMIM][BF4]和[HMIM][Tf2N]中的亨利常数Fig.6 Henry’s constants of R32 in [HMIM][PF6],[HMIM][TfO],[HMIM][BF4]and [HMIM][Tf2N]
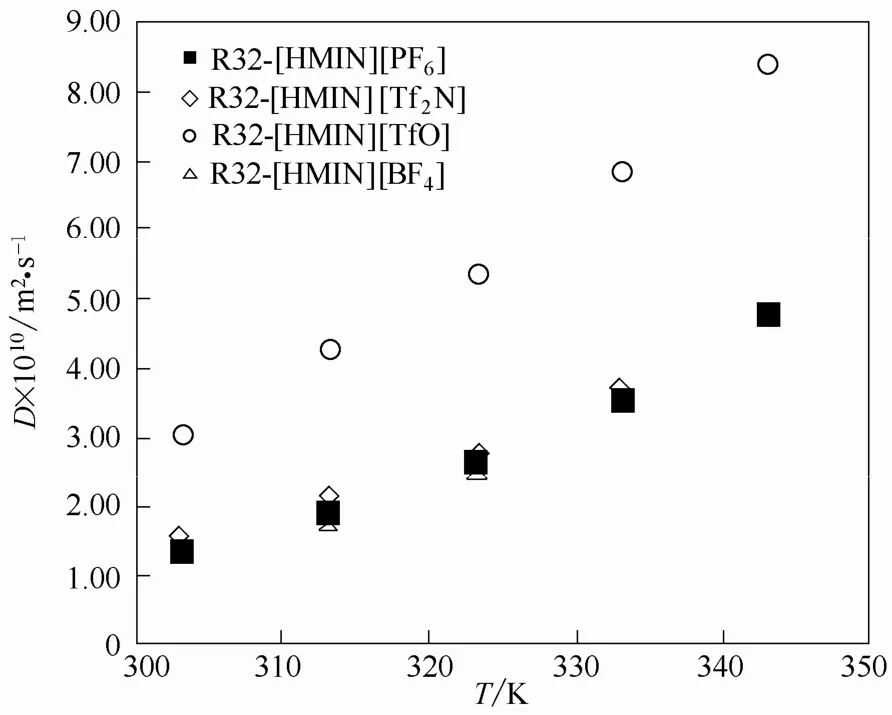
图7 R32 在[HMIM][PF6]、[HMIM][TfO]、[HMIM][BF4]和[HMIM][Tf2N]中的扩散系数Fig.7 Diffusion coefficients of R32 in [HMIM][PF6],[HMIM][TfO],[HMIM][BF4]and [HMIM][Tf2N]
扩散系数和亨利常数随温度的变化一般满足Arrhenius方程
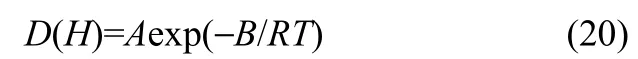
式中,R为气体常数;T为热力学温度;A和B为拟合参数。Arrhenius方程的计算结果和实验值的平均绝对相对偏差(AARD)采用式(21)计算
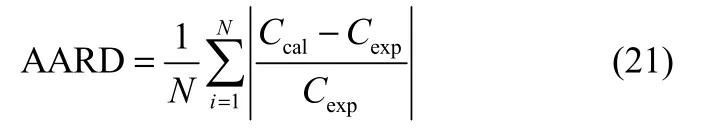
式中,Ccal为Arrhenius方程的计算值;Cexp为实验测量结果。采用Arrhenius方程对6种HFC在[HMIM][PF6]中亨利常数和扩散系数进行了关联,计算结果如表3所示,从表中可以看出,Arrhenius方程的计算结果和实验值吻合良好,亨利常数和扩散系数的AARD分别小于2.5%和6.0%。

表3 Arrhenius方程的拟合参数和计算结果Table 3 Coefficients and results of Arrhenius equation
3 结 论
本文采用压力衰减法测量了303.15~343.15 K范围内6种HFC在离子液体[HMIM][PF6]中的亨利常数和扩散系数。由于离子液体具有较大的黏度,气体在离子液体中的扩散系数比在传统的溶剂中大1~2个数量级。在本文研究的6种HFCs中,R32在离子液体[HMIM][PF6]中具有较快的扩散速率又具有较大的溶解度。因此,R32+[HMIM][PF6]是一种较为有前景的吸收式制冷循环工质对。采用Arrhenius方程对6种HFCs在[HMIM][PF6]中的亨利常数和扩散系数进行了拟合,平均绝对相对偏差分别小于2.5%和6.0%。
符 号 说 明
A,B——拟合参数
C——气体在离子液体中的浓度,mol·cm-3
Ccal——Arrhenius方程的计算值
Cexp——Arrhenius方程的实验值
Cz=0——离子液体表面的浓度,mol·cm-3
Cz=t=0——初始时刻离子液体表面的浓度,mol·cm-3
D——扩散系数,m2·s-1
H——亨利常数,MPa
k——比例常数
Mg——气体的摩尔质量,g·mol-1
Ml——离子液体的摩尔质量,g·mol-1
Mt——t时刻单位面积离子液体中气体的溶解量,g·cm-2
nf——打开阀门4后气体腔内气体的量,mol
ng——溶解到离子液体中气体的量,mol
ni——打开阀门4前气体腔内气体的量,mol
nl——离子液体的量,mol
Δn——进入扩散腔内气体的量,mol
p——压力,MPa
R——通用气体常数,
r——溶质分子的半径,nm
T——温度,K
t——时间,s
VEG——扩散腔的体积,cm3
VGC——气体腔的体积,cm3
Vl——离子液体的体积,cm3
x——溶解度
z——扩散距离,cm
η——溶剂的黏度,mPa·s
ρ——扩散腔内气体的密度,g·cm-3
ρf——打开阀门4后气体腔内气体的密度,g·cm-3
ρi——打开阀门4前气体腔内气体的密度,g·cm-3
下角标
cal——计算值
EG——扩散腔
exp——实验值
GC——气体腔
g——气体
l——离子液体
[1]SRIKHIRIN P,APHORNRATANA S,CHUNGPAIBULPATANA S.A review of absorption refrigeration technologies[J].Renewable and Sustainable Energy Reviews,2001,5(4):343-372.
[2]FARSHI L G,FERREIRA C A I,MAHMOUDI S M S,et al.First and second law analysis of ammonia/salt absorption refrigeration systems[J].International Journal of Refrigeration,2014,40:111-121.
[3]FAÚNDEZ C A,BARRIENTOS L A,VALDERRAMA J O.Modeling and thermodynamic consistency of solubility data of refrigerants in ionic liquids[J].International Journal of Refrigeration,2013,36(8):2242-2250.
[4]KIM S,KOHL P A.Theoretical and experimental investigation of an absorption refrigeration system using R134/[bmim][PF6]working fluid[J].Industrial & Engineering Chemistry Research,2013,52(37):13459-13465.
[5]SEILER M,KÜHN A,ZIEGLER F,et al.Sustainable cooling strategies using new chemical system solutions[J].Industrial &Engineering Chemistry Research,2013,52(47):16519-16546.
[6]DONG L,ZHENG D,WU X.Working pair selection of compression and absorption hybrid cycles through predicting the activity coefficients of hydrofluorocarbon+ionic liquid systems by the UNIFAC model[J].Industrial & Engineering Chemistry Research,2012,51(12):4741-4747.
[7]REN W,SCURTO A M.Phase equilibria of imidazolium ionic liquids and the refrigerant gas,1,1,1,2-tetrafluoroethane (R-134a)[J].Fluid Phase Equilibria,2009,286(1):1-7.
[8]SOUSA J M M V,GRANJO J F O,QUEIMADA A J,et al.Solubilities of hydrofluorocarbons in ionic liquids:experimental and modelling study[J].The Journal of Chemical Thermodynamics,2014,73:36-43.
[9]SOUSA J M M V,GRANJO J F O,QUEIMADA A J,et al.Solubility of hydrofluorocarbons in phosphonium-based ionic liquids:experimental and modelling study[J].The Journal of Chemical Thermodynamics,2014,79:184-191.
[10]SHIFLETT M B,YOKOZEKI A.Solubility differences of halocarbon isomers in ionic liquid [emim][Tf2N][J].Journal of Chemical &Engineering Data,2007,52(5):2007-2015.
[11]SHIFLETT M B,YOKOZEKI A.Solubility and diffusivity of hydrofluorocarbons in room-temperature ionic liquids[J].AIChE Journal,2006,52(3):1205-1219.
[12]SHIFLETT M B,HARMER M A,JUNK C P,et al.Solubility and diffusivity of difluoromethane in room-temperature ionic liquids[J].Journal of Chemical & Engineering Data,2006,51(2):483-495.
[13]SHIFLETT M B,HARMER M A,JUNK C P,et al.Solubility and diffusivity of 1,1,1,2-tetrafluoroethane in room-temperature ionic liquids[J].Fluid Phase Equilibria,2006,242(2):220-232.
[14]SHIFLETT M B,ELLIOTT B A,YOKOZEKI A.Phase behavior of vinyl fluoride in room-temperature ionic liquids [emim][Tf2N],[bmim][N(CN)2],[bmpy][BF4],[bmim][HFPS]and [omim][TFES][J].Fluid Phase Equilibria,2012,316:147-155.
[15]LIU X,HE M,LV N,et al.Vapor-liquid equilibrium of three hydrofluorocarbons with [HMIM][Tf2N][J].Journal of Chemical &Engineering Data,2015,60(5):1354-1361.
[16]LIU X,QI X,LV N,et al.Gaseous absorption of fluorinated ethanes by ionic liquids[J].Fluid Phase Equilibria,2015,405:1-6.
[17]LIU X,HE M,LÜ N,et al.Solubilities of R161 and R143a in 1-hexyl-3-methylimidazolium bis (trifluoromethylsulfonyl) imide[J].Fluid Phase Equilibria,2015,388:37-42.
[18]LIU X,BAI L,LIU S,et al.Vapor-liquid equilibrium of R1234yf/[HMIM][Tf2N]and R1234ze (E)/[HMIM][Tf2N]working pairs for the absorption refrigeration cycle[J].Journal of Chemical &Engineering Data,2016,61:3952-3957.
[19]GONG Y,WANG H,CHEN Y,et al.A high-pressure quartz spring method for measuring solubility and diffusivity of CO2in ionic liquids[J].Industrial & Engineering Chemistry Research,2013,52(10):3926-3932.
[20]CONDEMARIN R,SCOVAZZO P.Gas permeabilities,solubilities,diffusivities,and diffusivity correlations for ammonium-based room temperature ionic liquids with comparison to imidazolium and phosphonium RTIL data[J].Chemical Engineering Journal,2009,147(1):51-57.
[21]RAUSCH M H,HELLER A,HERBST J,et al.Mutual and thermal diffusivity of binary mixtures of the ionic liquids [BMIM][C(CN)3]and [BMIM][B(CN)4]with dissolved CO2by dynamic light scattering[J].The Journal of Physical Chemistry B,2014,118(17):4636-4646.
[22]CAMPER D,BECKER C,KOVAL C,et al.Diffusion and solubility measurements in room temperature ionic liquids[J].Industrial &Engineering Chemistry Research,2006,45(1):445-450.
[23]JALILI A H,MEHDIZADEH A,SHOKOUHI M,et al.Solubility and diffusion of CO2and H2S in the ionic liquid 1-ethyl-3-methylimidazolium ethylsulfate[J].The Journal of Chemical Thermodynamics,2010,42(10):1298-1303.
[24]SHOKOUHI M,ADIBI M,JALILI A H,et al.Solubility and diffusion of H2S and CO2in the ionic liquid 1-(2-hydroxyethyl)-3-methylimidazolium tetrafluoroborate[J].Journal of Chemical &Engineering Data,2009,55(4):1663-1668.
[25]CRANK J.The Mathematics of Diffusion[M].Oxford University Press,1979.
[26]MOGANTY S S,BALTUS R E.Diffusivity of carbon dioxide in room-temperature ionic liquids[J].Industrial & Engineering Chemistry Research,2010,49(19):9370-9376.
[27]ROCHA M A A,RIBEIRO F M S,FERREIRA AIMCL,et al.Thermophysical properties of [CN-1C1im][PF6]ionic liquids[J].Journal of Molecular Liquids,2013,188:196-202.
[28]COLLINGS A F,BAJENOV N.A high precision capillary viscometer and further relative results for the viscosity of water[J].Metrologia,1983,19(2):61-66.
[29]SHIFLETT M B,YOKOZEKI A.Gaseous absorption of fluoromethane,fluoroethane,and 1,1,2,2-tetrafluoroethane in 1-butyl-3-methylimidazolium hexafluorophosphate[J].Industrial &Engineering Chemistry Research,2006,45(18):6375-6382.
[30]HE M,PENG S,LIU X,et al.Diffusion coefficients and Henry’s constants of hydrofluorocarbons in [HMIM][Tf2N],[HMIM][TfO],and [HMIM][BF4][J].The Journal of Chemical Thermodynamics,2017,112:43-51.
date:2017-05-10.
Prof.HE Maogang,mghe@mail.xjtu.edu.cn
supported by the National Science Fund for Distinguished Young Scholars of China (51525604).
Diffusion coefficients and Henry’s constants of six hydrofluorocarbons in ionic liquid [HMIM][PF6]
LIU Xiangyang1,PAN Pei1,PENG Sanguo1,HE Maogang1,HE Yongdong2
(1Key Laboratory of Thermo-Fluid Science and Engineering,Ministry of Education,Xi’an Jiaotong University,Xi’an710049,Shaanxi,China;2School of Physical Science and Technology,Xinjiang University,Urumqi830000,Xinjiang,China)
Hydrofluorocarbon + ionic liquid is a potential working pair for the absorption refrigeration cycle.A pressure decay technique was used to measure the diffusion coefficients and Henry’s constants of six hydrofluorocarbons (R32,R125,R161,R143a,R1234yf and R152a) in 1-hexyl-3-methylimidazolium hexafluorophosphate ([HMIM][PF6]) in the temperature range from 303.15 K to 343.15 K.The experimental results show that the diffusion coefficients and Henry’s constants of six hydrofluorocarbons in [HMIM][PF6]increase with the increasing temperature.Compared with other five hydrofluorocarbons,R32 not only exhibits higher solubility but also higher diffusivity.Therefore,R32 + [HMIM][PF6]is very suitable for the absorption refrigeration cycle.The Arrhenius equation was applied to correlate the diffusion coefficients and Henry’s constants of six hydrofluorocarbons in [HMIM][PF6].The average absolute relative deviations between the calculated results and the experimental data were less than 2.5% and 6.0%,respectively.
pressure decay technique; diffusion coefficient; Henry’s constant; ionic liquid; hydrofluorocarbon
TK 123
A
0438—1157(2017)12—4486—08
2017-05-10收到初稿,2017-09-27收到修改稿。
联系人:何茂刚。
刘向阳(1987—),男,博士,副教授。
国家杰出青年科学基金项目(51525604)。
10.11949/j.issn.0438-1157.20170589
