黄酒中尿素的酶法降解应用研究
2017-12-22李由然吴志勇石贵阳江南大学粮食发酵工艺与技术国家工程实验室江南大学生物工程学院
□ 李由然 吴志勇 石贵阳 江南大学 粮食发酵工艺与技术国家工程实验室;江南大学 生物工程学院
黄酒中尿素的酶法降解应用研究
□ 李由然 吴志勇 石贵阳 江南大学 粮食发酵工艺与技术国家工程实验室;江南大学 生物工程学院
在黄酒生产中使用脲酶降解尿素有望成为控制氨基甲酸乙酯(EC)的含量的有效手段。本研究选取日本清酒生产用商品化脲酶NAGAPSIN,在考察了其基于温度和pH的酶学性质及各因素对酶降解尿素影响的基础上探索了该酶在降解成品黄酒中尿素中的应用。结果显示该酶的作用最适温度为30oC,最适作用pH为4.4;在低温及酸性条件下具有较好的稳定性。在成品黄酒中的效果验证表明,30 U/L的脲酶既可于2 d内降解约80%的尿素,且残余酶活易清除。基于以上结果,进一步提出了两种脲酶在实际生产中的应用方案。本研究为黄酒中尿素和EC的酶法控制提供了实验数据支持及实际应用指导。
黄酒;尿素;氨基甲酸乙酯;脲酶
黄酒是我国的特有酒种,其低耗粮、低酒度和高营养的酿造酒特质契合酒类市场营养保健的消费趋势,多年来产销量稳步增长。当前我国的黄酒酿造行业已摆脱了粗放式生产、低价竞争的局面,转而致力于提升产品的品质。然而在现有工艺水平下,尿素和重点致癌物质氨基甲酸乙酯(EC)含量偏高的问题仍然使整个行业面临着严峻的食品安全问题[1]。
黄酒中的尿素主要来源于发酵过程中酵母的代谢;以之为前体,在发酵后期和贮酒阶段会生成EC[2,3]。目前,国内外消除EC的主要方法有工艺优化法、代谢工程改造法和酶法[4]。其中酶法通过使用脲酶特异性降解EC的前体-尿素,可有效降低产品中EC的含量。脲酶作为食品添加剂已获欧盟,美国FDA等批准。同时,相比其他两种方法,其降解效率高且不改变黄酒的正常生产工艺,被认为是最适宜推广的EC控制方法[5]。国外多家企业分别研制了不同微生物来源的脲酶,并已成功应用于葡萄酒、清酒等发酵食品中EC的控制[6,7]。然而,只有满足以下两点要求脲酶才有应用于黄酒行业的价值:可作用于较低的pH(4.0)和在较高的乙醇浓度(15%)中仍保持生物活性。
现有研究多关注于不同来源脲酶的催化机理及酶学性质,其尿素降解效果的数据为利用纯酶在仅含有底物的理想体系实验中获得[8]。而有关商品化食品脲酶降解黄酒中尿素的应用研究仅在2006年由古越龙山采用日本武田公司的脲酶Takeda-AU开展实验所报道[9],其结果显示pH低于4时脲酶的效果已开始降低。在十年之后的今天,我国已着手在黄酒标准中加入尿素和EC含量的指标,随着国家“黄酒中EC预防控制技术指南”的发布,脲酶酶法降解作为被纳入的一种主要措施,其应用性研究的紧迫性不言而喻。本研究选取了当前在日本清酒行业中占据主要市场的食品脲酶NAGAPSIN作为对象,通过对其酶学性质及应用于黄酒尿素降解的考察,评估了其实际应用效果,并且提出了适合于我国黄酒生产过程的酶法尿素降解工艺。
1 材料与方法
1.1 材料
1.1.1 试剂
尿素、EC、9-羟基吨均为分析纯(>99%),购于Sigma公司。尿素和EC分别用无水乙醇为溶剂配制为10 g/L标准溶液,-4℃保存。9-羟基吨用正丙醇为溶剂配制为0.02 mol/L的溶液,避光-4℃保存。乙酸钠、乙酸、浓盐酸、无水乙醇和三氯乙酸(TCA)为分析纯,购于国药集团化学试剂有限公司。称取2.7216 g乙酸钠溶于1000 mL水中,用1%乙酸调节pH至7.2,配制成为0.02 mol/L乙酸钠溶液。浓盐酸用分析用水稀释至1.5 mol/L。TCA用分析用水配制成20%(w/w)的溶液。色谱纯乙腈购于ThermoFisher公司。
1.1.2 仪器设备
UV2000紫外可见分光光度计,美国UNICO公司;HB-100恒温金属浴,杭州博日科技有限公司;GNP-9080隔水式恒温培养箱,上海精密实验设备有限公司;Delta 320型pH 计,瑞士Mettler-Toledo 公司;Waters 2695高效液相色谱仪,Waters 2475荧光检测器,美国沃特斯公司。
1.1.3 实验材料
酸性脲酶:NAGAPSIN,日本长濑(NAGASE)公司,3500 U/g,出厂批号2656332。称取0.857 g脲酶样品溶于1 L蒸馏水中配制成酶液待使用。
酒样:市售绍兴黄酒产品1和2。
1.2 方法
1.2.1 尿素测定方法
(1)参照文献进行样品前处理。500 μL黄酒样品用乙醇稀释至1 000 μL,加入 100 μL 1.5 mol/L盐酸溶液和400 μL0.02mol/L 9-羟基吨溶液,混合均匀后于室温避光衍生30 min,采用0.22 μm有机系针头式滤器过滤,待测。
(2)色谱条件。色谱柱:C18色谱柱(Zorbax SB-Aq 250mm×4.6 mm,5 μm),荧光检测器:λex=234 nm,λem=600 nm,进样量:10 μL。流动相A:0.02 mol/L 乙酸钠(pH7.2),流动相B:乙腈,流速:0.8 mL/min。流动相洗脱梯度参照文献方法[10]。
1.2.2 pH对脲酶活力和稳定性的影响
最适作用pH:在1.7 mL 不同pH(2.4、3、3.4、4、4.4、5、5.4、6.7)的缓冲液中分别加入0.8 mL无水乙醇,1 mL 1%尿素溶液和0.5 mL酶液并混匀。于37℃反应30 min后,立即加入4 mL 10%TCA溶液终止反应。剩余的尿素含量用前述方法测定。在这一条件下,1 U定义为1分钟降解1 μmol尿素所需的酶量。
pH稳定性:将0.5 mL酶液和0.8 mL无水乙醇加入1.7 mL 不同pH(2.4、3、3.4、4、4.4、5、5.4、6.7)的缓冲液中并混匀,每个pH值配制4份。于室温静置6 h,期间分别于0、1.5、3.5、6 h的时刻取1份加入1 mL 1%尿素溶液依照前述方法测定脲酶活力。
1.2.3 温度对脲酶活力和稳定性的影响
最适作用温度:在1.7 mL pH4的缓冲液中分别加入0.8 mL无水乙醇,1 mL 1%尿素溶液和0.5 mL酶液并混匀。分别于4、10、16、20、30、40、℃反应30 min后,立即加入4 mL 10%TCA溶液终止反应。剩余的尿素含量用前述方法测定。
pH稳定性:将0.5 mL酶液和0.8 mL无水乙醇加入1.7 mL pH4的缓冲液中并混匀,分别于4、10、16、20、30、40℃静置72 h,每个温度配制7份。期间分别于0、2、6、12、24、48、72 h的时刻取1份加入1 mL 1%尿素溶液依照前述方法测定脲酶活力。
1.2.4 乙醇对脲酶活力的影响
在前述检测酶活的反应体系中改变乙醇终浓度分别为0%、5%、10%、15%、 30%、 40%、50%、60%、70%,以1 mL 1%尿素溶液为底物依前述方法检测不同乙醇浓度下的脲酶活力。
1.2.5 不同因素对脲酶降解尿素的影响
在模拟环境下考察不同pH对脲酶降解尿素的影响,具体实验方法为:于18 mL反应体系中分别加入0.09 mL 1%尿素溶液、0.18 mL 酶液、3.6 mL无水乙醇以及14.13 mL 不同pH(3、4、5)的缓冲液。混匀后分装于18个1.5 mL EP管中(每管1 mL),置于15℃每天取样检测残留尿素含量,共5 d,每个样品三个平行。
在模拟环境下考察不同温度对脲酶降解尿素的影响,具体实验方法为:于35 mL反应体系中分别加入0.175 mL 1%尿素溶液、0.35 mL 酶液、7 mL无水乙醇以及27.475 mL pH4的缓冲液。混匀后分装于35个1.5 mL EP管中(每管1 mL),分别置于0、5、10、15、20℃反应,每天取样检测残留尿素含量,共10 d,每个样品三个平行。
在模拟环境下考察不同尿素初始浓度对脲酶降解尿素的影响,具体实验方法为:于18 mL反应体系中分别加入0.18 mL 酶液、3.6 mL无水乙醇、14.13 mL pH 4缓冲液以及0.09 mL不同浓度的尿素溶液,使体系中尿素终浓度分别为20、30、 40、50 mg/L。混匀后分装于18个1.5 mL EP管中(每管1 mL),置于15℃每天取样检测残留尿素含量,共5 d,每个样品三个平行。
在模拟环境下考察不同脲酶添加量对尿素降解的影响,具体实验方法为:于18 mL反应体系中分别加入0.09 mL 1%尿素溶液、3.6 mL无水乙醇、14.13 mL pH4缓冲液以及0.09 mL不同浓度的酶液,使体系中脲酶终浓度分别为10、20、30、40、50 U/L。混匀后分装于18个1.5 mL EP管中(每管1 mL),置于15℃每天取样检测残留尿素含量,共5 d,每个样品三个平行。
1.2.6 脲酶对黄酒中尿素及EC降解能力的考察
向黄酒样品中加入终浓度为30 U/L的脲酶,分装于1.5 mL EP中分别避光静置于10℃及20℃,每天取样检测尿素及EC含量。
2 结果与分析
2.1 脲酶的最适pH和pH稳定性
脲酶样品在含有20%乙醇的不同pH缓冲液中(2.4、3、3.4、4、4.4、5、5.4、6.7)的催化活力及稳定性数据如图1所示。结果显示,在该条件下脲酶的最适作用pH为4.4,其在pH 3.4和pH 4下的活力十分接近最适pH。pH 5以上的条件会严重影响酶活,该酶在pH 6.7下几乎完全失活。对pH稳定性的考察显示,该脲酶在pH2~6.7的较宽范围内均比较稳定,6 h后酶活下降有限。
2.2 脲酶的最适温度和温度稳定性
脲酶样品在含有20%乙醇的pH 4缓冲液中置于不同温度下(4、10、16、20、30、40℃)的催化活力及稳定性数据如图2所示。结果显示,从4℃开始随温度升高酶活力逐步提高,至30℃为该脲酶的最适作用温度,40℃时酶活力开始降低。对温度稳定性的考察显示,该脲酶在所有实验温度下均在24 h内几乎完全丧失酶活。
2.3 脲酶对乙醇的耐受性

图1 pH(A)和稳定性(B)对脲酶活力的影响,
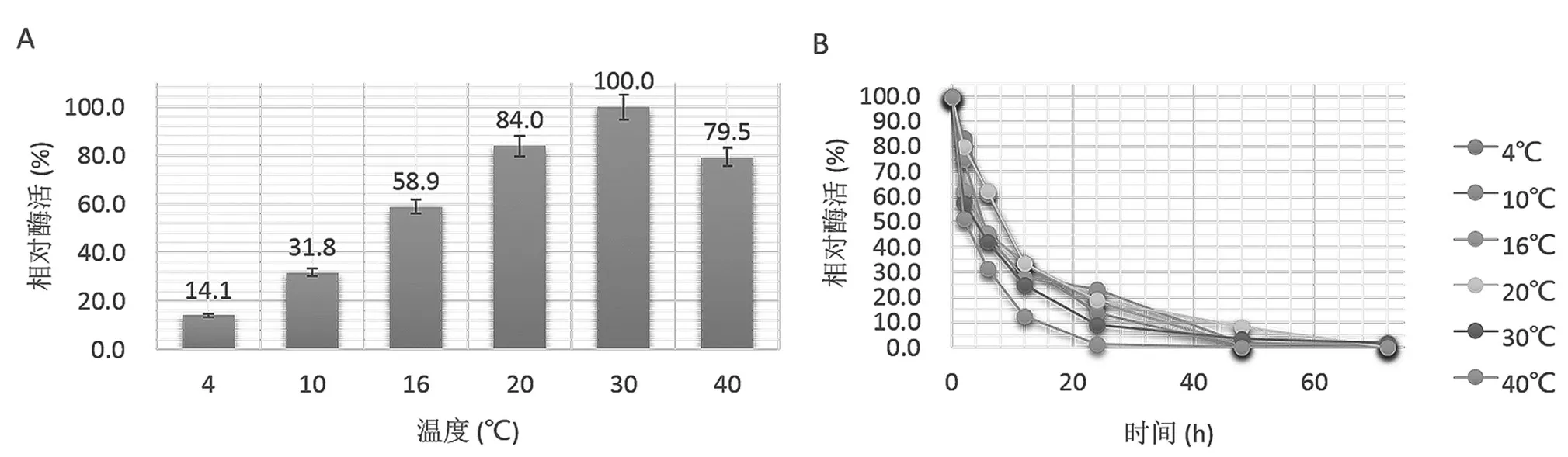
图2 温度对脲酶活力(A)和稳定性(B)的影响
脲酶在不同乙醇浓度中(0%、5%、10%、15%、30%、40%、50%、60%、70%)的活力如图3所示。结果显示脲酶的活力随乙醇浓度的提升而降低,而在15%的乙醇浓度下仍可保留超过70%的酶活,这一浓度与黄酒产品中的乙醇浓度相当。
2.4 pH和温度对脲酶降解尿素效果的影响
在含有20%乙醇的初始尿素浓度为50 mg/L的体系中加入30 U/L的脲酶,分别考察了pH 3、4、5时尿素的降解情况,如图4(A)所示。结果显示在pH 4下,脲酶在初始2 d内就可降解约70%尿素,进一步延长时间尿素的降解速率逐步减慢,在第5 d尿素最低降至10.8 mg/L。与以上结果相比,pH 3和pH 5时尿素的降解效果存在显著差距,表明pH 4为该酶最适宜的作用pH。在同样实验条件下,温度对脲酶降解尿素的效果也有显著影响,如图4(B)所示,其中20℃下10 d后尿素残留量最低(10.2 mg/L)。与前一实验的结果相似,初始2 d内尿素的降解速度最快,随后尿素含量保持平稳。值得注意的是在0℃的条件下,该脲酶仍具有相当的尿素降解能力(2 d可降解约50%),体现了其在黄酒低温贮存中应用的潜力。
2.5 尿素浓度和脲酶量对脲酶降解尿素效果的影响
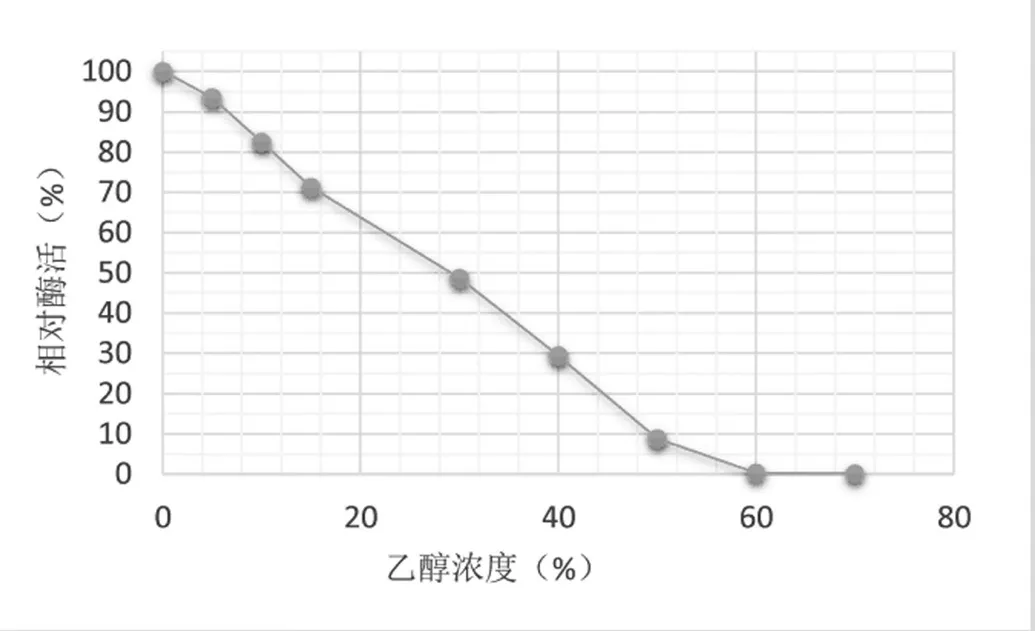
图3 乙醇浓度对脲酶活力的影响
为了考察脲酶对不同初始浓度尿素降解的效果,实验设置了含有20、30、40、50 mg/L尿素的反应体系,在20%乙醇存在的条件下,30 U/L脲酶对其降解的效果如图5(A)所示。结果显示在所有测试组中,尿素浓度均在初始2 d内快速降低,随后速度减慢;5 d后的尿素残留量与初始浓度正相关。为了考察脲酶的合理用量,在含有50 mg/L尿素的反应体系中分别加入10、20、30、40、50 U/L的脲酶,它们的降解结果如图5(B)所示。从10 U/L开始,脲酶加量的提升可显著增强尿素降解效果;至30 U/L后,继续提高脲酶加量所产生的效果十分有限。

图4 pH(A)和温度(B)对脲酶降解尿素效果的影响
2.6 脲酶降解黄酒产品中尿素的效果
经实验室检测,黄酒样品1的基本理化性质如表1所示,这些指标表明它们可以代表市售的大部分黄酒产品。

表1 黄酒样品的基本理化性质
依据对脲酶酶学性质的考察和模拟尿素降解实验的结果设置脲酶加量为30 U/L,分别在10℃和20℃研究脲酶对黄酒产品中尿素和EC降解的实际效果,结果如图6所示。脲酶在降解黄酒产品中尿素实验中所显示的特性与之前的酶学性质考察和模拟降解实验中保持一致。对于两种黄酒样品,脲酶均可以将尿素浓度降低至10 mg/L以下。无论保存在10℃还是20℃,尿素的降解效果均在初始2 d最为显著,进一步延长时间所带来的效果提升有限。对EC的检测结果也显示该脲酶对黄酒中已经形成的EC几乎无作用。

图6 脲酶对黄酒样品1和黄酒样品2中尿素和EC的降解效果
3 讨论
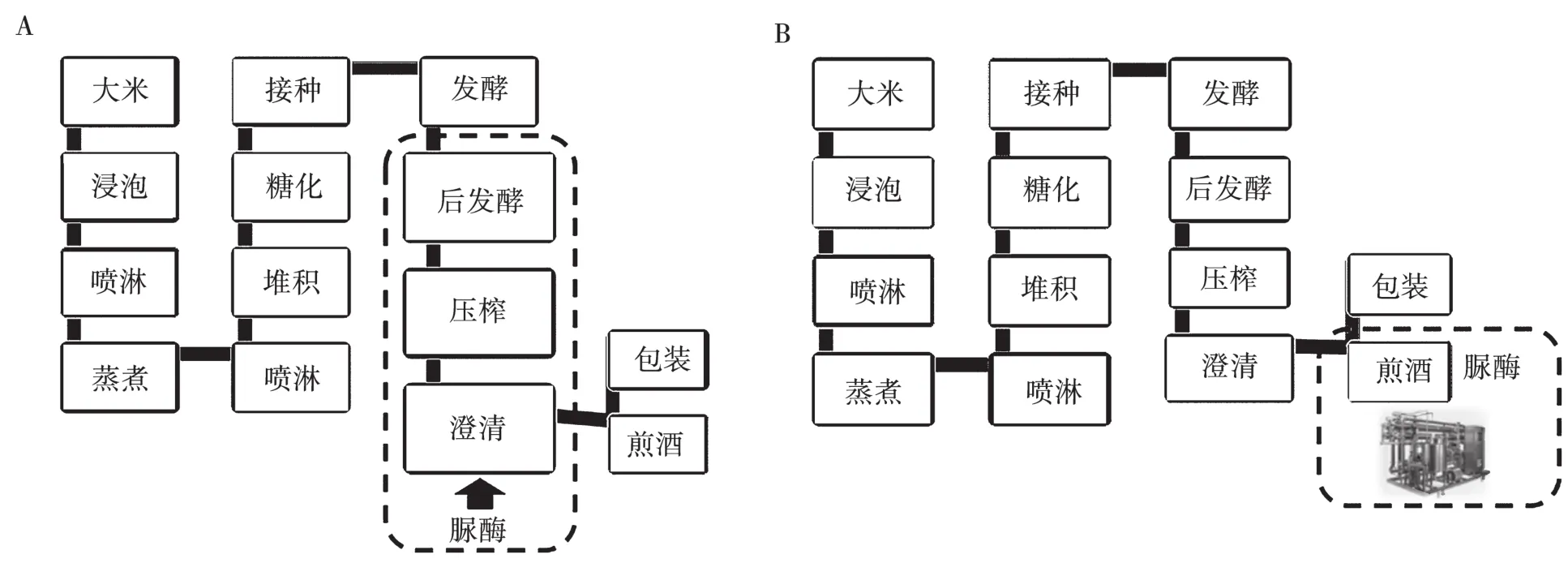
图7 脲酶在黄酒生产过程中的应用方案
脲酶应用于黄酒中尿素的降解具有用量少、效率高、对现有工艺及产品质量影响小等优势,这一技术手段已为越来越多的国内黄酒制造企业所认可[11,12]。在欧美及日本,多种脲酶已成功应用于葡萄酒、清酒等发酵食品中尿素的降解,然而这一酶制剂在黄酒中的应用尚缺乏实验数据支持及实际应用指导。本研究选取了在日本清酒发酵过程中占主要市场份额的脲酶NAGAPSIN作为研究对象,解析了其基于pH和温度的酶学性质;然后又通过模拟尿素降解实验考察应用的可行性及条件探索;最后基于前两部分实验的结果设计该脲酶在黄酒产品中降解尿素的应用实验。综合以上研究结果,该脲酶在pH及温度适应性方面非常适宜应用于黄酒。首先,相比较现有报道的另一种脲酶Takemate-AU,其最适pH更接近4这一黄酒的通常pH。其次,该酶达到相同降解效果的用量仅为Takemate-AU的一半左右,更少的用量对产品质量造成的影响更小。同时,该酶在低温范围内的高活性契合了黄酒发酵和贮存的低温条件,而在40℃以上的迅速失活又使其作用后易于除去[13]。
本研究仅选取了黄酒成品用于脲酶的应用实验,然而其使用方式不仅限于加入黄酒成品。根据Wu对黄酒发酵过程中尿素及EC的监测[14],发酵后期所积累尿素在之后的勾兑澄清、煎酒和贮存工段才大量转化为EC。因此,在EC大量形成之前应用脲酶都为时不晚。基于本研究中对脲酶特性的解析,可在黄酒发酵液压榨后加入脲酶,作用1~2 d之后利用煎酒时的高温(>90℃)除去脲酶的参与活力,这一方案不改变现有的黄酒生产工艺,影响产品质量的风险也最小,如图7(A)所示。脲酶应用的另一种方案是在煎酒后形成的半成品酒中加入脲酶,低温贮藏1~2 d,再通过膜过滤技术除去脲酶后上包装线,如图7(B)所示。
该方案的优点是脲酶的用量较小,但是需要额外的膜过滤设备。两种应用方案都有待于在实际生产过程中进一步的验证及调整优化。
[1]张顺荣,范文来,徐岩.不同香型白酒中氨基甲酸乙酯的研究与风险评估[J].食品与发酵工业,2016(5):198-202.
[2]AN D,OUGH C S. Urea Excretion and Uptake by Wine Yeasts as Affected by Various Factors[J]. American Journal of Enology and Viticulture,1993(1):35-40.
[3]JIAO Z, DONG Y, CHEN Q.Ethyl Carbamate in Fermented Beverages:Presence, Analytical Chemistry, Formation Mechanism, and Mitigation Proposals [J].Comprehensive Reviews in Food Science and Food Safety, 2014(4):611-626.
[4]巫景铭,洪瑞泽,马丽辉,等.黄酒生产中氨基甲酸乙酯的监测与控制[J].酿酒, 2011(3):64-67.
[5]杨广明.酸性脲酶与氨基甲酸乙酯降解酶产生菌的筛选及酶的特性[D].无锡:江南大学,2014.
[6]OUGH C S, TRIOLI G. Urea Removal from Wine by an Acid Urease [J].American Journal of Enology and Viticulture,1988(4):303-307.
[7]KOBASHI K, TAKEBE S, SAKAI T.Removal of Urea from Alcoholic Beverages with an Acid Urease [J].Journal of Applied Toxicology,1988(1):73-74.
[8]杨鲁强.酸性脲酶的制备,纯化及其性质研究[D].无锡:江南大学,2008.
[9]周建弟,丁关海,郑志强.酸性脲酶分解黄酒中尿素特性的研究[J].中国酿造,2006(11):45-46.
[10]邢江涛,钟其顶,熊正河,等.高效液相色谱-荧光检测器法测定黄酒中尿素含量[J].酿酒科技,2011(3):104-106.
[11]周建立,康振,刘庆涛,等.重组酸性脲酶对黄酒中尿素和氨基甲酸乙酯的降解应用[J].生物工程学报,2016(1):74-83.
[12]刘俊.中国黄酒中氨基甲酸乙酯控制策略及机制的研究[D].无锡:江南大学,2012.
[13]聂丽红,罗发兴.酶解双醛淀粉固定化脲酶的研究[J].食品与发酵工业,2009 (10):32-35.
[14]Wu H, Chen L, Pan G,et al.Study on the Changing Concentration of Ethyl Carbamate in Yellow Rice Wine during Production and Storage by Gas Chromatography/Mass Spectrometry[J].European Food Research and Technology,2012(5):779-782.
石贵阳。
