基于无菌动物研究肠道微生物与类风湿关节炎发病相关性
2017-12-22惠彩霞曾本华刘晓飞魏泓方勇飞
惠彩霞,曾本华,刘晓飞,魏泓,方勇飞*
(1.第三军医大学西南医院中西医结合科与风湿免疫中心,重庆 400038)
研究进展
基于无菌动物研究肠道微生物与类风湿关节炎发病相关性
惠彩霞1,曾本华2,刘晓飞1,魏泓2,方勇飞1*
(1.第三军医大学西南医院中西医结合科与风湿免疫中心,重庆 400038)
2.第三军医大学基础部实验动物学教研室,重庆 400038)
肠道微生物与宿主的生长发育、免疫、代谢等方面均密切相关,但肠道菌群与宿主之间复杂的相互作用在很大程度上仍然是未知的。目前无菌动物已成为探索肠道微生物与宿主相互作用的重要工具,多项研究使用无菌动物模型探讨肠道菌群在宿主代谢、机体免疫系统的发育和成熟等方面的作用,其中包括肠道菌群在自身免疫性疾病发病及预后中的作用。研究发现,肠道菌群作为环境因素之一可能参与类风湿关节炎(rheumatoid arthritis,RA)发病,然而其因果关系未明。本文将对使用无菌动物探讨肠道微生物参与类风湿关节炎发病的相关性研究作一综述,为进一步深入研究肠道菌群在RA发病中的作用及机制研究提供理论依据。
无菌动物;肠道菌群;类风湿关节炎;免疫;动物模型
类风湿关节炎是一种以慢性、对称性关节炎为主要表现的自身免疫性疾病,其基本病理改变为滑膜炎、血管翳的形成,并逐渐出现关节软骨和骨的破坏,最终可导致关节畸形和功能障碍。目前其病因和发病机制尚不明确,遗传背景和环境因素在RA发病中共同发挥作用。研究表明,肠道微生物作为重要的环境因素之一可能参与RA的发病,但其因果关系未明。
无菌动物是探讨肠道菌群与类风湿关节炎发病相关性研究良好的实验工具。无菌(germ-free,GF)动物是指在整个生命周期中不含任何微生物的动物,即不可检出一切细菌、病毒、真菌、原生动物和寄生虫[1],包括悉生(gnotobiotic)动物[2,3]。无菌动物模型的应用能够严格地排除其他微生物的干扰,为实验提供良好的同质性基础。无菌动物具有特定的免疫系统及免疫功能,利用无菌动物模型证实肠道微生物群对宿主免疫系统的发育和成熟起着至关重要的作用,同时亦可验证肠道菌群是否参与类风湿关节炎发病及其潜在机制,进一步为RA早期诊断和治疗提供新的方向。
1 基于无菌小鼠/大鼠探讨肠道菌群对宿主免疫系统发育和成熟的作用
无菌小鼠由于缺乏肠道微生物刺激故其免疫系统未发育完全。与普通小鼠相比,无菌小鼠具有更小的派伊尔氏小结(Peyer patches,PP),更少的肠系膜淋巴结(mesenteric lymph nodes,MLN)、肠相关淋巴组织及杯状细胞[4-6],小肠发育未完全,小肠表面积减少、绒毛细小、小肠固有层薄、细胞较少、上皮细胞更新较慢以及较大的盲肠与较薄的肠壁等特点。
肠道微生物对宿主免疫系统的发育起着至关重要的作用。与普通小鼠相比,GF小鼠肠上皮细胞(intestinal epithelial cells,IECs)表面Toll 样受体(Toll-like receptors,TLR)和主要组织相容性复合体(major histocompatibility complex,MHC) 表达减少且分泌较少分泌型IgA(SIgA)[7]。无菌小鼠较无特殊病原体(special pathogens free,SPF)小鼠相比,肠上皮淋巴细胞(intestinal epithelial lymphocytes,IEL)表达αβ T淋巴细胞受体(T lymphocyte receptor,TCR)减少以及T细胞免疫偏向TH2型免疫反应,研究发现将普通小鼠的肠道菌群移植至GF小鼠,αβTCR表达和Th1亚群细胞数量增加,同时出现上皮内淋巴细胞中表型CD8αβ+细胞增多,CD4-CD8-相对减少[8-10]。相比与SPF小鼠,GF小鼠的脾脏 CD4+T细胞及脾内生发中心减少导致抗体产生减少[11],同时发现此种小鼠体内免疫球蛋白IgA、 IgG、 IgM 的含量亦显著降低[4]。
无菌动物具有特定的免疫系统和免疫功能,肠道微生物促进无菌小鼠免疫系统的发育和成熟,无菌动物模型为进一步探讨肠道菌群是否参与RA发病及其潜在机制提供良好的实验工具。
2 利用无菌动物模型探讨肠道菌群与RA发病相关性
2.1 常用自发性关节炎动物模型
2.1.1 IL-1Ra-/-自发性关节炎模型
IL-1 受体拮抗剂基因敲除小鼠(IL-1Ra-/-)是一种由T细胞介导IL-1信号传导过表达而引发的自发性关节炎模型[12]。该模型的发生T细胞起关键作用,T细胞缺乏者不发生关节炎。
2.1.2 K/BxN自发性炎性关节炎模型
葡萄糖-6磷酸异构酶(glucose-6 phosphate-isomerase,GPI)T细胞受体转基因小鼠(K / BxN)是一种由自身反应性T细胞诱导浆细胞分泌大量抗GPI自身抗体而引发的自发性关节炎模型。该小鼠血清中含有大量高亲和力IgG1抗GPI抗体。
2.1.3 SKG小鼠自发性关节炎模型
SKG小鼠编码ZAP-70(T细胞中的信号转导分子)区域SH2的基因发生突变,异常ZAP-70改变了T细胞胸腺选择阈值,导致自身免疫性T细胞的阳性选择减少[13]。SKG小鼠也是一种Th17细胞依赖性的炎性关节炎模型。
2.2 无菌动物实验证实肠道菌群参与关节炎发病
研究表明,IL-1Ra-/-小鼠饲养在无菌条件下并不能自发关节炎,然而单定植乳酸菌、双歧杆菌后可快速发生关节炎,且关节炎的发生率和严重程度与常规饲养的小鼠相似[14]。无菌状态下的IL-1Ra- / -小鼠,在CD 3以及TLR2和TLR4刺激下,脾脏 Th17细胞产生IL-17和IL-1β水平明显降低,可能的原因是激活TLR2 / TLR4信号通路引起Th17/ Treg免疫反应失衡[14]。(见表1)
Wu等[15]发现K/BxN无菌小鼠较普通小鼠关节炎症状明显减轻,同时伴有血清抗GPI抗体滴度降低,肠道固有层及脾脏Th17 细胞的数量减少;然而在定植(segmented filamentous bacteria, SFB)分节丝状菌后,小鼠肠道固有层中 Th17 细胞数量增加,血清中自身抗体水平升高,小鼠亦出现明显关节炎症状。此外,K / BxN小鼠定植SFB后,小肠派氏集合淋巴结内滤泡辅助性T细胞(follicular helper T cells,TFH)数量增多,且自身抗体产生增多[16]。(见表1)
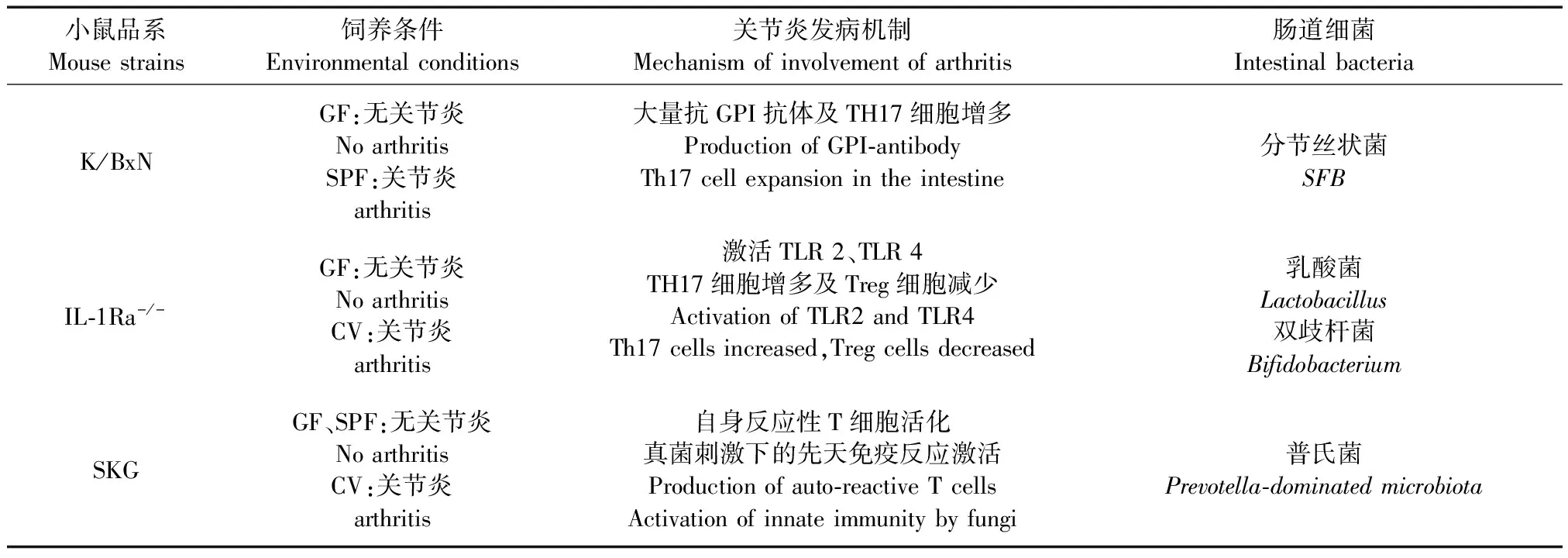
表1 常用自发性关节炎动物模型肠道细菌定植实验Tab.1 Animal models of spontaneous arthritis known to be correlated with intestinal bacteria colonization
注:GF:无菌动物;SPF:无特殊病原体动物;CV:普通动物;GPI: 葡萄糖-6磷酸异构酶;SFB: 分节丝状菌;TLR:Toll样受体;Treg cells:调节性T细胞;K/BxN:葡萄糖-6磷酸异构酶(GPI)T细胞受体转基因小鼠;IL-1Ra-/-:IL-1 受体拮抗剂基因敲除小鼠。
Note.GF: germ-free; SPF: specific pathogen free; CV:Conventional; GPI: glucose-6-phosphate isomerase; SFB: segmented filamentous bacteria; TLR: Toll-like receptor; Treg cells: regulatory T cells; K/BxN: Glucose-6 phosphate-isomerase (GPI) T-cell receptor transgenic mice; IL-1Ra-/-: IL-1 receptor antagonist gene knockout mice.
SKG小鼠在普通饲养条件下,可出现自发性关节炎,同时伴有血清中高水平IL-6(促进Th17分化),但在无菌条件下此种小鼠则不能发生关节炎,血清中亦检测不到IL-6[17]。另有研究发现,将早期RA患者肠道菌群(具有高丰度普氏菌)移植或将P.copri单菌定植至GF-SKG小鼠后,可诱导小鼠出现严重关节炎[18]。(见表1)
HLA-B27 转基因大鼠为自发脊柱关节炎和炎性肠病模型,然而在无菌环境中并不发生炎性肠病或外周关节疾病[19]。链球菌细胞壁(streptoccocal cell wall,SCW)诱导的大鼠关节炎模型研究表明,普通条件饲养的大鼠对关节炎抵抗,而无菌大鼠对关节炎易感,主要是由于打破T细胞免疫耐受[20]。在佐剂诱导的关节炎(adjuvant arthritis,AA)模型中,无菌饲养条件下的大鼠出现严重关节炎症,而普通饲养条件下仅出现中度关节炎症状且关节炎发病率较低。说明肠道细菌可调控免疫反应而抑制炎症。但具体机制仍不清楚[21]。研究发现,无菌ROS缺陷型Ncf 1突变小鼠,与野生型小鼠相比对胶原诱导性关节炎(collagen-induced arthritis model,CIA)易感性增加,其发生机制有待进一步研究[22]。
本课题组[23]研究发现 CIA易感小鼠与 CIA抵抗小鼠肠道菌群不同;分别移植 CIA易感小鼠与 CIA抵抗小鼠肠道菌群至无菌小鼠,前者能够使无菌小鼠 CIA 发病率增高、关节炎严重程度加重、血清IL-17含量及脾脏 Th17细胞的比例增高(P<0.05),然而,其中作用机制并不清楚,有待进一步研究。
以上研究结果表明某些特定肠道微生物能够触发T细胞反应失衡,导致遗传易感性宿主发生自身免疫性关节炎。无菌动物的使用为研究肠道微生物在类风湿关节炎发病中的作用及机制研究提供了重要工具。
3 基于无菌小鼠/大鼠探讨肠道菌群参与RA发病的潜在机制
RA是由一种由T淋巴细胞介导为主的自身免疫性疾病。Th17/Treg细胞失衡在RA发病中起到重要作用且与疾病活动度等因素相关[24],肠道菌群在调节Th17/Treg细胞平衡、维持免疫耐受及免疫应答中必不可少[25]。研究发现TLR2/TLR4在RA发病中具有重要作用[26],其中TLR4尤为重要[27]。
肠道菌群可诱导初始CD4+T细胞的分化。GF小鼠肠道固有层有较少的 CD4+T细胞,肠道共生菌促进肠道Th17细胞及调节性T 细胞(regulatory T cells,Treg)的分化[28]。研究发现GF小鼠免疫耐受丧失,表现为体内CD4+CD25+Foxp3T细胞减少、Th17细胞增加及IL-10分泌减少[25,29];脆弱拟杆菌的胞外多糖A(polysaccharide A,PSA)可以上调CD39表达以促进Treg细胞的分化,进而诱导白介素-10 (IL-10)产生[30,31]。GF小鼠TLR表达减少,定植乳杆菌后TLR4的mRNA表达及蛋白的含量显著增加[32]。肠道共生菌诱导T细胞分化、免疫反应发生,同时在维持免疫稳态、免疫耐受中具有重要的作用[33]。
利用无菌动物模型探讨肠道菌群参与RA发病的潜在机制,为RA早期诊断和治疗提供新的方向。
4 无菌动物模型在探讨肠道微生物与类风湿关节炎发病相关性研究中的意义及不足
无菌动物模型已经广泛用于研究宿主-微生物相互作用的各个领域,包括神经消化内科、心脏病学、生殖生物学、脂质代谢、骨稳态和自身免疫性疾病等方面。近年来,越来越多的研究表明,将特定肠道细菌定植于无菌小鼠,可证实肠道菌群参与关节炎的发病,将人体肠道微生物群移植至GF小鼠,建立人源化的类风湿关节炎动物模型,为进一步深入探讨肠道微生物与类风湿关节炎发病之间的关系提供重要实验工具。
然而,肠道微生物与类风湿关节炎发病之间的因果关系还未明确,通过比较GF和SPF小鼠研究结果尚不能直接应用于人体疾病的诊断、治疗和预防,在无菌动物实验中观察到的肠道菌群与类风湿关节炎联系的具体机制尚未完全了解,故仍需要进一步深入研究。
[1] Smith K,Mccoy KD,Macpherson AJ.Use of axenic animals in studying the adaptation of mammals to their commensal intestinal microbiota [J].Semin Immunol,2007,19(2): 59-69.
[2] Fritz JV,Desai MS,Shah P,et al.From meta-omics to causality: experimental models for human microbiome research [J].Microbiome,2013,1(1):1-15.
[3] Ping Y,Li LJ.The germfree murine animal: An important animal model for research on the relationship between gut microbiota and the host [J].Vet Microbiol,2012,157(1-2):1-7.
[4] Round JL,Mazmanian SK.The gut microbiota shapes intestinal immune responses during health and disease [J].Nat Rev Immunol,2009,9(5): 313-323.
[5] Macpherson AJ,Harris NL.Interactions between commensal intestinal bacteria and the immune system [J].Nat Rev Immunol,2004,4(6): 478-485.
[6] Deplancke B,Gaskins HR.Microbial modulation of innate defense: goblet cells and the intestinal mucus layer [J].Am J Clin Nutrit,2001,73(6): 1131S-1141S.
[7] Lee J,Lee CS,Hugunin KM,et al.Bacteria from drinking water supply and their fate in gastrointestinal tracts of germ-free mice: A phylogenetic comparison study [J].Water Res,2010,44(17): 5050-5058.
[8] Helgeland L,Vaage JT,Rolstad B,et al.Microbial colonization influences composition and T-cell receptor Vβ repertoire of intraepithelial lymphocytes in rat intestine [J].Immunology,1996,89(4): 494-501.
[9] Okada Y,Setoyama H,Matsumoto S,et al.Effects of fecal microorganisms and their chloroform-resistant variants derived from mice,rats,and humans on immunological and physiological characteristics of the intestines of ex-germfree mice [J].Infect Immun,1994,62(12): 5442-5446.
[10] Kawaguchi M,Nanno M,Umesaki Y,et al.Cytolytic activity of intestinal intraepithelial lymphocytes in germ-free mice is strain dependent and determined by T cells expressing gamma delta T-cell antigen receptors [J].Proc Nat Acad Sci U S A.1993,90(18): 8591-8594.
[11] Mazmanian SK,Liu CH,Tzianabos AO,et al.An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system [J].Cell,2005,122(1): 107-118.
[12] Reiko H,Shinobu S,Hidetoshi T,et al.Development of chronic inflammatory arthropathy resembling rheumatoid arthritis in interleukin 1 receptor antagonist-deficient mice [J].J Exp Med,2000,191(2): 313-320.
[13] Sakaguchi N,Takahashi T,Hata H,et al.Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice [J].Nature,2003,426(6965): 454-460.
[14] Abdollahi-Roodsaz S,Joosten L A,Koenders MI,et al.Stimulation of TLR2 and TLR4 differentially skews the balance of T cells in a mouse model of arthritis [J].J Clin Invest,2008,118(1): 205-216.
[15] Wu HJ,Ivanov II,Darce J,et al.Gut-residing segmented filamentous bacteria drive autoimmune arthritis via T helper 17 cells [J].Immunity,2010,32(6): 815-827.
[16] Teng F,Klinger C,Felix K,et al.Gut microbiota drive autoimmune arthritis by promoting differentiation and migration of Peyer’s patch T follicular helper cells [J].Immunity,2016,44(4): 875-888.
[17] Hida S,Miura NN,Adachi Y,et al.Cell wall beta-glucan derived from Candida albicans acts as a trigger for autoimmune arthritis in SKG mice [J].Biol Pharmaceut Bull,2007,30(8):1589-1592.
[18] Maeda Y,Kurakawa T,Umemoto E,et al.Dysbiosis contributes to arthritis development via activation of autoreactive T cells in the intestine [J].Arthrit Rheumatol,2016,68(11): 2646-2662.
[19] Taurog JD,Richardson JA,Croft JT,et al.The germfree state prevents development of gut and joint inflammatory disease in HLA-B27 transgenic rats [J].J Exp Med,1994,180(6): 2359-2364.
[20] Mf VDB,van Bruggen MC,Koopman JP,et al.Gut flora induces and maintains resistance against streptococcal cell wall-induced arthritis in F344 rats [J].Clin Exp Immunol,1992,88(2): 313-317.
[21] Kohashi O,Kuwata J,Umehara K,et al.Susceptibility to adjuvant-induced arthritis among germfree,specific-pathogen-free,and conventional rats [J].Infect Immun,1979,26(3): 791-794.
[22] Wing K,Klocke K,Samuelsson A,et al.Germ free mice deficient of reactive oxygen species have increased arthritis susceptibility [J].Eur J Immunol,2015,45(5): 1348-1353.
[23] Liu X,Zeng B,Zhang J,et al.Role of the gut microbiome in modulating arthritis progression in mice [J].Sci Rep,2016,6: 30594.
[24] Filho RACP,Díaz SJA,Fernando FS,et al.Immunomodulatory activity and control of Salmonella,Enteritidis colonization in the intestinal tract of chickens by Lactobacillus based probiotic [J].Veter Immunol Immunopathol,2015,167(1-2): 64-69.
[25] Niess JH,Leithäuser F,Adler G,et al.Commensal gut flora drives the expansion of proinflammatory CD4 T cells in the colonic lamina propria under normal and inflammatory conditions[J].J Immunol,2008,180(1):559-568.
[26] De AM,Francavilla R,Piccolo M,et al.Autism spectrum disorders and intestinal microbiota[J].Gut Microbes,2015,6(3):207-213.
[27] Van Praet JT,Donovan E,Vanassche I,et al.Commensal microbiota influence systemic autoimmune responses[J].Embo Journal,2015,34(4):466-474.
[28] Krych L,Nielsen D S,Hansen A K,et al.Gut microbial markers are associated with diabetes onset,regulatory imbalance,and IFN-γ level in NOD mice[J].Gut Microbes,2015,6(2):101-109.
[29] Nemoto Y,Kanai T,Kameyama K,et al.Long-lived colitogenic CD4+memory T cells residing outside the intestine participate in the perpetuation of chronic colitis[J].Gastroenterology,2009,183(8):5059-5068.
[30] Mazmanian SK,Round JL,Kasper DL.A microbial symbiosis factor prevents intestinal inflammatory disease[J].Nature,2008,453(7195):620-625.
[31] Mattner J,Debord K L,Ismail N,et al.Exogenous and endogenous glycolipid antigens activate NKT cells during microbial infections[J].Nature,2005,434(7032):525-529.
[32] Costello M,Ciccia F,Willner D,et al.Brief report: intestinal dysbiosis in ankylosing spondylitis[J].Arthritis Rheumatol,2015,67(3):686-691.
[33] Kelly D,Mulder IE.Microbiome and immunological interactions[J].Nutr Rev,2012,70 Suppl 1: S18-30.
Germ-freeanimalasamodeltostudytheroleofgutmicrobiotainthepathogenesisofrheumatoidarthritis
HUI Cai-xia1,ZENG Ben-hua2,LIU Xiao-fei1,WEI Hong2,FANG Yong-fei1*
(1.Department of Integrated Medicine and Rheumatology,Southwest Hospital,Third Military Medical University,Chongqing 400038,China; 2.Department of Experimental Animal Sciences,Third Military Medical University,Chongqing 400038)
The relationship between intestinal microbiome and host growth and development,immunity,metabolism and other aspects is very close.But the complex interaction between intestinal microbiota and host is still largely unknown.At present,germ-free animal models have become an important tool for exploring the interaction between intestinal microbiome and host.Many studies used germ-free animal models to explore the role of gut microbiome in host metabolism,the development of the immune system,including the role of gut microbiome in the pathogenesis and prognosis of autoimmune diseases.It has been found that intestinal microbiome as one of the environmental factors may be involved in the pathogenesis of rheumatoid arthritis,but its causal relationship is unknown.This paper will review the correlation between the intestinal microbiota and pathogenesis of rheumatoid arthritis by using germ-free animal models,and provide a theoretical basis for further study of the role of intestinal microbiome in the pathogenesis of rheumatoid arthritis.
Germ-free animal; Gut microbiome; Rheumatoid arthritis; Immunity; Animal models
FANG Yong-fei.E-mail: fangyongfei@qq.com
国家自然科学基金面上项目(No.81072921)。
惠彩霞(1989-),女,硕士研究生,主要从事微生物感染与类风湿关节炎发病的相关性研究。Email:1113806804@qq.com
方勇飞,男,博士,教授,博士生导师,主要从事类风湿关节炎病因及发病机制的研究。Email:fangyongfei@qq.com
Q95-33
A
1005-4847(2017) 06-0667-05
10.3969/j.issn.1005-4847.2017.06.015
2017-09-10
