斑马鱼肠道微生物的研究进展
2017-12-22张金花桂芳司婧张红周蓉甘露
张金花,桂芳,司婧,张红,4*,周蓉,甘露
(1.中国科学院近代物理研究所,兰州 730000; 2.中国科学院大学,北京 100049; 3.兰州城市供水(集团)有限公司,兰州 730000; 4.武威肿瘤医院,甘肃 武威 733000)
研究进展
斑马鱼肠道微生物的研究进展
张金花1,2,桂芳3,司婧1,张红1,4*,周蓉1,甘露1
(1.中国科学院近代物理研究所,兰州 730000; 2.中国科学院大学,北京 100049; 3.兰州城市供水(集团)有限公司,兰州 730000; 4.武威肿瘤医院,甘肃 武威 733000)
肠道微生物作为人体重要的“微生物器官”,在人体发育、肠道屏障、免疫调节、营养物质消化吸收、毒素排出、血管生成,以及疾病的发生、发展等方面发挥着巨大的作用。脊椎动物生物模型斑马鱼因其各系统发育与人类相应系统有许多共同特点,且具有胚胎透明、发育快速、肠道易于取样等优势,故成为研究肠道微生物的理想模型。然而在国内关于斑马鱼肠道微生物的研究尚处于起步阶段。文章总结了斑马鱼中肠道微生物的相关功能、肠道微生物群落的构建及其演替规律及肠道微生物结构的影响因素,为研究肠道微生物对人类健康的影响及其在疾病治疗中的应用前景提供理论依据。
肠道微生物;斑马鱼;相关功能;演替规律;影响因素;人类健康
动物在富含微生物的环境中演变,并且大多数动物与微生物群落形成密切的联系。人体内的大量共生微生物是人体后天获得的一个非常重要的“器官”,其中人体消化道是微生物重要的栖息场所。人体肠道内至少定植有500~1000种不同的细菌,驻留在人类胃肠道中的共生微生物数量(1014)接近人体细胞数量(1013)的10倍,并且包含比人类基因组更大的宏基因组数量,具有人体自身不具备的代谢功能[1,2]。Jemielita 等[3,4]发现微生物不是随机分布于肠道中,而是优先定位于特定的区域,相比于消化道的近端,远端中可培养细菌的含量更高,且聚集体中的细菌可以感测增强的局部群体密度以触发更高的分裂速率,故聚集体中的细菌生长速率明显大于独立细菌。
肠道微生物群现在被认为是与正常生理过程相关的功能性器官,具有其独特的功能,如促进食物消化与营养代谢、促进宿主免疫功能的发育、调节血管生成、改善肠屏障功能、帮助寄主抵抗病原菌等[5-8]。正常情况下,肠道菌群与人体内外环境始终维持着动态平衡,一旦这种平衡被打破,将发生肠道微生物的失调,进而导致多种疾病的发生,如胃肠疾病、糖尿病、肥胖、心血管疾病、营养不良等[9-12]。
斑马鱼(zebrafish,Daniorerio) 是一种杂食性淡水硬骨鱼,属于小型鲤科鱼类,是一种广泛用作发育生物学、生理学、分子遗传学、毒理学以及生殖生物学研究的模式动物[13-16]。且因其具有以下几个独特的优势,使得斑马鱼成为研究肠道微生物的理想模型。首先,胚胎的光透明性使其可以作为体内观察肠道细菌的理想模型。其次,斑马鱼发育迅速,且其肠道的组织和功能与哺乳动物的组织和功能相似。第三,斑马鱼的肠道易于取样和测量,在其生命周期的任何阶段对于“全栖息地”微生物的分析非常方便[5,6,17,18]。目前发现共生在斑马鱼体内的肠道菌群主要属于四大门类:梭菌属、蓝细菌、变形菌门和放线菌门[19]。同时斑马鱼具有完整的血管,造血功能,免疫、中枢神经系统,对于研究人类相关疾病的分子机制有巨大潜力[20]。因此,深入研究斑马鱼肠道微生物将有助于了解肠道微生物在人类健康中所起的作用,为肠道微生物在疾病治疗中的应用提供理论依据。
1 斑马鱼肠道微生物的相关功能
1.1 肠道微生物对斑马鱼发育的影响
哺乳动物和硬骨鱼消化道的发育和生理都非常相似,都是在最初无菌的绒毛膜保护区域中发育,但在微生物存在的情况下完成它们的成熟过程[8,21]。鱼被认为在孵化时从环境中获得它们的微生物群落。鱼类和哺乳动物的微生物群落在消化道中具有相似的功能:它们将多糖发酵成短链脂肪酸并保护宿主免受病原体感染[7,8]。斑马鱼肠道微生物会影响上皮再生和肠细胞形态[5]。研究表明,若无微生物群落,幼鱼肠的分化停滞在某特定阶段,且其特定方面的功能也随之改变,而当在后面的发育过程中引入细菌后,这种现象可被逆转[7,8]; 俄勒冈大学Karen Guillemin课题组通过对斑马鱼肠道微生物群的建立及其在脊椎动物消化道分化中的作用的研究,发现微生物群落在促进斑马鱼肠上皮的分化以及维持消化道的功能方面发挥重要作用[8]。斑马鱼的肠道微生物可合成并向宿主提供大量的生物素以满足机体需求。Yossa等[14]通过在鱼饮食中添加抗生素抑制肠道微生物的生长从而诱导生物素缺乏症状,发现斑马鱼出现生长减少,死亡率增加,皮肤、肠和腮组织异常、食物消耗减少和抽搐等现象。Semova等[22]发现,与无菌斑马鱼相比,野生型斑马鱼能通过增加脂质小滴的数量和大小,进而促进荧光标记过的脂肪酸的吸收。由此可见,微生物在胃肠道的发育中起着重要作用。此外,Hill等[23]发现在斑马鱼早期发育期间,胰岛β细胞的生长分裂需要肠道微生物群以及某些特定细菌如气单胞菌属和希瓦氏菌属的参与,这些细菌释放一种BefA蛋白,诱导β细胞的扩增,从而提高胰岛素的水平;且发现人体中也存在类似的微生物种群,可以产生能够诱导β细胞扩增的分泌蛋白,这一发现可能给糖尿病的诊断和治疗增加一利器。
1.2 肠道微生物对炎症反应的影响
肠道微生物是脂多糖(LPS)的主要来源。LPS是革兰阴性细菌致病的主要因素,可刺激几乎所有的真核细胞发生形态、代谢和基因表达变化,导致宿主细胞因子失控性表达[24-26]。Bates等[27]发现,与哺乳动物相似,暴露于LPS的斑马鱼产生剂量依赖性死亡、心脏跳动和嗜睡减少、水肿以及血液淤积等相关表现。近几年研究发现,LPS诱导的炎症信号与Toll样受体(TLRs)家族有关,LPS作为毒素通过过度刺激TLRs先天免疫信号,诱导致病性炎症反应[26,27]。在LPS结合蛋白(LBP)的协作下,LPS与单核细胞/巨噬细胞表面的CD14结合并且与TLR4/骨髓分化蛋白-2(MD-2)复合体相互作用,诱导核因子κB(NF-κB)的核易位和促炎细胞因子的上调[25]。同时,已有研究表明,MyD88(髓样分化蛋白)是在TLRs家族信号传导中起重要作用的通用衔接蛋白,通过MyD88的TLR信号转导,促进NF-kB的核易位以及促炎细胞因子的过度表达,导致全身性炎症反应发生,从而引起全身炎症反应综合症、中毒性休克和多器官功能障碍综合症[27]。
肠碱性磷酸酶(IAP) 是由肠上皮表达的内源性蛋白,其在肠黏膜屏障的维护中发挥着重要作用,包括调节十二指肠表面 pH值、解除游离核苷酸和细菌LPS的毒性、抑制肠道炎性反应、调节肠道菌群等[28-30]。Gul等[31]发现IAP可以通过促进肠道共生菌的生长、阻断细菌来源的促炎配体(如LPS)以及增强肠屏障功能来预防小鼠代谢综合症。在斑马鱼的研究中也得到相似的结果,IAP缺陷型斑马鱼对LPS毒性敏感,且暴露于LPS的野生型斑马鱼肠中嗜中性粒细胞的比例明显升高[27]。
通过对IAP调节肠道菌群相关机制的研究,发现IAP可负调节肠道共生菌与肠上皮细胞中LPS和TLR4的相互作用和炎性因子的产生,抑制炎性相关基因的表达(IAP调节肠道菌群的相关机制见下图1)。肠道内尚无细菌定植、肠黏膜生物屏障尚未建立的无菌斑马鱼体内 IAP 的表达水平较低。当向其肠道中添加活的或灭活的革兰阴性菌,或单独给予一定量的LPS 后,IAP 表达水平都明显升高,表明肠道共生菌中革兰阴性菌在诱导斑马鱼 IAP 的表达中发挥着重要作用[32]。IAP由革兰阴性菌中的LPS诱导并使LPS去磷酸化,使得具有活性的LPS浓度降低,LPS对TLR4的刺激作用减慢,炎性相关基因表达下调[27,29,32]。IAP以剂量依赖性方式显著降低促炎细胞因子的表达,早期补充肠内IAP可减少坏死性小肠结肠炎(NEC)相关的损伤并且可减少由炎症级联引起的效应[33]。上述研究结果表明,IAP在限制肠道微生物的促炎潜力和促进革兰阴性细菌的黏膜耐受中起重要作用。
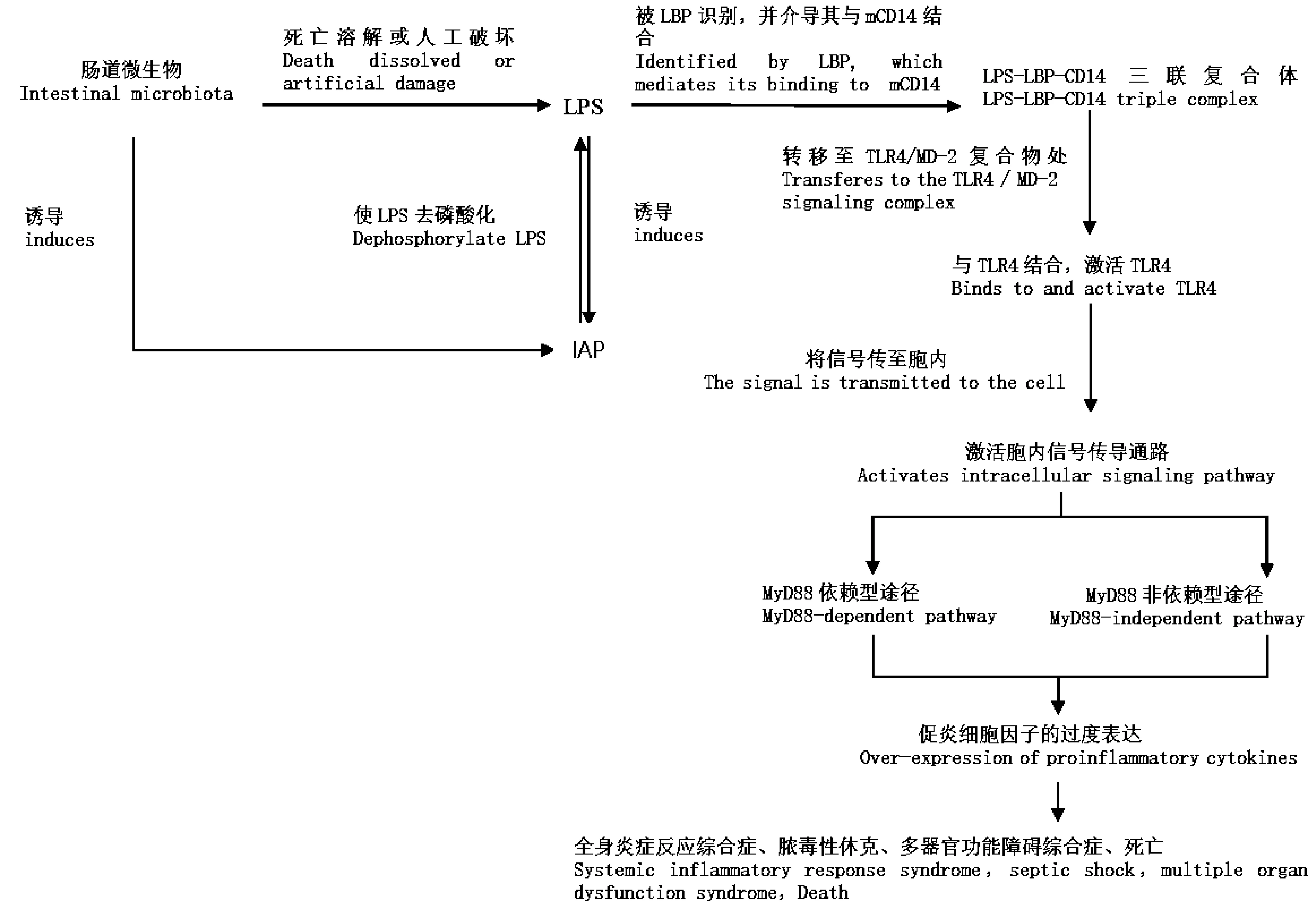
图1 肠道微生物通过LPS和IAP调节炎症反应Fig.1 Intestinal microbes regulate inflammatory response through LPS and IAP
2 斑马鱼肠道微生物群落的构建及其演替规律
中国科学院水生生物研究所的一项研究表明,斑马鱼也存在“岛屿”理论。由于动物消化道开始是无菌的,之后通过迁入、迁出形成了特定的群落并维持一定的稳态,所以根据生态地理学“岛屿”的概念,类似的,可以将斑马鱼消化道视为微生物生活的特殊“岛屿”,但该系统内微生物群落的构建和维持机制尚不清楚。余育和等[6]通过对斑马鱼从胚胎发育到性成熟发育过程中肠道微生物群落的研究,揭示了该“岛屿”系统微生物的构建和演替规律。研究结果表明,斑马鱼肠道微生物物种丰富度与肠道体积、发育时间的关系符合S=CAZ、S=CTW这一生态学基本规律。Yan等[6]发现,斑马鱼肠道微生物的组成及物种丰富度的演替指数较低,而且主要随时间发生变化,不过其肠道微生物群落的演替同时受生态位和随机因素的影响。
3 影响斑马鱼肠道微生物结构的因素
3.1 年龄对肠道微生物结构的影响
研究结果表明,肠道微生物群落的组成随着宿主成熟而变得不同,且肠道中的细菌多样性是宿主与其微生物群落之间共同进化的结果[6,34]。斑马鱼幼鱼肠道中厚壁菌门和变形杆菌占绝大多数,但成鱼肠道微生物主要是梭杆菌门[8,35]。且幼鱼与成鱼的比较发现,斑马鱼性成熟前比性成熟后具有更高水平的肠道微生物群,这种偏差的原因尚不清楚[4]。
3.2 饮食对肠道微生物结构的影响
膳食因素是影响肠道微生物群组成和代谢的重要因素之一,更是最容易改变或控制的因素[1,36]。饮食对肠道的影响可追溯到婴儿出生后。断奶前纯母乳喂养的婴儿肠道内具有更高水平的双歧杆菌属,而配方奶喂养的婴儿肠道内,具有较高水平的拟杆菌属以及伴有梭菌属和乳杆菌属的增加[10,36,37]。在斑马鱼的相关研究中也得到了类似的结果,肠道和环境微生物群的组成在动物发育早期朝不同方向演变,并且随着斑马鱼在恒定饮食条件下生长而变得越来越不同。杜克大学John F.Rawls 课题组通过对膳食脂肪水平与定植在斑马鱼肠道和周围环境中的微生物群落之间的动态关系的研究,发现膳食脂肪密度会显著影响斑马鱼肠道微生物的组成,不同的饮食可以直接或间接地影响肠道微生物的组成,进而影响宿主的发育和生理[35]。Semova等[22]发现饮食决定了斑马鱼肠道微生物的组成,该课题组将荧光标记的脂肪酸类似物加入无菌斑马鱼培养系统中,发现肠道微生物可以促进斑马鱼肠道上皮及肝脏对饲料脂肪酸的获取及细胞内脂滴的形成。该研究还发现,饲喂饵料可以使无菌斑马鱼肠道中厚壁菌门的细菌增加。高脂膳食情况下,能够引起野生型啮齿动物粪便中短链脂肪酸浓度显著降低,丁酸和双歧杆菌数量减少尤为明显,而产生LPS的菌群显著增多,从而引起机体的全身性炎症,最终引起代谢综合征的发生[22,36]。胃肠道中的微生物变化对宿主炎症和代谢反应具有深远的影响。例如高蛋白饮食会增加细菌酶如β-葡萄醛酸糖苷酶、偶氮还原酶和硝基还原酶的活性,从而产生触发炎症反应的有毒代谢物[10]。
3.3 环境内分泌干扰物对肠道微生物结构的影响
性别是影响哺乳动物肠道微生物组成的因素之一,但是研究发现,斑马鱼雄鱼和雌鱼没有统计学上显著的微生物群相关差异,但当斑马鱼暴露到额外的内分泌干扰化学品(EDC)后,会改变肠道微生物的组成,这可能与宿主脂质代谢有关[4,11]。Liu等[11]发现雌二醇和双酚A能显著诱导雄性斑马鱼卵黄蛋白原的表达并加速雄鱼甘油三酯的积累以及使CKC4丰度急剧增加。三氯生(TCS)在许多个人护理和家用产品中被广泛用作抗微生物剂和防腐剂,且是一种潜在的鱼内分泌干扰物[15,38,39]。俄勒冈州立大学Thomas J.Sharpton 利用斑马鱼来了解环境化学物质对肠道微生物群落的结构和生态动态的影响,发现斑马鱼肠道中含有对TCS暴露的抗性和易感性的微生物,并且TCS的暴露可引起成年斑马鱼微生物组的快速变化,从而影响宿主的发育和生理[9]。所以肠道微生物群可能是EDCs导致世界范围污染的一个指标。同时,EDCs对宿主健康也会造成一定的影响。研究表明TCS对斑马鱼早期阶段及成鱼均有不同程度的影响,会造成包括胚胎/幼鱼的急性毒性、孵化延迟和酶活性的改变,以及成鱼行为的改变即不稳定的游泳行为、平衡损失和异常的运动[15,38]。
3.4 免疫系统对肠道微生物结构的影响
相比较外部因素对肠道微生物群落影响的研究,人们对宿主的免疫系统是如何调节肠道微生物的了解所知甚少。硬骨鱼是目前已知的最低等的兼具固有与适应性免疫系统的脊椎动物。斑马鱼在生命的第一星期只有先天免疫功能,直到受精后4-6周特异性体液和细胞免疫应答才会发育,故斑马鱼是阐明先天性免疫和适应性免疫对肠道细菌群落构建的影响的理想动物模型[4,40,41]。研究发现除了小鼠模型,人类重组激活基因1(Rag1)缺陷型斑马鱼是唯一可用于研究T和B细胞缺陷免疫反应的动物模型[42]。
乌得勒支大学医学中心Schneeberger课题组利用斑马鱼模型研究控制微生物群落的先天和适应性免疫过程,发现在野生型斑马鱼的幼鱼(先天)阶段,弧菌的过度生长与初始缺乏适应性免疫是相关的[41]。Rag1缺陷型斑马鱼缺乏适应性免疫系统的功能性B和T淋巴细胞,但包括自然杀伤(NK)样细胞和非特异性细胞毒性细胞(NCC)的先天免疫系统[42]。Brugman等[41]发现T淋巴细胞过继转移到Rag1缺陷型斑马鱼后,会抑制弧菌的生长,而非淋巴细胞的过继转移不调节弧菌丰度。因此,T淋巴细胞通过调节斑马鱼肠道中弧菌的丰度来控制微生物组成。且相关研究者针对Rag1缺陷型小鼠也进行了相关研究报道。Zhang等[34]通过过继转移野生型小鼠骨髓,发现在断奶后的Rag1缺陷型小鼠的肠和固有层中产生了成熟的B和T细胞,逆转了在Rag1缺陷型小鼠中看到的表型,并抑制了结肠黏膜炎的发生。实验证明,相对于野生型斑马鱼的微生物,Rag1缺陷型斑马鱼(含有高弧菌丰度)诱导更强的T淋巴细胞反应。Brugman 等[41]发现在14周的Rag1缺陷型斑马鱼中,促炎细胞因子il-1β和cxcl8-l2的表达增加,而il-17f2、il-10和ifnγ显著降低,且从14周开始,Rag1缺陷型斑马鱼逐渐出现水肿或变得严重厌食。因此,淋巴细胞的缺乏不仅会影响肠道细菌群落构建,而且也会导致肠道炎症的发生。
4 结语
肠道微生物与人体的多种疾病相关联,对疾病的治疗和临床研究有深刻的影响,这可能成为解决肥胖、糖尿病、胃肠道疾病、代谢疾病等问题的新突破口,其已成为生命科学的研究热点之一。与小鼠的研究策略相似,斑马鱼肠道微生物的研究大体经历了传统微生物分离纯培养方法,非培养依赖的传统分子生物学方法如变性梯度凝胶电泳、末端片段长度多态性、荧光原位杂交技术和基因芯片等,以及基于测序的高通量组学方法3个阶段[6,7,19,43]。其中,高通量测序技术是目前测定样本中微生物组成信息的首选方法,能够更加准确、深入地分析肠道微生物生态系统的微生物结构组成、基因功能、代谢途径以及透析微生物与宿主之间的潜在关系,这是传统分子生物学技术所欠缺的[43,44]。
尽管斑马鱼肠道微生物的功能和多样性的研究方面已取得一定的进展,但迄今为止,人们对这些肠道微生物彼此错综复杂的关系及其对斑马鱼生理生活中的具体影响和调控机制的研究仍处于初级阶段,尤其在国内关于斑马鱼肠道微生物的报道也很有限。因此,针对该模式动物肠道微生物的研究有着广阔的发展前景,深入研究斑马鱼肠道微生物可为人类肠道健康的研究提供新的方法和思路。
[1] 翟奇啸,田丰伟,王刚等.肠道微生物与人体健康的研究进展[J].食品科学,2013,34(15):337-341.
[2] 朱莹莹,李春保,周光宏.饮食、肠道微生物与健康的关系研究进展 [J].食品科学,2015,36(15): 234-239.
[3] Jemielita M,Taormina MJ,Burns AR,et al.Spatial and temporal features of the growth of a bacterial species colonizing the zebrafish gut [J].MBio,2014, 5(6): e01751-14.
[4] Cantas L,Sørby JR,Aleström P,et al.Culturable gut microbiota diversity in zebrafish [J].Zebrafish,2012, 9(1): 26-31.
[5] Rawls JF,Samuel BS and Gordon JI.Gnotobiotic zebrafish reveal evolutionarily conserved responses to the gut microbiota [J].Proc Natl Acad Sci U S A,2004, 101(13): 4596-4601.
[6] Yan Q,van der Gast CJ,Yu Y.Bacterial community assembly and turnover within the intestines of developing zebrafish [J].PLoS One,2012, 7(1): e30603.
[7] He Q,Wang L,Wang F,et al.Microbial fingerprinting detects intestinal microbiota dysbiosis in Zebrafish models with chemically-induced enterocolitis [J].BMC Microbiol,2013, 13: 289.
[8] Bates JM,Mittge E,Kuhlman J,et al.Distinct signals from the microbiota promote different aspects of zebrafish gut differentiation [J].Dev Biol,2006, 297(2): 374-386.
[9] Gaulke CA,Barton CL,Proffitt S,et al.Triclosan exposure is associated with rapid restructuring of the microbiome in adult zebrafish [J].PLoS One,2016, 11(5): e0154632.
[10] Brown K,DeCoffe D,Molcan E,et al.Diet-induced dysbiosis of the intestinal microbiota and the effects on immunity and disease [J].Nutrients,2012, 4(8): 1095-1119.
[11] Liu Y,Yao Y,Li H,et al.Influence of endogenous and exogenous estrogenic endocrine on intestinal microbiota in zebrafish [J].PLoS One,2016, 11(10): e0163895.
[12] Tap J,Furet JP,Bensaada M,et al.Gut microbiota richness promotes its stability upon increased dietary fibre intake in healthy adults [J].Environ Microbiol,2015, 17(12): 4954-4964.
[13] 孙德明,穆苑,高昌,等.模型动物斑马鱼及其特定病原净化 [J].中国比较医学杂志,2009,19(12): 52-60.
[14] Yossa R,Sarker PK,Vandenberg GW.Preliminary evidence of the contribution of the intestinal microflora to biotin supply in zebrafish Danio rerio (Hamilton-Buchanan) [J].Zebrafish,2011, 8(4): 221-227.
[15] Oliveira R,Domingues I,Koppe Grisolia C,et al.Effects of triclosan on zebrafish early-life stages and adults [J].Environ Sci Pollut Res Int,2009, 16(6): 679-688.
[16] 周玉国,温海深.斑马鱼繁殖内分泌学研究进展 [J].中国实验动物学报,2007,15(06): 465-469.
[17] Russo P,Iturria I,Mohedano ML,et al.Zebrafish gut colonization by mCherry-labelled lactic acid bacteria[J].Appl Microbiol Biotechnol,2015, 99(8): 3479-3490.
[18] 何嘉玲,刘静,王天奇,等.斑马鱼的质量标准化 [J].中国实验动物学报,2014,22(06): 99-102.
[19] Li X,Yu Y,Feng W,et al.Host species as a strong determinant of the intestinal microbiota of fish larvae [J].J Microbiol,2012, 50(1): 29-37.
[20] 王玉佩,张红,周鑫,等.斑马鱼胚胎在电离辐射生物学研究中的应用 [J].原子核物理评论,2016,33(01): 94-104.
[21] Roeselers G,Mittge EK,Stephens WZ,et al.Evidence for a core gut microbiota in the zebrafish [J].ISME J,2011, 5(10): 1595-1608.
[22] Semova I,Carten D,Stombaugh J,et al.Microbiota regulate intestinal absorption and metabolism of fatty acids in the zebrafish [J].Cell Host Microbe,2012, 12(3): 277-288.
[23] Hill JH,Franzosa EA,Huttenhower C,et al.A conserved bacterial protein induces pancreatic beta cell expansion during zebrafish development [J].Elife,2016, 5: e20145.doi: 10.7554/eLife.20145
[24] Li H,Yang T,Liao T,et al.The redefinition of Helicobacter pylori lipopolysaccharide O-antigen and core-oligosaccharide domains [J].PLoS Pathog,2017, 13(3): e1006280.
[25] Singh S,Datta A,Schmidtchen A,et al.Tryptophan end-tagging for promoted lipopolysaccharide interactions and anti-inflammatory effects [J].Sci Rep,2017, 7(1): 212.doi:10.1038/s41598-017-00188-7
[26] 张雪梅,熊焕章.LPS诱导的炎症反应信号传导通路研究进展 [J].中国兽医杂志,2010,46(07): 45-47.
[27] Bates JM,Akerlund J,Mittge E,et al.Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents inflammation in zebrafish in response to the gut microbiota [J].Cell Host Microbe,2007, 2(6): 371-382.
[28] Gomes JR,Ayub LC,Dos Reis CA,et al.Goblet cells and intestinal alkaline phosphatase expression (IAP) during the development of the rat small intestine[J].Acta Histochem,2017, 119(1): 71-77.
[29] Biesterveld BE,Koehler SM,Heinzerling NP,et al.Intestinal alkaline phosphatase to treat necrotizing enterocolitis [J].J Surg Res,2015, 196(2): 235-240.
[30] Ejaz SA,Saeed A,Siddique MN,et al.Synthesis,characterization and biological evaluation of novel chalcone sulfonamide hybrids as potent intestinal alkaline phosphatase inhibitors [J].Bioorg Chem,2017, 70: 229-236.
[31] Gul SS,Hamilton AR,Munoz AR,et al.Inhibition of the gut enzyme intestinal alkaline phosphatase may explain how aspartame promotes glucose intolerance and obesity in mice [J].Applied Physiol Nutr Metab,2017, 42(1): 77-83.
[32] 毕景成,王新颖,黎介寿.肠碱性磷酸酶在肠屏障中作用的研究进展 [J].肠内与肠外营养,2015,22(04): 244-247.
[33] Rentea RM,Liedel JL,Fredrich K,et al.Intestinal alkaline phosphatase administration in newborns decreases systemic inflammatory cytokine expression in a neonatal necrotizing enterocolitis rat model [J].J Surg Res,2012, 177(2): 228-234.
[34] Zhang H,Sparks JB,Karyala SV,et al.Host adaptive immunity alters gut microbiota [J].ISME J,2015, 9(3): 770-781.
[35] Wong S,Stephens WZ,Burns AR,et al.Ontogenetic differences in dietary fat influence microbiota assembly in the zebrafish gut [J].MBio,2015, 6(5): p.e00687-15.
[36] 张晶,覃小丽,刘雄.膳食主成分对肠道微生物的影响研究进展 [J].食品科学,2015,36(05): 305-309.
[37] Chan YK,Estaki M and Gibson DL.Clinical consequences of diet-induced dysbiosis [J].Ann Nutr Metab,2013, 63 Suppl 2: 28-40.
[38] Pinto PS,Guerreiro M,Power DM.Triclosan interferes with the thyroid axis in the zebrafish (Danio rerio)[J].Toxicol Res,2012(2): 60-69.
[39] Ho JC,Hsiao CD,Kawakami K,et al.Triclosan (TCS) exposure impairs lipid metabolism in zebrafish embryos[J].Aquat Toxicol,2016, 173: 29-35.
[40] 谢英,张力,刘树锋.斑马鱼免疫学研究进展 [J].实验动物科学,2013,30(03): 50-53.
[41] Brugman S,Schneeberger K,Witte M,et al.T lymphocytes control microbial composition by regulating the abundance of Vibrio in the zebrafish gut [J].Gut Microbes,2014, 5(6): 737-747.
[42] Hohn C,Petrie-Hanson L.Rag1-/-mutant zebrafish demonstrate specific protection following bacterial re-exposure [J].PLoS One,2012, 7(9): e44451.
[43] 张美玲,杜震宇.水生动物肠道微生物研究进展 [J].华东师范大学学报(自然科学版),2016(01): 1-8.
[44] 杨天龙,刘旭川,廖奇,等.宏基因组技术在鸡肠道微生物中应用的研究进展 [J].中国畜牧兽医,2017,44(03): 659-666.
Researchprogressonintestinaltractmicroorganismsinzebrafish
ZHANG Jin-hua1,2,GUI Fang3,SI Jing1,ZHANG Hong1,4*,ZHOU Rong1,GAN Lu1
(1.Institute of Modern Physics,Chinese Academy of Sciences,Lanzhou 730000,China; 2.University of Chinese Academy of Sciences,Beijing 100049; 3.Lanzhou Urban Water Supply (Group) Co.,Ltd,Lanzhou 730000; 4.Wuwei Cancer Hospital,Gansu Wuwei 733000)
Intestinal microbiota as an important “microbial organ” in the human body may play a key role in the human development,intestinal barrier,immune regulation,digestion and nutrient absorption,detoxification,angiogenesis,as well as the occurrence and development of diseases.As a vertebrate biotype,zebrafish is widely used in the fields of developmental biology,immunology,genetics,toxicology and the establishment of human disease models,because of their common development and phylogenetic system with humans.A number of unique features,including its transparent embryos,rapid development,easy to take intestinal samples,and other advantages,made its wide popularity as an ideal model for the study of intestinal microbes.However,the research on zebrafish intestinal microbiology is still at an elementary stage.This paper summarizes the recent progress in research of zebrafish intestinal microbiota,including the related function of intestinal microbes in zebrafish,the assembly and succession of intestinal microbial community and factors influencing the intestinal microbial structure,and provides a theoretical basis for studying the effects of intestinal microbes on human health and its application in the treatment of diseases.
Intestinal microbiota; Zebrafish; Related function; Succession rule; Influencing factors; Human health
ZHANG Hong.E-mail: zhangh@impcas.ac.cn
国家自然科学基金联合基金重点项目(No.U1432248);科技部国家重点研发项目(No.2016YFC0904600);国家自然科学基金青年科学基金(No.11605255);兰州市科技计划项目(2015-3-75)。
张金花(1995-),女,硕士研究生,研究方向:斑马鱼毒理学。E-mail: 1633901483@qq.com
张红(1958-),女,研究员,博士,研究方向:辐射医学。E-mail: zhangh@impcas.ac.cn
Q95-33
A
1005-4847(2017) 06-0637-06
10.3969/j.issn.1005-4847.2017.06.009
2017-05-10
