胃癌人源性异种移植模型制备中的问题与策略
2017-12-22胡斌权曹博师长宏
胡斌权,曹博,师长宏
(1.第四军医大学学员旅,西安 710032; 2.第四军医大学实验动物中心,西安 710032)
研究进展
胃癌人源性异种移植模型制备中的问题与策略
胡斌权1,2,曹博1,2,师长宏2*
(1.第四军医大学学员旅,西安 710032; 2.第四军医大学实验动物中心,西安 710032)
总结患者来源的胃癌异种移植模型 (patient-derived xenograft model,PDX) 制备中存在的主要问题,提出相应的解决方案。介绍胃癌PDX模型在靶向药物研究中的独特优势,提出在强调肿瘤个体化模型的同时,要善于运用共性研究思维,分析模型的基因型特征开展肿瘤靶向治疗研究。
胃癌;人源性异种移植模型;靶向药物;基因型特征
胃癌的发病率和病死率较高,经外科手术切除后,约20%~40%的患者会发生复发和转移,其中位生存率仅为8个月左右[1,2]。因耐药的问题,胃癌的五年生存率仅只有20%[3]。胃癌早期即可存在亚临床微转移灶,是术后复发转移的根源。目前胃癌的治疗主要是根据肿瘤病理学类型及临床分期,结合患者状况和器官功能,有计划合理地应用手术、化疗、放疗和生物靶向等综合手段,达到最大幅度地控制肿瘤,延长生存期。但普通化疗选择性低,副作用大。近年来,围绕胃癌移植模型开展了大量治疗型药物的研发。
建立反映胃癌临床特征的患者来源的肿瘤异种移植 (patient derived xenograft,PDX) 模型对于胃癌研究具有重要意义,该模型被广泛应用于肿瘤研究的诸多领域,包括新型抗肿瘤药物的筛选[4]、联合用药试验和肿瘤耐药性研究[5]等。因PDX模型较好地模拟了肿瘤在患者体内生长的情况,临床预见性好,可被用于代替特定患者进行药物筛选,指导临床进行抗肿瘤的个体化治疗,即“阿凡达”试验,部分患者已从中获益[6-8]。虽然消化系统肿瘤,特别是结肠癌PDX模型取得了较大进展,但有关胃癌的PDX模型研究尚处于起步阶段。已有实验证实,胃癌PDX模型肿瘤在组织病理学特点、基因表达及对药物反应方面均与原发瘤保持高度一致[9,10],将其应用于胃癌研究,必然会推动胃癌的个体化治疗研究实现新的突破。
目前在PDX模型研究中,人们总是倾向于突出其异质性和保真性等特点,着重强调其个体化,虽然这与当前精准化医疗的趋势相吻合,但作为基础研究,更应该从个性化模型中提取共性的特点,而不是一味执着于个体化,这样易形成一种思维的弊端,限制PDX模型的应用研究。对于肿瘤PDX模型的应用,应立足于临床需求,既要利用其精准性,把握个体化,也要综合分析,归纳共性。
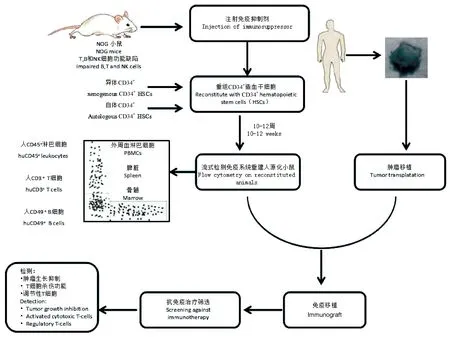
图1 Hu-PDX模型的建立Fig.1 Diagram of the establishment of humanized PDX models
1 胃癌PDX模型存在的主要问题
与人体其他部位来源的肿瘤相比,胃癌PDX模型虽然在组织病理学和基因型表达上保持与原发瘤的相似性[11,12],但存在三方面比较突出的问题。
1.1 胃癌PDX模型免疫微环境人源化
移植于小鼠体内的肿瘤,由于生长环境的改变,人源性间质成分在PDX模型传代过程中逐渐被鼠源化,随着传代次数增加,移植瘤与原发瘤组织间会逐渐产生差异[13,14]。这种差异会影响到研究成果的可靠性,因此,如何避免或减少这种人源性间质的丧失显得尤为重要。部分学者利用人源化小鼠获得人体免疫微环境重建,移植人体肿瘤后建立Hu-PDX模型(humanized PDX models)。比如通过移植人胚胎胸腺组织和CD34+造血干细胞至NOD/SCID小鼠体内,建立人源化免疫重建小鼠[15],进一步将这种具有人源化免疫系统的NOG小鼠整合到胃癌PDX模型中,模拟出人源化的微环境,提供肿瘤生长所需的人体免疫细胞(如图1)[16]。此类模型不仅能够提供与人体肿瘤生长类似的免疫微环境,同时也能解决常规PDX 模型因使用免疫缺陷小鼠而无法用于抗肿瘤免疫药物评估的问题。
1.2 原位PDX模型有利于转移的发生
转移是晚期胃癌难以治愈的重要原因,制备相应的转移模型具有重要意义。目前制备胃癌PDX模型多为皮下移植,与胃癌的原发环境存在较大差别,极少发生转移。研究发现,原位移植的PDX (patient-derived orthotopic xenografts,PDOX) 模型提供的肿瘤生长微环境更接近于患者的真实情况,有利于肿瘤相关基因的表达,能更好的模拟病人体内肿瘤的浸润特征,利于肿瘤的发生和转移[16,17]。Sicklick等[18]开展了胃肠道肿瘤的原位PDX移植模型研究,发现胃壁肿瘤的移植成功率可达到50%,有利于转移的发生[19,20]。
1.3 利用裸鼠建模可降低胃癌PDX模型中淋巴瘤的发生
在不同类型肿瘤的PDX移植模型中,均有报道个别病例形成与EBV相关的B细胞淋巴瘤,在胃癌的PDX模型中发生比例高达68%[21],且制备模型使用的均为重度联合免疫缺陷小鼠NOD/SCID、NSG或NOD。有文献报道其发生率(19.0%,24/126)显著高于结肠癌(2.3%,1/43)[22],特别是在F1代中淋巴瘤发生率高达33.3% (5/15)[21]。但使用裸鼠移植时就不会再有淋巴瘤的发生,即使在后续移植中使用NOD(F2)小鼠也不会形成淋巴瘤。分析原因是EVB感染的B细胞在人体内处于潜伏状态,但当移植到重度免疫缺陷小鼠后,由于缺乏功能性免疫细胞的作用,这些细胞易被活化形成淋巴瘤,这与临床免疫受损病人形成淋巴瘤是同样的机制[23]。而裸鼠存在功能性的NK细胞,抑制了潜伏感染EVB的活化。由于H.pylori相关的胃炎与胃癌的发生高度相关,在胃癌病例中基底炎症发生程度显著高于其它肿瘤[24],从而胃癌PDX模型中淋巴瘤的发生率显著高于其它肿瘤。因此使用裸鼠建立原代PDX模型不仅可以确保成功率,更可避免淋巴瘤的形成。建模完成后,我们可通过组织学和人类白细胞标记对模型进行检查以排除淋巴瘤成分[25,26]。由于重度联合免疫缺陷小鼠(NPG或NOD)缺乏功能性T细胞、B细胞和NK细胞,因此,将从裸鼠获得的原代PDX肿瘤组织进一步原位移植NSG或NOD小鼠将有利于胃癌的发生和转移表型的展示,易形成与临床特征相近的转移模型,而且还不会发生淋巴瘤。
2 基于PDX模型的胃癌靶向药物筛选
靶向治疗、基因检测和高通量测序技术与PDX模型的整合成功开启了肿瘤精准治疗的时代。人们通过综合分析测序数据和具有特殊突变的PDX模型为临床肿瘤患者提供新的优化治疗方案,从而克服肿瘤多药耐药的问题,提高临床治疗效果。胃癌的异质性很强,对常规化疗药物的敏感性较差,预后不佳,因而个体化的靶向治疗也就显得尤为重要。目前,胃癌药物的靶点主要集中在分子水平,这些靶点可以是肿瘤细胞表面特异性抗原或受体,也可是肿瘤新生血管内皮细胞表面特异性抗原或受体。例如,①曲妥单抗(trastuzumab)是第一个被应用于胃癌靶向治疗的药物[27],其针对的靶点为HER2 (human epidermal growth factor receptor 2);②雷莫芦单抗 (ramucirumab)于2014年被美国FDA (the Food and Drug Administration)批准用于晚期胃癌的治疗,该药是一种抗VEGF-R2的单克隆抗体,通过阻断该受体与VEGF结合,达到抑制其活化,使VEGF的血管生成效应不能实现,从而产生抗肿瘤血管的多种效应[25]。尽管靶向治疗具有巨大的潜力,但是在实际操作过程中有相当多的肿瘤都难以被靶向药物识别。研究显示,曲妥单抗仅对少部分患者有效,且可能因二次耐药在短时间内疗效减低,甚至是治疗失败[28,29]。抗VEGF/VEGFR药物的应用也面临类似问题,一方面肿瘤对药物存在抵抗性,影响疗效,另一方面药物治疗中会出现严重的副作用[30]。同时,动物模型与人体对药物反应的差异性导致了靶向治疗中临床疗效远低于临床前的动物模型试验效果,药物临床预见性低也是靶向药物筛选研究中亟待解决的问题之一[31]。
PDX模型较好地保留了人类肿瘤的基因组特征,可用于肿瘤耐药机制的研究和联合用药试验,指导临床进行抗肿瘤个体化治疗,为患者提供优化的替代治疗方案从而克服肿瘤的耐药性[32,33]。同时,该模型复制了肿瘤病人的异质性,可建立反映患者自身特征的药物评价系统,能较好地解决上述临床预见性低的问题,是迄今为止最接近临床研究的肿瘤模型[31,34],无论是对研究现有的已知靶点,还是筛选潜在的新治疗靶点均有重要意义[10]。由于靶向治疗特异性高,同种靶向药物对不同基因型的患者在疗效上可能存在较大的差别,故靶点的筛选是靶向治疗的核心,这些靶点往往是由肿瘤发生突变后出现的新基因或原有基因高表达的结果。不同患者来源的胃癌PDX模型较好地保留原代肿瘤细胞的异质性,单其性质可能会略有不同,甚至体现在基因的表达上,对一部分模型有效的靶向药物,在其他患者的模型上不一定具有相同疗效,当出现差异时应分析来源,查阅资料,特别是应开展基因型的研究,目的是从个性研究中,整合出共性的结论。
在胃癌的靶向治疗中,对基因改变的利用是核心,这个概念已扩展到药物开发和临床试验。美国国家癌症研究所(National Cancer Institute,NCI)开发了一种新的癌症临床试验的类型[35],称为"NCI-MATCH" (NCI-Molecular Analysis for Therapy Choice),该试验的特点是针对不同靶点给予针对性的靶向药物,试验分组和靶点的选择是通过基因测序来完成的,而不是按照肿瘤的病种和部位划分。这种深入基因水平的分组方式,不仅是精准性医疗的体现,同时也是一种共性研究,它打破了以往传统的分类界限,从不同的癌种中提取出了共性的基因学特征,更有利于靶向治疗的开展。受其启发,在胃癌PDX模型研究中,也可采取相似的思路:①对建立的胃癌PDX模型瘤组织进行基因测序,分析肿瘤遗传改变情况,在基因水平上进行分组;②针对不同的基因分组,采取适当的靶向药物进行试验,而不考虑肿瘤类型;③对治疗有效的组持续试验直至出现耐药或治愈,对于复发的组,分析耐药的原因,是否存在新的基因改变,针对新的基因型可换药研究,如未发生基因改变而耐药,则该组退出研究;④记录各药的疗效差异,分析实验结果,分析不同药物在不同基因型别模型上的反应过程。这种研究模式的优势在于其分类的依据是基因表达的差异,较传统的按肿瘤发生部位和病理类型等分类方式更适用于靶向治疗,比如,高通量测序技术可以用来确定基因型和药物反应之间的关系[7]。该思路集中体现了共性思维,其研究不再局限于某个病人的PDX模型鼠上,而是深入基因水平,其研究结论也就有了更好的推广性。
3 展望
胃癌PDX模型的成功率较低,约为10.7%-60%,影响成瘤的相关因素较多[24]。研究发现,不同于其它类型的PDX模型,制备胃癌PDX模型,选择裸鼠、NOD/SCID或NSG小鼠在模型成功率方面均无显著差别。胃癌PDX模型的成功率与病人的年龄、性别、并发症、吸烟饮酒史均无相关性,与肿瘤标志物CEA、CA19-9的表达也无相关性,与原发肿瘤的分型、转移特性以及化疗的相关性尚存争议[9,10,21]。唯一可以确定的是胃癌组织中瘤细胞的数量可显著提高PDX模型的成功率,同时瘤组织离体时间越短,成瘤率越高[21]。
除了使用原发胃癌组织建立PDX模型外,也有报道使用转移瘤建模,或对在PDX模型上发生转移的瘤组织进行研究,观察胃癌转移后的变化,对比两类模型实验结果的差异,研究意义重大。Jiang等[3]使用胃神经分泌癌组织成功建立了PDX肺转移模型,发现顺铂不仅抑制胃癌的生长,同时也能抑制胃癌的转移,进一步对外周血中循环肿瘤细胞(circulating tumor cells,CTCs)展开研究,发现不同亚型的CTCs对顺铂的敏感程度不同。该思路突破了以往研究中仅分析移植部位瘤块,而忽略了转移瘤的弊端,使得实验结果更接近于真实情况。
总体来说,胃癌靶向药物的研究相对滞后,有关胃癌PDX模型在临床前药效评估研究中的报道较少[10,36],但随着肿瘤分子生物学、分子病理学研究的深入发展,依托PDX模型开展的分子靶向治疗将成为一种新的治疗手段,基于已有PDX模型的基因分型研究将有效推动胃癌药物开发和临床试验,人们会掌握更多的胃癌亚型和新的靶向治疗药物[37],获得更为高效的靶向选择方案,促进胃癌PDX模型的转化研究。
[1] Jacome AA,Coutinho AK,Lima EM,et al.Personalized medicine in gastric cancer: Where are we and where are we going? [J].World J Gastroenterol,2016,22(3): 1160-1171.
[2] Lee J,Bass AJ,Ajani JA.Gastric adenocarcinoma: an update on genomics,immune system modulations,and targeted therapy [J].Am Soc Clin Oncol Educ Book,2016,35: 104-111.
[3] Jiang J,Wang DD,Yang M,et al.Comprehensive characterization of chemotherapeutic efficacy on metastases in the established gastric neuroendocrine cancer patient derived xenograft model [J].Oncotarget,2015,6(17): 15639-15651.
[4] Fong EL,Martinez M,Yang J,et al.Hydrogel-based 3D model of patient-derived prostate xenograft tumors suitable for drug screening [J].Mol Pham,2014,7(11): 2040-2050.
[5] Monsma DJ,Cherba DM,Eugster EE,et al.Melanoma patient derived xenografts acquire distinct Vemurafenib resistance mechanisms [J].Am J Cancer Res,2015,5(4): 1507-1518.
[6] Cho SY,Kang W,Han JY,et al.An integrative approach to precision cancer medicine using patient-derived xenografts [J].Mol Cells,2016,39(2): 77-86.
[7] Gao H,Korn JM,Ferretti S,et al.High-throughput screening using patient-derived tumor xenografts to predict clinical trial drug response [J].Nat Med,2015,21(11): 1318-1325.
[8] Monsma DJ,Cherba DM,Richardson PJ,et al.Using a rhabdomyosarcoma patient-derived xenograft to examine precision medicine approaches and model acquired resistance [J].Pediatr Blood Cancer,2014,61(9): 1570-1577.
[9] Zhu Y,Tian T,Li Z,et al.Establishment and characterization of patient-derived tumor xenograft using gastroscopic biopsies in gastric cancer [J].Scientific reports,2015,5: 8542.
[10] Zhang T,Zhang L,Fan S,et al.Patient-derived gastric carcinoma xenograft mouse models faithfully represent human tumor molecular diversity [J].PLoS One,2015,10(7): e0134493.
[11] Rosfjord E,Lucas J,Li G,et al.Advances in patient-derived tumor xenografts: From target identification to predicting clinical response rates in oncology [J].Biochem Pharmacol,2014,91(2):135-143.
[12] Guilhamon P,Butcher LM,Presneau N,et al.Assessment of patient-derived tumour xenografts (PDXs) as a discovery tool for cancer epigenomics [J].Genome Med,2014,6(12):116.
[13] Monsma DJ,Monks NR,Cherba DM,et al.Genomic characterization of explant tumorgraft models derived from fresh patient tumor tissue [J].J Transl Med,2012,10: 125.
[14] Uronis JM,Osada T,Mccall S,et al.Histological and molecular evaluation of patient-derived colorectal cancer explants [J].PLoS One,2012,7(6): e38422.
[15] Shultz LD,Saito Y,Najima Y,et al.Generation of functional human T-cell subsets with HLA-restricted immune responses in HLA class I expressing NOD/SCID/IL2r gamma(null) humanized mice [J].Proc Nat Acad Sci U S A,2010,107(29):13022.
[16] Izumchenko E,Meir J,Bedi A,et al.Patient-derived xenografts as tools in pharmaceutical development [J].Clin Pharmacol Ther,2016,99(6): 612-621.
[17] Hiroshima Y,Maawy A,Zhang Y,et al.Patient-derived mouse models of cancer need to be orthotopic in order to evaluate targeted anti-metastatic therapy [J].Oncotarget,2016,7(44): 71696-71702.
[18] Sicklick JK,Leonard SY,Babicky ML,et al.Generation of orthotopic patient-derived xenografts from gastrointestinal stromal tumor [J].J Transl Med,2014,12: 41.
[19] Yang B,Tuo S,Tuo CW,et al.A liver-metastatic model of human primary gastric lymphoma in nude mice orthotopically constructed by using histologically intact patient specimens [J].Chin J Cancer,2010,29(6): 579-584.
[20] Furukawa T,Kubota T,Watanabe M,et al.Orthotopic transplantation of histologically intact clinical specimens of stomach cancer to nude mice: correlation of metastatic sites in mouse and individual patient donors [J].Int J Cancer,1993,53(4): 608-612.
[21] Choi YY,Lee JE,Kim H,et al.Establishment and characterisation of patient-derived xenografts as paraclinical models for gastric cancer [J].Sci Rep,2016,6: 22172.
[22] Zhang L,Liu Y,Wang X,et al.The extent of inflammatory infiltration in primary cancer tissues is associated with lymphomagenesis in immunodeficient mice [J].Sci Rep,2015,5: 9447.
[23] Vockerodt M,Yap LF,Shannon Lowe C,et al.The Epstein-Barr virus and the pathogenesis of lymphoma [J].2015,235(2): 312-322.
[24] You W,Brown LM,Zhang L,et al.Randomized double-blind factorial trial of three treatments to reduce the prevalence of precancerous gastric lesions [J].J Natl Inst Cancer 2006,98(14): 974-983.
[25] Fujii E,Kato A,Chen YJ,et al.Characterization of EBV-related lymphoproliferative lesions arising in donor lymphocytes of transplanted human tumor tissues in the NOG mouse [J].Exp Anim,2014,63(3): 289-296.
[26] 胡神保,李小毅,商中华.人源性异种移植模型在胃肠道恶性肿瘤治疗中的应用 [J].癌症进展,2016(10): 938-943.
[27] Javle M,Smyth EC,Chau L.Ramucirumab successfully targeting angiogenesis in gastric cancer[J].Clin Cancer Res,2014,20(23): 5875-5881.
[28] Shimoyama S.Unraveling trastuzumab and lapatinib inefficiency in gastric cancer: Future steps (Review)[J].Mol Clin Oncol,2014,2(2): 175-181.
[29] Wang Q,Zhang X,Shen E,et al.The anti-HER3 antibody in combination with trastuzumab exerts synergistic antitumor activity in HER2-positive gastric cancer [J].Cancer Lett,2016,380(1): 20-30.
[30] 田树红,王日超,邢桂兰,等.抗VEGF /VEGFR类抗癌药物研发的现状和展望 [J].中国肿瘤生物治疗杂志,2015,22(5): 637-645.
[31] 李克娟,黄昊,高苒.人源肿瘤异种移植模型在精准肿瘤医学中的研究 [J].中国比较医学杂志,2017,27(1): 91-98.
[32] 邱业峰,赵志兵,法云智.人源性肿瘤异种移植的小鼠模型在肿瘤精准医学中的应用 [J].实验动物科学,2016(04): 78-83.
[33] Zhao N,Zhang C,Zhao Y,et al.Optical imaging of gastric cancer with near-infrared heptamethine carbocyanine fluorescence dyes [J].Oncotarget,2016,7(35): 57277-57289.
[34] 胡斌权,陈城明,张同弟,等.人体肿瘤PDX移植模型的优与劣 [J].实验动物科学,2015,32(05):59-62.
[35] Choi YY,Cheong JH.Beyond precision surgery: Molecularly motivated precision care for gastric cancer [J].Eur J Surg Oncol,2017,43(5): 856-864.
[36] Wang H,Lu J,Tang J,et al.Establishment of patient-derived gastric cancer xenografts: a useful tool for preclinical evaluation of targeted therapies involving alterations in HER-2,MET and FGFR2 signaling pathways [J].BMC Cancer,2017,17(1): 191.
[37] Jou E,Rajdev L.Current and emerging therapies in unresectable and recurrent gastric cancer [J].World J Gastroenterol,2016,22(20): 4812-4823.
Problemsandstrategiesintheresearchofpatient-derivedgastriccancerxenograftmodels
HU Bin-quan1,2,CAO Bo1,2,SHI Chang-hong2*
(1.the Fourth Military Medical University,Student Brigade,Xi’an 710032,China; 2.the Fourth Military Medical University Laboratory Animal Center,Xi’an 710032)
In this paper,we summarize the major problems existing in establishing gastric cancer patient-derived xenograft (PDX) models and its solutions,and introduce its advantages on screening targeted drugs.As many previous research emphasized on individual characteristics too much,we argue that we should pay more attention to the generality of what we are studying in order to analyze the genotype of PDX models before taking a targeted therapy.
Gastric cancer; Patient-derived xenografts(PDX) models; Targeted drugs; Genotype characteristics
SHI Chang-hong.E-mail: changhong@fmmu.edu.cn
国家自然科学基金(No.31572340,No.31772546);军队实验动物专项课题(No.SYDW2014-002)。
胡斌权(1995-),男,本科生.研究方向:动物模型的制备。E-mail: 15502966618@163.com
师长宏(1973-),男,博士,教授.研究方向:肿瘤动物模型。E-mail: changhong@fmmu.edu.cn
Q95-33
A
1005-4847(2017) 06-0643-05
10.3969/j.issn.1005-4847.2017.06.010
2017-04-11
