风湿性心脏病患者形成左心房血栓危险因素分析
2017-12-21郎玥孙燕
郎玥 孙燕
(山东大学齐鲁医院东营分院/鸿港医院 心内科,山东东营 257000)
风湿性心脏病患者形成左心房血栓危险因素分析
郎玥 孙燕
(山东大学齐鲁医院东营分院/鸿港医院 心内科,山东东营 257000)
目的:分析风湿性心脏病(风心病)患者形成左心房血栓危险因素,为风心病患者左心房血栓的预防提供参考。方法:217例风心病患者按照超声检查结果,将检出左心房血栓者纳入检出组,将未检出左心房血栓者纳入未检出组,计算患者左心房血栓发生率并比较两组患者临床资料以及超声心动图、血清指标检查检测结果,运用Logistic多因素回归分析,总结影响风心病患者形成左心房血栓的危险因素。结果:217例患者中,共有99例检出左心房血栓,发生率为45.62%。多因素回归分析提示房颤、左心房自回声是影响风心病患者形成左心房血栓的独立危险因素,且随着二尖瓣膜口面积、AT-Ⅲ、NO2/NO3的下降以及左心房面积、左心房收缩期内径、LPA、CRP的上升,患者左心房血栓形成风险逐渐上升(P<0.05)。结论:风心病患者左心房血栓的形成与其病变类型以及超声心动图、血清指标变化均具有密切关联,定期监测患者上述指标变化、评估其左心房血栓形成风险并开展早期干预,对于左心房血栓的控制具有积极意义。
风湿性心脏病;左心房;血栓;危险因素
风湿性心脏病(风心病)患者有着较高的左心房血栓形成风险,病残、病死率较高[1]。风心病患者左心房血栓的形成不仅与局部血流机械性梗阻有关[2],也与机体抗栓能力的显著下降具有密切关联[3]。因此,系统分析风心病患者左心房血栓形成的机制及危险因素有其临床参考价值。
1 对象与方法
1.1 研究对象
以2015年2月至2017年3月期间明确风心病诊断217例患者资料进行对照分析。217例患者中,男117例,女100例,年龄22~53岁,平均(35.75±3.19)岁,病程3~6年,平均(3.99±1.40)年,病变类型[4]:二尖瓣狭窄71例,二尖瓣病变37例,二尖瓣轻微关闭27例,窦性心律35例,房颤47例。
1.2 研究方法
TEE检查左心房血栓状态结果判断参照文献标准[5],未检出组计算患者左心房血栓发生率。使用发色底物显色法检测抗凝血酶-Ⅲ(AT-Ⅲ),酶联免疫吸附法检测溶血磷脂酸(LPA)浓度,硝酸镁还原法检测NO2/NO3水平,免疫比浊法检测CRP水平[6-7]。比较检出组与未检出组两组患者临床资料以及超声心动图、血清指标检测结果,运用Logistic多因素回归分析,总结影响风心病患者形成左心房血栓的危险因素。
所有数据以EXCEL表整理,采用SPSS18.0统计,χ2检验, t或t’检验,Logistic多因素回归分析,以P<0.05为有统计学意义。
2 结果
217例患者中,共有99例检出左心房血栓,发生率为45.62%。
各指标单因素分析见表1。检出组房颤发生率高于未检出组,差异有统计学意义(P<0.05),两组患者年龄、病程、性别比较,差异无统计学意义(P>0.05)。检出组二尖瓣膜口面积、AT-Ⅲ、NO2/NO3低于未检出组,其左心房面积、左心房收缩期内径、LPA、CRP高于未检出组,差异有统计学意义(P<0.05)。
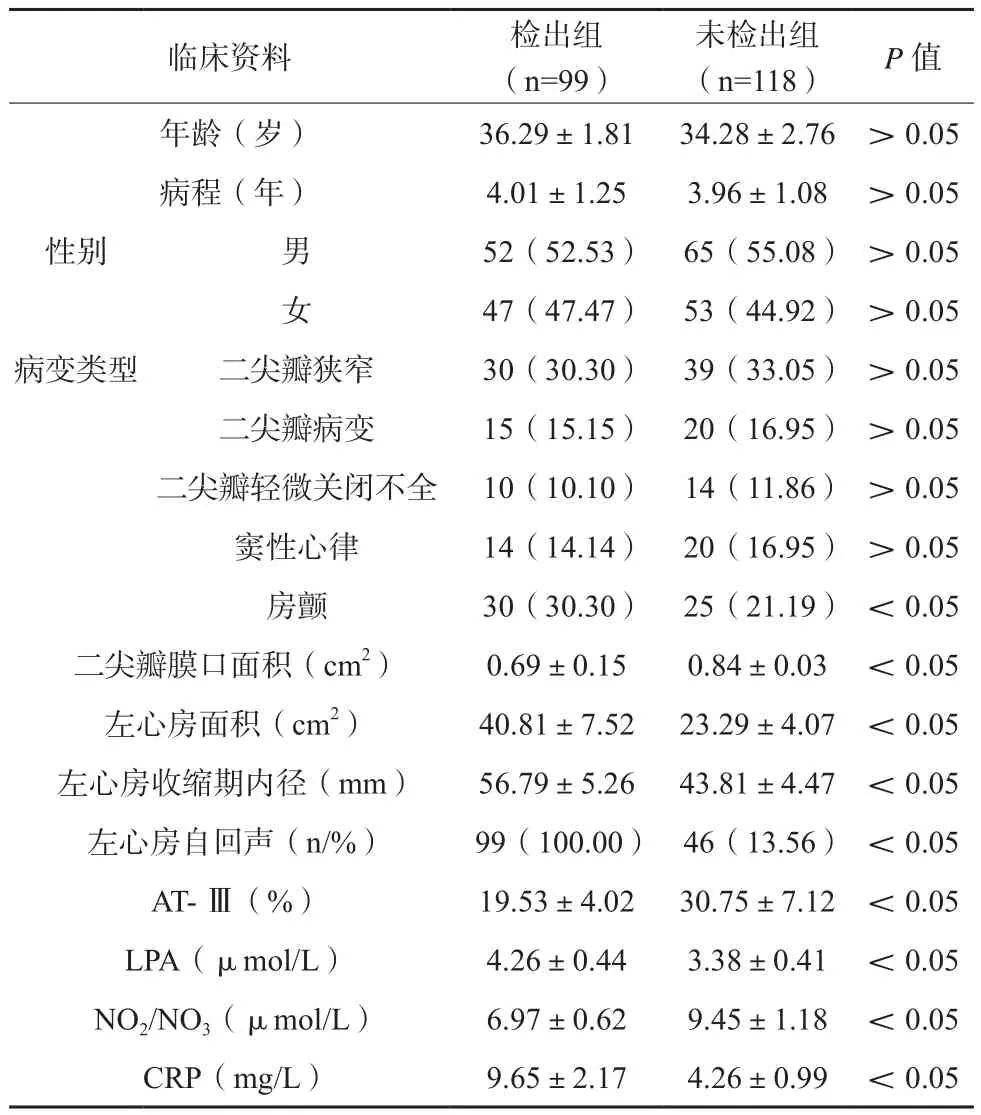
表1 患者单因素分析表(n/%)
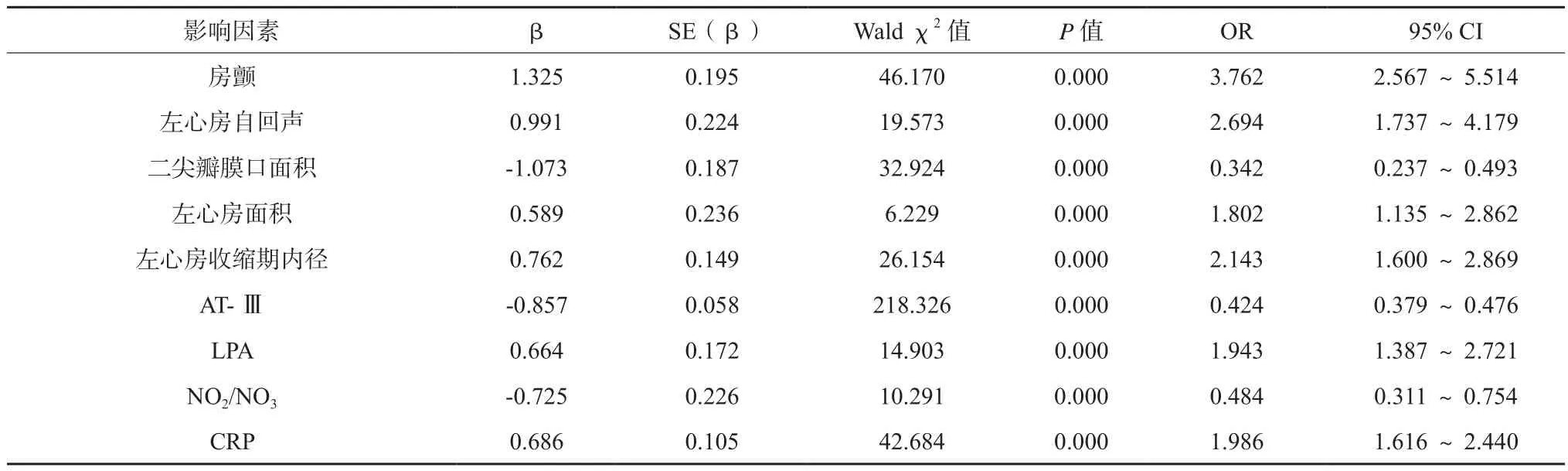
表2 影响风心病患者形成左心房血栓的多因素回归分析结果
多因素回归分析见表2。房颤、左心房自回声是影响风心病患者形成左心房血栓的独立危险因素,且随着二尖瓣膜口面积、AT-Ⅲ、NO2/NO3的下降,以及左心房面积、左心房收缩期内径、LPA、CRP的上升,患者左心房血栓形成风险逐渐上升(P<0.05)。
3 讨论
此次研究217例风心病患者左心房血栓发生率达45.62%,风心病特别是二尖瓣狭窄极易形成左心房血栓,威胁患者生存质量[8]。左心房血栓形成后,患者局部血液循环受到明显阻滞,此时体内血管往往出现血液淤积、血栓形成、血管阻塞,造成全身正常血液循环受阻,易引发多种血液循环疾病[9];与此同时,风心病患者较差的免疫功能,往往进一步诱发感染及其他部位血栓形成,从而加重患者病情,导致残疾甚至死亡[10]。
此次研究提示房颤、左心房自回声的发生可导致患者左心房血栓形成风险成倍增加,其原因为:1)房颤患者心房内血流速度较慢且往往处于瘀滞状态,可激活血小板并上调β血小板球蛋白、血小板第4因子、凝血酶-抗凝血酶复合体、D-二聚体等血栓前状态分子标志物表达水平,奠定血栓形成的血液学基础[11-12]。2)左心房自回声是指非造影状态下左心房与左心耳内出现的烟雾状回声,主要呈漩涡样运动且与白色噪音伪差存在明显区别,这一现象的发生意味着患者左心房内膜存在明显损伤,此时血小板极易粘附聚集于损伤部位,奠定血栓形成的病理学基础[13]。
回归分析还提示随着二尖瓣膜口面积、AT-Ⅲ、NO2/NO3的下降以及左心房面积、左心房收缩期内径、LPA、CRP的上升,患者左心房血栓形成风险逐渐上升,其机制包括:1)二尖瓣膜口面积的减小与左心房面积、左心房收缩期内径的增大说明患者处于机械性瓣膜梗阻状态,这一状态所引发的左心房内血流瘀滞、心室血流剪切力下降,均可造成左心房有效充盈减少,进而降低内皮型一氧化氮合酶(eNOS)表达水平与生物活性,加之内皮细胞损伤对eNOS表达水平的不良影响,均造成血栓形成风险大幅上升[14-15]。2)AT-Ⅲ是体内主要的抗凝调节蛋白,约占人体AT抗凝总活力的70%,其水平稳定是维持促凝、抗凝、抗纤溶系统平衡的关键,而患者反复风湿活动所致血管内皮细胞受损可造成AT-Ⅲ活性降低与凝血酶释放增加,为中和过量凝血酶,AT-Ⅲ水平进一步下降,形成恶性循环,最终造成左心房血栓的发生[16]。3)NO2/NO3是NO的稳定代谢产物,其血清含量能够准确反映机体NO水平,故NO2/NO3下降意味着NO分泌减少,此时NO对血小板的抑制作用难以有效发挥,是造成纤溶酶原激活物抑制剂1表达增加、血小板粘附聚集的主要原因,也是促使左心房血栓形成的重要因素。4)作为一种多功能磷脂信使,LPA主要由活化的血小板产生,故可准确反映机体血小板活化状态,其主要作用在于促进单核细胞趋化蛋白-1和内皮细胞内细胞间黏附分子-1表达,进而增强单核细胞趋化性、吸引单核细胞及白细胞进入病灶区域[17]。机体血液循环内LPA水平上升意味着血小板大量激活,而高水平LPA可经过反馈作用增强血小板聚集能力,形成“血小板激活-LPA升高-血小板激活”放大效应循环,诱发血栓的形成与进展[18]。
概括而言,最主要的影响因素为机体促凝因素的增加与抗凝抗栓能力的下降;早期识别高危患者并予以科学、合理的干预治疗,有望降低患者左心房血栓形成风险。
[1] CHEN Z Q, HONG L, WANG H, et al. Application of Percutaneous Balloon Mitral Valvuloplasty in Patients of Rheumatic Heart Disease Mitral Stenosis Combined with Tricuspid Regurgitation[J]. Chin Med J, 2015, 128(11): 1479.
[2] HOLMES D R, KAR S, PRICE M J, et al. Prospective randomized evaluation of the Watchman Left Atrial Appendage Closure device in patients with atrial fibrillation versus longterm warfarin therapy: the PREVAIL trial[J]. J Am Coll Cardiol,2014, 64(1): 1-12.
[3] 任波, 李玲, 顾鹏. 超声诊断风湿性心脏病合并房颤并发左上肢动脉血栓栓塞1例[J]. 医学影像学杂志, 2016, 26(8): 1421-1421.
[4] PARASHAR A, SUD K, DEVGUN J, et al. Feasibility of LAA closure for left atrial thrombus in patients with aortic stenosis and AF[J]. J Am Coll Cardiol, 2016, 68(7): 770.
[5] BAJWA A, HYDER S N, AZIZ S. The fac-tors causing left atrial appendage clot formation in patients with se-vere rheumatic mitral stenosis[J]. Heart Res Open J, 2016, 3(1): 1-5.
[6] REMENYI B, ELGUINDY A, SMITH S C, et al. Valvular aspects of rheumatic heart disease[J]. The Lancet, 2016,387(10025): 1335-1346.
[7] STONE D, BYRNE T, PERSHAD A. Early results with the LARIAT device for left atrial appendage exclusion in patients with atrial fibrillation at high risk for stroke and anticoagulation[J]. Catheter Cardiovasc Interv, 2015, 86(1): 121-127.
[8] MEIER B, BLAAUW Y, KHATTAB A A, et al. EHRA/EAPCI expert consensus statement on catheter-based left atrial appendage occlusion[J]. Europace, 2014, 16(10): 1397-1416.
[9] 邹远泉, 周跃, 钟山, 等. 风湿性心脏病左心房血栓形成的机制、各因素的作用及其相互关系的研究[J]. 中西医结合心脑血管病杂志, 2015, 13(6): 806-807.
[10] MURDOCH D, MCAULAY L, WALTERS D L. Combined percutaneous balloon mitral valvuloplasty and left atrial appendage occlusion device implantation for rheumatic mitral stenosis and atrial fibrillation[J]. Cardiovasc Revasc Med, 2014,15(8): 428-431.
[11] DI MINNO M N D, AMBROSINO P, RUSSO A D, et al.Prevalence of left atrial thrombus in patients with non-valvular atrial fibrillation[J]. Thromb Haemost, 2016, 115(3): 663-677.
[12] 任波, 李玲, 顾鹏. 超声诊断风湿性心脏病合并房颤并发左上肢动脉血栓栓塞1例[J]. 医学影像学杂志, 2016, 26(8): 1421-1421.
[13] VERMA A, CAIRNS J A, MITCHELL L B, et al. 2014 focused update of the Canadian Cardiovascular Society Guidelines for the management of atrial fibrillation[J]. Can J Cardiol, 2014,30(10): 1114-1130.
[14] KARTHIKEYAN G, ANANTHAKRISHNAN R,DEVASENAPATHY N, et al. Transient, subclinical atrial fibrillation and risk of systemic embolism in patients with rheumatic mitral stenosis in sinus rhythm[J]. Am J Cardiol,2014, 114(6): 869-874.
[15] 柳佳吉, 罗志强, 来永强, 等. 血管性血友病因子在风湿性二尖瓣狭窄合并心房纤颤左心房血栓形成中的作用[J]. 中华胸心血管外科杂志, 2015, 31(10): 612-615.
[16] MURUGESAN V, PULIMAMIDI V K, RAJAPPA M, et al. Elevated fibrinogen and lowered homocysteine-vitamin determinants and their association with left atrial thrombus in patients with rheumatic mitral stenosis[J]. Br J Biomed Sci,2015, 72(3): 102-106.
[17] ANDRADE J, KHAIRY P, DOBREV D, et al. The clinical profile and pathophysiology of atrial fibrillation[J]. Circ Res,2014, 114(9): 1453-1468.
[18] GILLINOV A M, GELIJNS A C, PARIDES M K, et al. Surgical ablation of atrial fibrillation during mitral-valve surgery[J]. N Engl J Med, 2015, 372(15): 1399-1409.
R541.2
A
2095-5200(2017)06-083-03
10.11876/mimt201706033
郎玥,本科,主治医师,研究方向:心内科临床,Email:sdlangyue1991@163.com。
