窄带成像诊断Barrett食管及早期食管腺癌分析
2017-12-21李晶晶连军
李晶晶 连军
(1.宁夏石嘴山市第一人民医院消化科,宁夏石嘴山 753600;2.宁夏第五人民医院石嘴山中心医院内三科,宁夏石嘴山 753600)
窄带成像诊断Barrett食管及早期食管腺癌分析
李晶晶1连军2
(1.宁夏石嘴山市第一人民医院消化科,宁夏石嘴山 753600;2.宁夏第五人民医院石嘴山中心医院内三科,宁夏石嘴山 753600)
目的:分析窄带成像(NBI)诊断Barrett食管及早期食管腺癌的效能,探讨其临床应用价值。方法:185例疑似Barrett食管、早期食管腺癌患者为研究对象,依次行内镜下常规白光、NBI及复方碘染色,比较3种方法观察病变轮廓及浅表毛细血管结构形态的清晰度,将3种方法的诊断结果与病理检查结果对比,计算灵敏度、特异性、准确率。结果:常规白光观察粘膜腺管开口形态的清晰度低于复方碘染色,常规白光、复方碘染色观察病变轮廓、粘膜腺管开口形态的清晰度均低于NBI,差异有统计学意义(P<0.05)。185例患者中,病理检查共确诊47例(25.41%)Barrett食管及早期食管腺癌。常规白光的诊断灵敏度、特异性、准确率、阴性预测值、阳性预测值均低于复方碘染色,复方碘染色诊断的诊断效能与NBI相仿但其灵敏度明显低于后者。结论:NBI诊断Barrett食管及早期食管腺癌的效能优于常规内镜、安全性优于复方碘染色,可以作为一种安全、准确、可靠的诊断技术推广。
窄带成像;Barrett食管;早期食管腺癌;诊断
Barrett食管是指食管下段复层鳞状上皮被单层柱状上皮替代的病理改变,可伴肠化生或不伴有肠化生,被认为是食管腺癌和部分胃-食管连接处腺癌的癌前病变[1]。尽管食管腺癌仅占食管癌的10%,但其转移早、复发风险高的特点,使之较食管鳞癌患者预后更差。因此,早期明确Barrett食管诊断并判断食管腺癌发生情况,对于降低食管腺癌发病率、为患者争取根治性手术机会有着重要意义[2]。窄带成像(NBI)是一种新型内镜下成像技术,通过过滤内镜光源并保留窄带广谱,NBI可在无需染色的前提下清晰观察粘膜表面微细腺管形态与微血管形态,为病灶的定位与性质判断提供可靠参考[3]。现将NBI诊断Barrett食管与早期食管腺癌的效能进行分析。
1 对象与方法
1.1 研究对象
2014年5月至2017年6月185例疑似Barrett食管[4]及早期食管癌患者,均未合并下段食管癌、胃底贲门癌等其他消化道恶性肿瘤,无食管狭窄等解剖形态学异常。
1.2 检查方法
1.2.1 内镜检查 患者均于内镜检查前禁食水6 h,使用GIF-Q240Z内镜以及CLV-260SL NBI氙气冷光源系统(日本Olympus公司),依次行内镜下常规白光[5]、NBI及复方碘染色[6]观察,可疑病变取活检。对各模式下图像轮廓和腺管开口形态的清晰度进行评价,评价标准[7]:1分:难以看清;2分:模糊可见;3分:较为清晰;4分:非常清晰。NBI模式下正常食管粘膜为绿色,可疑病变一般为褐色。复方碘染色观察完毕后退镜,患者口服20 mL 5%硫代硫酸钠溶液以清除食管粘膜覆盖的复方碘溶液,减轻碘溶液所致痉挛、疼痛,降低喉炎、化学肺炎、超敏反应甚至过敏性休克等不良反应发生风险。
1.2.2 病理检查 内镜检查各阶段发现的可疑病变均送病理组织检查,将切除标本染色,脱水、切片后置于电镜下观察,根据文献[8]标准诊断及分类。
1.3 诊断效能分析
比较不同模式下清晰度,数据输入SAS统计软件,以P<0.05为差异有统计学意义。以病理组织学检查结果为金标准,计算内镜下常规白光、NBI及复方碘染色图像诊断效能,计算公式[9]:灵敏度=真阳性/(真阳性+假阴性)×100%;特异性:真阴性/(真阴性+假阳性)×100%;准确率=(真阳性+真阴性)/总例数×100%;阳性预测值=真阳性/(真阳性+假阳性)×100%;阴性预测值=真阴性/(真阴性+假阴性)×100%。
2 结果
2.1 图像评分
常规白光观察粘膜腺管开口形态的清晰度低于复方碘染色,常规白光、复方碘染色观察病变轮廓、粘膜腺管开口形态的清晰度均低于NBI,差异有统计学意义(P<0.05)。见表1。
2.2 诊断效能
185例患者中,病理检查共确诊47例(25.41%)Barrett食管及早期食管腺癌。常规白光的诊断灵敏度、特异性、准确率、阴性预测值、阳性预测值均低于复方碘染色,复方碘染色诊断的诊断效能与NBI相仿但其灵敏度明显低于后者。见表2、表3。

表1 3种诊断方法的图像评分对比(n=185,n/%)
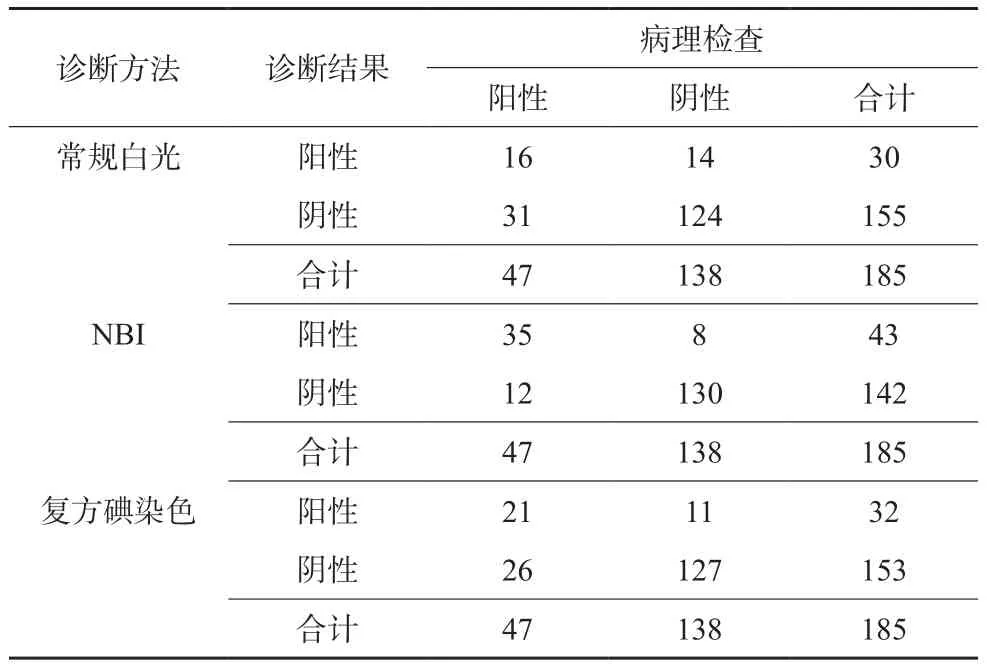
表2 3种诊断方法与病理检查结果的对比(n)

表3 3种方法诊断Barrett食管合并早期食管腺癌的效能(%)
3 讨论
20世纪70年代,我国食管腺癌的发生率约占食管癌的10%,这一数字至90年代已升至15.9%,其流行病学趋势逐渐向欧美发达国家靠拢[10]。作为食管腺癌的独立危险因素,伴有特殊肠上皮化生的Barrett食管可导致患者食管腺癌发生风险上升30~50倍,与此同时,食管腺癌患者预后极差,5年生存率不足13%[11-12]。Barrett食管的癌变步骤包括特殊肠上皮化生、低度异型增生、高度异型增生、原位癌、浸润性腺癌。内镜及食管粘膜活检是诊断Barrett食管的常用技术,理想情况下,内镜下发现食管远端管状食管与囊状胃交界处明显柱状上皮化生,并与鳞状、柱状上皮交界分离,即可指导Barrett食管的判断,然而,实际临床工作中,约有20%的人群交界处解剖结构变异,且食管下段炎症所致齿状线辨别不清、食管粘膜与Barrett食管粘膜难以区分,均可导致Barrett食管的常规内镜漏诊[13-14]。本组常规白光内镜检查病变轮廓、粘膜腺管开口形态的清晰度评分集中于1~2分且诊断Barrett食管和早期食管腺癌的灵敏度仅为34.04%。
与常规内镜相比,染色内镜在Barrett食管及早期食管腺癌的诊断中具有较大的优势,碘与食管鳞状上皮细胞内糖原发生反应并被染色,糖原含量极低的发育不良细胞以及癌细胞基本不被染色[15]。染色结果可为正常粘膜与病变粘膜的辨别与区分提供可靠参考。因此碘染色法灵敏度、准确率上升,显现出这一技术的诊断价值。然而,由于碘溶液的强烈粘膜刺激作用,患者检查后易出现胸骨后疼痛、化学性食管炎、喉炎等不良反应,且染色范围难以覆盖食管入口、颈段食管以及下咽部均导致该技术的安全性受限[16]。
作为染色内镜的替代技术,NBI的成像原理为:红、绿、蓝滤光片将氙气灯发出的白光过滤后照射至组织粘膜表面,滤光片对光源的窄化作用可使光子渗透至胃肠粘膜深部,为病灶的定位与识别提供准确参考[17]。与此同时,窄化后的蓝光波长仅为415 nm,此时血红蛋白对蓝光的吸收率达到峰值,故NBI能够在清晰显示病变轮廓的基础上,为粘膜表面细微结构及毛细血管的观察与识别创造良好条件[18]。此外,与染色内镜相比,NBI还可避免因染色不均所致观察视野限制,从而在保证安全性的同时进一步提高诊断灵敏度。因此,在3种方法的对比中,NBI观察病变轮廓、粘膜腺管开口形态的清晰度最高,且诊断Barrett食管和早期食管腺癌的效能最为理想。
[1] KATO M, GODA K, SHIMIZU Y, et al. Image assessment of Barrett’s esophagus using the simplified narrow band imaging classification[J]. J Gastroenterol, 2017, 52(4): 466-475.
[2] SHARMA P, BERGMAN J J, GODA K, et al. Development and validation of a classification system to identify highgrade dysplasia and esophageal adenocarcinoma in Barrett’s esophagus using narrow-band imaging[J]. Gastroenterology,2016, 150(3): 591-598.
[3] 黄学, 贾秋红, 刘福建. Barrett食管的内镜诊断技术应用进展[J]. 山东医药, 2016, 56(31): 109-111.
[4] ALMOND L M, HUTCHINGS J, LLOYD G, et al. Endoscopic Raman spectroscopy enables objective diagnosis of dysplasia in Barrett’s esophagus[J]. Gastrointest Endosc, 2014, 79(1): 37-45.
[5] SONG J, ZHANG J, WANG J, et al. Meta-analysis of the effects of endoscopy with narrow band imaging in detecting dysplasia in Barrett’s esophagus[J]. Dis Esophagus, 2015, 28(6): 560-566.
[6] 张云. 内镜窄带成像技术与Lugol液染色诊断Barrett食管的对比研究[J]. 国际消化病杂志, 2017, 37(2): 114-116.
[7] KIESSLICH R. Columnar Epithelium-Lined (Barrett’s)Esophagus: Mucosal Neoplasias[M]//Early Neoplasias of the Gastrointestinal Tract. Springer US, 2014: 115-127.
[8] HASHIMOTO R, HIRASAWA D, CHONAN A, et al. “Small white sign” in Barrett’s esophageal cancer under the squamous epithelium[J]. Gastrointest Endosc, 2017, 86(1): 231-233.
[9] CAMERON G R, JAYASEKERA C S, WILLIAMS R, et al.Detection and staging of esophageal cancers within Barrett’s esophagus is improved by assessment in specialized Barrett’s units[J]. Gastrointest Endosc, 2014, 80(6): 971-983.
[10] HAIDRY R J, BUTT M A, DUNN J M, et al. Improvement over time in outcomes for patients undergoing endoscopic therapy for Barrett’s oesophagus-related neoplasia: 6-year experience from the first 500 patients treated in the UK patient registry[J].Gut, 2015, 64(8): 1192-1199.
[11] 王芳军, 高昳, 赵可, 等. 窄带成像放大内镜在Barrett食管随访监测中的应用价值[J]. 中华消化内镜杂志, 2016, 33(11): 764-768.
[12] SAMI S S, SUBRAMANIAN V, BUTT W M, et al. High definition versus standard definition white light endoscopy for detecting dysplasia in patients with Barrett’s esophagus[J]. Dis Esophagus, 2015, 28(8): 742-749.
[13] POUW R E, VISSER M, ODZE R D, et al. Pseudo-buried Barrett’s post radiofrequency ablation for Barrett’s esophagus, with or without prior endoscopic resection[J].Endoscopy, 2014, 46(02): 105-109.
[14] BOERWINKEL D F, SWAGER A F, CURVERS W L, et al.The clinical consequences of advanced imaging techniques in Barrett’s esophagus[J]. Gastroenterology, 2014, 146(3): 622-629.
[15] 赵娜. 窄带成像技术、染色法及超声内镜联合应用在早期食管癌中的应用价值[D]. 石河子:石河子大学, 2014.
[16] ESPINO A, CIROCCO M, DACOSTA R, et al. Advanced imaging technologies for the detection of dysplasia and early cancer in barrett esophagus[J]. Clin Endosc, 2014, 47(1): 47.
[17] REALDON S, ANTONELLO A, ARCIDIACONO D, et al.Adherence to WCRF/AICR lifestyle recommendations for cancer prevention and the risk of Barrett’s esophagus onset and evolution to esophageal adenocarcinoma: results from a pilot study in a high-risk population[J]. Eur J Nutr, 2016, 55(4):1563-1571.
[18] KAGEMOTO K, OKA S, TANAKA S, et al. Clinical outcomes of endoscopic submucosal dissection for superficial Barrett’s adenocarcinoma[J]. Gastrointest Endosc, 2014, 80(2): 239-245.
R735.1
A
2095-5200(2017)06-023-03
10.11876/mimt201706009
李晶晶,本科,主治医师,研究方向:消化道早癌临床研究,Email:Szsljj783@163.com。
