低分子肝素对肾小球肾炎大鼠血栓调节蛋白、单核细胞趋化蛋白-1及细胞间粘附因子-1的影响
2017-12-21翟金俊
翟金俊
山西省人民医院急诊科,山西太原 030012
低分子肝素对肾小球肾炎大鼠血栓调节蛋白、单核细胞趋化蛋白-1及细胞间粘附因子-1的影响
翟金俊
山西省人民医院急诊科,山西太原 030012
目的探讨低分子肝素对肾小球肾炎大鼠血栓调节蛋白、单核细胞趋化蛋白-1及细胞间粘附因子-1的影响。方法随机选取我院实验室饲养雌性3月龄、24月龄Wistar大鼠各36只,随机数字表法分为正常对照组A、B,脂多糖诱导模型组A、B,低分子肝素治疗组A、B,每组12只。于建模成功后12、24、48h分别取大鼠断头取血测定其血浆血栓调节蛋白(PTM)、单核细胞趋化蛋白-1(MCP-1)及细胞间粘附因子-1(ICAM-1)的表达情况。结果与正常对照组A、B相比较,脂多糖诱导模型组A、B各时间点血浆调节蛋白、单核细胞趋化蛋白-1、细胞间粘附因子-1水平均显著升高,P<0.05,肾小球肾炎大鼠模型诱导成功;经治疗低分子肝素治疗组A、B24h及48h血浆血栓调节蛋白、单核细胞趋化蛋白-1、细胞间粘附因子-1明显降低,P<0.05。24h及48h低分子肝素治疗组A的血浆血栓调节蛋白、单核细胞趋化蛋白-1、细胞间粘附因子-1水平显著低于低分子肝素治疗组B,P<0.05。结论低分子肝素可有效改善肾小球肾炎大鼠的炎性反应,低龄大鼠48h的改善效果最佳,低分子肝素的炎症抑制作用最明显,增龄可阻碍低分子肝素对肾小球炎症的抑制作用。
低分子肝素;肾小球肾炎;血栓调节蛋白;单核细胞趋化蛋白-1;细胞间粘附因子-1
急性肾小球肾炎为多发于双侧肾小球的变态反应性疾病。临床以血尿、高血压以及不同程度水肿为主要表现,患者主要存在免疫异常现象以及炎症损伤现象。临床多数研究显示,其发生为纤维蛋白沉积造成内皮细胞炎性损伤[1-2]。炎性细胞的募集、浸润以及活化受到粘附因子、细胞因子以及炎性介质的介导,单核细胞趋化蛋白-1和细胞间粘附因子-1为炎症反应的重要介导介质,在炎性细胞的趋化及激活中占据重要角色[3-4]。另有研究显示,肾小球疾病患者亦存在凝血活性异常现象,血栓调节蛋白作为内皮细胞强抗凝活性蛋白,其表达水平有效反映血管内皮细胞损伤程度[5]。临床相关肾小球肾炎发病机制及药物治疗疗效的研究广泛,但对不同年龄患者治疗疗效的研究甚少。故本次研究建立肾小球肾炎模式,探讨低分子肝素对其血浆血栓调节蛋白、单核细胞趋化蛋白-1及细胞间粘附因子-1表达的影响,同时分析低分子肝素对不同年龄肾小球肾炎治疗的临床效果。具体研究报道如下。
1 资料与方法
1.1 一般资料
随机选取我院实验室饲养雌性3月龄Wistar大鼠36只,随机数字表法分为正常对照组A、脂多糖诱导模型组A、低分子肝素治疗组A,每组12只。大鼠体重在 220~ 230g之间,平均(220±15)g,饲养环境喂养饲料等差异无统计学意义。另随机选取我院实验室饲养雌性24月龄Wistar大鼠36只,随机数字表法分为正常对照组B、脂多糖诱导模型组B、低分子肝素治疗组B,每组12只。大鼠体重在 420~ 450g,平均(430±20)g,饲养环境喂养饲料等差异无统计学意义。3月龄组大鼠的平均月龄为(3.1±0.15)月、24月龄组的平均月龄为(24.2±0.19)月,3月龄组组内比较及24月龄组组内比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 动物模型制备 正常对照组A和正常对照组B大鼠均尾静脉注射0.9%氯化钠溶液3.0mL形成正常对照模型。脂多糖诱导模型组A、低分子肝素治疗组A、脂多糖诱导模型组B、低分子肝素治疗组B均给予大鼠尾静脉注射脂多糖(美国Sigma公司,10mg/100mg)14mg/kg诱导制备肾小球肾炎大鼠模型。低分子肝素治疗组A和低分子肝素治疗组B大鼠均于肾小球肾炎模型制备前一天起给予肝素(Sigma公司,160USP/mg)250U/100g腹腔内注射,每天一次。
1.2.2 研究方法 分别根据上述动物模型制备方法处理各组大鼠。于动物实验第12、24、48h分别选取各组大鼠4只进行断头采血。每只大鼠采血12mL置于枸缘酸钠抗凝试管中备用。备用血37℃水浴30min后,2000r/min离心5min。分别取离心血清及血浆保存于-30°冰箱备用。采用酶联免疫吸附试验测定血浆血栓调节蛋白、血清单核细胞趋化蛋白-1及血清细胞间粘附因子-1。酶联免疫吸附试验试剂盒选取美国Adlitteram Diagnostic Laboratories 公司产品,具体操作依据说明书进行。
1.3 观察指标
(1)血浆血栓调节蛋白水平;(2)单核细胞趋化蛋白-1水平;(3)细胞间粘附因子-1水平。
1.4 统计学方法
研究获取患者资料采用SPSS18.0系统软件分析;计量资料以()表示,采用t检验,计数资料以百分比表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠血浆血栓调节蛋白水平分析比较
与正常对照组A、B相比较,脂多糖诱导模型组A、B各时间点血浆调节蛋白水平均显著升高,差异有统计学意义(P<0.05),肾小球肾炎大鼠模型诱导成功;与脂多糖诱导模型组A、B相比较,低分子肝素治疗组A、B 24h及48h血浆血栓调节蛋白水平明显降低,差异有统计学意义(P<0.05),低分子肝素治疗效果较佳;与正常对照组A相比较,低分子肝素治疗组A 24h及48h血浆血栓调节蛋白水平差异无统计学意义(P>0.05)。3月龄组与24月龄组脂多糖诱导模型各时间点血浆血栓调节蛋白水平比较差异无统计学意义(P>0.05),而24h及48h低分子肝素治疗组A的血浆血栓调节蛋白水平显著低于低分子肝素治疗组B,差异有统计学意义(P<0.05)。见表1。
2.2 大鼠单核细胞趋化蛋白-1水平分析比较
与正常对照组A、B相比较,脂多糖诱导模型组A、B各时间点单核细胞趋化蛋白-1水平均显著升高,差异有统计学意义(P<0.05),肾小球肾炎大鼠模型诱导成功;与脂多糖诱导模型组A、B相比较,低分子肝素治疗组A、B24h及48h单核细胞趋化蛋白-1水平明显降低,差异有统计学意义(P<0.05),低分子肝素治疗效果较佳;与正常对照组A相比较,低分子肝素治疗组A48h单核细胞趋化蛋白-1水平差异无统计学意义(P>0.05),更趋近于正常水平。3月龄组与24月龄组脂多糖诱导模型各时间点单核细胞趋化蛋白-1水平比较差异无统计学意义(P>0.05),而24h及48h低分子肝素治疗组A的单核细胞趋化蛋白-1水平显著低于低分子肝素治疗组B,差异有统计学意义(P<0.05),增龄可阻碍低分子肝素对肾小球炎症的抑制作用。具体见表2。
表1 大鼠血浆血栓调节蛋白水平分析比较(±s,ng/mL)

表1 大鼠血浆血栓调节蛋白水平分析比较(±s,ng/mL)
注:3月龄组:与正常对照组 A 相比较,a1t=5.620,P=0.001;a2t=5.706,P=0.001;a3t=5.572,P=0.001;a4t=3.237,P=0.018;a5t=2.126,P=0.078;a6t=0.215,P=0.837;与脂多糖诱导模型组A相比较,b1t=1.737,P=0.133;b2t=4.640,P=0.004;b3t=4.658,P=0.004。24月龄组:与正常对照组B相比较,a7t=7.643,P=0.000;a8t=7.566,P=0.000;a9t=7.566,P=0.000;a10t=3.919,P=0.008;a11t=4.411,P=0.005;a12t=3.490,P=0.013;与脂多糖诱导模型组B相比较,b4t=1.611,P=0.158;b5t=3.635,P=0.011;b6t=5.032,P=0.002。3月龄与24月龄比较:与脂多糖诱导模型组A相比较,脂多糖诱导模型组B c1t=1.288,P=0.245;c2t=1.281,P=0.247;c3t=1.262,P=0.254;与低分子肝素治疗组A相比较,低分子肝素治疗组B d1t=0.994,P=0.359;d2t=3.143,P=0.020;d3t=2.604,P=0.040
组别12h血浆血栓调节蛋白水平 24h血浆血栓调节蛋白水平 48h血浆血栓调节蛋白水平3月龄组 正常对照组A 2.26±0.54 2.26±0.53 2.26±0.54脂多糖诱导模型组A 4.88±0.76a1 4.88±0.75a2 4.88±0.77a3低分子肝素治疗组A 3.89±0.85a4,b1 2.95±0.36a5,b2 2.36±0.76a6,b3 24月龄组 正常对照组B 2.27±0.56 2.27±0.55 2.27±0.55脂多糖诱导模型组B 5.52±0.64a7,c1 5.52±0.66a8,c2 5.52±0.66a9,c3低分子肝素治疗组B 4.55±1.02a10,b4,d1 3.97±0.54a11,b5,d2 3.51±0.45a12,b6,d3
表2 大鼠单核细胞趋化蛋白-1水平分析比较(± s,pg/mL)
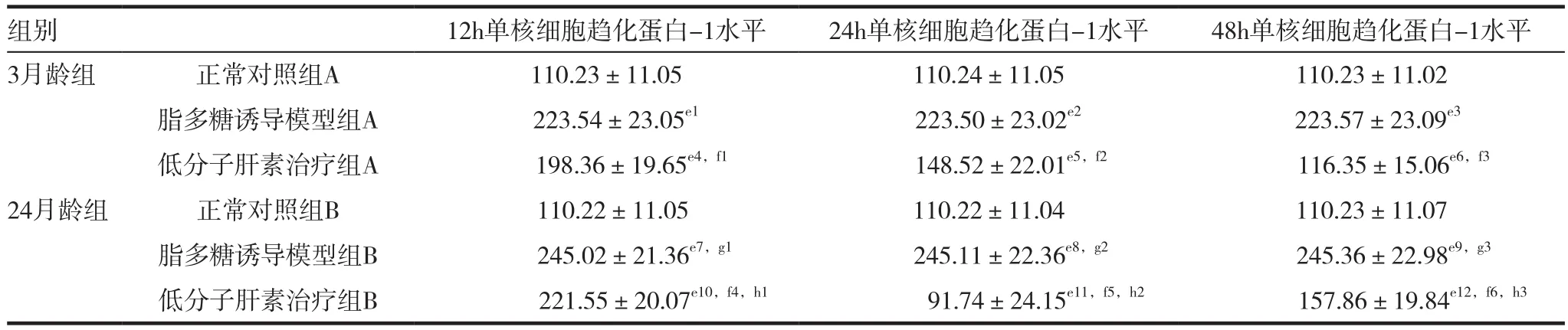
表2 大鼠单核细胞趋化蛋白-1水平分析比较(± s,pg/mL)
注:3月龄组:与正常对照组 A 相比较,e1t=8.866,P=0.000;e2t=8.871,P=0.000;e3t=8.860,P=0.000;e4t=7.819,P=0.000;e5t=3.109,P=0.021;e6t=0.656,P=0.536;与脂多糖诱导模型组A相比较,f1t=1.663,P=0.147;f2t=4.708,P=0.003;f3t=7.779,P=0.000。24月龄组:与正常对照组B相比较,e7t=11.210,P=0.000;e8t=10.818,P=0.000;e9t=10.595,P=0.000;e10t=9.719,P=0.000;e11t=6.140,P=0.001;e12t=4.192,P=0.006;与脂多糖诱导模型组B相比较,f4t=1.602,P=0.160;f5t=3.243,P=0.018;f6t=5.764,P=0.001。3月龄与24月龄比较:与脂多糖诱导模型组A相比较,脂多糖诱导模型组B g4t=1.367,P=0.221;g5t=1.347,P=0.227;g6t=1.338,P=0.229。与低分子肝素治疗组A相比较,低分子肝素治疗组B h4t=1.651,P=0.150;h5t=2.645,P=0.038;h6t=3.333,P=0.016
组别 12h单核细胞趋化蛋白-1水平 24h单核细胞趋化蛋白-1水平 48h单核细胞趋化蛋白-1水平3月龄组 正常对照组A 110.23±11.05 110.24±11.05 110.23±11.02脂多糖诱导模型组A 223.54±23.05e1 223.50±23.02e2 223.57±23.09e3低分子肝素治疗组A 198.36±19.65e4,f1 148.52±22.01e5,f2 116.35±15.06e6,f3 24月龄组 正常对照组B 110.22±11.05 110.22±11.04 110.23±11.07脂多糖诱导模型组B 245.02±21.36e7,g1 245.11±22.36e8,g2 245.36±22.98e9,g3低分子肝素治疗组B 221.55±20.07e10,f4,h1 91.74±24.15e11,f5,h2 157.86±19.84e12,f6,h3
2.3 大鼠细胞间粘附因子-1水平分析比较
与正常对照组A、B相比较,脂多糖诱导模型组A、B各时间点细胞间粘附因子-1水平均显著升高,差异有统计学意义(P<0.05),肾小球肾炎大鼠模型诱导成功;与脂多糖诱导模型组A、B相比较,低分子肝素治疗组A、B 24h及48h细胞间粘附因子-1水平明显降低,差异有统计学意义(P<0.05),低分子肝素治疗效果较佳;与正常对照组A相比较,低分子肝素治疗组A48h细胞间粘附因子-1水平差异无统计学意义(P>0.05),更趋近于正常水平。3月龄组与24月龄组脂多糖诱导模型各时间点细胞间粘附因子-1水平比较差异无统计学意义(P>0.05),而24h及48h低分子肝素治疗组A的细胞间粘附因子-1水平显著低于低分子肝素治疗组B,差异有统计学意义(P<0.05)。见表3。
3 讨论
肾小球肾炎(简称肾炎)是临床常见的肾脏疾病,根据其病因不同,分为原发性肾小球肾炎和继发性肾小球肾炎。其中原发性肾小球肾炎多为感染所造成的自身免疫性疾病[6]。人体免疫系统通过抗原抗体复合物沉积或交叉反应对肾小球基底膜造成损伤,进而引起肾脏功能障碍。急性肾小球肾炎作为临床常见肾炎类型,主要表现为凝血异常以及炎性损伤。单核细胞趋化蛋白-1、细胞间粘附因子-1及血栓调节蛋白可有效反应肾小球肾炎疾病变化。
本研究显示在脂多糖诱导肾小球肾炎大鼠模型组A、B,MCP-1水平均显著升高,证明MCP-1可作为炎症产生的标志因子。单核细胞趋化蛋白-1(MCP-1)为CC趋化因子家族成员,在脂多糖、干扰素γ、白细胞介素、表皮细胞生长因子等刺激诱导下,内皮细胞、单核细胞、上皮细胞以及巨噬细胞等均可分泌MCP-1[7]。其中肾小球细胞即为MCP-1分泌的主要来源。在急性肾小球肾炎发生发展过程中,MCP-1发挥重要的炎性趋化作用。肾小球炎性损伤时,MCP-1趋化并激活单核巨噬细胞,加速炎性损伤作用的同时也可与CCR2受体相结合,促使CCR2受体内部G蛋白偶联受体激酶-2转位并发生Ser/Thr磷酸化,受体钙离子内流应答,快速脱敏,降低MCP-1的趋化性,可使其趋化诱导的炎性细胞准确定位到炎症部位[8-9]。
表3 大鼠细胞间粘附因子-1水平分析比较(± s,ng/mL)
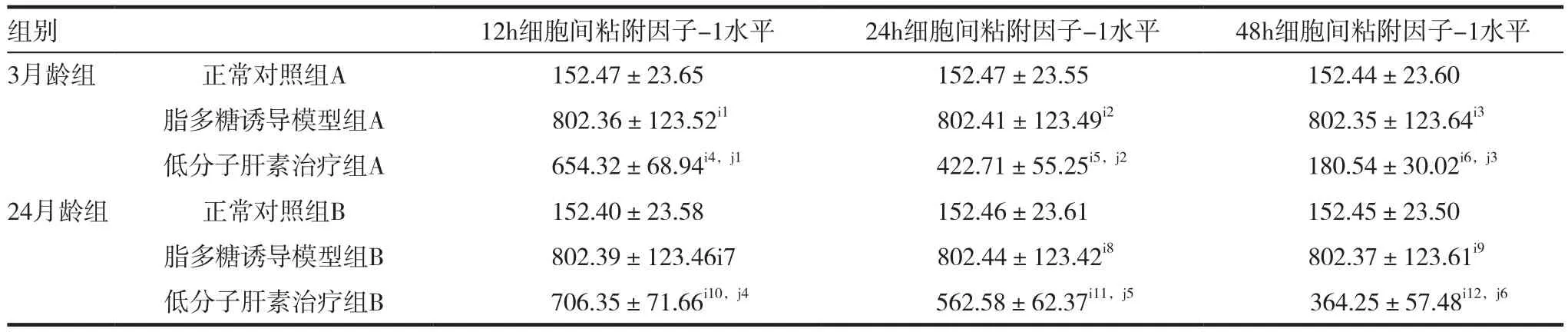
表3 大鼠细胞间粘附因子-1水平分析比较(± s,ng/mL)
注:3月龄组:与正常对照组 A 相比较,i1t=10.335,P=0.000;i2t=10.340,P=0.000;i3t=10.327,P=0.000;i4t=13.771,P=0.000;i5t=8.999,P=0.000;i6t=1.472,P=0.192;与脂多糖诱导模型组 A 相比较,j1t=2.093,P=0.081;j2t=5.613,P=0.001;j3t=9.774,P=0.000。24月龄组:与正常对照组 B 相比较,i7t=10.343,P=0.000;i8t=10.345,P=0.000;i9t=10.331,P=0.000;i10t=14.686,P=0.000;i11t=12.299,P=0.000;i12t=6.821,P=0.001;与脂多糖诱导模型组B相比较,j4t=1.346,P=0.227;j5t=3.469,P=0.013;j6t=6.428,P=0.001。3月龄与24月龄比较:与脂多糖诱导模型组A相比较,脂多糖诱导模型组B k1t=0.000,P=1.000;k2t=0.000,P=1.000;k3t=0.000,P=1.000。与低分子肝素治疗组A相比较,低分子肝素治疗组 B l1t=1.046,P=0.336;l2t=3.357,P=0.015;l3t=5.666,P=0.001
组别 12h细胞间粘附因子-1水平 24h细胞间粘附因子-1水平 48h细胞间粘附因子-1水平3月龄组 正常对照组A 152.47±23.65 152.47±23.55 152.44±23.60脂多糖诱导模型组A 802.36±123.52i1 802.41±123.49i2 802.35±123.64i3低分子肝素治疗组A 654.32±68.94i4,j1 422.71±55.25i5,j2 180.54±30.02i6,j3 24月龄组 正常对照组B 152.40±23.58 152.46±23.61 152.45±23.50脂多糖诱导模型组B 802.39±123.46i7 802.44±123.42i8 802.37±123.61i9低分子肝素治疗组B 706.35±71.66i10,j4 562.58±62.37i11,j5 364.25±57.48i12,j6
本次研究显示在脂多糖诱导肾小球肾炎大鼠模型组A、B,细胞间粘附因子-1水平均显著升高,其主要原因是细胞间粘附因子-1(ICAM-1)是免疫球蛋白超基因家族成员之一。肾小球肾炎发生发展过程中,细胞增殖以及炎性细胞的浸润除与MCP-1相关外,与ICAM-1的作用亦密切相关[10]。细胞间粘附因子作为细胞表面糖蛋白分子,可促进炎症反应中白细胞的粘附以及活化[11]。肾小球肾炎时,炎症局部炎性细胞因子增多,促使ICAM-1的表达上调,进一步刺激免疫细胞发挥作用,放大局部炎症效应。所以,该分子同样可用于炎症的监控。
血栓调节蛋白(PTM)是Esmon及Owen于1981年首次发现,是一种单链跨膜糖蛋白,首次从兔肺中分离获取[12]。本次研究提示在脂多糖诱导肾小球肾炎大鼠模型组A、B,血浆血栓调节蛋白水平均显著升高。这是因为PTM作为凝血酶表面受体,在动静脉、血管淋巴管内皮、肾脏组织、肺脏组织以及胎盘组织中广泛分布[13]。其可针对性与凝血酶相结合,激活蛋白C,对凝血因子V以及凝血因子VIII起到抑制效果,从而发挥其抗凝作用[14-15]。另外PTM与凝血酶结合后可对凝血酶激活的纤溶抑制剂(TAFI)起到活化作用,形成TAFIa。TAFIa对炎症介质缓激肽、过敏毒素C3a、过敏毒素C5a起到抑制作用,降低其致炎活性,具有重要的抗炎、抗血管内膜增生作用,是内皮损伤的重要标记物,可有效反应机体脏器、组织的炎症程度[16]。
低分子肝素被证实在肾小球肾炎的治疗中起到重要作用,其具有显著的抗凝作用,可抑制肾小球肾炎疾病的血栓栓塞,减少凝血酶的产生,降低凝血酶的活性,改善肾小球肾炎疾病凝血异常症状[17]。此外,低分子肝素还可激活细胞外基质,降低各类蛋白酶的活性,进而使细胞外基质的沉积情况得到改善。郭金宝[18]对44例原发性肾小球肾炎患者进行低分子肝素治疗,结果发现,治疗后患者的肌酐清除率明显好转,尿中白蛋白也降低,说明低分子肝素可改善肾功能,降低肾脏损伤。在本研究中,通过低分子肝素的应用,低分子肝素治疗组A、B 24h及48h大鼠血浆血栓调节蛋白水平明显降低,说明低分子肝素在肾小球肾炎大鼠的抗凝作用较佳。ICAM-1和MCP-1作为炎症细胞激活和游走趋化的重要分子,在炎症发生和炎症严重程度的评估中发挥重要作用。低分子肝素应用后发现,ICAM-1和MCP-1的水平也明显降低,说明低分子肝素抑制了肾脏细胞等趋化因子和炎症细胞活化、游走相关的粘附分子的产生,进而抑制肾小球的炎症情况。
此外,本次研究结果提示,低分子肝素治疗组A、B 24h及48h细胞间粘附因子-1、单核细胞趋化蛋白-1水平明显下降,其主要可能是低分子肝素可抑制白细胞介素-6的分泌,使超氧化物歧化酶的分泌量增加,从而对MCP-11起到抑制表达的效果,进一步抵抗炎症反应[19]。林淑芃[20]等在研究中发现老龄个体在肾小球内纤维蛋白的沉积较青年个体严重,使得低分子肝素在老年个体中的内皮保护作用降低。本研究也发现,低分子肝素对3月龄大鼠肾小球炎症的改善程度要优于24月龄大鼠,提示低分子肝素对低龄个体内皮细胞具有更好的保护力。在该本研究中,24h及48h后,3月龄低分子肝素治疗组A的血栓调节蛋白、单核细胞趋化蛋白-1、细胞间粘附因子-1水平显著低于24月龄低分子肝素治疗组B(P<0.05),这提示低分子肝素对于低龄个体的内皮细胞保护作用更佳。
综上,低分子肝素在肾小球肾炎疾病中的应用具有显著的抗凝以及抗炎作用,可明显下调血栓调节蛋白、单核细胞趋化蛋白-1以及细胞间粘附因子-1水平。高龄组的低分子肝素治疗效果较低龄组差,增龄可阻碍低分子肝素对肾小球炎症的抑制作用。
[1] Kokuzawa A,Morishita Y,Yoshizawa H,et al.Acute poststreptococcal glomerulonephritis with acute kidney injury in nephrotic syndrome with the glomerular deposition of nephritis-associated plasmin receptor antigen[J].Internal Medicine,2013,52(18):2087-2091.
[2] Jurci V,Vizjak A,Rigler AA,et al.Goodpasture’s syndrome with concomitant immune complex mixed membranous and proliferative glomerulonephritis[J].Clinical Nephrology,2014,81(3):216-223.
[3] 朱贞刚.单核细胞趋化蛋白-1的表达在小儿急性肾小球肾炎临床之价值探索[J].医学信息,2013,26(10):179-180.
[4] Wagrowska-DanilewiczM,DanilewiczM.Intercellular adhesion molecule-1 (ICAM-1), leucocyte functionassociated antigen-1(LFA-1) and leucocyte infiltration in proliferative human glomerulonephritis[J].ActaHistochemica:Zeitschrift fur Histologische Topochemie,1998,100(2):201-215.
[5] 马昆,阿力亚·吐斯娜,桑晓红,等.血栓调节蛋白在系膜增生性肾小球肾炎中的相关探讨[J].新疆医科大学学报,2007,30(12):1354-1355,1359.
[6] Sandhu G,Bansal A,Ranade A,et al.C3 glomerulopathy masquerading as acute postinfectious glomerulonephritis[J].American Journal of Kidney Diseases:The Official Journal of the National Kidney Foundation,2012,60(6):1039-1043.
[7] 毛志敏,周如丹.MCP-1在炎性反应中的研究进展[J].医学综述,2013,19(6):964-966.
[8] Liu H,Zhang XP,Yi ZW,et al.Efficacy of antisense monocyte chemoattractant protein-1 (MCP-1) in a rat model of mesangial proliferativeglomerulonephritis[J].Renal Failure,2013,35(10):1418-1428.
[9] 吴四海,楼跃,黄磊,等.单核细胞趋化蛋白-1的作用机制研究进展[J].中华临床医师杂志(电子版),2012,06(10):2773-2775.
[10] 徐余宗.粘附因子与肾小球肾炎[J].国外医学免疫学分册,1995,18(2):84-86.
[11] Nguyen TT,Shou I,Funabiki K,et al.Correlations among expression of glomerular intercellular adhesion molecule 1(ICAM-1),levels of serum soluble ICAM-1,and renal histopathology in patients with IgA nephropathy[J].American Journal of Nephrology,1999,19(4):495-499.
[12] Esmon CT,Owen WG.Identification of an endothelial cell cofactor for thrombin-catalyzed activation of protein C[J].ProcNatiAcadSci USA,1981,78(4):2249~ 2252.
[13] 滕林,李俊明,余曼,等.创伤和感染所致多器官功能障碍综合征大鼠血栓调节蛋白的动态表达[J].中国老年学杂志,2012,32(5):1005-1007.
[14] Conway EM.Thrombomodulin and its role in inflammation[J].SeminImmunopathol,2012,34(1):107-125.
[15] 翁海滨.严重创伤患者早期凝血功能变化及与血浆血栓调节蛋白、蛋白C的关系[J].中华创伤杂志,2012,28(5):437-439.
[16] 王霞.血栓调节蛋白在相关疾病中作用的研究进展[J].山东医药,2015,55(34):104-105.
[17] 陈香美,徐启河.肝素治疗肾小球疾病的机理研究进展 [J].中华肾脏病杂志,1998,14(5):331-333.
[18] 郭金宝.低分子肝素治疗原发性肾小球肾炎的临床探讨 [J].中国继续医学教育,2016,8(34):147-149.
[19] Hogysen AK,Abrahamsen TG.Heparin suppresses lipopolysaccharide-induced monocyte production of several cytokines,but simultaneously stimulates C3 production[J].Thromb Res,1995,80(2):179-180.
[20] 林淑芃,孙雪峰,陈香美,等.低分子肝素和尿激酶对老年大鼠肾小球内皮细胞损伤保护作用的比较[J].中国老年学杂志,2008,28(3):212-214.
Effects of low molecular weight heparin on thrombomodulin,monocyte chemoattractant protein -1 and intercellular adhesion molecule -1 in rats with glomerulonephritis
ZHAI Jinjun
Emergency Department, the People's Hospital of Shanxi province, Taiyuan 030012, China
ObjectiveTo investigate the effect of low molecular weight heparin on thrombomodulin, monocyte chemoattractant protein-1 and intercellular adhesion molecule-1 in glomerulonephritis rats.Methods3 month old female rats(n=36) and 24 month old Wistar rats(n=36) in our laboratory were selected, and randomly divided into normal control group A, B, lipopolysaccharide induced model group A, B, low molecular heparin treatment group A,B, 12 rats in each group.The rats were taken blood into determine the expression of plasma thrombomodulin(PTM),monocyte chemoattractant protein-1(MCP-1) and intercellular adhesion factor -1(ICAM-1)。ResultsCompared with normal control group A, B, Plasma regulatory protein, monocyte chemoattractant protein-1, intercellular adhesion molecule-1 levels in model group in each time point induced by LPS were significantly increased(P<0.05),glomerulonephritis rat model was successfully induced. After treatment, the levels of plasma thrombomodulin,monocyte chemoattractant protein-1 and intercellular adhesion factor-1 in A, B24h and 48h groups were significantly lower than those in low molecular weight heparin treatment group(P<0.05). The levels of plasma thrombomodulin,monocyte chemoattractant protein-1 and intercellular adhesion molecule-1 in 24h and 48h in LMWH group A were significantly lower than those in low molecular weight heparin treatment group B(P<0.05).ConclusionLow molecular weight heparin can effectively improve the inflammatory response in rats with glomerulonephritis, the improvement effect of 48h in young rats was the best, low molecular weight heparin has the most obvious inhibitory effect on inflammation, and aging can inhibit the inhibitory effect of low molecular weight heparin on glomerular inflammation.
Low molecular weight heparin; Glomerulonephritis; Thrombomodulin; Monocyte chemoattractant protein-1; Intercellular adhesion factor-1
R692.6
A
2095-0616(2017)23-38-05
2017-09-14)
