pEGFP-N1-MeCP2上调质粒的构建及意义
2017-12-20罗军强
罗军强
(荆门市第一人民医院神经外科,湖北 荆门 448000;荆门市五三医院外科,湖北 荆门 431821)
陈治军,刘平非,冯雨,谢腾
(荆门市第一人民医院神经外科,湖北 荆门 448000)
pEGFP-N1-MeCP2上调质粒的构建及意义
罗军强
(荆门市第一人民医院神经外科,湖北 荆门 448000;荆门市五三医院外科,湖北 荆门 431821)
陈治军,刘平非,冯雨,谢腾
(荆门市第一人民医院神经外科,湖北 荆门 448000)
目的:构建MeCP2真核表达载体并在SH-SY5Y细胞中表达。方法:采用RT-PCR、pEGFP-N1-MeCP2质粒提取、Western blot检测pEGFP-N1-MeCP2在在SH-SY5Y细胞中的表达。结果:将重组质粒pEGFP-N1-MeCP2与pEGFP-N1空载体组分别转染至SH-SY5Y细胞中,48h后利用Western Blot检测表明, 转染pEGFP-N1-MeCP2的细胞在82 kDa处可见一特异性的表达带,为MeCP2与GFP的融合蛋白,而在空载体组未见条带;在27KDa附近,空载体组可见条带,而转染pEGFP-N1-MeCP2的细胞未见条带,提示pEGFP-N1-MeCP2载体能够在SH-SY5Y细胞中表达。结论:构建pEGFP-N1-MeCP2上调质粒是进一步研究MeCP2蛋白功能的基础,也是研究MeCP2蛋白在帕金森病中作用机制的关键。
帕金森病;MeCP2;TH;SH-SY5Y细胞;6-OHDA
MeCP2在大多数组织中都有表达,但在大脑中表达最丰富。胞浆蛋白标准化的定量研究显示,肺和脾也是MeCP2表达丰富的组织[1]。直接定量测定成年小鼠每个细胞核中MeCP2分子,大脑神经元有16000000个,胶质细胞中较少,而肝细胞中少30倍[2]。小鼠神经元中MeCP2水平出生时相对较低,出生后3个月快速增加,随后达到平台期[2,3]。由于出生时神经形成已经完成,神经元在一个恒定数目范围内增加是由于MeCP2表达上调。而这个时候,这些神经元经历着活跃的突触发育。
鉴于MeCP2在大脑中可能作为大脑发育的调节因子或维持神经元/胶质功能的因子。我们的研究发现,MeCP2在帕金森病细胞模型中的表达下降,鉴于MeCP2在神经元中的作用,我们推测,MeCP2的表达下降可能参与了帕金森病的致病过程。因此,我们从人肺癌细胞cDNA文库中获得MeCP2基因,构建真核表达载体并在SH-SY5Y细胞中表达,为进一步研究MeCP2的功能打下基础。
1 材料与方法
1.1 材料
人神经母细胞瘤细胞SH-SY5Y细胞株购自美国America Type Culture Collection(ATCC)细胞库,人肺癌细胞A549,载体pEGFP-N1,感受态大肠杆菌DH 5α,D2000 plus DNA ladder、D2000 DNA ladder(Beijing Solarbio Science & Techology Co., LTD),DNA聚合酶(TAKARA Bioiotechnology(Dalian) Co. ,LTD),PstI(Fermentas Inc.),XhoI(Fermentas Inc.)T4 DNA连接酶(Fermentas Inc.),Trizol Reagent(Invitrogen Life Technologies),TOYOBO First Strand cDNA Synthesis Kit ReverTra Ace -α(TOYOBO CO,LTD),琼脂糖凝胶DNA回收试剂盒(Tiangen Biotech(Beijing) CO.,LTD),10mM dNTPs(Fermentas Inc.)。一抗:MeCP2大鼠抗人抗单克隆抗体购 自美国Sigma公司,TH羊抗人抗单克隆抗体购自购自 Santa Cruz公司;Westem blot检测试剂盒购自上海晶美生物公司。二抗:兔抗鼠、鼠抗羊二抗均购自福州迈新生物技术开发公司。β-肌动蛋白(β-actin)抗体购自美国Santa Cruz 公司。
1.2 方法
1)pEGFP-N1-MeCP2质粒构建 据MeCP2基因的CDC区设计引物及酶切位点:设计包含Pst I 和 Xho I (Promega USA)酶切位点的扩增MeCP2全长引物。上游引物5’ GCGCTCGAGGGTAAAAGCCGTCCGGAAAAT3’和下游引物5’CGGCTGCAGGCTAACTCTCTCGGTCACGGGC3’。其中包含下划线的为所含酶切位点。利用PCR扩增MeCP2编码序列,反应体系为50μL:10×PCR缓冲液5μL,dNTP 5μL、Taq酶 2.5μL、cDNA模板2μL,上下游引物(10μmol)各1.5μL。PCR反应条件:94℃ 2min、94℃ 10s、55℃ 30s、68℃ 80s,共32个循环;68℃延伸3min。68→94℃、30s→64℃、30s→72℃,4min(30次)末段延伸72℃、10min。将获得的PCR产物通过凝胶电泳明确扩增大小后,利用前述切胶回收方法纯化PCR产物。取PCR产物利用XhoⅠ和KpnⅠ酶双酶切,回收大片段,加T4连接酶16℃水浴过夜。连接产物转化感受态DH5a,将转化产物均匀涂布于含100mg/L氨苄青霉素的LB选择平板上倒置培养过夜。筛选2~3个菌落,摇菌后取1μL进行PCR扩增鉴定;小量提取质粒DNA,进行双酶切鉴定,将双酶切鉴定正确的质粒送华大基因测序。
2)pEGFP-N1-MeCP2质粒真核细胞表达的western blot检测鉴定 SH-SY5Y细胞转染pEGFP-N1-MeCP2质粒,提取总蛋白western blot表达鉴定。操作过程:蛋白样品提取;蛋白浓度测定;SDS-PAGE电泳;转膜,封闭;结合一抗,置于4℃摇床过夜;结合二抗,将抗体稀释液加入PVDF膜后置于摇床室温震摇1h;洗膜4次,每次5min,后利用PBS洗膜三次去除残存的Tween-20,利用ECL发光液暗室曝光显色并分析蛋白表达强弱。
2 结果
2.1 PCR扩增MeCP2 cDNA片段
通过PCR扩增的方法成功获得了MeCP2 cDNA片段,PCR的产物在l%琼脂糖凝胶上的分析,特异性片段的大小为1531bp。见图1。
2.2 重组质粒的鉴定结果
1)限制性内切酶酶切鉴定结果 用PstI和Xho I双酶切重组质粒pEGFP-N1-MeCP2得到与预期大小相符的外源基因插入片段,结果与PCR产物的大小1531bp比对相吻合,说明克隆成功。见图2。

图1 MeCP2 PCR产物琼脂糖电泳图 图2 pEGFP-N1-MeCP2 质粒酶切鉴定图
2)测序鉴定结果 将重组质粒重组质粒pEGFP-N1-MeCP2送去进行测序,比对与MeCP2的序列一致,说明插入的片段是正确的,克隆成功。
2.3 pEGFP-N1-MeCP2的表达鉴定结果
将重组质粒pEGFP-N1-MeCP2与pEGFP-N1空载体组分别转染至SH-SY5Y细胞中,48h后利用Western Blot检测表明, 转染pEGFP-N1-MeCP2的细胞在82 kDa处可见一特异性的表达带,为MeCP2与GFP的融合蛋白,而在空载体组未见条带;在27KDa附近,空载体组可见条带,而转染pEGFP-N1-MeCP2的细胞未见条带,提示pEGFP-N1-MeCP2载体能够在SH-SY5Y细胞中表达。见图3。
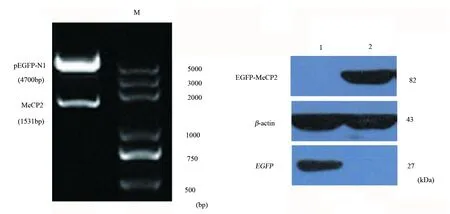
图3 重组质粒pEGFP-N1-MeCP2与pEGFP-N1空载体组分别转染至SH-SY5Y细胞中的表达鉴定
3 讨论
自从第一次发现MeCP2调节脑中特定区域基因的表达,包括正面的和负面的作用,以及独立活性依赖的调节[4,5]。目前,研究越来越多的集中于MeCP2的目标基因。发生于神经科学上MeCP2基因的缺失和过表达,发现的第一个与MeCP2相关的基因是脑源性神经营养因子(BDNF)。BDNF是一个生长因子,与神经元再生、神经元成熟、神经元功能维持及神经元存活、钙离子稳态、及突触可塑性方面发挥着重要作用,以及在学习、记忆、神经功能障碍中发挥重要作用[6]。
目前,脑内MeCP2与BDNF的机制尚不清楚[7,8],但是MeCP2表达的高低却与BDNF紧密相关[9]。体外培养的小鼠皮质神经元中,过表达MeCP2提高了BDNF表达[10],然而,因突变致MeCP2基因失去功能的小鼠,脑内BDNF表达降低[9]。MeCP2基因突变的小鼠,脑内BDNF恢复正常水平时,许多Rett综合征类似的生理学和行为缺陷症状得到了改善[11,12]。在培养神经细胞试验中发现,MeCP2与BDNF第三启动子结合抑制BDNF转录[4,13]。MeCP2基因突变的小鼠与野生型相比,BDNF蛋白表达和基因表达均下降了70%[14]。BDNF表达下降被认为造成了Rett综合征的病理过程。更重要的是,这些发现提示有些基因的活性受MeCP2调控。膜的去极化导致了MeCP2的磷酸化,引起目标基因启动子的释放,从而引起转录激活[4]。MeCP2基因敲除的小鼠,神经元活性受影响,研究MeCP2基因表达下降和其他基因表达提高之间的关系很困难。虽然MeCP2被广泛的认为是一个转录抑制因子,最近的研究显示,他可以与活性基因结合而调节基因表达[14~16]。
经证实,MeCP2可以抑制Dlx5、 Dlx6、Fxyd1、Reln和Gtl2的表达[17,18]。无MeCP2表达的小鼠,前额叶Dlx5、 Dlx6的转录作用明显加强[17]。在无MeCP2基因表达的小鼠和Rett综合征患者,前额叶Fxyd1表达明显较高[19]。在无MeCP2基因表达的小鼠和Rett综合征患者,BDNF、GABRB3和UBE3A的表达下降[20]。这些基因在调控神经发育阶段的树突结构和GABA能神经元功能方面发挥着重要作用。Dlx5和GABRB3是GABA能神经元发挥作用所必须的,前者调节合成GABA,后者则与GABA受体亚单位结合[20,21]。这些在额叶表达的基因与GABA能神经元的相互作用,证实了Rett综合征患者额叶GABA能神经元信号通路的功能紊乱[22]。然而,涉及到树突形态学改变的基因可以解释Rett综合征和无MeCP2基因表达小鼠树突修饰的原因。
Skirmantas Kriaucionis(2006)研究发现[23],无MeCP2表达的小鼠脑组织中Uqcrc1过表达,Uqcrc1可以显著增加线粒体呼吸容量以及减少呼吸效率,过表达的Uqcrc1可导致N2A细胞(小鼠神经元细胞)线粒体呼吸功能的异常;他们通过电子显微镜(透射电镜)观察野生型和无MeCP2表达的小鼠脑组织没有发现线粒体总体结构的异常。体内实验显示MeCP2与Uqcrc1的启动子区结合,无MeCP2表达的小鼠,Uqcrc1表达提高以及导致神经学上的症状。在酶作用底物提供呼吸链复合体Ⅰ或呼吸链复合体Ⅱ,含有Uqcrc1蛋白的呼吸链复合体Ⅲ导致了异常的线粒体呼吸功能。Blue native electrophoresis 检测显示:MeCP2突变的小鼠,呼吸链复合体Ⅰ活性正常,提示呼吸链复合体Ⅰ没有提高异常的线粒体呼吸功能;这些研究显示,呼吸链复合体Ⅲ是增强线粒体呼吸功能的原因。在细胞系中,过表达的Uqcrc1与上游的呼吸链复合体Ⅳ酶作用底物促使线粒体呼吸速率提高。在Pavel(2009)的实验中[24],MeCP2基因突变的小鼠,超微结构显示轴突和树突异常,以及异常扩展的线粒体和脊膜。JC Russell(2007)[25]首次发现,首次发现,在低氧和兴奋性毒性诱导干预的小脑颗粒神经元,MeCP2功能下降。完全MeCP2基因敲除小脑颗粒神经元较野生型死亡过程发生较早;在缺少MeCP2蛋白表达的CGC细胞与野生型的相比,神经元死亡明显较多,其过程是缺少MeCP2蛋白引起线粒体功能紊乱,线粒体释放caspase和AIF,从而启动神经元的凋亡。鉴于MeCP2基因灭活抑制基因的表达及其所致的转录紊乱,过表达的死亡复合体在中枢神经系统活性增加,使得神经元更容易受损以致死亡。
综上所述,MeCP2蛋白在神经元中有着很重要的生物学作用,并且与Rett综合症等相关疾病有着密切的联系;我们已经证实,MeCP2可能参与了帕金森病的发病过程。为了进一步研究MeCP2蛋白在帕金森病中的作用机制,本研究克隆得到了MeCP2的全长编码序列,并通过Western Blot检测表达的融合蛋白在SH-SY5Y细胞中的表达,为进一步研究其功能打下基础。
[1]Shahbazian M D, Antalffy B, Armstrong D L, et al.Insight into Rett syndrome: MeCP2 levels display tissue- and cell-specific differences and correlate with neuronal maturation[J]. Hum Mol Genet, 2002, 11(2):115~124.
[2]Skene P J, Illingworth R S, Webb S, et al. Neuronal MeCP2 is expressed at near histone-octamer levels and globally alters the chromatin state[J]. Mol Cell, 2010, 37(4):457~468.
[3]Kishi N, Macklis J D. MECP2 is progressively expressed in post-migratory neurons and is involved in neuronal maturation rather than cell fate decisions[J]. Mol Cell Neurosci, 2004,27(3):306~321.
[4]Chen W G, Chang Q, Lin Y, et al. Derepression of BDNF transcription involves calcium-dependent phosphorylation of MeCP2[J].Science, 2003,302(5646):885~889.
[5]Cohen D R, Matarazzo V, Palmer A M, et al.Expression of MeCP2 in olfactory receptor neurons is developmentally regulated and occurs before synaptogenesis[J]. Mol Cell Neurosci, 2003, 22(4):417~429.
[6]Binder D K, Scharfman H E. Brain-derived neurotrophic factor[J]. Growth Factors, 2004, 22(3):123~131.
[7]Chahrour M, Jung S Y, Shaw C, et al. MeCP2, a key contributor to neurological disease, activates and represses transcription[J].Science,2008, 320(5880):1224~1229.
[8]Abuhatzira L, Makedonski K, Kaufman Y, et al. MeCP2 deficiency in the brain decreases BDNF levels by REST/CoREST-mediated repression and increases TRKB production[J]. Epigenetics, 2007, 2(4):214~222.
[9]Chang Q, Khare G, Dani V, et al. The disease progression of MeCP2 mutant mice is affected by the level of BDNF expression[J]. Neuron, 2006, 49(3): 341~348.
[10]Klein M E, Lioy D T, Ma L, et al. Homeostatic regulation of MeCP2 expression by a CREB-induced microRNA[J]. Nat Neurosci, 2007, 10(12):1513~1514.
[11]Larimore J L, Chapleau C A, Kudo S, et al. Bdnf overexpression in hippocampal neurons prevents dendritic atrophy caused by Rett-associated MeCP2 mutations[J]. Neurobiol Dis, 2009, 34(2):199~211.
[12]Kondo M, Gray L J, Pelka G J, et al.Environmental enrichment ameliorates a motor coordination deficit in a mouse model of Rett syndrome-MeCP2 gene dosage effects and BDNF expression[J]. Eur J Neurosci, 2008, 27(12):3342~3350.
[13]Martinowich K, Hattori D, Wu H, et al. DNA methylation-related chromatin remodeling in activity-dependent BDNF gene regulation[J].Science,2003,302(5646) :890~893.
[14]Yasui D H, Peddada S, Bieda M C, et al.Integrated epigenomic analyses of neuronal MeCP2 reveal a role for long-range interaction with active genes[J]. Proc Natl Acad Sci USA, 2007, 104(49):19416~19421.
[15]Chahrour M, Jung S Y, Shaw C, et al.MeCP2, a key contributor to neurological disease, activates and represses transcription[J]. Science, 2008, 320(5880):1224~1229.
[16]Skene P J, Illingworth R S, Webb S, et al.Neuronal MeCP2 is expressed at near histone~octamer levels and globally alters the chromatin state[J]. Mol Cell, 2010, 37(4):457~468.
[17]Horike S, Cai S, Miyano M, et al.Loss of silentchromatin looping and impaired imprinting of DLX5 in Rett syndrome[J]. Nat Genet, 2005, 37(1):31~40.
[18]Jordan C, Li H H, Kwan H C, et al. Cerebellar gene expression pro?les of mouse models for Rett syndrome reveal novel MeCP2 targets[J]. BMC Med Genet, 2007, 8: 36.
[19]Deng V, Matagne V, Banine F, et al.FXYD1 is anMeCP2 target gene overexpressed in the brains of Rett syndrome patients and MeCP2~null mice[J]. Hum Mol Genet, 2007, 16(6):640~650.
[20]Samaco R C, Hogart A, LaSalle J M. Epigenetic overlap in autism-spectrum neurodevelopmental disorders: MeCP2 de?ciency causes reduced expression of UBE3A and GABRB3[J]. Hum Mol Genet, 2005, 14(4):483~492.
[21]Hogart A, Nagarajan R P, Patzel K A, et al.15q11-13 GABAA receptor genes are normally biallelically expressed in brain yet are subject to epigenetic dysregulation in autism~spectrum disorders[J]. Hum Mol Genet, 2007, 16(6):691~703.
[22]Blue M E, Naidu S, Johnston M V. Development of amino acid receptors in frontal cortex from girls with Rett syndrome[J]. Ann Neurol, 1999, 45(4):541~545.
[23]Kriaucionis S, Paterson A, Curtis J, et al. Gene Expression Analysis Exposes Mitochondrial Abnormalities in a Mouse Model of Rett Syndromen[J]. Mol Cell Biol, 2006, 26(13):5033~5042.
[24]Belichenko P V, Wright E E, Belichenko N P, et al.Widespread Changes in dendritic and Axonal Morphology in MeCP2-Mutant Mouse Models of Rett Syndrome: Evidence for Disruption of Neuronal Networks[J].J Comp Neurol, 2009, 514(3):240~258.
[25]Russell J C, Blue M E, Johnston M V, et al.Enhanced cell death in MeCP2 null cerebellar granule neurons exposed to excitotoxicity and hypoxia[J]. Neuroscience, 2007,150 (3):563~574.
2017-09-26
湖北省自然科学基金项目(2014CFB09);湖北省荆门市科技计划项目(2013S01);湖北省荆门市科技计划项目(2015S01);荆门市重点科技计划项目(YFZD2016045)。
罗军强(1976-),男,主治医师,主要从事神经退行性疾病的诊疗工作;通信作者:谢腾,44255018@qq.com。
[引著格式]罗军强,陈治军,刘平非,等. pEGFP-N1-MeCP2上调质粒的构建及意义[J].长江大学学报(自科版), 2017,14(24):48~52.
R34
A
1673-1409(2017)24-0048-05
[编辑] 方多
