体外循环中合适红细胞比容选择的荟萃分析
2017-12-20孙燕华吉冰洋
周 琴,孙燕华,吉冰洋
·临床研究·
体外循环中合适红细胞比容选择的荟萃分析
周 琴,孙燕华,吉冰洋
目的荟萃分析临床体外循环中可接受的最低安全红细胞比容(Hct)值。方法筛查了PubMed,EMBASE,Cochrane Controlled Clinical Trial register,万方以及中国知网等数据库。其中所纳入的随机对照研究都根据体外循环中不同的Hct提供了不同的临床终点数据。如果各研究间显示为低异质性,则选择固定效应模型进行数据分析,反之,选择随机效应模型。根据改良Jadad评分量表对这些纳入文献的质量进行了评估,最终纳入了四篇文献。结果其中心脏并发症的合并相对危险度(RR)是0.408,95%可信区间(CI)为0.257~0.646,总效应量Z值为3.82(P=0.00)。平均动脉压(MAP)和尿量的标准化均数差(SMD)分别为-0.288和0.474,95%CI分别为-0.564~-0.012和0.171~0.778,Z值为2.04(P=0.041)和 3.06(P=0.002)。此外,在输血、肾脏损害、神经功能障碍以及胸腔引流量、ICU住院时长等临床指标方面没有显著的统计学差异。结论与体外循环中相对较高的红细胞比容相比,体外循环中采用较低的红细胞比容可以减少术后的心脏并发症,但其是否有临床意义还需进一步证实。
体外循环;红细胞比容;血液稀释;心脏手术
体外循环预充毫无疑问会带来血液稀释的问题。一定程度的血液稀释可以降低血液黏滞度,改善微循环,因此对机体是有益的[1]。然而,对于体外循环中维持红细胞比容(hematocrit, Hct)究竟多少最佳,临床上还没有达成共识。大部分临床机构选择在体外循环中维持Hct不低于0.28,而其他一部分中心推荐低危患者可以耐受Hct低至0.14[2]。Hct是反映血液携氧能力的主要指标,较低的Hct值是否能够满足组织的氧供需平衡呢?此外,随之而来的循环波动以及器官并发症等问题也不容忽视[3-4]。因此,关于临床上可接受的最低安全Hct值存在很大争议。为了全面评价体外循环中的Hct值,笔者进行了荟萃分析,通过比较不同的Hct值所影响的临床指标,希望找到体外循中合适的Hct值,从而指导临床工作。
1 资料与方法
1.1纳入标准 本研究所选取的文献需要满足以下三个标准:①必须是关于成人(>18岁)的临床研究。②必须是随机对照研究,即按照低Hct组和对照组随机分配患者。③必须报告体外循环期间以及心脏手术后的临床指标,包括:血流动力学指标,器官功能状态和ICU时长等。非随机对照研究,或者不满足以上三点的研究予以排除。
1.2检索策略和数据提取 笔者检索了PubMed,EMBASE, Cochrane Controlled Clinical Trial register,万方数据以及中国知网等相关数据库。所采用的检索词包括“体外循环”,“心脏手术”和“Hct”,对所纳入文章的参考文献也进行了相关的查阅。
所提取的信息包括:所研究的患者数量,体外循环中的最低Hct值,预充液的类型,体外循环期间的平均动脉压和温度,以及不同的心肌保护措施等。见表1。
1.3质量评价 采用改良Jadad量表来评价每篇纳入文献的质量(表2)。该量表包括随机性,盲法,删失或失访,纳入或排除标准,负效应,数据分析等内容。分值范围为0~8,高分表示文献的质量高。通常4~8分代表高质量,0~3分代表低质量。
文献检索,数据提取以及质量评价都分别由两位研究者进行。当意见不统一时,通过讨论由研究组的领导来决定。
1.4数据分析 使用 StataSE 12.0.软件对荟萃数据进行分析。对于纳入文献中的二分类变量数据采用合并后的相对危险度(relative risk,RR)和95%可信区间(confidence interval,CI)来表示。而连续性变量的效应值用标准化均数差(standardized mean difference,SMD)来表示。评价组间异质性采用Q检验和I2检验的方法。如果异质性较低(例如,P>0.05,I2<50%),则采用固定效应模型来计算合并的RR或SMD,反之,选择随机效应模型进行合并。某些研究的数据表达类型为中位数和四分位间距,则根据《系统评价手册》将其转化为均数和标准差的形式。
2 结 果
在筛选了6 034条题录后排除1 638篇重复的文献。在4 396条题录中,通过题目和摘要排除4 278篇,选择了118篇进行浏览全文,其中有24篇观察性研究、41篇无相关数据、16篇非英语、28篇没有根据Hct分组。提取9篇随机对照研究中有4篇文章关于儿童、1篇文章缺乏相同临床指标予以排除,最终纳入了4篇满足标准的文献。
有三篇文章提供了关于心脏并发症的数据[3-5]。最终合并的RR为 0.408,95%CI为0.257~0.646,总效应量Z值为3.82(P=0.0),异质性检验显示各研究间并不存在显著性差异(P=0.638,I2=0.0%)。

表1 纳入文献的体外循环中研究的基本特征
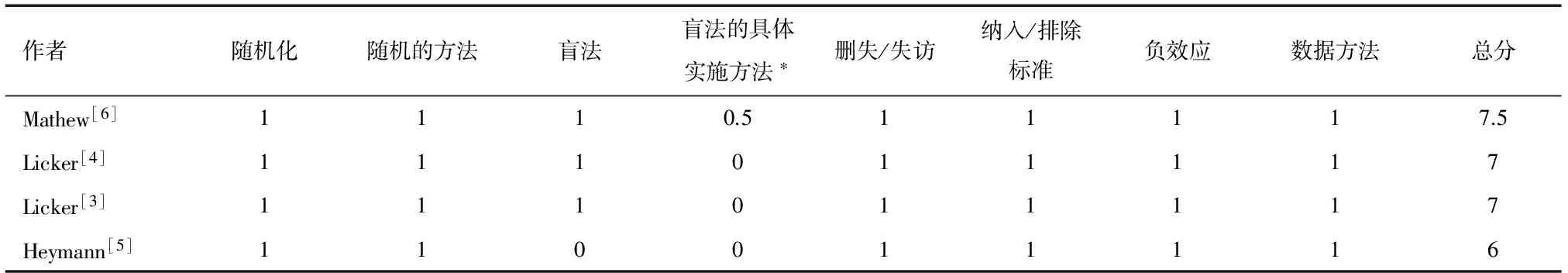
表2 改良Jadad 分值量表
注:*双盲得1分;单盲得0.5分。
关于手术后尿量,三篇文献报道了相关数据[3-5]。低Hct组和对照组相比,合并后的SMD为0.474,95%CI为0.171~0.778, 总效应量Z值为3.06(P=0.002),组间异质性不高(P=0.136,I2=49.8%)。
对于提供了平均动脉压(MAP)的相关数据的三篇文献而言[3-4,6],并不存在明显的组间异质性(P=0.382,I2=0.0%)。合并后SMD为-0.288,95%CI为-0.564~-0.012,总效应量Z值为2.04(P=0.041)。
有三篇文献报道了神经和肾脏并发症[3-5]。二者合并后的RR分别为1.394和0.880,95%CI分别为0.289~6.713(P=0.679)和0.310~2.501(P=0.811)。异质性检验提示组间并无显著差异(P=0.506,I2=0.0% 和P=0.964,I2=0.0%)。 对于输注红细胞人数这一终点指标而言,其合并后的RR为1.335,95%CI是0.839~2.124(P=0.222),组间异质性也较低(P=0.343,I2=6.7%)。
此外,提供术毕CVP数据的文献有三篇[3-5]。笔者得到合并的SMD为0.283,95%CI是-0.016~0.582(P=0.064)。异质性检验提示并无显著差异(P=0.640,I2=0.0%)。对于胸腔引流量,合并后的SMD是0.200,95%CI是-0.098~0.498(P=0.189),组间异质性较低(P=0.801,I2=0.0%)。对关于ICU时长的这三篇文章进行统计分析也没有发现存在很高的组间异质性(P=0.999,I2=0.0%),合并后的SMD是0.003,95%CI是-0.294~0.301(P=0.983)。
3 讨 论
3.1血液稀释 血液稀释最显著的优势在于降低血液黏滞性从而改善组织灌注[3]。然而,一方面,超过安全极限的血液稀释会增加患者缺血损伤的风险;另一方面,采用全血预充或者输血同样增加患者的风险[2,7]。一项关于6 980位接受冠状动脉旁路移植术的患者的研究表明体外循环期间Hct<0.23并不显著增加死亡率[8]。然而,Fang等在他的2 738位冠状动脉旁路移植的患者的研究中发现当Hct<0.14时,死亡率增加两倍[9]。
3.2血流动力学改变 血液黏滞性的降低会导致显著的前负荷依赖性的每搏输出量增加(28%)[4],原因在于增加了静脉回心血量以及促进脾脏等储血器官的血管收缩。根据此篇荟萃分析,低Hct组的MAP和尿量较对照组低[3-6],但是当比较肾脏并发症的发生率时,两组并无统计学差异。这也许是因为灌注师在体外循环期间预期达到的血液稀释程度、温度以及MAP不同。
3.3脏器功能 首要的问题是造成器官功能不全的最低允许的Hct值是多少,血液稀释降低了血液的晶体渗透压,从而导致液体向组织间隙的转移,这在一定程度上造成潜在的心肌、 胃肠道、黏膜肌层以及肺脏的水肿,此外还可能导致血管内容量不足,这些都可降低器官的氧供[1,10]。
3.3.1神经系统并发症 一项来自杜克大学的研究表明,对于研究纳入的2 862位接受冠状动脉旁路移植术的患者而言,没有证据证实较低的Hct值与神经系统并发症有关[11]。在此篇荟萃分析中得出了相同的结论。然而,根据Mathew,不同的医院评估神经系统损伤的指标不尽相同,一些医院将视觉记忆、语言理解以及定向障碍作为神经系统功能异常的指标[6],而其他一些研究者认为中风和暂时性脑缺血也应该被考虑[3-5]。众所周知,低温可以保护大脑功能,但是每个研究中维持的温度都不尽相同[12-13]。此外,老年患者在接受小的择期手术时比年轻人发生意识功能减低的可能性更高 。尽管笔者所纳入的研究对象大部分都是老年人,而且排除了存在神经系统合并症的患者,但是仍然不能忽视年龄和温度等混杂因素的影响。
3.3.2心脏并发症 对心肌而言,血液稀释所导致的血液黏滞性降低可以促进狭窄血管和侧枝循环的血流,从而平衡血液携氧能力的下降[3-4]。在此篇荟萃分析中发现,体外循环中维持较低的Hct值可以通过降低术后心梗的发生率而达到心肌保护的效果。 但是,由于样本量较小,很难证实Hct的重要性,因为这些心脏病患者长期服用的心肌阻滞类药物也在一定程度上降低心肌代谢的需要 (大约 20%~30%)、减轻交感神经兴奋所介导的正性肌力作用[4]。为了避免围术期心肌损伤,每个研究都运用了一些心肌保护技术,例如转机前的麻醉药物预处理、冷血停搏液等[3-5]。
3.3.3肾脏并发症 体外循环相关的血液稀释是导致肾脏损伤的主要原因,血液稀释通过降低血液的携氧能力以及血流再分布显著地降低了肾脏的氧供[10]。但是在此荟萃分析中并没有发现能够证明血液稀释相关肾损伤的有力证据 ,这也许是因为心输出量的增加、肾血流的增加以及外周血管阻力的改变,这些因素都可以提高器官灌注[14]。此外,低温和一定的麻醉深度都可能增加肾脏保护作用[15]。
3.4局限性 此篇荟萃分析的主要局限性在于:①相关的随机对照研究比较贫乏,纳入的文献所包括的共同指标过少;②研究的样本量较小,因此会导致数据的非正态分布;③不同的研究所采取的Hct范围不尽相同;④混杂因素的干扰。例如,体外循环中所采取的温度,围术期的管理方面都存在差异,会导致潜在的偏倚;⑤纳入的文献中有两篇来自同一研究团队,可能会影响合并的效应量。⑥由于只纳入了英文文献,可能会遗漏非英语的相关文献。考虑到上述问题,这些纳入的数据也许不能很好反映体外循环中Hct的真实影响。
4 结 论
如果血红蛋白的作用是为健康人提供充分的氧供来满足氧耗,而对大部分接受体外循环的患者而言,他们的心肺功能储备是不足的。因此,体外循环期间合适的红细胞比容也受到患者自身冠脉疾病和其他因素的影响。鉴于目前有限的监测手段和现有的临床证据,笔者并不能确定这一合适的Hct。而未来更多高质量的随机对照研究能带来一定帮助。
[1]Berger K, Sander M, Spies CD,etal. Profound haemodilution during normothermic cardiopulmonary bypass influences neither gastrointestinal permeability nor cytokine release in coronary artery bypass graft surgery [J]. Br J Anaesth, 2009, 103(4):511-517.
[2]Groom RC. High or low hematocrits during cardiopulmonary bypass for patients undergoing coronary artery bypass graft surgery [J]? An evidence-based approach to the question. Perfusion, 2001, 16(5): 339-343.
[3]Licker M, Ellenberger C, Sierra J,etal. Cardioprotective effects of acute normovolemic hemodilution in patients undergoing coronary artery bypass surgery [J]. Chest, 2005, 128(2): 838-847.
[4]Licker M, Sierra J, Kalangos A,etal. Cardioprotective effects of acute normovolemic hemodilution in patients with severe aortic stenosis undergoing valve replacement [J]. Transfusion, 2007, 47(2): 341-350.
[5]von Heymann C, Sander M, Foer A,etal. The impact of an hematocrit of 20% during normothermic cardiopulmonary bypass for elective low risk coronary artery bypass graft surgery on oxygen delivery and clinical outcome--a randomized controlled study [ISRCTN35655335] [J]. Critical Care, 2006, 10(2):R58.
[6]Mathew JP, Mackensen GB, Phillips-Bute B,etal. Effects of extreme hemodilution during cardiac surgery on cognitive function in the elderly [J]. Anesthesiology, 2007, 107(4): 577-584.
[7]Hajjar LA, Vincent JL, Galas FR,etal. Transfusion requirements after cardiac surgery: the TRACS randomized controlled trial [J]. JAMA, 2010, 304(14): 1559-1567.
[8]DeFoe GR, Ross CS, Olmstead EM,etal. Lowest hematocrit on bypass and adverse outcomes associated with coronary artery bypass grafting. Northern New England Cardiovascular Disease Study Group [J]. Ann Thorac Surg, 2001, 71(3): 769-776.
[9]Fang WC, Helm RE, Krieger KH,etal. Impact of minimum hematocrit during cardiopulmonary bypass on mortality in patients undergoing coronary artery surgery [J]. Circulation, 1997, 96(9 Suppl):II-194-9.
[10]Vermeer H, Teerenstra S, de Sevaux RG,etal. The effect of hemodilution during normothermic cardiac surgery on renal physiology and function: a review [J]. Perfusion, 2008, 23(6): 329-338.
[11]Yilmaz M, Ozen A, Yay K,etal. The relationship between low intraoperative hematocrit levels during cardiopulmonary bypass and postoperative neurological events [J]. Heart Surg Forum, 2013, 16(5): E243-247.
[12]Gruber EM, Jonas RA, Newburger JW,etal. The effect of hematocrit on cerebral blood flow velocity in neonates and infants undergoing deep hypothermic cardiopulmonary bypass [J]. Anesth Analg, 1999, 89(2): 322-327.
[13]Jonas RA, Wypij D, Roth SJ,etal. The influence of hemodilution on outcome after hypothermic cardiopulmonary bypass: results of a randomized trial in infants [J]. J Thorac Cardiovasc Surg, 2003, 126(6): 1765-74.
[14]Huybregts RA, de Vroege R, Jansen EK,etal. The association of hemodilution and transfusion of red blood cells with biochemical markers of splanchnic and renal injury during cardiopulmonary bypass [J]. Anesth Analg, 2009, 109(2): 331-339.
[15]Taniguchi FP, Martins AS. Effect of haematocrit on pump and kidney dysfunction after myocardial revascularization [J]. Acta Cardiol, 2009, 64(1): 41-45.
Theoptimalhematocritvalueduringcardiopulmonarybypass:ameta-analysis
Zhou Qin, Sun Yan-hua, Ji Bing-yang
DepartmentofCardiopulmonaryBypass,StatekeylaboratoryofCardiovascularMedicine,FuwaiHospital,NationalCenterforCardiovascularDisease,ChineseAcademyofMedicalScienceandPekingUnionMedicalCollege,Beijing, 100037,China
JiBing-yang,Email:jibingyang@fuwai.com
ObjectiveInitiation of cardiopulmonary bypass(CPB) inevitably leads to hemodilution, there is thus wide variation in practice with regard to the minimum safe acceptable hematocrit (Hct) during cardiac surgery. To search the ideal Hct during CPB, we screened all relevant published randomized controlled trials to perform a meta-analysis for Hct during cardiopulmonary bypass.MethodsWe searched PubMed, EMBASE, the Cochrane Controlled Clinical Trial register, WANFANG and CNKI databases for published articles. Randomized controlled trials were included when the research provided data of different clinical endpoints according to various Hct values during CPB. We choose a fixed-effects model when the trials showed low heterogeneity, otherwise a random-effects model was used. The quality of studies were assessed by modified Jadad scale.ResultsFour studies were included in this meta-analysis. The overall pooled relative risk(RR) for cardiac complications was 0.408, 95% confidence interval (CI)=[0.257-0.646], and the z-score for overall effect was 3.82(P=0.00). The standardized mean difference(SMD) of the MAP and urine volume were -0.288 and 0.474, respectively. with the 95%CI=[-0.564 -0.012] and [0.171-0.778]. The z-score for overall effects were 2.04(P=0.041) and 3.06(P=0.002).ConclusionCompared with relatively high Hct value in CPB, lower Hct could reduce cardiac complications after surgery, although there were no significant differences in the outcomes of blood transfusion, renal failure, neurological dysfunction, as well as chest tube drainage and length of ICU stay . Further studies involving optimal Hct value are expected to be investigated if we want to find out a critical point at which the patients do not need blood transfusion and their organ functions suffer least.
Cardiopulmonary bypass; Hematocrit; Hemodilution; Cardiac surgery
10.13498/j.cnki.chin.j.ecc.2017.04.07
100037 北京,北京协和医学院国家心血管病中心中国医学科学院阜外医院体外循环科
吉冰洋 E-mail: jibingyang@fuwai.com
2016-02-04)
2016-05-20)
