Zn2+对青蛤的胁迫效应
2017-12-19李永仁郭永军邢克智
梁 健,李永仁,郭永军,邢克智
( 天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384 )
Zn2+对青蛤的胁迫效应
梁 健,李永仁,郭永军,邢克智
( 天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384 )
在盐度25和水温26~28 ℃下,将壳长为(35.32±0.89) mm的青蛤暴露于Zn2+质量浓度10.00、19.95、39.81、79.43、158.49、316.23 mg/L试验组及空白对照组,得出Zn2+的半致死质量浓度和安全质量浓度;之后又研究了Zn2+在青蛤鳃和内脏团中的蓄积和血淋巴液中超氧化物歧化酶、过氧化氢酶、酸性磷酸酶的活性。试验结果表明,Zn2+的96 h半致死质量浓度为191.56 mg/L,安全质量浓度为1.92 mg/L;96 h半致死质量浓度下, Zn2+在青蛤鳃中蓄积速度快于内脏团,血淋巴液中超氧化物歧化酶、过氧化氢酶和酸性磷酸酶活性呈先诱导再抑制的趋势,安全质量浓度下无明显变化,但均高于对照组;两种组织中的Zn2+质量浓度与处理时间呈正相关。本研究结果为青蛤健康养殖和毒理学研究提供了参考。
青蛤;Zn2+;急性毒性;蓄积过程;生化指标
青蛤(Cyclinasinensis)别称赤嘴仔,外壳青黑色,外缘有紫色环,因而得名赤嘴蛤,主要分布于朝鲜半岛、日本、中国大陆及台湾海区,常栖息于近高潮区和中潮区的泥沙滩中[1-2]。青蛤营滤食性埋栖生活, 埋栖深度与规格、季节及底质有关。青蛤的水管较长,滤食硅藻及浮游生物和有机碎屑[2],对重金属等污染物有极强的吸附积累作用,极易受污染。近年来随着沿海经济的发展, 工厂水以及生活污水大量排入, 海水环境污染日益严重,给沿海贝类养殖业带来严重危害,重金属污染导致的海洋贝类死亡引起了广泛关注,已报道有长牡蛎(Crassostreagigas)[3]、海湾扇贝(Argopectenirradias)[4]、栉孔扇贝(Chlamysfarreri)[5]、菲律宾蛤仔(Ruditapesphilippinarum)[6]、毛蚶(Scapharcasubcrenata)[7]、紫贻贝(Mytilusedulis)[8]等。对青蛤的研究主要集中在监测养殖或自然环境中其体内重金属的含量[9],对重金属的毒性、蓄积及免疫机能的研究较少,仅见Zn2+、Cd2+对幼贝的影响[10],而Zn2+对青蛤成贝的毒性及在不同组织中的蓄积研究则未见报道。锌是生物体所必需的微量元素之一,对生物的生长、发育、遗传、免疫和内分泌等重要生理过程起重要作用。但摄入过量的锌会威胁到生物的生存,通过食物链的蓄积作用间接威胁人类的健康。本研究利用水生生物急性毒性试验方法测定了Zn2+对青蛤的半致死质量浓度和安全质量浓度,在此基础上研究了青蛤不同组织对Zn2+的蓄积能力及血淋巴液中免疫相关酶的活性变化,以探明青蛤的应激反应机制。
1 材料与方法
1.1 材料
于2014年7月,从天津独流减河河口处采捕的青蛤中,选择个体完整,规格相近,活力良好的个体作为试验用贝,放入室内沙滤海水中暂养5 d,海水盐度25,水温26~28 ℃,pH 8.20~8.32,连续充气,日换水一次,投喂小球藻(Chlorellavulgaris),暂养后挑选闭壳反应迅速、平均壳长为(35.32±0.89) mm的个体进行试验。
1.2 Zn2+对青蛤的急性毒性试验
根据预试验结果和等对数间距法[11],本试验设置Zn2+离子质量浓度为10.00、19.95、39.81、79.43、158.49、316.23 mg/L的试验组及空白对照组,每组设3个平行。使用40 L蓝色塑料箱进行试验,每组放青蛤30枚,试验期间不投饵、不充气,日半量换水1次,及时挑出死亡个体。试验开始后24、48、72、96 h统计各组青蛤死亡数。贝壳张开,外套膜收缩,用玻璃棒轻触碰长时间未反应视为死亡。
1.3 青蛤对Zn2+的蓄积试验
在前面试验得出的Zn2+的半致死质量浓度和安全质量浓度下,养殖健康青蛤,每组10枚,设3个平行,6、12、36、72、96、120 h和168 h,各试验组解剖青蛤5枚,分离鳃和内脏团,称量质量后加入到放有消化液(硝酸和高氯酸4∶1)的消化试管中加热消化至液体澄清,用天津农学院农业分析测试中心的原子吸收分光光度计(上海普析,型号TAS-990super)测定Zn2+质量浓度。试验期间不投饵、不充气,日半量换水1次,及时挑出死亡个体。
1.4 免疫指标测定
在蓄积试验的6、12、24、36、48、72、96、120、144、168 h,自围心腔抽取血淋巴液,并混合。每组随机取青蛤5枚,4 ℃、6000 r/min,离心10 min,取上清液,用南京建成生物工程公司提供的试剂盒测定超氧化物歧化酶、过氧化氢酶、酸性磷酸酶的活性及总蛋白的含量。
1.5 数据处理
用SPSS 17.0软件对试验数据进行线性回归分析,检验显著性(P<0.05),计算96 h半致死质量浓度(LC50)、95%置信区间和相关系数r2。
安全质量浓度按下式计算[12]:
安全质量浓度=96 h LC50×AF
式中,AF为应用系数,设为0.01。
2 结 果
2.1 Zn2+对青蛤的急性毒性
不同质量浓度Zn2+对青蛤的毒性见表1。采用SPSS 17.0软件线性回归统计分析表明,死亡率概率单位与Zn2+质量浓度对数的相关方程为y= -5.518+2.418x,相关系数r2=0.865。96 h半致死质量浓度为191.56 mg/L,95%置信区间为149.79~266.31 mg/L,安全质量浓度为1.92 mg/L。
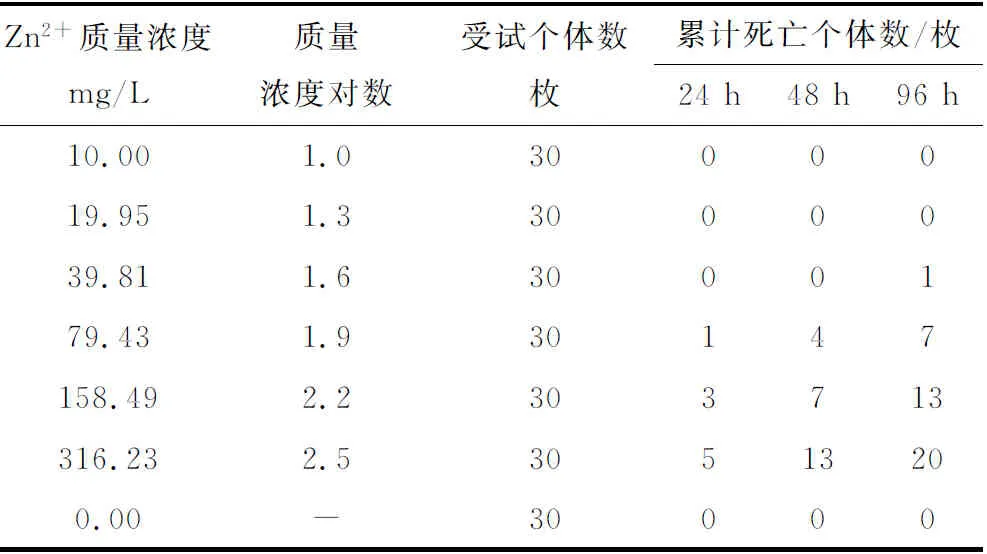
表1 不同质量浓度Zn2+对青蛤的急性毒性
2.2 青蛤对Zn2+的蓄积
在96 h半致死质量浓度胁迫下,Zn2+在青蛤鳃和内脏团的含量随时间延长而升高,在鳃中的平均蓄积量为2.16 μg/(g·h);在内脏团中的平均蓄积量为0.86 μg/(g·h)。整个试验过程中,鳃中的Zn2+含量始终高于内脏团(表2)。
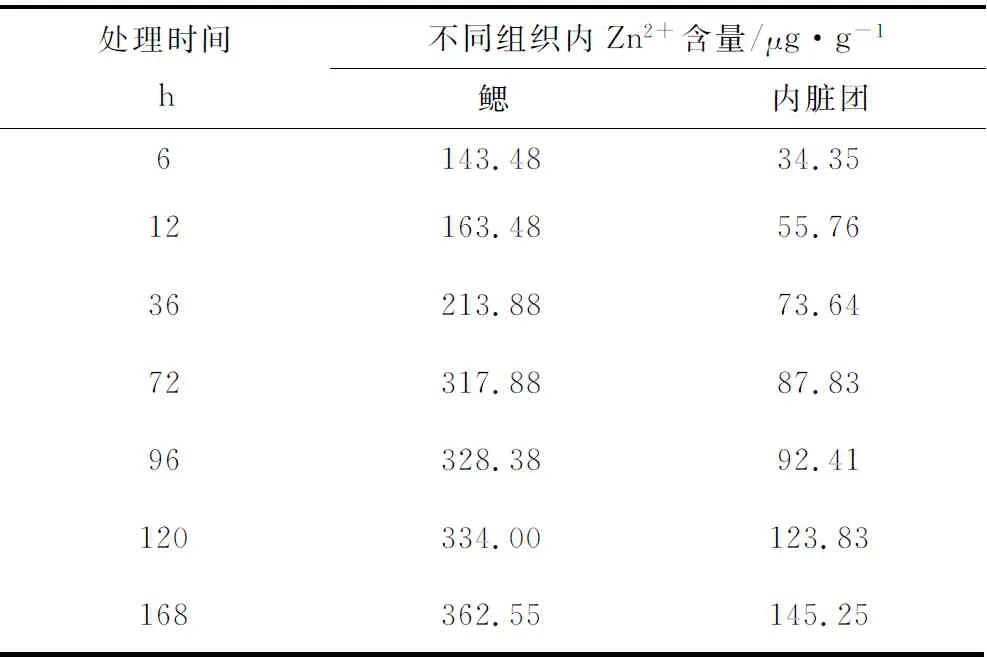
表2 96 h半致死质量浓度(191.56 mg/L)胁迫下青蛤各组织内Zn2+含量
安全质量浓度胁迫下, Zn2+在鳃中的平均蓄积量为0.22 μg/(g·h),内脏团中平均蓄积量为0.15 μg/(g·h),鳃组织中Zn2+的含量在初期低于内脏团,36 h后超过内脏团(表3)。
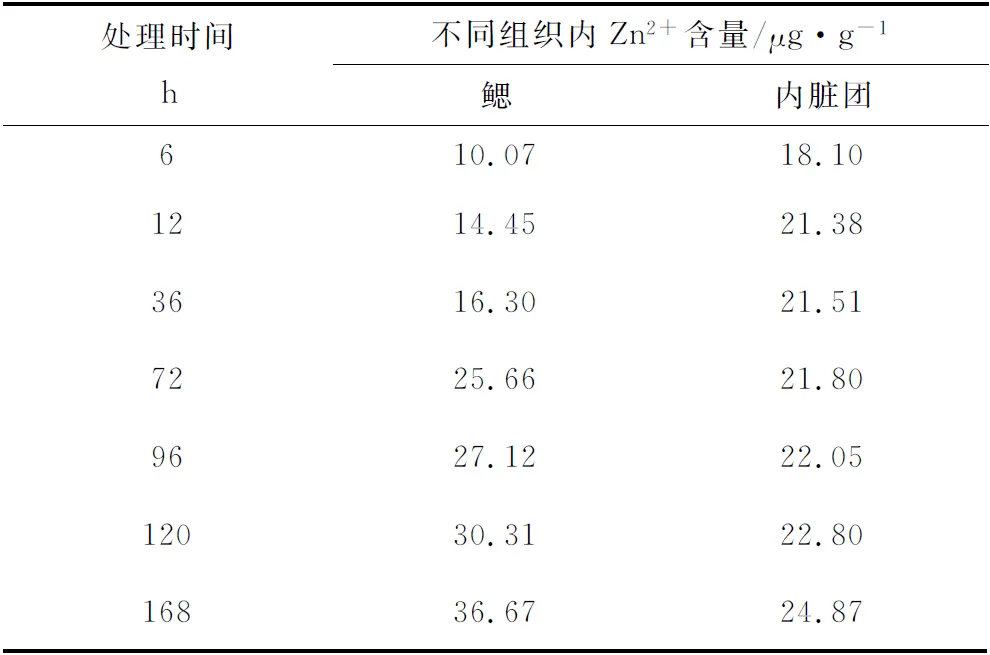
表3 安全质量浓度胁迫(1.92 mg/L)下青蛤各组织内Zn2+含量
2.3 Zn2+对青蛤血淋巴生化指标的影响
96 h半致死质量浓度处理组超氧化物歧化酶活性变化呈“诱导—抑制”趋势,在36 h达峰值95.06 U/mg,随后下降,144 h后与对照组差异不显著(P>0.05)。安全质量浓度处理组超氧化物歧化酶活性稳定,显著高于对照组(P<0.05)(图1)。
两试验组的过氧化氢酶活性高于对照组,呈“诱导—抑制”的变化趋势,只是达到峰值的时间不同。96 h半致死质量浓度处理组在48 h达到峰值12.03 U/mg,安全质量浓度处理组在72 h时达到峰值11.17 U/mg(图2)。
整个试验期间,96 h半致死质量浓度处理组的酸性磷酸酶活性均处于较高水平,显著高于对照组(P<0.05),在24 h时达到峰值3.15 U/mg。而安全质量浓度处理组的酸性磷酸酶活性较为稳定,略高于对照组,峰值(2.38 U/mg)出现在48 h(图3)。
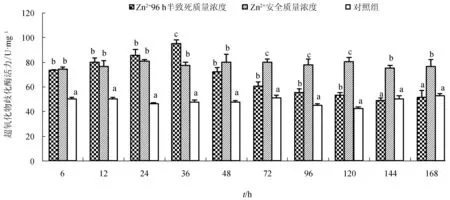
图1 不同Zn2+质量浓度下青蛤血淋巴液中超氧物歧化酶的活性同一时间点上字母相同的表示差异不显著(P>0.05),下同.
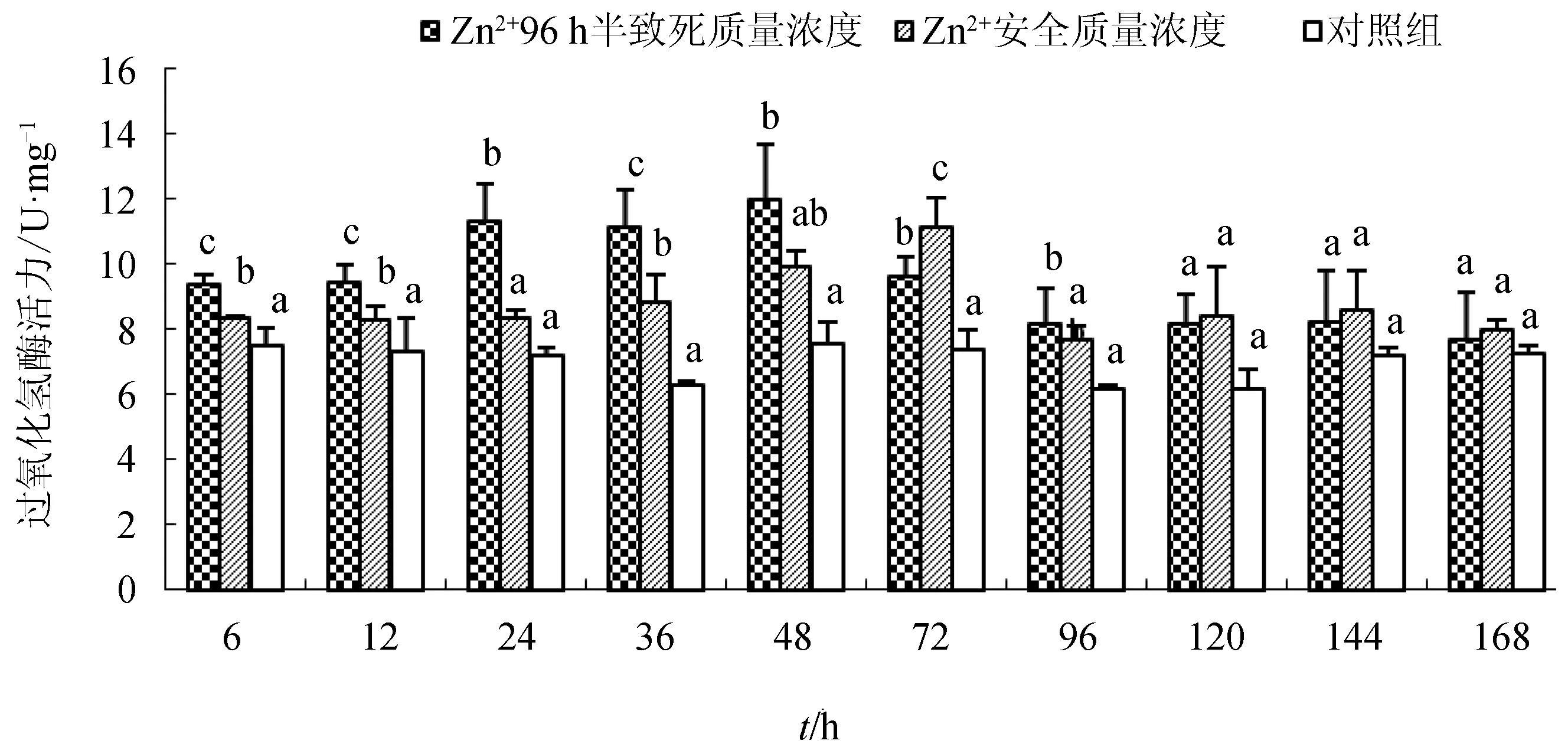
图2 不同Zn2+质量浓度下青蛤血淋巴液中过氧化氢酶的活性
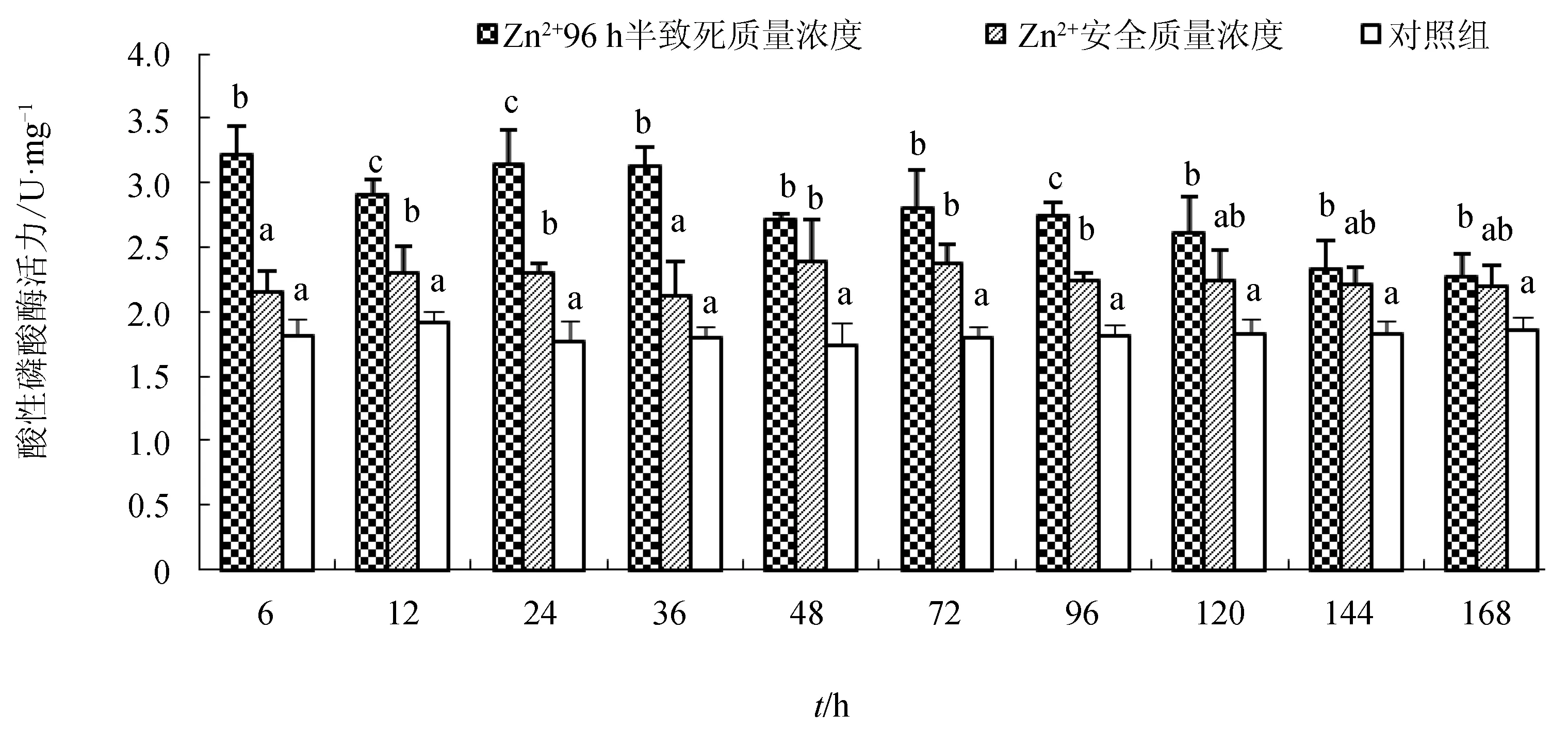
图3 不同Zn2+质量浓度下青蛤血淋巴液中酸性磷酸酶的活性
3 讨 论
3.1 Zn2+对青蛤的毒性
本试验中,Zn2+对青蛤的96 h半致死质量浓度为191.56 mg/L,安全质量浓度为1.92 mg/L。有研究指出,Zn2+对青蛤幼贝的96 h半致死质量浓度为160 mg/L[10],略低于本试验的结果,这可能是由于试验贝类的规格差异所导致[本试验为2龄成贝,平均壳长(35.32±0.89) mm]。由刘琼玉等[13]研究结果得知,菲律宾蛤仔对Zn2+的安全质量浓度为0.87 mg/L,这表明青蛤抵御Zn2+毒性的能力要远高于菲律宾蛤仔。
本试验中青蛤Zn2+安全质量浓度(1.92 mg/L),高于1997年颁布的海水水质标准(0.50 mg/L)[14],但考虑到贝类对重金属具有很强的累积作用,因此若发现养殖海区或池塘水体中的Zn2+质量浓度接近或超过其安全质量浓度时,应及时采取措施,减少不必要的损失。
3.2 Zn2+在青蛤体内的蓄积
重金属一般是通过以下两种方式进入贝类体内并蓄积:一、由表皮渗透入组织中,通过血液循环被输送到其他组织器官;二、摄食消化过程中间接地被贝类所摄入。在半致死质量浓度胁迫下,各组织对Zn2+的蓄积能力顺序为:鳃>内脏团,这可能与鳃作为呼吸器官直接接触高质量浓度Zn2+的海水,通过渗透作用进入鳃组织中有关。安全质量浓度胁迫下,在72 h之前各组织对Zn2+的蓄积能力顺序为:内脏团>鳃,这可能与内脏团的解毒作用和金属硫蛋白的诱导作用有关。金属硫蛋白是一种低分子量、能被金属诱导表达的金属结合蛋白[15],广泛存在于生物体内。胁迫初期进入体内的Zn2+达到一定质量浓度后便诱导内脏团组织启动金属硫蛋白的合成,并被金属硫蛋白结合以减轻其毒性[16]。但随着胁迫时间的增加,体内Zn2+的质量浓度不断增加,与金属硫蛋白的结合达到饱和而溢出,通过渗透作用进入鳃组织的Zn2+便无处可去而停留在鳃中,这可能就是本试验72 h后鳃组织的蓄积能力超过内脏团的原因。
3.3 Zn2+对青蛤抗氧化酶活性的影响
重金属进入生物体后会诱导机体产生大量的H2O2、·OH等活性氧自由基,破坏生物体内的活性氧平衡,造成多种类型的氧化损伤[17-18],而超氧化物歧化酶、过氧化氢酶往往是生物体防御氧化应激的第一道防线。这两种酶组成超氧化物歧化酶—过氧化氢酶系统以清除体内因污染胁迫产生的过多活性氧自由基[19]。本研究中,在Zn2+96 h半致死质量浓度胁迫初期,青蛤血淋巴液中的超氧化物歧化酶和过氧化氢酶活性均显著高于对照组(P<0.05),表现出诱导效应。但随着高质量浓度重金属胁迫时间的增加,超氧化物歧化酶和过氧化氢酶活性降低甚至受到抑制,生物体内出现大量氧自由基,损伤机体,总体表现出“先诱导—后抑制”趋势。不同种类的贝类对不同重金属胁迫也出现相似结果。如陈琳琳等[20]的研究结果表明,Hg能够在短期内增加紫贻贝抗氧化酶的活性,但随着胁迫时间的延长,会明显抑制相关抗氧化酶的活性。丁鉴峰等[21]发现,随着不同地区的污染程度加重,菲律宾蛤仔的超氧化物歧化酶活性逐渐升高,但当污染程度达到一定时,超氧化物歧化酶活性急剧下降。笔者在做Cu2+对青蛤的胁迫效应影响的试验中也证实了上述观点(待发表)。出现这种现象的原因可能为,重金属进入生物体后激活体内抗氧化防御系统,诱导合成抗氧化酶以清除活性氧自由基,形成胁迫初期抗氧化酶活性升高的现象。但长时间胁迫下超氧化物歧化酶、过氧化氢酶活性大幅度降低,表明高质量浓度金属离子长时间胁迫下抑制了抗氧化酶的活性。
本试验中,在Zn2+安全质量浓度(1.92 mg/L)胁迫下,青蛤的超氧化物歧化酶、过氧化氢酶活性显著高于对照组,Stebbing[22]将这种低质量浓度重金属胁迫下出现的增益现象,称为“毒物兴奋效应”。这也说明Zn2+胁迫对超氧化物歧化酶、过氧化氢酶活性的诱导与质量浓度和胁迫时间有关,在较低质量浓度时,表现出诱导效应,高质量浓度下,诱导效应加强,随时间的增加达峰值后,抑制效应显著。
酸性磷酸酶广泛存在于贝类血细胞的溶酶体中,当环境发生变化或有异物进入体内时,可以催化有机磷酸水解释放磷酸根离子,以清除和杀伤进入体内的异物以及病原[20]。本研究中,酸性磷酸酶活性的变化趋势与抗氧化酶超氧化物歧化酶、过氧化氢酶基本一致,Zn2+96 h半致死质量浓度胁迫下酸性磷酸酶活性呈现“诱导—抑制”的趋势,诱导效应可能与抗氧化酶机制一致,但抑制效应可能由以下两条途径所导致:一是毒物造成的血细胞溶解,导致溶酶体活性降低;二是毒物改变了血细胞内溶酶体的膜通透性,导致酸性磷酸酶渗漏[23]。
[1] 庄启谦.中国动物志,软体动物门,双壳纲,帘蛤科[M]. 北京: 科学出版社, 2001:236-241.
[2] 王兴强,曹梅,阎斌伦,等.青蛤的生物学及其繁殖[J]. 水产科学, 2006, 25(6):312-316.
[3] 王增焕,林钦,王许诺,等.华南沿海牡蛎重金属含量体征及其风险评估[J]. 水产学报, 2011, 35 (2):291-297.
[4] 马元庆,秦华伟,李磊,等.海湾扇贝体内重金属含量研究[J]. 海洋湖沼通报, 2010(1):47-51.
[5] 马元庆,张秀珍,孙玉增,等.栉孔扇贝对重金属的富集效应研究[J]. 水产学报, 2010, 34(10):1572 -1578.
[6] 苑旭洲,崔毅,陈碧鹃,等.菲律宾蛤仔对6种重金属的生物富集动力学[J]. 渔业科学进展, 2012, 33(4):49-55.
[7] 冯志权,马明辉,关春江,等.长江以北毛蚶体内Hg、Cd、Pb、AS残留量研究[J]. 海洋环境科学, 2000, 19(2):50-53.
[8] 张少娜,孙耀,宋云利,等.紫贻贝(Mytilusedulis)对4种重金属的生物富集动力学特性研究 [J]. 海洋与湖沼, 2004, 35(5):438-445.
[9] 董志国,李晓英,程汉良,等.养殖青蛤体内6种重金属在5种组织中分布差异及安全评估[J].水产科学,2011,30(6):331-334.
[10] 周凯,么宗利,来琦芳,等.重金属Zn2+、Cd2+对青蛤幼贝的致毒效应[J]. 海洋渔业, 2007, 29(1):63-67.
[11] 周永欣,章宗涉.水生生物毒性试验方法 [M]. 北京:农业出版社, 1989:109-191.
[12] 张宜奎,宋秀凯,刘爱英,等.重金属Cd2+、Cu2+对文蛤的急性毒性[J]. 海洋湖沼通报, 2011(3):51-56.
[13] 刘琼玉,洪华生,蔡立哲.重金属锌、铅对菲律宾蛤仔的急性毒性试验[J]. 台湾海峡, 1997, 16(1):50-53.
[14] 国家环境保护局,国家技术监督局.GB 3097—1997,海水水质标准[S]. 北京:中国标准出版社, 1998.
[15] Hamer D H. Metallothionein[J]. Annual Review of Biochemistry, 1986(55):913-951.
[16] 张笑一,潘渝生.重金属致毒的化学机理[J]. 环境科学研究, 1997, 10(2):45-49.
[17] Novelli E L B, Vieir E P, Rodrigues N L, et al. Risk assessment of cadmium toxicity on hepatic and renal tissues of rats [J]. Environ Res, 1998(79):102-105.
[18] Silva A M M, Novelli E L B, Faseineli M L, et al. Impact of an environmentally realistic intake of water contaminants and superoxide formation on tissues of rats [J]. Environ Pollult,1999(105):243-249.
[19] 于庆云,王悠,许彦,等. 镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响[J]. 生态毒理学报, 2013, 8(4):504-512.
[20] 陈琳琳,张高生,陈静,等.汞、硒暴露对紫贻贝(Mytilusedulis)抗氧化酶系统的影响[J].生态毒理学报,2011,6(4):383-388.
[21] 丁鉴峰,闫喜武,赵立强,等.海洋污染物对菲律宾蛤仔的免疫毒性[J].生态学报,2013,33(17):5419-5425.
[22] Stebbing A R D. Hormesis-the stimulation of growth by low level of inhibitors[J]. Science of the Total Environment,1982, 22(3):213-234.
[23] Gagne F, Auclair J, Turcotte P, et al. Ecotoxicity of CdTe quantum dots to freshwater mussels: impacts on immune system, oxidative stress and genotoxicity [J]. Aquatic Toxicology, 2008, 86(3):333-340.
EffectsofZn2+onClamCyclinasinensis
LIANG Jian, LI Yongren, GUO Yongjun, XING Kezhi
( Tianjin Key Laboratory of Aqua-ecology and Aquaculture, Department of Fishery Sciences, Tianjin Agricultural University, Tianjin 300384, China )
LC50and safe concentrations were determined in clamCyclinasinensiswith shell length of (35.32±0.89) mm exposed to six gradient concentrations of Zn2+(10.00,19.95, 39.81,79.43,158.49, and 316.23 mg/L) and accumulation of Zn2+in gill and visceral mass and activities of superoxide dismutase (SOD), catalase (CAT), and acid phosphatase (ACP) in hemolymph of the clam were investigated under LC50and safe concentrations of Zn2+at water temperature of 26—28 ℃ and a salinity of 25.It was found that the LC50of Zn2+was 191.56 mg/L, and safe concentration 1.92 mg/L for 96 h. There was more rapid accumulation of Zn2+in gill than that in the visceral mass during the experiment. The activities of SOD, CAT and ACP in hemolymph showed a trend of first induction and then inhibition under the LC50concentration, higher than that in the control group, even though without significant change under safe concentration during the experiment. The findings provide certain significance in healthy breeding and the study of toxicology of clamCyclinasinensis.
Cyclinasinensis; Zn2+; acute toxicity; accumulation process; biochemical indicator
10.16378/j.cnki.1003-1111.2017.02.008
2015-11-08;
2016-05-16.
国家贝类产业技术体系项目(CARS-48);天津市高等学校创新团队基金资助项目(TD12-5018);天津市应用基础与前沿技术研究计划项目(15JCYBJC30400);天津市科技特派员项目(14JCTPJC00521).
梁健(1988—),男,助理实验师,硕士;研究方向:贝类遗传育种. E-mail: liangjian1230123@126.com. 通讯作者:邢克智(1956—),男,教授;研究方向:水产动物增养殖.E-mail:kzxing8886@126.com.
S968.31
A
1003-1111(2017)02-0167-05
