拉莫三嗪缓释片的制备及体外释放行为考察
2017-12-19朱宣羽张燕丁子莹操锋中国药科大学药学院药剂系南京98国家食品药品监督管理总局药品评审中心北京00089
朱宣羽,张燕,丁子莹,操锋#(.中国药科大学药学院药剂系,南京98;.国家食品药品监督管理总局药品评审中心,北京00089)
拉莫三嗪缓释片的制备及体外释放行为考察
朱宣羽1*,张燕2,丁子莹1,操锋1#(1.中国药科大学药学院药剂系,南京211198;2.国家食品药品监督管理总局药品评审中心,北京100089)
目的:改进原研制备工艺,仿制拉莫三嗪缓释片,并考察其体外释放行为。方法:采用羟丙基甲基纤维素(HPMC)E4M CR和HPMC K100LV CR制备缓释骨架片芯,以尤特奇®L30D-55为肠溶材料包衣,制备拉莫三嗪缓释片。以与原研制剂体外释放度的相似因子f2为指标,采用单因素法筛选处方中乳糖用量、HPMC E4M CR和HPMC K100LV CR质量比、HPMC用量及包衣增质量。结果:片芯处方为拉莫三嗪50 mg、HPMC K100LV CR 40 mg、HPMC E4M CR 61.4 mg、乳糖128 mg,最佳包衣增质量为3%。自制制剂和原研制剂在含0.5%十二烷基硫酸钠的pH 6.8磷酸盐缓冲液、pH 4.5乙酸-乙酸钠缓冲液和水中的体外释放行为均相似。结论:成功仿制了拉莫三嗪缓释片,且工艺比原研制剂更加简单、易行。
拉莫三嗪;缓释片;肠溶包衣;体外释放
拉莫三嗪(Lamotrigine)是新一代苯三嗪类广谱抗癫痫药,通过阻断电压依赖性钠离子通道、抑制谷氨酸释放,从而发挥抗癫痫作用[1]。其口服吸收好,生物利用度高,不存在肝药酶诱导作用,发生药物相互作用的几率低,在临床上广泛应用于癫痫患者的治疗[2-3]。
GSK公司研制的拉莫三嗪缓释片(Lamictal XR)于2013年在美国批准上市。该制剂通过亲水凝胶骨架片芯、肠溶包衣和“DiffCORE”释药技术3种方式控制药物释放。其中“DiffCORE”释药技术由英国GSK公司自行研发,主要体现在:于拉莫三嗪缓释片直径约9 mm的包衣片上削去部分肠溶层,形成2个(上、下面)直径约5 mm的裸露片芯孔洞[4]。该技术对相关技术和设备要求高,难以被完全模仿,也难以实现产业化。
笔者初期在考察原研制剂的体外释放行为后发现,原研制剂中的拉莫三嗪在0.01 mol/L盐酸溶出介质中2 h的累积释放度仅为3%左右,这一结果也被相关研究者所佐证[5]。这意味着原研制剂采用“DiffCORE”释药技术后药物在酸性介质中的释放行为与普通肠溶制剂类似,并未显著增加,故笔者希望采用普通肠溶片的技术实现原研制剂同样的释药效果。本试验采用普通肠溶片的技术,使用与原研制剂相同的辅料对拉莫三嗪缓释片进行仿制,通过调节骨架片芯处方和包衣增质量来控制释药效果,以期制得在不同溶出介质中与原研制剂有相似释药效果的拉莫三嗪缓释片。
1 材料
1.1 仪器
LC-2010cHT型高效液相色谱仪(日本岛津公司);pHS-25型pH计(上海仪电科学仪器股份有限公司);TDP型单冲式压片机(上海天祥健台制药机械有限公司);YPD-300D型片剂硬度仪和BY300A型小型包衣机(上海黄海药检仪器有限公司);ZRS-8G型智能溶出仪(天津天大天发科技有限公司)。
1.2 药品与试剂
拉莫三嗪原料药(浙江华海药业股份有限公司,批号:5629-13-001,纯度:98.4%);拉莫三嗪对照品(中国食品药品检定研究院,批号:100775-200401,纯度:100%);拉莫三嗪缓释片(原研制剂,商品名:Lamictal XR,美国GSK公司,批号:4ZP2831,规格:50 mg/片);乳糖(德国美剂乐集团);羟丙基甲基纤维素(HPMC)E4M CR和HPMC K100LV CR(卡乐康技术有限公司);硬脂酸镁(安徽山河药用辅料有限公司);尤特奇®L30D-55(Eudragit®L30D-55,德国罗姆公司);单硬脂酸甘油酯[嘉法狮(上海)贸易有限公司];枸橼酸三乙酯(蚌埠丰源有限公司);聚山梨酯80(青岛天力源生物科技有限公司);甲醇为色谱纯,乙酸铵、浓盐酸、磷酸钠、十二烷基硫酸钠(SDS)、乙酸、乙酸钠均为分析纯,水为双蒸水。
2 方法与结果
2.1 拉莫三嗪缓释片的制备
2.1.1 骨架片芯的制备参考美国FDA审评报告[6]和原研制剂相关专利[7]拟定片芯处方。称取拉莫三嗪原料药和乳糖,过80目筛后混匀,加入适量水为润湿剂制软材,过16目筛制湿颗粒,50℃下干燥2 h,过18目筛整粒。称取处方量HPMC E4M CR、HPMC K100LV CR和硬脂酸镁,过60目筛后混匀,加入干燥颗粒混匀后压片(硬度6~7 kg),制得骨架片芯。
2.1.2 缓释片的制备参考尤特奇®L30D-55包衣液技术资料和使用指导[8]拟定包衣液处方。称取尤特奇®L30D-55包衣液与水混合,搅匀,为包衣液A。称取枸橼酸三乙酯、聚山梨酯80与水混合,加入单硬脂酸甘油酯,于70℃水浴加热至溶解,趁热高速分散(3 000 r/min分散0.6 min),冷却至室温后为包衣液B。将包衣液B缓慢加入包衣液A中,搅拌40 min,采用BY300A型小型包衣机进行包衣(转速:30 r/min,温度:30℃,流速:1.2 mL/min),达到目标增质量后于40℃下固化30 min,制得拉莫三嗪缓释片。
2.2 拉莫三嗪的含量测定
2.2.1 色谱条件色谱柱:Dikma C18反相色谱柱(150 mm×4.6 mm,5 μm);流动相:0.8 g/L乙酸铵溶液(用乙酸调pH至4.5)-甲醇(32∶68,V/V);流速:1 mL/min;柱温:25℃;检测波长:310 nm;进样量:50 μL。
2.2.2 方法学考察按2015年版《中国药典》(四部)通则9101相关要求进行方法学考察。结果显示,拉莫三嗪质量浓度(c)对峰面积(A)的回归方程为A=67 124c-6 560.7(R2=0.999 6,n=6),其线性范围为2.5~80 μg/mL;高、中、低质量浓度样品的回收率分别为(101.14±0.42)%、(100.16±0.53)%、(98.63±0.39)%(n=3);精密度试验的峰面积RSD为0.78%(n=6);24 h内稳定性试验的含量RSD为1.14%(n=6)。结果均符合相关规定。
2.3 体外释药考察
按2015年版《中国药典》(四部)通则0931第二法(桨法)进行操作。参考美国FDA公开的评审报告[6]后确定前2 h以700 mL的0.01 mol/L盐酸溶液为释放介质,之后以加入200 mL磷酸盐缓冲液(PBS)调整为900 mL含0.5%SDS的pH 6.8的PBS(0.05 mol/L)为释放介质。同时分别考察自制制剂在水和pH 4.5乙酸-乙酸钠缓冲液中的释药效果。设转速为50 r/min,温度为37℃,取样时间为2、5、7、12、15、24 h,取样体积为5 mL(同时补充同温等量相应介质),取样液过0.45 μm尼龙滤膜后,取续滤液进样测定。采用外标一点法根据峰面积计算相应浓度和累积释放度,绘制释药曲线。
2.4 单因素试验优化缓释片处方
2.4.1 乳糖用量乳糖遇水后快速溶解,使片芯中形成大量孔道,从而改变骨架片的溶蚀行为,影响药物的释放,因此需要对乳糖用量进行考察。固定拉莫三嗪用量为50 mg,HPMC K100LV CR用量为40 mg,HPMC E4M CR用量为61.4 mg,包衣增质量为3%,包衣液处方为尤特奇®L30D-55 8.26 g、柠檬酸三乙酯0.46 g、聚山梨酯80 0.09 g、单硬脂酸甘油酯0.24 g、固含量为20%~25%,按“2.1”项下方法制备乳糖用量分别为68、128、188 mg的拉莫三嗪缓释片,记为F1、F2、F3。按“2.3”项下方法绘制上述拉莫三嗪缓释片和原研制剂在含0.5%SDS的pH 6.8的PBS中的释药曲线,采用相似因子(f2)法[9]比较自制制剂与原研制剂的相似性。结果显示,乳糖用量与拉莫三嗪缓释片的释放速率呈正相关,F1、F2、F3与原研制剂释药曲线的f2分别为41.33、74.26、40.71(n=6),以f2越大越相似为标准,确定128 mg为乳糖用量。F1、F2、F3中骨架片芯的处方组成见表1,释药曲线见图1。
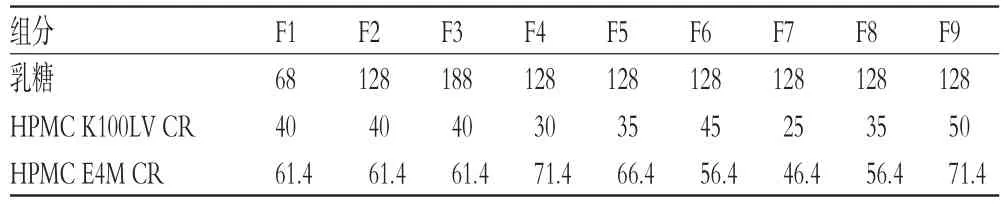
表1 单片拉莫三嗪缓释片中骨架片芯的处方组成(mg)Tab1FormulationcompositionsofoneLamotriginesustained-release tablet(mg)
2.4.2 HPMC比例由于HPMC的黏度会影响骨架片芯的溶蚀行为,通过调整低黏度HPMC K100LV CR和高黏度HPMC E4M CR的比例可控制药物在骨架片芯中的释放行为。按“2.4.1”项下处方量和方法,制备不同质量比(40∶61.4、30∶71.4、35∶66.4、45∶56.4)HPMC K100LV CR-HPMC E4M CR的拉莫三嗪缓释片,记为F2、F4、F5、F6。按“2.3”项下方法绘制上述拉莫三嗪缓释片和原研制剂在含0.5%SDS的pH 6.8的PBS中的释药曲线,比较其相似性。结果显示,HPMC E4M CR比例越高,缓释材料黏度越大,自制制剂释放越慢。F2、F4、F5、F6与原研制剂释药曲线的f2分别为73.62、33.77、48.27、33.24(n=6),故确定40∶61.4为HPMC K100LV CR-HPMC E4M CR的质量比。F2、F4、F5、F6中骨架片芯的处方组成见表1,释药曲线见图1。

图1 单因素试验的释药曲线(±s,n=6)Fig1Drugreleasecurvesofsinglefactor test(±s,n=6)
2.4.3 HPMC总量缓释材料的总量将影响凝胶骨架的降解速度,而药物的释放行为与凝胶骨架的降解速度有关。因此,在确定HPMC比例的情况下,分别比较不同总量(101.4、71.4、91.4、121.4 mg)HPMC所制拉莫三嗪缓释片(记为F2、F7、F8、F9)与原研制剂在含0.5%SDS的pH 6.8的PBS中释药曲线的相似性。结果显示,HPMC总量越大,自制制剂的释放速率越慢。F2、F7、F8、F9与原研制剂释药曲线的f2分别为70.86、38.69、43.03、35.22(n=6),故确定每片101.4 mg为HPMC的总量。F2、F7、F8、F9中骨架片芯的处方组成见表1,释药曲线见图1。
2.4.4 包衣增质量包衣层厚度过大会减慢包衣膜的溶解速度而减缓药物释放,厚度过小则无法保证其耐酸能力。因此以表1中F2处方,按“2.1”项下方法制备包衣增质量分别为2%、3%、4%、5%的拉莫三嗪缓释片。比较其与原研制剂在含0.5%SDS的pH 6.8的PBS中释药曲线的相似性。结果显示,上述自制制剂与原研制剂释药曲线的f2分别为31.96、68.86、59.41、49.11(n=6),故确定包衣增质量为3%。自制制剂与原研制剂的释药曲线见图1。
2.5 缓释片在不同介质中的释药曲线测定
以表1中F2为片芯处方,包衣增质量为3%,按“2.1”项下方法制备拉莫三嗪缓释片(批号:160310)。按“2.3”项下方法考察自制制剂与原研制剂在含0.5%SDS的pH 6.8的PBS、pH 4.5乙酸-乙酸钠缓冲液和水中的释药曲线。结果显示,自制制剂与原研制剂在含0.5%SDS的pH 6.8的PBS中释药曲线的f2为69.01(n=6),表明自制制剂和原研制剂释药行为相似。在pH 4.5乙酸-乙酸钠缓冲液和水中自制制剂与原研制剂的体外释放行为基本一致。由于二者的24 h累积释放度均小于20%,而f2法计算相似标准是每个时间点的累积释放度差异不超过10%,因此计算f2值意义不大。因此,确定拉莫三嗪缓释片的片芯处方为表1中F2,包衣增质量为3%。自制制剂与原研制剂在3种介质中的体外释放曲线见图2。
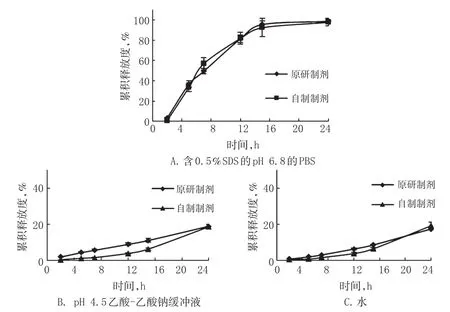
图2 自制制剂与原研制剂在不同介质中的体外释药曲线(±s,n=6)Fig 2The in vitro release curves of original and self-made preparations in 3 kinds of media(±s,n=6)
2.6 重复性试验
根据片芯处方为拉莫三嗪50 mg、HPMC K100LV CR 40 mg、HPMC E4M CR 61.4 mg、乳糖128 mg、包衣增质量为3%,按“2.1”项下方法制备拉莫三嗪缓释片3批(批号:20160313、20160316、20160319),每批1 000片。考察3批自制制剂与原研制剂在含0.5%SDS的pH 6.8的PBS中的累积释放度,并计算其RSD。绘制原研制剂与自制制剂在含0.5%SDS的pH 6.8的PBS、pH 4.5乙酸-乙酸钠缓冲液和水中24 h内的释药曲线,计算批号20160313自制制剂与原研制剂在3种介质中的f2。重复性试验结果见表2,原研制剂与自制制剂在3种介质中的释药曲线见图3。
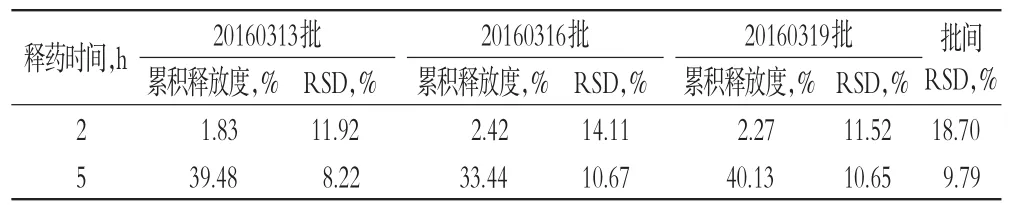
表2 重复性试验结果(n=6)Tab 2Results of repetitive test(n=6)
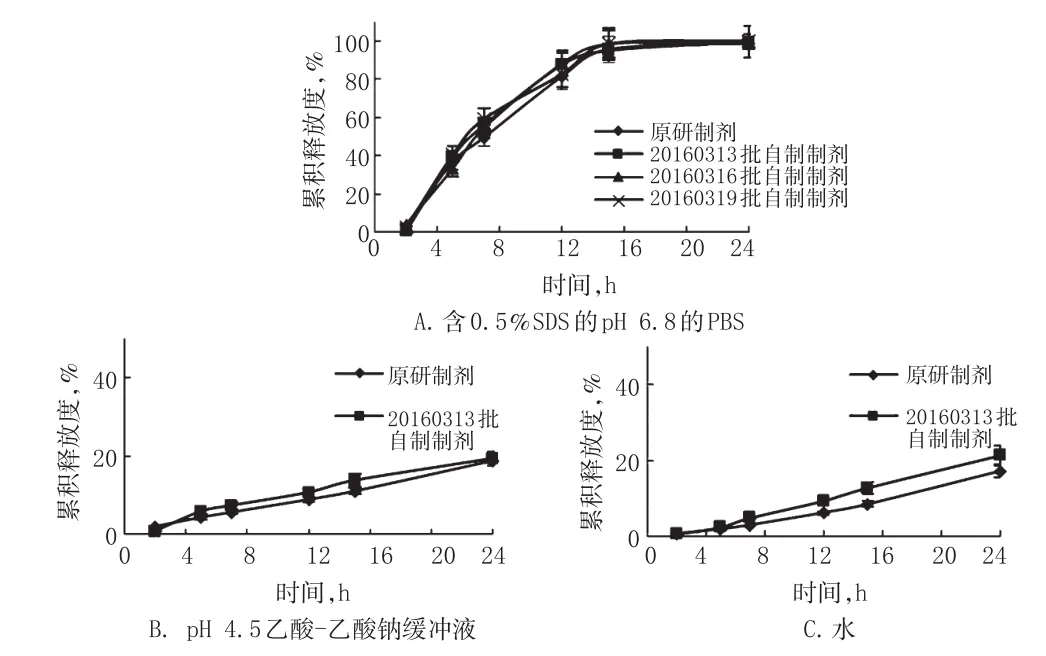
图3 原研制剂与自制制剂在3种介质中的体外释药曲线(±s,n=6)
Fig 3The in vitro release curves of original and self-made preparations in 3 kinds of media(±s,n=6)
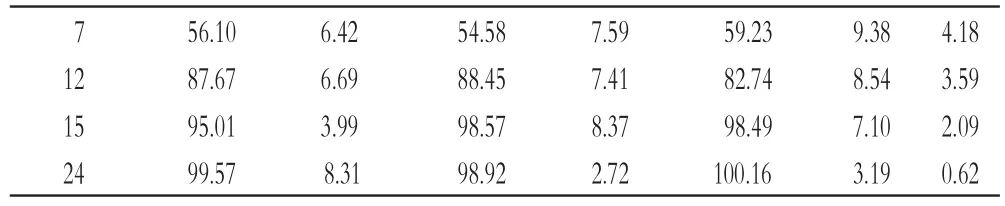
Fig 3The in vitro release curves of original and self-made preparations in 3 kinds of media(±s,n=6)
7 12 15 24 56.10 87.67 95.01 99.57 6.42 6.69 3.99 8.31 54.58 88.45 98.57 98.92 7.59 7.41 8.37 2.72 59.23 82.74 98.49 100.16 9.38 8.54 7.10 3.19 4.18 3.59 2.09 0.62
由表2结果显示,3批自制制剂在含0.5%SDS的pH 6.8的PBS中2 h时累积释放度的RSD均未超过20%,5 h(不包括5 h)之后累积释放度的RSD均未超过10%,符合缓释制剂要求[10]。
20160313 批自制制剂与原研制剂在含0.5%SDS的pH 6.8的PBS、pH4.5乙酸-乙酸钠缓冲液和水中的f2均大于50。这表明自制制剂与原研制剂的体外释药行为基本一致。
3 讨论
本研究还对比了尤特奇®和雅克宜®两类包衣材料,二者制成的包衣膜耐酸能力相似,但在水介质中雅克宜®包衣材料迅速溶解,与原研制剂差异过大,故选择尤特奇®进行后续研究。梁福萍等[5]将致孔剂SDS添加入包衣液处方中,以此来模拟“DiffCORE”释药技术制备拉莫三嗪缓释片,也得到了体外释放行为与原研制剂相似的制剂。对比双方研究结果发现,梁福萍等[5]的最佳处方需要将包衣增质量提高到6.4%时才能与原研制剂释放行为最为接近;而本研究所得的拉莫三嗪缓释片制备方法未添加致孔剂并仅将包衣增质量控制为3%即可得到相一致的释药效果。相关研究结果也显示,减小包衣膜厚度与加入致孔剂均能提高药物的释放,达到类似效果[11],但相对而言,减小包衣膜厚度更简单易行。
本研究参考了原研制剂专利[8]中的处方信息并经试验筛选,通过调整骨架片芯和包衣膜厚度,获得了与原研体外释放行为相一致的自制品。自制制剂在实验室环境下规模放大制备3批,其批间差异符合规定,处方重复性良好,且与原研制剂在不同介质中的释放行为相似性良好。制备采用完整的肠溶包衣方式,避免了原研“DiffCORE”释药技术中的包衣膜钻孔工艺,有效简化了操作流程,适合国内工业化生产,具有较好的开发前景。此外,制剂的稳定性试验仍在进行中,同时由于自制制剂在实验室环境下制备,还有待中试放大以进一步验证处方工艺的可靠性。
[1]St-Louis EK.Minimizing AED adverse effects:improvingqualityoflifeintheinterictal state in epilepsy care[J].Curr Neuropharmacol,2009,7(2):106-114.
[2]Steiner TJ,Dellaportas CI,Findley LJ,et al.Lamotrigine monotherapy in newly diagnosed untreatedepilepsy:adouble-blindcomparison with phenytoin[J].Epilepsia,1999,40(5):601-607.
[3]Nieto-Barrera M,Brozmanova M,Capovilla G,et al.A comparison of monotherapy with lamotrigine or carbamazepine in patients with newly diagnosed partial epilepsy[J].Epilepsy Res,2001,46(2):145-155.
[4]Sunil-SadanandN,NavinV.Controlledreleaseformulationoflamotrigine:US,7939102[P].2011-03-10.
[5]梁福萍,尹莉芳.致孔剂对拉莫三嗪肠溶缓释片酸介质中释放度的影响[J].中国新药杂志,2015,24(17):2029-2035.
[6]FDA.Clinical pharmacology/biopharmaceutics reviewofnda-22-115[EB/OL].[2016-07-28].http://www.accessdata.fda.gov/drugsatfda_docs/nda/2009/022115s000_ClinPharmR.pdf.
[7]伊恩·R·巴克斯顿,罗宾·柯里,迈纳·A·德拉-克鲁兹,等.含拉莫三嗪的缓释制剂:中国,CN101229169[P].2012-11-21.
[8]Petereit HU.尤特奇(聚甲基丙烯酸酯)应用技术指南[M].平其能,张灿,译.北京:化学工业出版社,2009:43-50.
[9]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308-311.
[10]国家食品药品监督管理局.化学药物口服缓释制剂药学研究技术指导原则[EB/OL].[2016-07-28].http://www.cde.org.cn/zdyz.do?method=largePage&id=2319.
[11]张蜀,林华庆,邓红,等.左旋盐酸沙丁胺醇凝胶骨架包衣缓释片的制备[J].中国新药杂志,2009,18(13):1257-1261.
Preparation of Lamotrigine Sustained-release Tablets and Study on the in vitro Release Behavior
ZHU Xuanyu1,ZHANG Yan2,DING Ziying1,CAO Feng1(1.Dept.of Pharmacy,School of Pharmacy,China Pharmaceutical University,Nanjing 211198,China;2.Center for Drug Evaluation,China Food and Drug Administration,Beijing 100089,China)
OBJECTIVE:To improve the original preparation technology,imitate Lamotrigine sustained-release tablets,and study its in vitro release behavior.METHODS:Hydroxypropylmethylcellulose(HPMC)E4M CR and HPMC K100LV CR were used to prepare the sustained-release matrix core.Using Eudragit®L30D-55 as enteric coating material,Lamotrigine sustained-release tablets were prepared.Using the similar factor f2of in vitro release rate of original preparation as index,single factor was used to screen the amount of lactose,mass ratio of HPMC E4M CR and HPMC K100LV CR,amount of HPMC and weight of coating layer in the formulation.RESULTS:The formulation of matrix core was as follow as lamotrigine 50 mg,HPMC K100LV CR 40 mg,HPMC E4M CR 61.4 mg,lactose 128 mg,and the optimal weight of coating layer of 3%.The in vitro release of self-made and original preparations were similar in pH 6.8 phosphate buffer containing 0.5%sodium dodecyl sulfate,pH 4.5 acetic acid sodium acetate buffer and water.CONCLUSIONS:Lamotrigine sustained-release tablets are successfully imitated,and the technology is more simple and feasible than original preparation.
Lamotrigine;Sustained-release tablet;Enteric coating layer;in vitro release
R943
A
1001-0408(2017)34-4872-04
DOI10.6039/j.issn.1001-0408.2017.34.31
*硕士研究生。研究方向:药物新剂型与新技术。电话:025-83271092。E-mail:sinn_zhu@163.com
#通信作者:副教授,博士。研究方向:药物新剂型与新技术。电话:025-83271092。E-mail:cpufengc@gmail.com
2017-05-15
2017-09-07)
(编辑:邹丽娟)
