天冬总皂苷的大孔树脂纯化工艺研究Δ
2017-12-19刘亮杜江冯华丁丽娜陈东林周英信遵义医药高等专科学校药学系贵州遵义56006贵阳中医学院药学院贵阳55000遵义市食品药品检验所中药室贵州遵义56000
刘亮,杜江,冯华,丁丽娜,陈东林,周英信(.遵义医药高等专科学校药学系,贵州遵义56006;.贵阳中医学院药学院,贵阳55000;.遵义市食品药品检验所中药室,贵州遵义56000)
天冬总皂苷的大孔树脂纯化工艺研究Δ
刘亮1*,杜江2,冯华3,丁丽娜1,陈东林1,周英信1(1.遵义医药高等专科学校药学系,贵州遵义563006;2.贵阳中医学院药学院,贵阳550002;3.遵义市食品药品检验所中药室,贵州遵义563000)
目的:对天冬总皂苷的大孔树脂纯化工艺进行优选。方法:以天冬总皂苷含量等为指标,采用单因素试验考察大孔树脂型号、上样吸附时间、上样液稀释倍数、吸附容量、洗脱溶剂体积分数及用量、洗脱速度,对大孔树脂纯化工艺进行优化,并进行验证试验。结果:HPD-300型大孔树脂对天冬总皂苷吸附及解析能力较强;最优纯化工艺为上样吸附时间60 min,上样液质量浓度0.1 g/mL,吸附容量120 mL(15 BV),使用3 BV的60%乙醇溶液进行洗脱,洗脱速度为4 BV/h。验证试验中总皂苷的平均解析率为68.30%(RSD=0.95%,n=3)。结论:优选的纯化工艺稳定、可行,可较好地分离纯化天冬总皂苷。
天冬;总皂苷;大孔树脂;纯化工艺
天冬为百合科植物天门冬[Asparagus cochinchinensis(Lour.)Merr.]的块根,具有养阴清热、润肺滋肾的功效,是一种临床常用中药。天冬是贵州省内的大宗药材,种植面积较大,仅在遵义市凤冈县就有近3 000亩的天冬种植基地。天冬主要含有糖类、氨基酸、皂苷类等成分[1],具有抗氧化、抗衰老、抗菌等药理活性[2]。通过文献查阅,笔者发现目前对天冬总皂苷提取工艺方面研究较少[3-4],且尚未见其纯化工艺研究的报道。鉴于此,本试验以总皂苷含量为指标,考察不同型号大孔树脂对分离纯化天冬总皂苷的影响,在此基础上优选出总皂苷的最佳纯化工艺,以期为制订天冬药材质量标准及其进一步开发利用提供依据。
1 材料
1.1 仪器
UV2501型紫外分光光度计(日本岛津公司);ADHG 90AOA型电热恒温鼓风干燥箱(宁波江南仪器厂);SHZ-Ⅲ型循环水真空泵、RE-52型旋转蒸发器(上海亚荣生化仪器厂);FA2004B型电子天平(上海越平科学仪器有限公司)。
1.2 药材与试剂
天冬药材于2016年6月收集于贵州遵义,经遵义医药高等专科学校药学系张学愈副教授鉴定为百合科植物天门冬[Asparagus cochinchinensis(Lour.)Merr.]的块根;AB-8、S-8、DM-130型大孔树脂(陕西乐博生化科技有限公司)。菝葜皂苷元对照品(上海圻明生物科技有限公司,批号:126-19-2,纯度:≥98%);HPD-100、HPD-300、D-101型大孔树脂(沧州宝恩化工有限公司);其他试剂均为分析纯,试验用水为高纯水。
2 方法与结果
2.1 天冬总皂苷含量测定
2.1.1 对照品溶液制备将准确称量的菝葜皂苷元对照品7.8 mg加甲醇溶解,转移至25 mL棕色量瓶中定容,摇匀,即得。
2.1.2 供试品溶液制备准确称取天冬药材粗粉5 g,水浴90℃加热提取2次,第1次用40 mL水提取1 h,第2次用30 mL水提取40 min,过滤,滤液加水溶解并定容至100 mL量瓶中,摇匀。从中移取10 mL,用水饱合正丁醇分3次萃取(15、15、15 mL),合并正丁醇萃取液,用正丁醇饱和的水20 mL萃取,减压回收正丁醇层至干,浓缩物用甲醇溶解并定容于25 mL量瓶中,摇匀,即得。
2.1.3 测定波长选择分别精密吸取对照品溶液、供试品溶液适量,置于15 mL具塞试管中,挥干甲醇,加入5%的香草醛冰醋酸溶液0.2 mL、高氯酸0.8 mL,摇匀,密塞,60℃水浴显色15 min。取出后立即用冰水冷却5 min,再加入5 mL冰醋酸稀释,摇匀,静置10 min。在400~800 nm波长范围内进行扫描,结果显示对照品在455 nm波长处有较大吸收峰,而样品在455 nm波长处有最大吸收峰,故选择455 nm波长为本试验的测定波长,波长扫描见图1、图2。

图1 对照品溶液波长扫描图Fig1Wavelengthscanningforreference substance solutions
图2 供试品溶液波长扫描图Fig 2Wavelength scanning for test sample solutions
2.1.4 线性关系考察试验方法参考文献[5]。分别用刻度吸量管准确移取菝葜皂苷元对照品溶液0、0.1、0.2、0.4、0.6、0.8、1.0 mL于具塞试管中,按“2.1.3”项下方法处理后,于455 nm波长处测定吸光度。以对照品质量浓度为横坐标(x)、吸光度为纵坐标(y)进行线性回归,得回归方程y=0.011 69x+0.030 56(r=0.999 4),结果表明总皂苷质量浓度在5.2~52 μg/mL范围内与吸光度线性关系良好。
2.1.5 方法学考察依法进行精密度与准确度试验。结果,精密度试验RSD为0.50%(n=6);准确度试验中,平均回收率为98.83%(RSD=1.88%,n=6),均符合相关要求。
2.2 大孔树脂纯化工艺优选
2.2.1 天冬提取液制备准确称取天冬药材粗粉50 g,依次用70%乙醇回流提取2次,每次400 mL,每次提取1.5 h。合并2次提取液浓缩至无醇味,再加水定容至250 mL量瓶中,摇匀,即得质量浓度为0.2 g/mL的天冬提取液。
2.2.2 树脂预处理分别称取6种型号(AB-8、S-8、D-101、DM-130、HPD-100、HPD-300)的大孔吸附树脂适量,用95%乙醇浸泡24 h之后,转移至玻璃柱中,用纯化水洗至无醇味,即得。
2.2.3 大孔树脂型号选择试验方法参考文献[6]。分别称取上述6种树脂0.5 g置于具塞锥形瓶中,再加入天冬提取溶液20 mL,每间隔5 min振摇1次,持续2 h。静止24 h后,抽滤,滤液加水稀释至100 mL,即得天冬吸附后溶液。
将抽干后的树脂置于具塞锥形瓶中,加70%乙醇20 mL进行解吸,每间隔5 min振摇1次,持续2 h。静止24 h后,抽滤,滤液浓缩乙醇至干,浓缩液加水稀释至100 mL,即得天冬解吸后溶液。
将上述所得溶液按“2.1”项下操作并进行总皂苷的含量测定,计算树脂对总皂苷的静态吸附量、静态吸附率及解析率。静态吸附量=(原溶液质量浓度-吸附后溶液质量浓度)×吸附液体积/树脂质量;静态吸附率=(原溶液质量浓度-吸附液质量浓度)/原溶液质量浓度×100%;静态解析率=(解析液质量浓度×解析液体积)/静态吸附量×100%。6种树脂静态吸附和解析结果见表1。
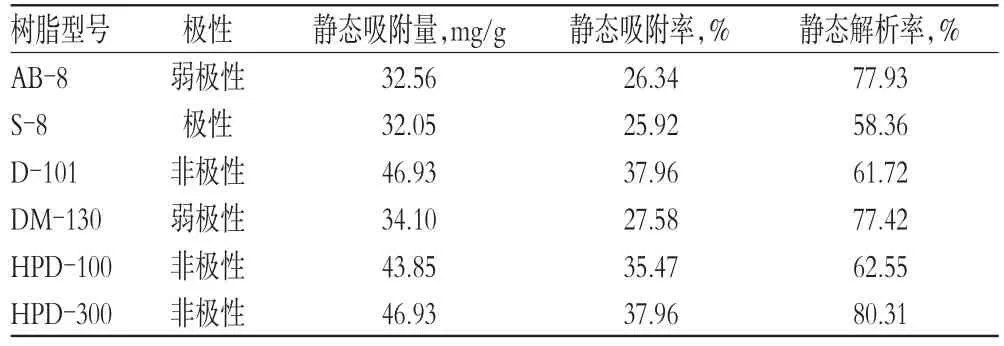
表1 6种树脂静态吸附和解析结果Tab 1Static adsorption-desorption results of 6 kinds of macroporous resins
由表1结果可知,6种型号大孔树脂静态吸附量、静态吸附率及静态解析率相差较大,其中HPD-300型树脂的静态吸附率与静态解析率均最大,因此确定选用HPD-300型大孔树脂用于后续的分离纯化工艺研究。2.2.4静态吸附动力学特征考察试验方法参考文献[7]。称取HPD-300大孔树脂0.5 g,转移到具塞锥形瓶中,精密加入天冬提取液20 mL,摇匀,静置吸附,于15、30、60、90、120、180、240、300、360 min移取1 mL上层清液(同时补纯水1 mL),将上清液加水至10 mL,按“2.1”项下操作并测定总皂苷含量,计算静态吸附率,绘制静态吸附动力学曲线,结果见图3。

图3 HPD-300树脂静态吸附动力学曲线Fig 3Static adsorption curves of HPD-300 macroporous resin
由图3可知,加入天冬提取液后,树脂在60 min内静态吸附率变化较快,而之后则变化较缓。因此,为了快速达到较高的吸附率,确定上样静态吸附时间为60 min。
2.2.5 上样液稀释倍数考察试验方法参考文献[8]。称取HPD-300型大孔树脂5份,每份4 g,装入离子交换柱中。取天冬提取液60 mL分别稀释1、2、3、4、5倍后,分别上柱静态吸附1 h,再以3 BV/h的流速进行吸附,吸附完成后,用水洗脱至近无色,再用70%乙醇3 BV洗脱,流速控制为3 BV/h。依次收集流出液,蒸干乙醇,用水溶解并定容至100 mL量瓶中,取10 mL,按“2.1”项下操作并测定总皂苷含量,计算解析量及解析率。其中,解析量=解析液质量浓度×解析液体积;解析率=(某解析液的解析量/加入量)×100%。上样液不同稀释倍数比较结果见表2。

表2 上样液不同稀释倍数比较Tab 2Comparison of column solutions with different dilution multiple
由表2可知,大孔树脂对天冬总皂苷的解析率随着稀释倍数的增加呈现先增大后减小的规律:当稀释倍数为3倍时,解析率最高;但稀释倍数为2~4倍时,解析率变化不大。结合操作的速度,确定上样液稀释2倍最佳,即天冬药液质量浓度为0.1 g/mL。
2.2.6 吸附容量考察试验方法参考文献[9]。称取HPD-300型大孔树脂4 g装柱,取天冬提取液(0.1 g/mL)以3 BV/h的流速上样吸附。流出液每10 mL收集1份,共收集20份,分别加水补足至100 mL,摇匀,取10 mL,按“2.1”项下操作并测定总皂苷含量。以上样体积为横坐标、总皂苷泄漏率(流出液皂苷质量浓度/上样液皂苷质量浓度×100%)为纵坐标,绘制吸附泄漏曲线,结果见图4。
由图4可知,随着上样液体积的增加,泄漏率也不断增加,但增加的程度有差异。当上样液体积达到120 mL时,泄漏率明显增大,说明树脂吸附已经达到动态饱和吸附量,故确定上样体积为120 mL(15 BV),即1 g树脂动态吸附生药量为3 g。
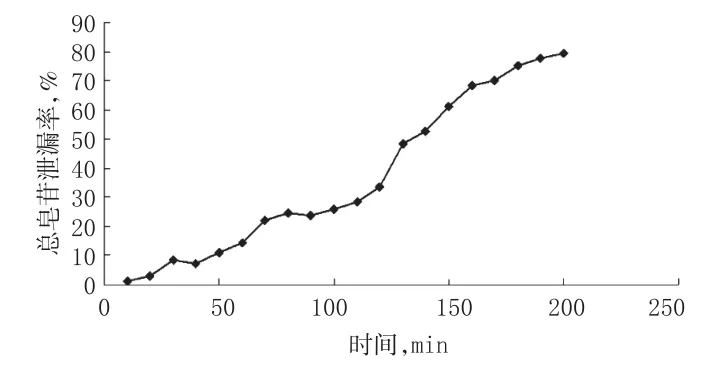
图4 HPD-300树脂上样吸附泄漏曲线Fig4AdsorptionleakingcurvesofHPD-300 macroporous resin
2.2.7 洗脱溶剂体积分数考察称取HPD-300型大孔树脂4 g装柱,加入天冬提取液(0.1 g/mL)120 mL,静态吸附后,以3 BV/h的流速进行吸附,再用水洗脱至近无色。之后依次用50%、60%、70%、80%、90%乙醇溶液,各以流速3 BV/h洗脱4 BV,依次收集乙醇洗脱液。回收乙醇后用水溶解并定容至100 mL量瓶中,取10 mL,按“2.1”项下操作并测定总皂苷含量,计算解析量及解析比例。其中,解析比例=某洗脱浓度的解析量/总解析量×100%。洗脱溶剂不同体积分数比较结果见表3。
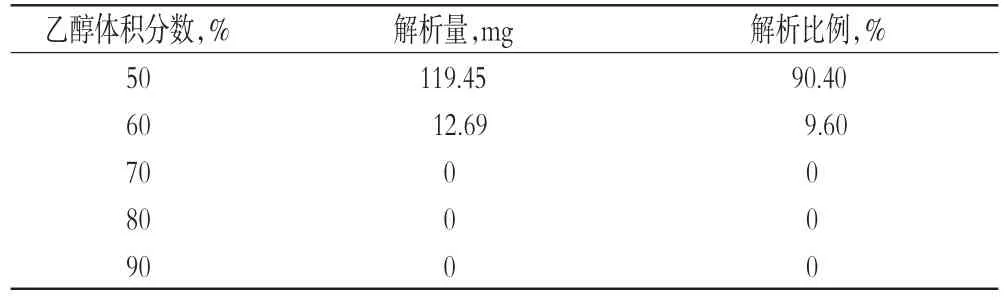
表3 洗脱溶剂不同体积分数比较Tab 3Comparison of different volume fraction of elution
由表3可知,天冬总皂苷主要集中在50%乙醇洗脱液中,占解析量的90.40%,60%乙醇洗脱后即达到完全洗脱,之后的洗脱液中无总皂苷检出,故确定60%乙醇溶液为洗脱溶剂。
2.2.8 洗脱溶剂用量考察称取HPD-300型大孔树脂4 g装柱,加入天冬提取液120 mL(0.1 g/mL)上柱静态吸附后,以3 BV/h的流速进行吸附。吸附完成后,先用水洗至近无色,再用60%乙醇6 BV以3 BV/h的流速洗脱,每1 BV收集1份。分别浓缩后用水溶解并定容至100 mL量瓶中,取10 mL,按“2.1”项下操作并测定总皂苷含量,计算解析量及解析比例,结果见表4。
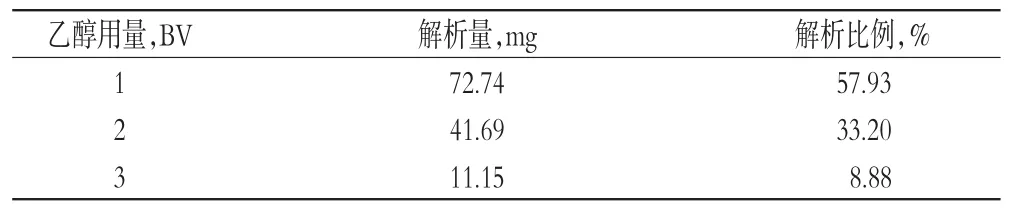
表4 洗脱溶剂不同用量比较Tab 4Comparison of different quantities of elution
4 5 6 0 0 0 0 0 0
由表4可知,60%乙醇洗脱用量达到3 BV时,即可将总皂苷完全洗脱下来,故确定洗脱溶剂用量为3 BV。2.2.9洗脱速度考察称取HPD-300型大孔树脂4 g装柱,共5份,加入天冬提取液静态吸附后,分别以1、2、3、4、5 BV/h的流速进行吸附。吸附结束后,先用水洗脱至近无色,再用60%乙醇3 BV以1、2、3、4、5 BV/h的速度洗脱。依次收集洗脱液,浓缩后用水溶解并定容至100 mL量瓶中,取10 mL,按“2.1”项下操作并测定总皂苷含量,计算解析量及解析率,结果见表5。
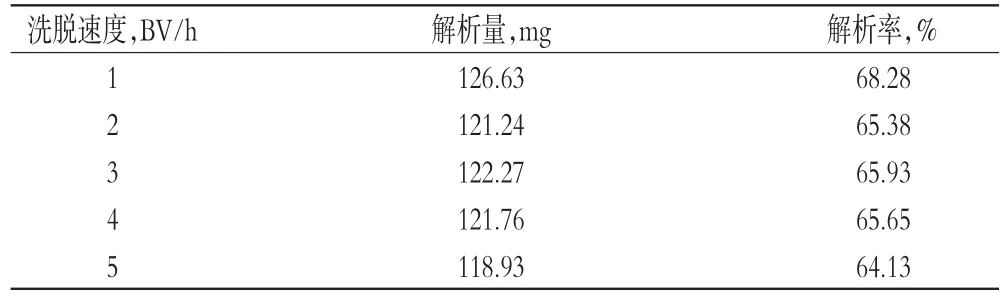
表5 溶剂不同洗脱速度比较Tab 5Comparison of different flow velocities of elution
由表5可知,洗脱速度越大,解析率越小,但2~4 BV/h洗脱速度之间的解析率变化不明显。因此,综合考虑速度及总皂苷的解析率,确定洗脱速度为4 BV/h。
2.2.10 工艺验证试验根据上述单因素试验结果,取HPD-300型大孔树脂4 g装柱,共3份,分别加入天冬提取液静态吸附后,以4 BV/h的流速进行吸附。吸附结束后,用水洗脱至近无色,再用60%乙醇3 BV洗脱。分别收集洗脱液,浓缩后用水溶解并定容至100 mL量瓶中,取10 mL,按“2.1”项下操作并测定总皂苷含量,计算解析量及解析率,结果见表6。
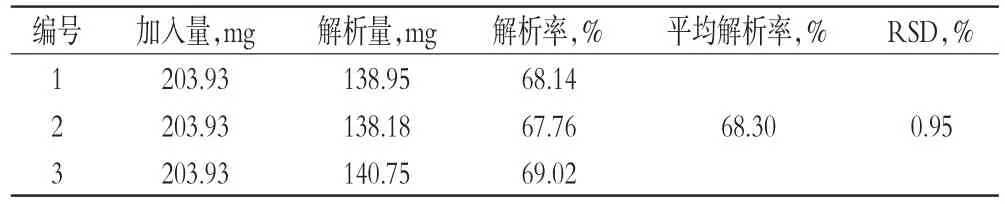
表6 纯化工艺验证结果Tab 6Validation test result of purification technology
由表6可知,60%乙醇洗脱液中总皂苷的平均解析率为68.30%(RSD=0.95%,n=3),说明该工艺有较好的分离纯化效果。
3 讨论
天冬药材由于含有多糖类成分,因此在粉碎成粗粉前,一定要充分的干燥,否则会增加粉碎的难度,甚至损坏机器;同时称量天冬粗粉时,速度要快,否则天冬药材易吸收水分降低测量的准确度;由于天冬中多糖含量较高、极性较大,故为了排除多糖的干扰,一定要在正丁醇萃取后,再用水进行反萃取,从而将皂苷与多糖类成分分离。大孔树脂在装柱时应尽量将气泡除去,以免柱子出现断层;加入供试液时,应缓缓加入,防止树脂冲起,影响分离效果。
目前采用大孔吸附树脂技术分离、纯化药材皂苷类等有效部位的研究较多[10-16]。本试验在参考文献的基础上,通过一系列工艺参数的优化研究,首次建立起大孔吸附树脂分离纯化天冬中总皂苷的工艺路线,其具体工艺参数为:上样质量浓度为0.1 g/mL,上样量15 BV,上样吸附时间60 min,上样及洗脱流速为4 BV/h,乙醇体积分数为60%,用量为3 BV。
综上,通过大孔树脂的吸附和解析试验及验证试验,优选所得的纯化工艺稳定、可行,可为天冬皂苷的纯化制备提供依据。
[1]林钰文.中药天冬研究进展[J].海峡药学,2008,20(6):90-93.
[2]李敏,费曜,王家葵.天冬药材药理实验研究[J].时珍国医国药,2005,16(7):580-582.
[3]万路平,刘亮,丁丽娜,等.正交试验法优选天冬渗漉提取工艺[J].中国民族民间医药,2016,25(2):19-20.
[4]杜芳权,颜继忠.超声提取天冬多糖和总皂苷工艺研究[J].科技资讯,2011,9(21):96-97.
[5]刘亮,丁丽娜,陈东林,等.天冬总皂苷的超声提取工艺优化[J].井冈山大学学报(自然科学版),2015,36(2):81-86.
[6]李春红,梅志强,田吉,等.大孔树脂对黄独总皂苷的分离纯化工艺优选[J].中国实验方剂学杂志,2012,18(16):27-29.
[7]兰艳素,李长江,潘乐.大孔树脂纯化广豆根总黄酮工艺的优化[J].中成药,2016,38(7):1644-1647.
[8]廖春燕,黄瑶,杨晓.AB-8大孔树脂纯化鸡骨草总皂苷的工艺研究[J].河南农业科学,2013,42(3):150-153.
[9]张若洁,徐永霞,王鲁峰,等.大孔树脂纯化芦笋总皂苷的工艺研究[J].中草药,2012,43(6):1097-1100.
[10]柏冬,王瑞海,李景远,等.大孔树脂纯化大蒜总皂苷的工艺优选[J].中国实验方剂学杂志,2013,19(12):4-7.
[11]林伟鑫,姚曦,李勇,等.三七总皂苷提取、大孔树脂纯化工艺研究[J].食品与药品,2015,17(3):156-161.
[12]蒋珍藕,邱宏聪,邓聿胤.藤三七总皂苷的大孔树脂纯化工艺优选[J].中国实验方剂学杂志,2014,20(2):26-29.
[13]刘艳平,丁越,张彤,等.知母皂苷BⅡ的提取及大孔树脂纯化工艺研究[J].中药材,2013,36(6):994-998.
[14]柳庆龙,李煌,林珠灿,等.星点设计-响应面法优化大孔树脂纯化藤茶总黄酮的工艺[J].中国药房,2016,27(7):942-945.
[15]郑淑霞,易骏,吴锦忠,等.大孔树脂纯化莲房总黄酮的工艺研究[J].中国药房,2015,26(31):4405-4408.
[16]李欠南,田丽萍,王金辉,等.大孔树脂分离纯化籽瓜总皂苷的工艺研究[J].食品工业,2015,36(8):146-149.
Study on the Purification Technology of Total Saponins from Asparagus cochinchinensis with Macroreticular Resin
LIU Liang1,DU Jiang2,FENG Hua3,DING Lina1,CHEN Donglin1,ZHOU Yingxin1(1.Zunyi Medical and Pharmaceutical College,Guizhou Zunyi 563006,China;2.School of Pharmacy,Guiyang College of TCM,Guiyang 550002,China;3.Office of TCM,Zunyi Institute for Food&Drug Control,Guizhou Zunyi 563000,China)
OBJECTIVE:To optimize the purification technology of total saponins from Asparagus cochinchinensis with macroreticular resin.METHODS:Using content of total saponins from A.cochinchinensis as index,single factor test was used to investigate the macroreticular resin model,sampling adsorption time,mass concentration of the column,adsorption capacity,volume fraction and the amount of elution solvent,elution rate,and optimize the purification technology.And verification test was conducted.RESULTS:HPD-300 macroreticular resin showed strong absorption and desorption property.The optimal purification technology was that sampling adsorption time was 60 min,mass concentration of sample liquid was 0.1 g/mL,adsorption capacity was 120 mL(15 BV),it was eluded with 60%ethanol solution with 3 BV and elution rate was 4 BV/h.In the verification test,the average desorption rate of total saponins was 68.30%(RSD=0.95%,n=3).CONCLUSIONS:Optimized purification technology is stable,feasible,and can easily separate and purify the total saponins from A.cochinchinensis.
Asparagus cochinchinensis;Total saponins;Macroreticular resin;Purification technology
R284.2
A
1001-0408(2017)34-4868-04
DOI10.6039/j.issn.1001-0408.2017.34.30
遵义市科技计划课题(No.遵市科合社字〔2013〕24号)
*硕士。研究方向:中药、民族药化学成分及质量标准。E-mail:jikman1@163.com
2017-04-14
2017-09-27)
(编辑:刘明伟)
