盐酸鲁拉西酮固体分散体的制备、表征及体外溶出行为研究
2017-12-19赵海涛宋光西殷学治吴沉王兵常州制药厂有限公司江苏常州213018
赵海涛,宋光西,殷学治,吴沉,王兵(常州制药厂有限公司,江苏常州213018)
盐酸鲁拉西酮固体分散体的制备、表征及体外溶出行为研究
赵海涛*,宋光西,殷学治,吴沉,王兵(常州制药厂有限公司,江苏常州213018)
目的:制备盐酸鲁拉西酮固体分散体,提高其溶出度。方法:选用聚维酮K30为载体,以溶剂法制备不同药载比(1∶0.5、1∶1、1∶2)的盐酸鲁拉西酮固体分散体。比较3种盐酸鲁拉西酮固体分散体与物理混合物(盐酸鲁拉西酮-聚维酮K30)、原研制剂的体外溶出度;采用X射线粉末衍射法对盐酸鲁拉西酮原料药、聚维酮K30与外加辅料、物理混合物(1∶2)与外加辅料、盐酸鲁拉西酮固体分散体(1∶2)与外加辅料的晶体结构进行分析。结果:药载比1∶0.5、1∶1、1∶2的盐酸鲁拉西酮固体分散体溶出速率较物理混合物有显著提高,且载体比例越大,固体分散体溶出越快;药载比为1∶2的盐酸鲁拉西酮固体分散体与原研制剂20 min时体外溶出度分别为101.2%、100.2%。X射线粉末衍射结果显示,物理混合物中存在盐酸鲁拉西酮和辅料的特征吸收峰;盐酸鲁拉西酮固体分散体中的盐酸鲁拉西酮特征吸收峰基本消失,辅料特征吸收峰仍存在。结论:以药载比1∶2制得的盐酸鲁拉西酮固体分散体与原研制剂体外溶出行为相似,且其中盐酸鲁拉西酮以无定形存在。
盐酸鲁拉西酮;固体分散体;聚维酮K30;溶出度
盐酸鲁拉西酮是一种非典型抗精神病药,其治疗精神分裂症的机制类似其他非典型抗精神病药,可能与多巴胺D2和5-羟色胺2a受体的拮抗有关[1]。与传统抗精神病药比较,非典型抗精神病药具有疗效更好、能产生较少锥体外系副作用、基本不发生迟发性运动障碍的优点。也有研究报道,盐酸鲁拉西酮可以改善认知功能[2]。盐酸鲁拉西酮片(Latuda®)由日本Sunovion Pharmaceuticals Inc生产,于2010年10月被美国FDA批准上市。
盐酸鲁拉西酮在生物药剂学分类系统(BCS)属于Ⅳ类[3],为低溶解性、低渗透性药物。一般难溶性药物的口服生物利用度较低,提高药物溶出度是改善其生物利用度的有效途径。固体分散体(Solid dispersion)技术是将难溶性药物分散于适宜载体中形成固体分散物,药物以分子、无定形或微晶状态分散存在,可增加药物溶解度、抑制药物晶体形成、保证药物高度分散性和润湿性等,利于提高药物溶出度[4]。有研究报道,将硝苯地平、齐拉西酮、头孢地尼、非诺贝特等难溶性药物制备成固体分散体均显著提高了药物的溶出度[5-8]。本研究选用聚维酮K30为载体材料,以溶剂法制备不同药载比的盐酸鲁拉西酮固体分散体;采用高效液相色谱(HPLC)法,以溶出度为指标筛选最优药载比,同时对最优药载比所制盐酸鲁拉西酮固体分散体进行表征。
1 材料
1.1 仪器
Empyrean型X射线粉末衍射仪(荷兰PNalytical公司);WSG3型流化床制粒机(德国Glatt公司);ZP-19型旋转式压片机(上海第一制药机械厂);RCZ-8M型智能溶出仪(天津天大天发科技有限公司);e2695型HPLC仪(美国Waters公司)。
1.2 药品与试剂
盐酸鲁拉西酮原料药及对照品(常州制药厂有限公司,批号:150922、060-155,纯度:99.6%、99.8%);甘露醇(德国Merck公司,批号:M774694);交联羧甲基纤维素钠(美国FMC公司,批号:TN14827751);聚维酮K30(美国ISP公司,批号:0001895574);胶态二氧化硅(德国Degussa AG公司,批号:154102814);硬脂酸镁(湖州展望药业有限公司,批号:20150803);盐酸鲁拉西酮片(原研制剂,商品名:Latuda®,日本Sunovion Pharmaceuticals Inc,批号:M0543630P,规格:每片40 mg);甲醇为色谱纯,其余试剂均为分析纯,水为蒸馏水。
2 方法与结果
2.1 样品的制备
2.1.1 盐酸鲁拉西酮固体分散体以聚维酮K30为载体材料,采用溶剂法制备盐酸鲁拉西酮固体分散体。按药载比(m/m)为1∶0.5、1∶1、1∶2分别称取盐酸鲁拉西酮原料药40 mg和聚维酮K30 20、40、80 mg,分别置于烧杯中,加入1 000 mL无水乙醇,振摇,超声(功率:240 W)30 min后使完全溶解。使用WSG3型流化床制粒机,设定流化床制粒机进风温度为85℃,将上述溶液喷雾干燥,完毕后在流化床制粒机内壁收集物料,过40目不锈钢筛网,得盐酸鲁拉西酮固体分散体。分别外加甘露醇(102、82、42 mg)、交联羧甲基纤维素钠(4.8、4.8、4.8 mg)、胶态二氧化硅(1.6、1.6、1.6 mg)、硬脂酸镁(1.6、1.6、1.6 mg),使用ZP-19型旋转式压片机压片,控制片质量为170 mg、硬度为60~80 N,片子备用。盐酸鲁拉西酮固体分散片的处方组成见表1。
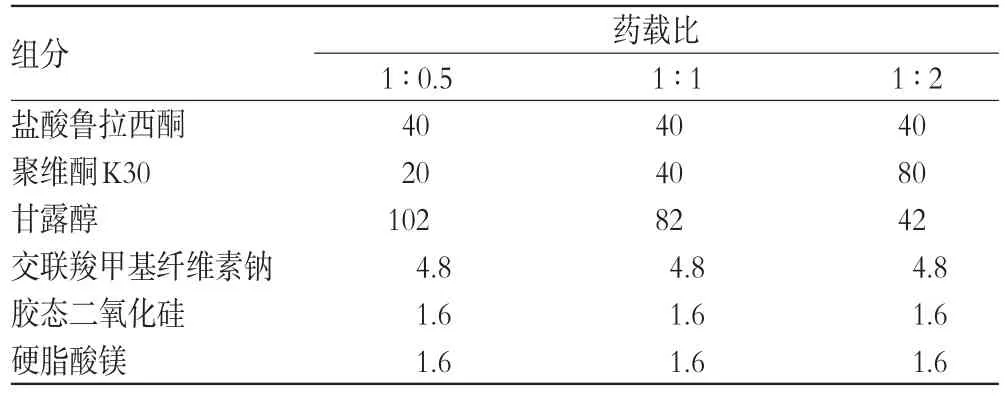
表1 盐酸鲁拉西酮固体分散片的处方组成(mg)Tab 1Formulation of Lurasidone hydrochloride solid dispersible tablets(mg)
2.1.2 盐酸鲁拉西酮物理混合物按表1中药载比1∶2的处方量称取原辅料,置于塑料袋中,密封,手工混合均匀,使用ZP-19型旋转式压片机压片,控制片质量为170 mg、硬度为60~80 N,片子备用。
2.2 盐酸鲁拉西酮分析方法的建立
2.2.1 色谱条件采用HPLC法测定盐酸鲁拉西酮的含量。色谱柱:Dikma C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.06%三氟乙酸溶液(60∶40,V/V);流速:1.0 mL/min;柱温:30℃;检测波长:230 nm;进样量:10 μL。2.2.2系统适用性试验精密称取盐酸鲁拉西酮固体分散体(约相当于盐酸鲁拉西酮25 mg)及盐酸鲁拉西酮对照品25 mg,分别置于50 mL量瓶中,加甲醇溶液30 mL,超声(功率:240 W)15 min,放冷,用甲醇-水(60∶40,V/V,下同)稀释至刻度,摇匀,过滤。取续滤液1 mL至10 mL量瓶中,用甲醇-水稀释至刻度,摇匀,分别作为供试品溶液和对照品溶液。另取不含盐酸鲁拉西酮的空白辅料,用甲醇-水溶解稀释制成溶液,过滤,取续滤液作为空白对照。按“2.2.1”项下色谱条件进样测定,记录色谱。结果显示,盐酸鲁拉西酮与溶剂峰分离良好,理论板数按盐酸鲁拉西酮峰计不低于3 000,空白辅料对盐酸鲁拉西酮峰测定无干扰。
2.2.3 线性关系考察精密称定盐酸鲁拉西酮对照品25 mg,置于50 mL量瓶中,加入甲醇溶解并稀释至刻度,摇匀,制得贮备液。分别吸取上述贮备液1.0、1.5、2.0、2.5、3.0、3.5 mL,置于25 mL量瓶中,加甲醇稀释至刻度,摇匀,按“2.2.1”项下色谱条件进样测定,记录峰面积。以盐酸鲁拉西酮质量浓度为横坐标(x)、峰面积为纵坐标(y)进行线性回归,得回归方程为y=117 341 489x+46 143(r=0.999 9)。结果表明,盐酸鲁拉西酮质量浓度在0.02~0.07 mg/mL范围内与峰面积呈良好的线性关系。其检测限为0.016µg/mL(信噪比为3),定量限为0.064µg/mL(信噪比为10)。
2.2.4 准确度考察按表1中药载比1∶2的处方量,分别制备20%、80%、100%、120%4个不同浓度的溶液,每个浓度平行3份,共计12份,测定盐酸鲁拉西酮的含量,计算平均回收率。结果显示,20%、80%、100%、120%浓度溶液的平均回收率分别为101.5%、100.2%、100.4%、100.7%,RSD分别为0.7%、0.6%、0.3%、0.9%(n=3),RSD均小于2%。
2.2.5 精密度试验制备6份质量浓度为0.05 mg/mL的供试品溶液,按“2.2.1”项下色谱条件进样测定,记录峰面积,考察精密度。结果显示,峰面积的RSD为0.5%(n=6)。
2.2.6 稳定性试验制备质量浓度为0.05 mg/mL的供试品溶液,分别放置0、8、40 h,按“2.2.1”项下色谱条件进样测定,记录峰面积,按外标法计算含量。结果显示,含量的RSD为0.1%(n=3),表明供试品溶液在40 h内稳定性良好。
2.3 溶出度试验
参照美国FDA溶出曲线方法(FDA dissolution method)[9],采用桨板法检测“2.1”项下所制不同药载比的盐酸鲁拉西酮固体分散体、盐酸鲁拉西酮物理混合物(药载比1∶2)和原研制剂的体外溶出度。设定转速为50 r/min,溶出介质为pH 3.8的麦氏缓冲溶液900 mL,取样时间为5、10、15、20、30、45 min,取样量为10 mL,取样同时补加同温、等量溶出介质。溶出液经0.45µm微孔滤膜过滤,取续滤液,按“2.2.1”项下色谱条件进样测定,记录峰面积,按外标法计算含量并绘制溶出曲线。结果,盐酸鲁拉西酮固体分散体(1∶0.5、1∶1、1∶2)20 min累积溶出度分别为89.3%、93.5%、101.2%,而盐酸鲁拉西酮物理混合物20 min累积溶出度只有75.8%,原研制剂20 min累积溶出度为100.2%。结果显示,药载比1∶2的盐酸鲁拉西酮固体分散体与原研制剂的累积溶出度最接近。3种盐酸鲁拉西酮固体分散体、物理混合物和原研制剂的体外溶出曲线见图1。
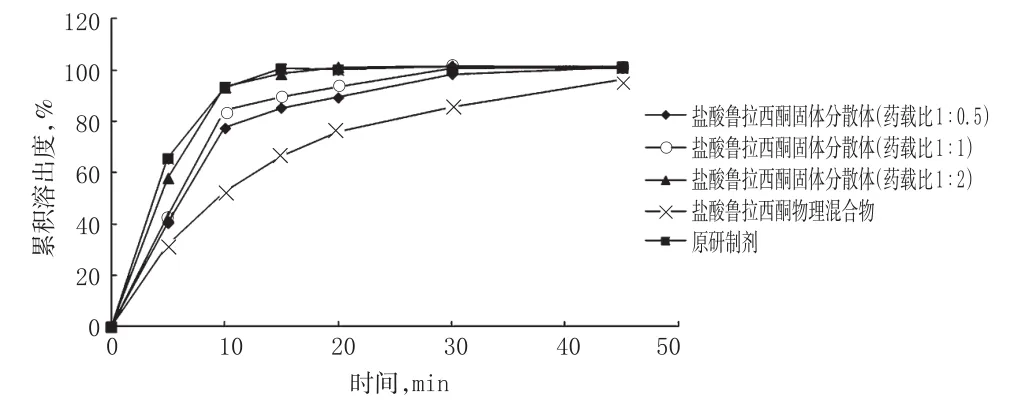
图13 种盐酸鲁拉西酮固体分散体、物理混合物和原研制剂的体外溶出曲线Fig 1The in vitro dissolution curves of 3 kinds of lurasidone hydrochloride solid dispersion,physical mixture and original preparation
2.4 X射线衍射分析
使用X射线粉末衍射仪,分别对盐酸鲁拉西酮原料药、聚维酮K30与外加辅料、盐酸鲁拉西酮物理混合物(药载比1∶2)和盐酸鲁拉西酮固体分散体(药载比1∶2)进行分析。X射线粉末衍射图见图2。
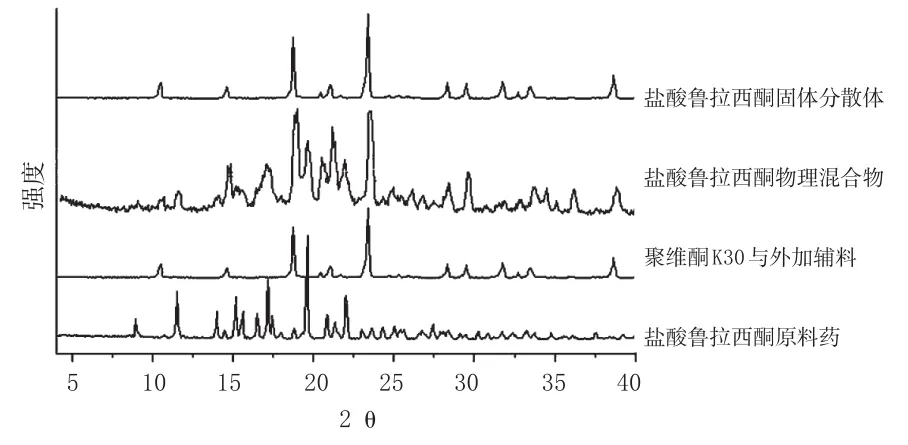
图2 X射线粉末衍射图Fig 2X-ray power diffraction pattern
从图2可见,盐酸鲁拉西酮原料药的晶体衍射峰明显,特征吸收峰2θ分别为8.8°、11.4°、13.9°、15.1°、15.6°、16.5°、17.1°、19.5°、20.8°、22.0°、27.3°;聚维酮K30与外加辅料的特征吸收峰2θ分别为10.5°、14.7°、18.7°、20.4°、21.0°、23.4°、28.3°、29.6°、31.8°、33.4°、38.6°;在盐酸鲁拉西酮物理混合物的图谱中可看到盐酸鲁拉西酮的特征吸收峰仍存在,说明盐酸鲁拉西酮仍以晶体形式存在;而盐酸鲁拉西酮固体分散体的图谱中盐酸鲁拉西酮的特征吸收峰基本消失,只有辅料特征吸收峰还存在,表明在盐酸鲁拉西酮固体分散体中,盐酸鲁拉西酮是以无定形存在,失去了原有的晶体结构,高度分散在载体中。溶出度试验结果也表明,将盐酸鲁拉西酮制备成固体分散体后,能显著提高其溶出度。
3 讨论
本研究采用固体分散体技术,提高盐酸鲁拉西酮溶出度,进而提高其生物利用度。所以将难溶性药物制备成口服固体制剂时,可以考虑选择固体分散体技术。
聚维酮是合成聚合物,主要由线型1-乙烯基-2-吡咯烷酮基团组成,不同的聚合度导致聚合物不同的分子量[10]。聚维酮K30是最常用型号,在固体制剂中,常被用作黏合剂。但由于聚维酮K30是高分子亲水性物质,所以近年来其常被用作固体分散体载体来研究。
盐酸鲁拉西酮片原研厂家是日本住友制药株式会社,日本住友制药株式会社已经在全球范围布局专利保护,在中国授权专利CN101184489B、CN102048734B,权利要求书中独立权利要求保护原料药粒径、预胶化淀粉等关键辅料。而本研究成功地避开了独立权利要求书中要保护的内容,通过固体分散体技术制备成片剂,且所制片剂溶出行为与原研制剂基本一致。
[1]Citrome L.Lurasidone for schizophrenia:a brief review of a new second-generation antipsychotic[J].Clinical Schizophrenia&Related Psychoses,2011,4(4):251-257.
[2]Meyer JM,Loebel AD,Schweizer E.Lurasidone:anewdrugindevelopmentforschizophrenia[J].Expert Opin Investig Drugs,2009,18(11):1715-1726.
[3]European Medicines Agency.Assessment report[EB/OL].(2014-04-08)[2017-01-22].http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002713/WC500164684.pdf.
[4]刘善峰,徐爱霞,李叶桓,等.氟比洛芬聚丙烯酸树脂RL/RS固体分散体的制备[J].药学研究,2014,33(3):155-157.
[5]黄好武,罗玉鸿,梁飞华.硝苯地平固体分散体制备工艺的研究[J].今日药学,2011,21(1):20-24.
[6]苗燕飞,陈国广,任丽莉.盐酸齐拉西酮固体分散体的制备及其溶出度测定[J].中国医院药学杂志,2014,34(1):38-41.
[7]郭波红,陈毅华,晋晨晨.头孢地尼泊洛沙姆188固体分散体的制备及表征[J].广东药学院学报,2014,30(3):261-264.
[8]张晶晶,王少平.熔融法制备非诺贝特固体分散体及体外溶出研究[J].药学与临床研究,2014,22(2):109-111.
[9]U.S.Food and Drug Administration.Dissolution methods[EB/OL].(2013-01-31)[2017-01-22].https://www.accessdata.fda.gov/scripts/cder/dissolution/dsp_SearchResu-lts.cfm.
[10]R.C.罗,P.J.舍斯基,P.J.韦勒.药用辅料手册[M].北京:化学工业出版社,2005:584-589.
Preparation and Characterization of Lurasidone Hydrochloride Solid Dispersion and Study on the in vitro Dissolution Behavior
ZHAO Haitao,SONG Guangxi,YIN Xuezhi,WU Chen,WANG Bing(Changzhou Pharmaceutical Factory Co.Ltd.,Jiangsu Changzhou 213018,China)
OBJECTIVE:To prepare the lurasidone hydrochloride solid dispersion,and improve its dissolution rate.METHODS:Taking povidone K30 as the carrier,solvent method was used to prepare the lurasidone hydrochloride solid dispersion with different drug-load ratios(1∶0.5,1∶1,1∶2).The in vitro dissolution rates of 3 kinds of lurasidone hydrochloride solid dispersion with physical mixture(lurasidone hydrochloride-povidone K30)and original preparation were compared.X-ray powder diffraction method was adopted to analyze the crystal structures of raw material of lurasidone hydrochloride,povidone K30 and accessories,physical mixture(1∶2)and accessories,and lurasidone hydrochloride solid dispersion(1∶2)and accessories.RESULTS:Compared with physical mixture,the dissolution rate of lurasidone hydrochloride solid dispersion with drug-load ratios of 1∶0.5,1∶1,1∶2 was significantly improved,and the dissolution rate of solid dispersion was increased as the increase of the carrier ratio.The in vitro dissolution rates of lurasidone hydrochloride solid dispersion with drug-load ratio of 1∶2 and original preparation were respectively 101.2%and 100.2%in 20 min.X-ray powder diffraction showed,there were characteristic absorption peaks of lurasidone hydrochloride and accessories in physical mixture;the characteristic absorption peak of lurasidone hydrochloride in solid dispersion disappeared basically,and the characteristic absorption peak of accessories still existed.CONCLUSIONS:The in vitro dissolution of lurasidone hydrochloride solid dispersion with drug-load ratio of 1∶2 is similar to original preparation,and lurasidone hydrochloride exists in the solid dispersion as amorphous form.
Lurasidone hydrochloride;Solid dispersion;Povidone K30;Dissolution rate
R943
A
1001-0408(2017)34-4876-03
DOI10.6039/j.issn.1001-0408.2017.34.32
*工程师。研究方向:新药与仿制药开发。电话:0519-88251312。E-mail:tao02411@163.com
2017-06-11
2017-08-25)
(编辑:邹丽娟)
