Pd/γ-Al2O3催化剂催化氧化邻-二甲苯
2017-12-18胡凌霄张长斌
胡凌霄 王 莲 王 飞 张长斌* 贺 泓,3,*
Pd/-Al2O3催化剂催化氧化邻-二甲苯
胡凌霄1,2王 莲1,2王 飞1,2张长斌1,2*贺 泓1,2,3,*
(1中国科学院生态环境研究中心,环境模拟与污染控制国家重点联合实验室,北京 100085;2中国科学院大学,北京 100049;3中国科学院城市环境研究所,福建厦门 361021)
利用纳米-Al2O3(10 nm)和普通-Al2O3(200-300 nm),采用浸渍法制备了1% () Pd/-Al2O3催化剂,考察了其催化氧化邻-二甲苯的性能以及催化剂的活性在氢气还原前后的区别。实验结果发现1% () Pd/-Al2O3(nano)在H2还原后催化氧化邻-二甲苯的活性最高,90为150 ℃。利用X射线衍射(XRD)、比表面积(BET)、透射电镜(TEM)、X射线光电子能谱(XPS)等表征手段,研究了1%()Pd/-Al2O3催化剂物性结构与催化性能之间的构效关系。结果表明,还原态Pd是H2还原后催化剂催化氧化邻-二甲苯的活性物种;Pd的颗粒大小与催化剂活性有显著的关系,小粒径有利于催化剂活性提高;纳米-Al2O3载体与Pd之间的相互作用强,有利于Pd的粒径控制和分散,从而提高1% () Pd/-Al2O3(nano)催化剂的活性。
-Al2O3;贵金属催化剂;催化氧化;邻-二甲苯
1 引言
挥发性有机物(VOCs)是大气污染物的重要成分之一,对环境和人体健康具有严重危害1,因此有效消除VOCs污染具有重要的环境意义。其中,苯系物(苯、甲苯、二甲苯)是一类典型的VOCs。随着人们对环境问题的日益重视,VOCs的排放控制和苯系物的催化净化研究引起广泛的关注。
在众多消除VOCs的方法中,催化氧化法是最具实用前景的控制技术2,它具有净化效率高、适用范围广、能源消耗低、二次污染少的优点。而贵金属催化剂因其起燃温度低、净化效率高、使用寿命长等特性,是目前最常用的苯系物催化氧化剂3−6。其中,贵金属Pd由于具有较好的低温活性和选择性,是常用的催化剂活性组分之一7。在贵金属催化剂体系中,大多选择热稳定性好、比表面积大的材料作为载体,如活性炭、氧化铝、CeO2、TiO2等8−11。其中,Al2O3有较高的比表面积和多孔性,结构稳定、不溶于水,所以研究较多。
重要的是,何种价态的Pd为活性中心的问题仍存在争议。目前的一些研究结果表明,相对于氧化态的Pd,还原态的Pd表现出更高的低温催化氧化苯系物的活性9,11−13,Sam14和Wang15,16等研究了Pd/-Al2O3催化剂催化氧化邻-二甲苯的性能。研究发现,1% () Pd/-Al2O3催化剂经过氢气预处理后,邻-二甲苯的完全转化温度降低了10 °C,XPS分析表明,氢气预处理后催化剂中形成了金属态的Pd,即在VOCs的完全氧化中,相比氧化态的Pd,金属态的Pd具有更高的活性。Nahm等17研究发现H2预处理不但增强了甲苯在Pd/Al2O3催化剂上的吸附,同时还提高了甲苯的转化率,这表明金属态的Pd物种对催化氧化甲苯有更高反应活性。另一些研究结果表明PdO物种是催化反应的活性中心5,18−20,肖小燕等20采用共沉淀法制备了一系列不同Pd含量的PdO-CeO2催化剂,并测试了催化剂的CO氧化反应的活性,发现PdO物种的氧化活性高于金属态Pd物种的活性。还有学者认为Pd0和PdO物种同时存在才具有最好的催化活性11,Padilla等21考察了CeO2的添加对Pd/Al2O3催化剂催化氧化苯的性能影响。研究结果表明,CeO2能够提供氧源,利于催化剂表面保持Pd0和PdO物种同时存在,从而促进苯的催化氧化。除了Pd的价态,Pd的颗粒尺寸也是影响催化剂催化氧化活性的因素。Kim等10的研究表明,催化剂的催化活性与活性组分的颗粒尺寸有关。Ferrer等9发现当添加20% () V2O5时,催化剂的催化活性依赖于Pd物种的颗粒尺寸大小。
本文选用邻-二甲苯为研究对象,比较了利用普通-Al2O3制备的1% () Pd/-Al2O3(usual)和纳米-Al2O3制备的1% ()Pd/-Al2O3(nano)催化剂催化氧化邻-二甲苯的反应活性,通过XRD、BET、TEM、XPS等表征手段,研究催化剂物性结构与活性之间的关系,探讨了引起活性差异的原因。
2 实验部分
2.1 实验试剂
实验所需的试剂:普通-Al2O3(SIGMA-ALDRICH, MSDS:199974),纳米-Al2O3(阿拉丁,99.9%),二水合硝酸钯(阿拉丁,分析纯);其余试剂均为分析纯,本实验所用的水均为去离子水。
2.2 催化剂制备
负载的贵金属催化剂均采用浸渍法制备,贵金属含量均为1% ()。分别购买普通-Al2O3和纳米-Al2O3载体,将Pd(NO3)2∙2H2O溶解后加入载体悬浊液中,室温搅拌1 h,旋蒸并在100 °C条件下干燥过夜,550 °C焙烧2 h;预处理在30 mL∙min−1的H2气氛中进行,处理温度为300 °C,时间为2 h,考察Pd物种的存在状态对催化剂活性的影响。
2.3 催化剂表征
催化剂的物性分析(XRD)在荷兰的PANalytical XPert Pro型X射线衍射仪上进行测定。在管电压40 kV和管电流40 mA条件下,采用Cu射线,= 0.15406 nm,在5°−40°范围内进行扫描,扫描步长为0.02°。
催化剂的Brunauer-Emmett-Teller(BET)比表面积及孔结构在美国康塔(Quantachrome)公司的Autosorb-1C仪器上进行测定。吸附质为N2,测定温度为−196 °C。测定前样品先预处理,从室温以10 °C·min−1的速率升至70 °C,保持30 min;以10 °C·min−1的速率升至120 °C,保持30 min;以10 °C·min−1的速率升至300 °C,保持300 min,完成预处理后降至室温。样品的比表面积用BET方程求得,用Barrett-Joyner-Halenda(BJH)模型测得样品的中孔结构,用t-模型测得样品的微孔结构。
催化剂的透射电镜(TEM)在日本JEOL JEM 2010型透射电子显微镜上测定,加速电压为200 kV。
催化剂的X射线光电子能谱(XPS)在日本Shimadzu公司的ESCA-3400 XPS系统上进行,激发光源为单色化的Mg射线(1253.6 eV),工作电压和电流分别为10 kV和15 mA。
催化剂的分散度由氢氧滴定方法测定。具体实验步骤如下:将100 mg新鲜样品在21% O2/N2气氛下500 °C处理30 min,降至室温后用Ar气吹扫10 min,接着切换到10% H2/Ar 在300 °C处理2 h,降至120 °C后切换到Ar吹扫30 min,再用21% O2/N2处理40 min,Ar吹扫40 min;通过脉冲方式将10% H2/Ar注入至信号不再变化;通过催化剂表面的H2消耗量计算金属再载体上的分散度。
2.4 催化剂活性评价
催化剂的活性评价在常压流通固定床反应器中进行。反应条件:[o-xylene] = 150 × 10-6,20% O2为反应气,80% N2为平衡气和吹扫气。气体总流量为100 mL∙min−1,催化剂用量为100 mg (40−60目),WHSV约为60000 mL∙g−1∙h−1。采用一台气相色谱(安捷伦6890N,HP-5MS毛细管柱,30 m × 0.25 mm × 0.25 µm)对邻二甲苯含量进行检测,另一台气相色谱(上海分析仪器厂GC-112A碳分子筛填充柱)对含碳产物进行检测。
3 结果与讨论
3.1 催化剂活性
3.1.1 普通氧化铝载体、纳米氧化铝载体及氢气预处理的影响
图1为氢气还原前后,氧化铝为载体的Pd基催化剂催化氧化邻-二甲苯的转化率及与二氧化碳选择性随反应温度的变化曲线。从图1可以看出,氢气还原前,在空速为60000 mL∙g−1∙h−1时,两种Pd/-Al2O3催化剂催化性能基本一致,90(邻-二甲苯转化率达到90%所需的温度)都约为210 °C,二氧化碳选择性在99%以上。对于负载型的贵金属催化剂,氢气预处理对催化剂的性能往往有较大的影响。因此,将催化剂在氢气气氛中300 °C预处理2 h。经过H2预处理,两种-Al2O3载体的催化剂活性均有不同程度提升。其中纳米氧化铝作为载体的催化剂表现出更高的活性,90低于155 °C,而1% () Pd/-Al2O3(usual)的90为180 °C,表明氢气还原后纳米氧化铝作为载体的催化剂活性提高幅度大。另外,反应的CO2选择性都在99%以上。根据以上实验结果,推测还原态的Pd是Pd/-Al2O3催化剂催化氧化邻-二甲苯的活性物种。

(a) Catalytic activity of o-xylene oxidation of Pd/-Al2O3catalyst before and after hydrogen reduction; (b) Carbon dioxide selectivity of Pd/-Al2O3catalyst before and after hydrogen reduction. The catalyst was pretreated under H2atmosphere at 300 °C for 2 h, [o-xylene] = 150 × 106, 20% O2as reaction gas, 80% N2as balance gas, total gas flow 100 mL∙min−1weight hourly space velocity (WHSV) =60000 mL∙g−1∙h−1.
3.1.2 耐久性测试
在150 °C下,Pd/-Al2O3(nano)催化剂的活性随时间的变化如图2所示。在连续100 h的反应测试中,该催化剂上邻-二甲苯的转化率和CO2选择性均没有明显降低。反应中未检测到CO或有机小分子化合物,CO2和H2O是该反应中仅有的产物,反应中的邻-二甲苯转化率达到90%,碳平衡可达到(100 ± 5)%。这些结果说明Pd/-Al2O3(nano)催化剂的催化活性持久,具有较长的寿命。
3.2 催化剂表征
3.2.1 载体及催化剂的物理性质
载体的比表面积、孔结构以及孔分布往往对催化剂的活性有很大影响22。表1为空白载体、负载Pd的催化剂以及氢气还原以后的催化剂的比表面积、孔径以及孔容。从表1可以看出,普通氧化铝载体、纳米氧化铝载体以及负载Pd的催化剂,其比表面积(BET理论)接近,孔体积和孔径差别较大。

图2 H2还原后,1% (w) Pd/γ-Al2O3 (nano)催化剂催化氧化邻-二甲苯活性和CO2转化率随时间变化的曲线
The catalyst was pretreated under H2atmosphere at 300 °C for 2 h, [o-xylene] = 150 × 106, 20% O2as reaction gas, 80% N2as balance gas, total gas flow 100 mL∙min−1, WHSV = 60,000 mL∙g−1∙h−1.
从BET数据中没有看出孔容、孔径等对催化剂活性影响的规律,认为比表面积、孔径不是影响Pd/-Al2O3催化剂活性的主要因素。
载体及Pd/-Al2O3催化剂的吸附、脱附等温线和孔径分布如图3和图4所示。从图3看出,纳米氧化铝的N2-sorption曲线回滞环属于H3型,认为是片状粒子堆积形成的狭缝孔。图4也表明,纳米氧化铝材料除了微孔、介孔,还存在大量堆积孔。负载金属后,Pd/-Al2O3(nano)堆积孔平均孔径减小,可能是部分堆积孔被贵金属Pd覆盖,从而使平均孔径减小。普通氧化铝中,N2-sorption曲线在相对压力(/0)为0.45−0.95之间有明显上升,说明样品中存在着大量介孔。普通氧化铝负载贵金属Pd后,孔径增大,猜测是负载金属后,金属颗粒覆盖了一些普通氧化铝载体表面较小的孔,使得平均孔径增大。
3.2.2 催化剂的晶相结构
为了验证3.1.1节中提出金属态的Pd是活性组分,分别对未预处理和H2气氛下300 °C预处理的样品进行XRD表征,结果如图5所示。
由图5可知,2= 37.7°, 45.9°, 66.9°处的衍射峰为-Al2O3(PDF 79-1558)的特征峰,2= 33.5°, 33.8°, 54.7°处的衍射峰为PdO的晶相峰(PDF 41-1107),2= 40.2°, 46.8°, 68.3°处的衍射峰为金属Pd的特征峰(PDF 87-0639)。可以看出,无论经过H2还原还是未经还原,其XRD图谱中均出现了金属Pd。H2还原前,普通-Al2O3和纳米-Al2O3为载体的催化剂中的PdO衍射峰明显,而Pd的衍射峰非常弱,说明Pd大多以PdO形式存在。H2还原后,两种催化剂中还原态Pd的衍射峰强都明显增加,且PdO的衍射峰基本消失。说明H2预处理后,催化剂表明的Pd物种被还原为金属态Pd。结合催化剂活性数据,认为H2预处理使催化剂表面的PdO还原为Pd,催化剂活性明显上提高,还原态Pd是H2还原后Pd/-Al2O3催化剂催化氧化邻-二甲苯的活性组分。
相比H2还原后的Pd/-Al2O3(usual),还原后的Pd/-Al2O3(nano)中还原态Pd衍射峰强度弱、结晶度差,说明Pd在纳米-Al2O3上的分散度高于普通-Al2O3。结合活性数据,两种催化剂在H2还原后活性提高程度不同,推测催化剂的活性还与Pd的粒径和分散度有关。
3.2.3 催化剂的表面组成
为了进一步验证3.1.1节以及3.2.2节中提出金属态的Pd是Pd/-Al2O3催化剂催化氧化邻-二甲苯的活性组分,分别对未预处理和H2气氛下300 °C预处理的样品进行XPS表征,结果如图6所示。

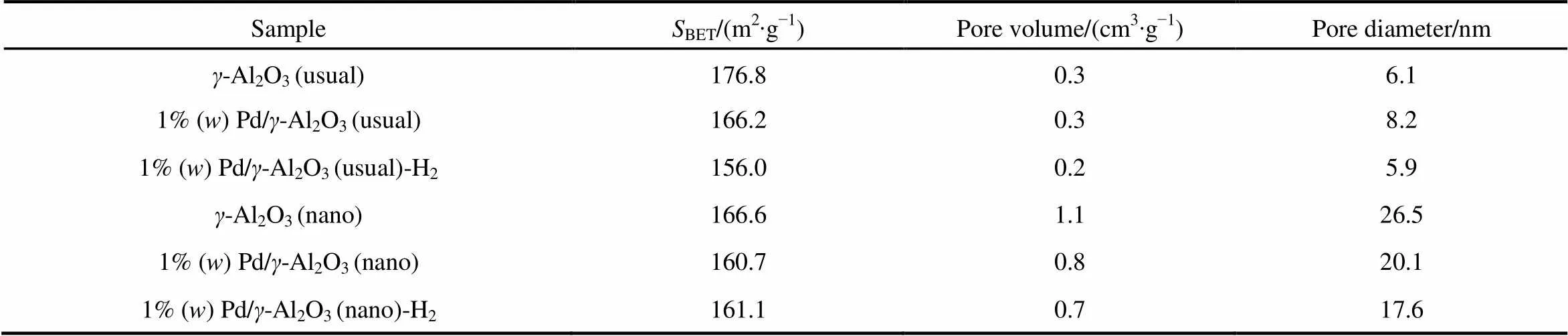
表1 载体及催化剂的比表面积(SBET)、孔容和孔径

图3 载体及Pd/γ-Al2O3催化剂的吸附、脱附等温线

图4 载体及Pd/γ-Al2O3催化剂的孔径分布

图5 不同预处理的1% (w) Pd/γ-Al2O3催化剂的XRD图谱
在还原后的催化剂中,XPS测试结果表明催化剂中含有少量PdO,可能是由于XPS不是原位表征,催化剂在测量前或测量中被氧化。
3.2.4 催化剂中Pd颗粒粒径及分布
Pd的粒径是影响还原后催化剂活性的重要因素。为了证明3.2.2节中的猜测,催化剂的活性除了与Pd的氧化还原状态有关,还与Pd的粒径和分散度有关,分别对未预处理和H2气氛下300 °C预处理的样品进行TEM表征,结果如图7所示。
从图7中可以得到,氢气还原后,Pd/-Al2O3(nano)催化剂中Pd的平均粒径(3.8 nm)较小,且颗粒大小较均匀。普通-Al2O3上Pd颗粒大小不均,存在大量大颗粒的Pd,同时也存在一些从TEM图像上较难分辨的细小颗粒,统计Pd的平均粒径约11.3 nm。由于还原后的1% () Pd/-Al2O3(nano)活性大大提高,说明当Pd为金属态存在时,小颗粒的Pd具有更好的活性。
为了进一步验证不同氧化铝催化剂表面Pd颗粒粒径的差异,同时采用氢氧滴定法测定了催化剂表面贵金属Pd的分散度,计算Pd颗粒粒径。由表2结果可知,在纳米氧化铝上,由氢氧滴定计算得到的Pd颗粒粒径大小与TEM统计结果接近,约2.6 nm;而在普通氧化铝上Pd颗粒粒径约4.7 nm,与TEM统计结果存在较大差异,这可能是由于Pd在普通氧化铝上的粒径分布范围太宽,使TEM的Pd粒径产生较大偏差引起的。但总体来看,尽管两种方法计算的Pd分散度有所差异,但纳米氧化铝催化剂上贵金属Pd的分散度都显著高于普通氧化铝为载体催化剂。

图6 不同预处理的1% (w) Pd/γ-Al2O3催化剂的XPS图谱
图7 氢气还原后的1% () Pd/-Al2O3催化剂的TEM图片
Fig.7 TEM pictures of 1% () Pd/-Al2O3catalysts after hydrogen reduction.
(a) 1% () Pd/-Al2O3(usual)-H2; (b) 1% () Pd/-Al2O3(nano)-H2. Inset is the particle size distribution of Pd particles. Figure (a) particle size is mainly concentrated in 5−10 nm, figure (b) particle size is mainly concentrated in 2−4 nm.

表2 Pd/γ-Al2O3 (nano)-H2和Pd/γ-Al2O3 (usual)-H2催化剂的分散度(D)、邻-二甲苯转化频率()及其反应条件
以氢氧滴定法测定的Pd分散度为基础,计算了两种催化剂在180 °C时的TOF (turnover frequency)。在计算催化剂的TOF时,采用提高空速的方法将邻-二甲苯转化率降至15%以下,具体测试条件和TOF计算结果见表2。从表2数据可以看出,纳米氧化铝催化剂的TOF约为普通氧化铝载体催化剂的2倍,表明纳米氧化铝载体催化剂Pd的本证活性显著优于普通氧化铝载体催化剂,也证明Pd分散度的变化是引起不同氧化铝载体催化剂活性差异的关键因素。
4 结论
制备了普通-Al2O3和纳米-Al2O3负载相同含量(1% ())的贵金属Pd催化剂,考察了其催化氧化邻-二甲苯性能,发现纳米-Al2O3为载体的催化剂在H2还原后活性最高,90为150 °C。通过XRD、XPS、BET、TEM等表征手段,发现还原态Pd是催化氧化邻-二甲苯的主要活性物种;纳米氧化铝载体有利于Pd粒径的控制和分散,从而提高1% () Pd/-Al2O3(nano)催化剂的活性;当Pd为金属态存在时,小颗粒的Pd活性更高。
(1) Ernstgard, L.; Gullstrand, E.; Lof, A.; Johanson, G.2002,, 759. doi: 10.1136/oem.59.11.759.
(2) Deng, J. G.; He, S. N.; Xie, S. H.; Yang, H. G.; Liu, Y. X.; Dai, H. X.. 2014,, 1119. [邓积光, 何胜男, 谢少华, 杨黄根, 刘雨溪, 戴洪兴. 高等学校化学学报, 2014,, 1119. ]
doi: 10.7503 /cjcu20131271.
(3) Zhu, X.; Shen, M.; Lobban, L. L.; Mallinson, R. G.2011,, 123. doi: 10.1016/j.jcat.2010.11.023.
(4) Li, W. B.; Gong, H.2010,, 885 [黎维彬, 龚 浩. 物理化学学报, 2010,, 885. ] doi: 10.3866/PKU.WHXB20100436
(5) Okumura, K.; Kobayashi, T.; Tanaka, H.; Niwa, M.. 2003,, 325. doi: 10.1016/S0926-3373(03)00101-2.
(6) Barakat, T.; Rooke, J. C.; Tidahy, H. L.; Hosseini, M.; Cousin, R.; Lamonier, J. F.; Giraudon, J. M.; De, W. G.; Su, B. L.; Siffert, S.2011,1420. doi: 10.1002/cssc.201100282
(7) Centi, G.2001,, 287.doi: 10.1016/S1381-1169(01)00155-8
(8) Lu, H. F.; Zhou, Y.; Han, W. F.; Huang, H. F.; Chen, Y. F.2013,, 101. doi: 10.1016/j.apcata.2013.05.036.
(9) Ferrer, V.; Moronta, A.; Sánchez, J.; Solano, R.; Bernal, S.; Finol, D.2005,, 487. doi: 10.1016/j.cattod.2005.07.059.
(10) Kim, H. S.; Kim, T. W.; Koh, H. L.; Lee, S. H.; Min, B. R.2005,, 125. doi: 10.1016/j.apcata.2004.02.027.
(11) Tidahy, H. L.; Hosseni, M.; Siffert, S.; Cousin, R.; Lamonier, J. F.; Aboukaïs, A.; Su, B. L.; Giraudon, J. M.; Leclercq, G.2008,, 335. doi: 10.1016/j.cattod.2007.09.008.
(12) Huang, H.; Leung, D. Y. C.2011,, 348.
doi: 10.1021/cs200023p.
(13) Huang, S.; Zhang, C.; He, H.2008,, 15.
doi: 10.1016/j.cattod.2008.08.020.
(14) Sang, C. K.; Wang, G. S.2009,,.
doi: 10.1016/j.apcatb.2009.09.001.
(15) Wang, G. S.; Lee, J. W.; Sang, C. K.2008,, 133.
doi: 10.1016/j.apcatb.2008.03.011.
(16) Ordóñez, S.; Bello, L.; Sastre, H.; Rosal, R.; Dı́Ez, F. V.2002,, 139.doi:10.1016/S0926-3373(02)00036-X
(17) Wang, G. S.; Sang, C. K.; Kang, H. C.; Nahm, S. W.; Lee, J. W.; Moon, H.2007,, 5868.
doi: 10.1016/j.apsusc.2006.12.079.
(18) Okumura, K.; Niwa, M.2002,, 121.doi: 10.1016/j.apsusc.2006.12.079
(19) Yazawa, Y.; Yoshida, H.; Takagi, N.; Komai, S. I.; Satsuma, A.; Hattori, T.1998,, 261.doi: 10.1016/S0926-3373(98)00080-0
(20) Xiao, X. X.; Lu, J. Q.; Su, X. W.; Guo, M.; Luo, M. F.. 2009,, 561 [肖小燕, 鲁继青, 苏孝文, 郭 明, 罗孟飞. 物理化学学报, 2009,, 561.] doi: 10.3866/PKU.WHXB20090327
(21) Padilla, J. M.; Angel, G. D.; Navarrete, J.2008,, 541. doi: 10.1016/j.cattod.2007.12.053.
(22) Wu, C. S.; Lin, Z. A.; Tsai, F. M.; Pan, J. W.2000,, 419.Doi: 10.1016/S0920-5861(00)00487-9
(23) Pecchi, G.; Morales, M.; Reyes, P.; React, K.1997,, 237.
(24) Sekizawa, K.; Eguchi, K.; Widjaja, H.; Machida, M.; Arai, H.1996,, 245.doi: 10.1016/0920-5861(95)00241-3
(25) Pecchi, G.; Reyes, P.; Concha, I.; Fierro, J. L. G.1998,, 309.doi: 10.1006/jcat.1998.2164
(26) Brun, M.; Berthet, A.; Bertolini, J. C.1999, 104, 55. doi:10.1016/S0368-2048(98)00312-0
(27) Iwasa, N.; Kudo, S.; Takahashi, H.; Masuda, S.; Takezawa, N.1993,, 211. doi: 10.1007/BF00771756
(28) Venezia, A. M.; Rossi, A.; Duca, D.; Martorana, A.; Deganello, G.1995,, 113. doi: 10.1016/0926-860X(94)00286-X
Catalytic Oxidation of o-Xylene over Pd/-Al2O3Catalysts
HU Ling-Xiao1,2WANG Lian1,2WANG Fei1,2ZHANG Chang-Bin1,2,*HE Hong1,2,3,*
(1;23)
1% () Pd/-Al2O3catalysts were prepared by the impregnation method using nano-Al2O3(10 nm) and-Al2O3(200-300 nm) as support materials. The catalysts were tested for catalytic oxidation of o-xylene and the difference of catalyst activity before and after hydrogen reduction was investigated. The results indicate that 1% () Pd/-Al2O3(nano) has the highest catalytic activity for o-xylene oxidation after H2reduction, and the90(The temperature of conversion rate of o-xylene reaches 90%) was 150 °C. The structure-activity relationships of the catalysts were studied by X-ray diffraction (XRD), transmission electron microscopy (TEM), and X-ray photoelectron spectroscopy (XPS), while the specific surface area was determined using the Brunauer-Emmett-Teller (BET) isotherm. The results show that the reduced Pd is the active species for catalytic oxidation of o-xylene. Pd particle size has a significant influence on the catalyst activity and a small Pd particle size is favorable. There is a strong interaction between the supporter (nano-Al2O3) and the Pd species, which facilitates the particle size control and Pd dispersion, thereby increasing the catalyst activity of the 1% () Pd/-Al2O3(nano) catalyst.
-Al2O3; Noble metal catalyst; Catalytic oxidation; o-Xylene
December 28, 2016;
March 27, 2017;
April 19, 2017.
Corresponding authors.ZHANG Chang-Bin, Email: cbzhang@rcees.ac.cn; Tel: +86-62849121. HE Hong, Email: honghe@rcees.ac.cn; Tel: +86-62849123.
10.3866/PKU.WHXB201704192
O643.36
The project was supported by the National Natural Science Foundation for Excellent Young Scholars, China (21422706) and National Natural Science Foundation of China (51678560).
优秀青年基金(21422706)和国家自然科学基金(51678560)项目资助
