泼洒糖蜜对池塘养殖罗氏沼虾生长和水质的影响
2017-12-18朱锦裕卜弘毅胡冲冲苗淑彦
朱锦裕,卜弘毅,胡冲冲,苗淑彦
( 扬州大学 动物科学与技术学院,江苏 扬州 225009 )
泼洒糖蜜对池塘养殖罗氏沼虾生长和水质的影响
朱锦裕,卜弘毅,胡冲冲,苗淑彦
( 扬州大学 动物科学与技术学院,江苏 扬州 225009 )
将单口面积1.33~2.33 hm2、环境相似的6口罗氏沼虾养殖池塘分为2组,3口池塘投喂蛋白质水平为35.4%的饲料,且每日适量泼洒糖蜜(试验组),3口池塘投喂蛋白质水平为41.9%的饲料,不泼洒糖蜜(对照组),常规管理。养殖期间,每隔15 d取水样检测氨氮和亚硝态氮含量。156 d的饲养结果表明,对照组和试验组罗氏沼虾的产量分别为6600 kg/hm2和6427.5 kg/hm2,降低饲料中的蛋白水平结合泼洒糖蜜不影响罗氏沼虾的生长(P>0.05),养殖效益亦无显著差异(P>0.05)。但试验组池塘水中氨氮较对照组低54.0%,亚硝态氮低21.0%,泼洒糖蜜显著降低了池塘氨氮和亚硝态氮含量(P<0.05)。
罗氏沼虾;池塘养殖;生物絮团;水质;养殖效益
罗氏沼虾(Macrobrachiumrosenbergii)又名马来西亚大虾或淡水长臂大虾,食性广、个体大、生长速度快、养殖周期短,自东南亚地区引进我国后,经30余年的养殖,已成为我国重要的淡水虾类,养殖遍及江苏、广东、广西、上海、浙江、福建等16个省市,养殖总面积约3.34×104hm2,年产量超过1.2×105t。Hari等[1]的研究表明,罗氏沼虾饲料中蛋白质水平在30%较适宜。Mukhopadhyay等[2]建议,罗氏沼虾饲料中可消化蛋白质水平应高于30%。Chowdhury等[3]认为,当饲料中蛋白质含量35%时,罗氏沼虾的生长和饲料转化最优。但在生产实践中,由于片面追求高产高密度养殖,目前市场上的罗氏沼虾饲料蛋白含量基本在40%以上,有的高达45%,远高于罗氏沼虾的实际需求量,氮、磷和总悬浮物等排放强度较高,严重污染养殖水体和周围环境[4],制约了罗氏沼虾池塘养殖的可持续健康发展。
向养殖水体中添加碳源调节水体的碳氮比,不仅可以促进异养细菌的大量繁殖,降低氨氮与亚硝氮在水体中的积累[5],还可形成生物絮团为养殖动物提供天然饵料,降低养殖成本[6]。本试验通过向池塘中添加碳源,同时降低饲料中蛋白质含量,考察生物絮团对养殖水体中氨氮的降解作用,探讨罗氏沼虾饲料中适宜的蛋白质添加水平,为罗氏沼虾健康养殖提供参考。
1 材料与方法
1.1 试验饲料的配制
对照组饲料的蛋白质水平为41.9%,试验组饲料的蛋白质水平为35.4%。具体饲料配方及组成见表1,由扬州市富民饲料厂按配方生产。
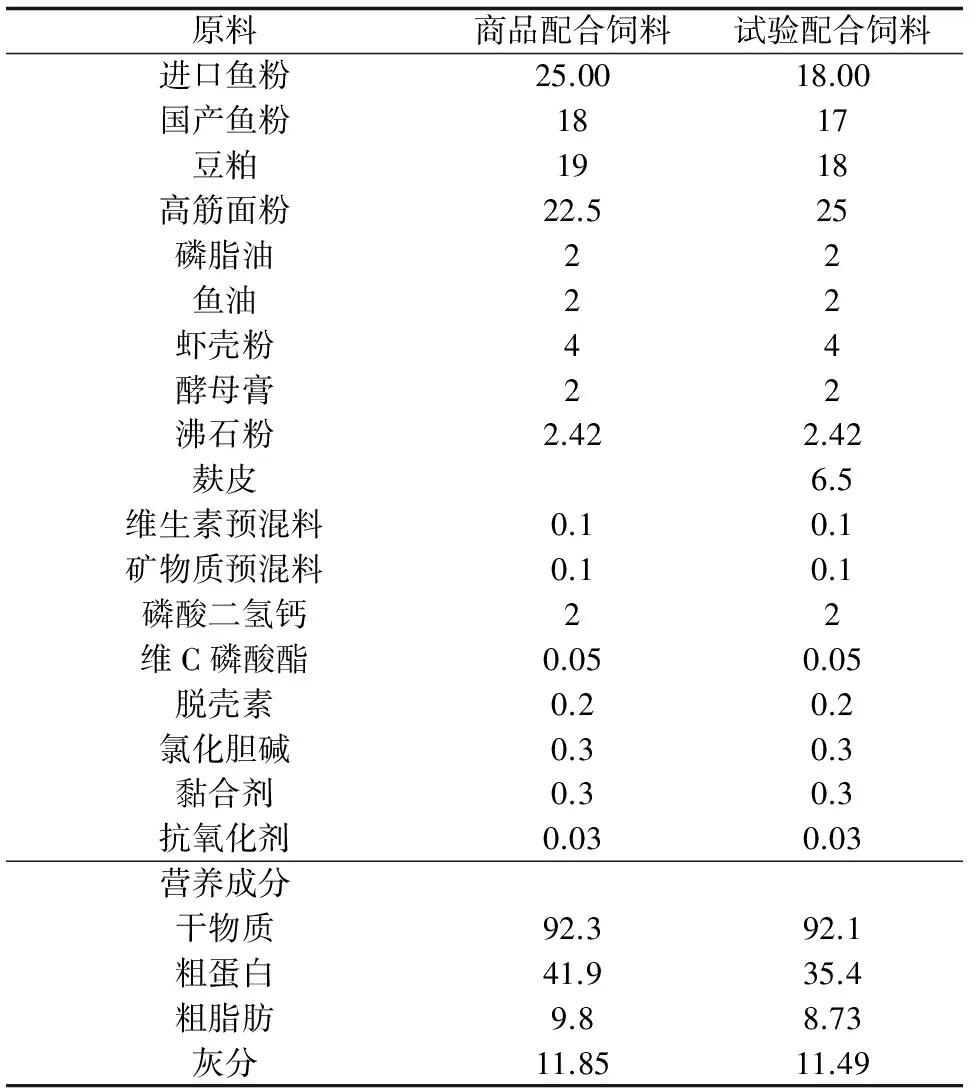
表1 试验饲料配方及常规营养组成(干物质) %
1.2 试验设计及养殖管理
养殖试验在江苏省高邮市罗氏沼虾室外养殖池塘内进行,1#~3#池塘为对照组,投喂商品配合饲料,4#~6#池塘为试验组,投喂试验配合饲料,并泼洒糖蜜,对照组和试验组养殖管理措施相同(表2)。试验用罗氏沼虾苗购自江苏省吴江市园区虾苗场,为当年人工培育的同一批种苗,规格均匀,健康无病。虾苗在保温大棚内养至5月份温度回升后放养至池塘。07:00和18:00投喂饲料,观察摄食情况并记录。
1.3 糖蜜添加
所添加的碳源为糖蜜,计算公式为:
ΔCH=20×(F×N×NE)/(C×E)
式中,ΔCH为水体中添加糖蜜量(kg);20为本研究中所采用的碳氮比;F为饲料投喂量(kg);N为饲料中的氮含量(%);NE为氮在水中的溶失率(50%);C为碳源含碳量(50%);E为微生物转化效率(50%)[8]。
每日上午投饵后,用塑料容器称取糖蜜,用池塘水溶解稀释后全池均匀泼洒,阴雨天减少泼洒量或不泼洒。
1.4 指标测定
养殖期间,观察罗氏沼虾的生长,轮捕上市,十月中旬全部捕出,记录虾产量和价格。
每半个月检测1次氨氮和亚硝态氮含量。采样时,10:00时用柱状采水器在池塘四角及中央各采水2 L,混合待用。取混合水样1 L,冷藏带回试验室,用纳氏试剂法测定氨氮含量,N-(1-萘基)-乙二胺光度法测定亚硝酸含量。
1.5 统计分析
取各检测点的平均值,采用EXCEL 2003和SPSS 13.0软件进行统计分析,显著水平为P< 0.05。
2 结 果
2.1 罗氏沼虾产量与效益
经过156 d的养殖,对照组产值平均为24.14万元/hm2,成本平均为16.34万元/hm2,效益为78 786元/hm2;试验组的产值平均为23.54万元/hm2,平均成本为15.59万元/hm2,效益为79 010元/hm2(表2)。
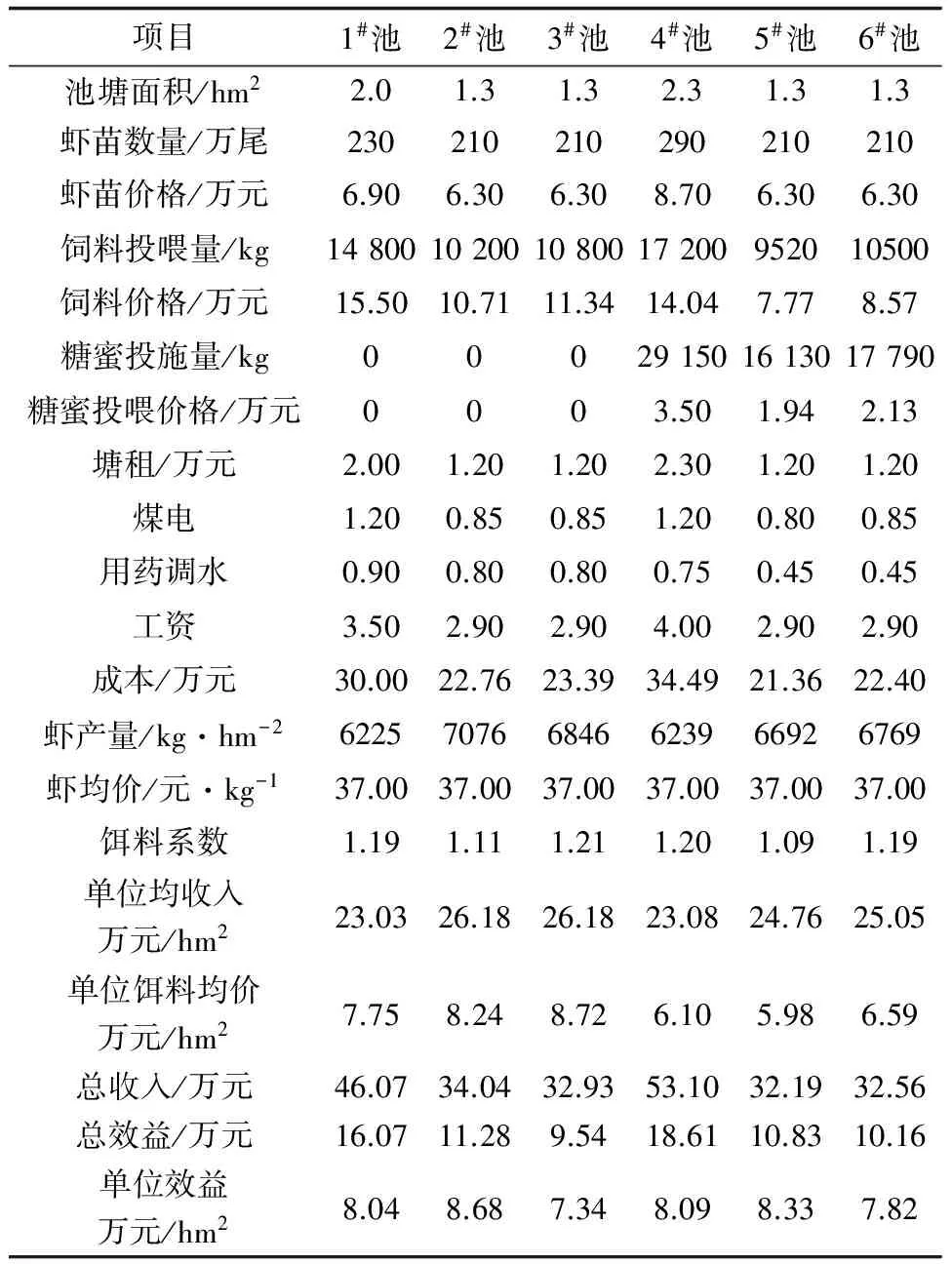
表2 罗氏沼虾池塘概况及养殖效益分析
2.2 各池塘水中氨氮和亚硝态氮的含量
各池塘中氨氮和亚硝态氮的含量见表3、表4。由表3、表4可见,整个养殖期间,对照组和试验组池塘中氨氮含量和亚硝态氮含量均呈现上升趋势,但试验组水中的上升幅度小于对照组。试验结束时,试验组氨氮为2.97 mg/L,较对照组低54.0%,亚硝态氮为0.166 mg/L,较对照组低21.0%。这说明减少饲料中的蛋白质含量并向池塘中添加糖蜜有效降低了池塘氨氮和亚硝态氮水平,改善了罗氏沼虾养殖池水质。
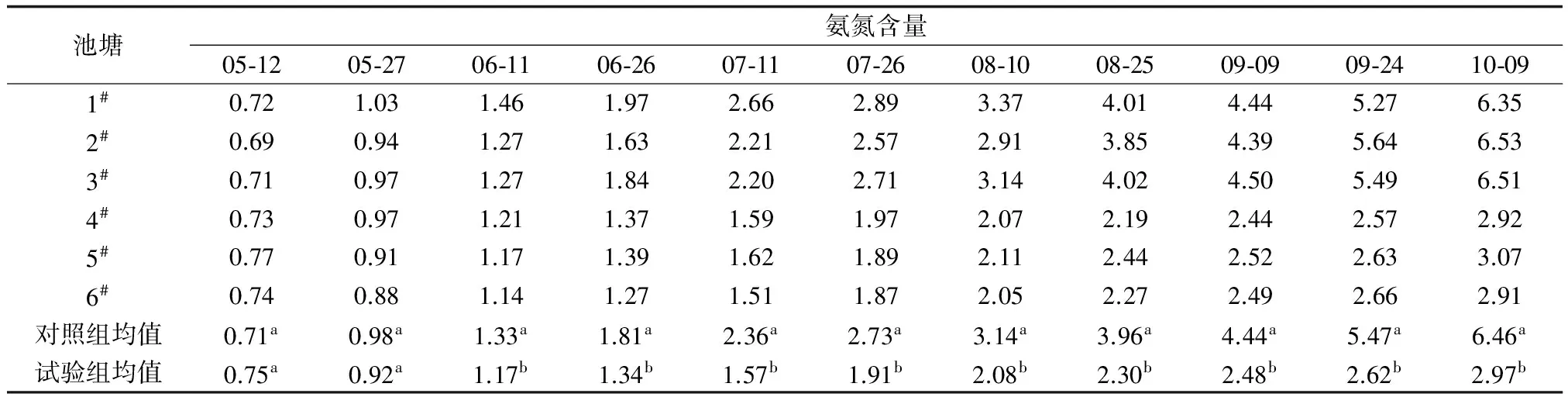
表3 不同时间各罗氏沼虾养殖池塘水中氨氮的含量 mg/L
注:表中数据以平均值±标准差表示(n=3),同列不同上标英文字母表示差异显著(P<0.05).下同.
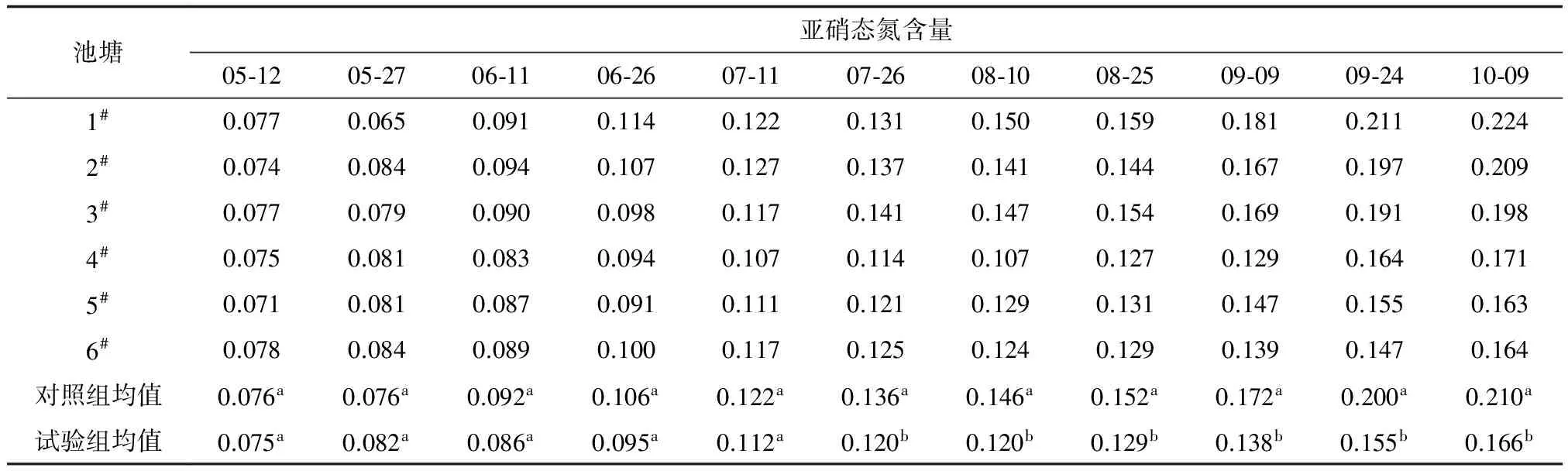
表4 罗氏沼虾池塘亚硝态氮含量 mg/L
3 讨 论
近年来,罗氏沼虾养殖面积逐渐扩大,高密度是高产量的重要措施,但高密度养殖下,病害频发,高氮、磷含量养殖废水的排放,恶化了养殖环境,严重影响了罗氏沼虾养殖业的健康发展。生物絮团技术通过添加有机碳源,将异养细菌和微藻共同培养形成不规则的絮团状微生物聚集体,以达到净化水质和提供饵料的作用[7-10],改善了养殖水体水质并促进养殖生物的生长,是一种新兴的生态养殖技术。
在印度、泰国和巴西等国家,生物絮团技术已成功运用于罗非鱼和对虾的养殖中[11]。Crab等[12]通过添加醋酸盐、葡萄糖、甘油和甘油+芽孢杆菌来处理罗氏沼虾养殖池中的废水,取得了一定的成效。有研究发现,当水中碳氮比=20∶1时,更易形成生物絮团,并能够有效降低水中无机氮含量,改善养殖水环境[11,13-14]。赵大虎等[15]研究发现,选择碳源时,主要应考虑碳源自身的性质,越易被微生物吸收利用的碳源,其净化水质的效果越明显。用同位素标记法跟踪生物絮团去路时发现,养殖动物在正常摄食饲料的同时,会摄取大量的生物絮团。这些被摄入的生物絮团能够促进蛋白质的利用率,降低饵料系数[16]。
根据以上研究,可以得出如下结论:首先,生物絮团技术可尝试用于解决罗氏沼虾水体富营养化的问题,以期能够减少养殖废水外排量,保护生态环境;第二,添加外源碳源使水中碳氮比=20∶1,能够有效培育生物絮团;第三,选择易被细菌吸收利用的碳水化合物作为碳源效果更佳;第四,生物絮团水体中添加益生菌水质净化效果更佳;第五,养殖动物能够摄食生物絮团,并能够促进生长。在本研究中,通过对池塘水质进行监控,以及对池塘收益进行统计,结果也印证了生物絮团在水质改良和营养供给能力上的优势。
3.1 养殖效益与经济分析
在养殖环境和管理措施基本相似的情况下,对照组和试验组罗氏沼虾的单位效益分别为78 786元/hm2和79 010元/hm2,说明降低饲料蛋白含量并未显著影响罗氏沼虾的养殖效益,说明了生物絮团对罗氏沼虾的营养补充作用,大幅降低了养殖饲料成本(对照组和试验组饲料成本为80 914元/hm2和60 870元/hm2)。Xu等[17]在养殖过程中,向养殖池泼洒碳源,也有效地提高了凡纳滨对虾(Litopenaeusvannamei)的生长和消化酶的活性;Megahed[18]用不同蛋白水平的饲料投喂短沟对虾(Penaeussemisulcatus),发现向养殖水体适量泼洒碳源,也能有效提高短沟对虾的生长和存活率。目前,共有3种观点支持生物絮团对养殖动物的营养贡献。首先,生物絮团中含有虾类生长所需要的蛋白、脂肪、矿物质和维生素[19-20];其次,生物絮团可以刺激水产动物消化酶的分泌[17,21-22];第三,生物絮团含有类胡萝卜素、叶绿素、植物甾醇、酚和氨基糖等“生物活性因子”,能有效促进水产动物的生长[23]。虽然泼洒糖蜜在一定程度上增加了生产投入,但从资源利用来看,可有效缓解日益紧张的蛋白资源,推动水产养殖业的可持续发展。
3.2 生物絮团调节水质的作用
生物絮团理论由以色列学者Avnimelech提出并应用到实际生产中,有效降低了养殖水体中的氨氮以及亚硝酸氮水平[7]。本试验中,向试验池中泼洒糖蜜,并降低饲料蛋白含量,可有效降低水中的氨氮和亚硝态氮水平,其原因有两方面。首先,饲料残饵是池塘中氮的主要来源之一[7]。本试验中,试验组饲料蛋白含量比对照组低7%,既节约了蛋白,缓解了蛋白资源的不足,又有效降低了残饵中氮的水平,促进了健康养殖。其次,传统养殖主要依靠硝化反应去除氨氮,硝化细菌将氨氮转化为亚硝态氮和硝态氮,导致亚硝态氮和硝态氮大量积累,随着养殖的时间延长,若整个养殖周期内不换水,水体中硝化反应也无法将大量的氨氮去除,最终导致养殖后期水体中氨氮迅速积累。添加碳源会促使异养细菌繁殖,促进对无机氮的吸收。有研究指出,异养细菌降低氨氮的速度约是硝化反应的10倍[24]。异养细菌可利用氨氮大量繁殖直接形成生物絮团,生物絮团快速异氧化氨氮才是水体氨氮去除的有效途径,而异养细菌是生物絮团系统中总氨氮去除的主要力量。基于这一原理,Wang等[26-26]向金鱼(Carassiusauratus)和凡纳滨对虾的养殖水体中泼洒碳源,均有效地降低了水体中的氨氮和亚硝态氮水平,改善了水质效果。
本研究结果表明,生物絮团技术可有效降低养殖水体中的氨氮和亚硝态氮含量,达到改善养殖水质的效果,形成的生物絮团还可作为饵料被罗氏沼虾摄食,从而促进了罗氏沼虾生长,实现饲料蛋白的充分利用。
[1] Hari B, Madhusoodana B. Comparative evaluation of dietary protein levels and plant-animal protein ratios inMacrobrachiumrosenbergii[J]. Aquaculture Nutrition, 2003, 9(2):131-137.
[2] Mukhopadhyay P K, Rangacharyulu P V, Mitra G, et al. Applied nutrition in freshwater prawn,Macrobrachiumrosenbergiiculture [J]. Journal of Applied Aquaculture, 2003, 13(3/4):317-340.
[3] Chowdhury M, Goda A, El-Haroun E, et al. Effect of dietary protein and feeding time on growth performance and feed utilization of post larval freshwater prawnMacrobrachiumrosenbergii[J]. Journal of Fisheries and Aquatic Science, 2008, 3(1):1-11.
[4] Stokstad E. Down on the shrimp farm [J]. Science, 2010, 328(5985):1504-1505.
[5] Crab R, Defoirdt T, Bossier P, et al. Biofloc technology in aquaculture: beneficial effects and future challenges [J]. Aquaculture, 2012,356/357(4):351-356.
[6] Burford M A,Thompson P J,Mcintosh P R.The contribution of flocculated material to shrimp (Litopenaeusvannamei) nutrition in high-intensity,zero-exchange system [J].Aquaculture,2004,232(114):525-537.
[7] Avnimelech Y, Kochba M. Evaluation of nitrogen uptake and excretion by tilapia in biofloc tanks, using N-15 tracing [J]. Aquaculture, 2009, 287 (1/2):163-168.
[8] Avnimelech Y. Carbon/nitrogen ratio as a control element in aquaculture systems [J]. Aquaculture, 1999, 176(3/4):227-235.
[9] Tacon A G J, Cody J J, Conquest L D, et al. Effect of culture system on the nutrition and growth performance of Pacific white shrimp,Litopenaeusvannamei(Boone) fed different diets [J]. Aquaculture Nutrition, 2002, 8(2):121-139.
[10] Arnold S J, Coman F E, Jackson C J, et al. High-intensity, zero water-exchange production of juvenile tiger shrimp,Penaeusmonodon: an evaluation of artificial substrates and stocking density [J]. Aquaculture, 2009,293(1):42-48.
[11] 罗国芝, 朱泽闻, 潘云峰, 等. 生物絮凝技术在水产养殖中的应用[J]. 中国水产, 2010(2):62-63.
[12] Crab R, Chielens B, Wille M, et al. The effect of different carbon sources on the nutritional value of bioflocs, a feed forMacrobrachiumrosenbergiipostlarvae [J]. Aquaculture Research,2010, 41(4):559-567.
[13] 邓吉朋,黄建华,江世贵,等.生物絮团在斑节对虾养殖系统中的形成条件及作用效果[J].南方水产科学,2014(6):29-37.
[14] Zhao P, Huang J, Wang X H, et al.The application of bioflocs technology in high-intensive, zero exchange farming systems ofMarsupenaeusjaponicus[J]. Aquaculture,2012,354/355(2):97-106.
[15] 赵大虎, 添加不同碳源对生物絮团组分和凡纳滨对虾生理健康、生长的影响[D]. 青岛:中国海洋大学, 2013:3-4.
[16] Hari B, Kurup B M, Varghese J T, et al.Effects of carbohydrate addition on production in extensive shrimp culture systems[J]. Aquaculture,2014,241(1/4):179-194.
[17] Xu W J, Pan L Q. Effects of bioflocs on growth performance, digestive enzyme activity and body composition of juvenileLitopenaeusvannameiin zero-water exchange tanks manipulating C/N ratio in feed [J]. Aquaculture, 2012,356/357(4):147-152.
[18] Megahed M E. The effect of microbial biofloc on water quality, survival and growth of the green tiger shrimp (Penaeussemisulcatus) fed with different crude protein levels [J].Journal of Arabian Aquaculture Society, 2010(5):119-142.
[19] Luo G, Wang C, Liu W, et al. Growth, digestive activity, welfare, and partial cost-effectiveness of genetically improved farmed tilapia (Oreochromisniloticus) cultured in a recirculating aquaculture system and an indoor biofloc system [J]. Aquaculture, 2014,422/423(1):1-7.
[20] Hassan S N, Sandra T S, Alberto J P N. Bioavailability of crude protein and lipid from biofloc meals produced in an activated sludge system for white shrimp,Litopenaeusvannamei[J]. Revista Brasileira de Zootecnia, 2015, 44(8):269-275.
[21] Moss S M, Divakaran S, Kim B G. Stimulating effects of pond water on digestive enzyme activity in the Pacific white shrimpLitopenaeusvannamei(Boone)[J]. Aquaculture Research, 2001, 32 (2):125-131.
[22] Anand P S S, Kohli M P S, Kumar S, et al. Effect of dietary supplementation of biofloc on growth performance and digestive enzyme activities inPenaeusmonodon[J]. Aquaculture, 2014(418/419):108-115.
[23] Ju Z Y, Forster I, Conquest L, et al. Determination of microbial community structures of shrimp floc cultures by biomarkers and analysis of floc amino acid profiles [J]. Aquaculture Research, 2008, 39(2): 118-133.
[24] Hargreaves J A. Photosynthetic suspended-growth systems in aquaculture [J].Aquacultural Engineering, 2006, 34(3):344-363.
[25] Wang G J, Yu E M, Xie J, et al. Effect of C/N ratio on water quality in zero-water exchange tanks and the biofloc supplementation in feed on the growth performance of crucian carp,Carassiusauratus[J]. Aquaculture, 2015(443):98-104.
[26] Xu W J, Pan L Q, Sun X H, et al. Effects of bioflocs on water quality, and survival, growth and digestive enzyme activities ofLitopenaeusvannamei(Boone) in zero-water exchange culture tanks [J]. Aquaculture Research, 2013,44(7):1093-1102.
EffectsofMolassesSupplementationonGrowthandWaterQualityinGiantFreshwaterPrawnMacrobrachiumrosenbergiiPonds
ZHU Jinyu,BU Hongyi, HU Chongchong,MIAO Shuyan
( College of Animal Science and Technology,Yangzhou University, Yangzhou 225009, China )
A 156-day feeding trial was conducted in 6 outdoor ponds with surface area of 1.3—2.3 hm2in Gaoyou, Jiangsu province, China to investigate effects of bioflocs technology (BFT) on water quality and growth performance of giant freshwater prawnMacrobrachiumrosenbergii. Juvenile giant freshwater prawn were fed diet containing 35% protein in 3 test ponds with addition of molasses as biofloc with the C/N ratio of 20 based on the amount of daily diet and fed diet containing 42% protein in 3 control ponds without addition of molasses. During the experiment, contents of ammonia nitrogen and nitrite-N in water were monitored in a 15 day interval. The results showed that there were significantly lower levels of ammonia-N (reduced by 54.0%) and nitrite-N (reduced by 21.0%) in the test ponds than those in the control ponds (P<0.05). The prawn yield was found to be 6600 kg/hm2in the test ponds and 6427.5 kg/hm2in the control ponds, indicating that even though decline in dietary protein level, molasses addition did not significantly affect the growth of the prawn (P>0.05). Meanwhile, no difference in economic benefits was observed in both groups (P>0.05). However, feed cost was significantly decreased by reducing the protein level in the test group (P<0.05), due to reduce in the use of protein sources. The findings provided theoretical basis and research foundation in applying biofloc technology in healthy and sustainable development of prawn culture.
Macrobrachiumrosenbergii; pond culture; biofloc technology; water quality; economic benefit
10.16378/j.cnki.1003-1111.2017.02.015
2016-03-04;
2016-05-17.
江苏省水产三新工程(Y2014-34);扬州大学2015大学生科技创新基金项目(x2015683).
朱锦裕(1995—),男,本科生;研究方向:水产养殖. E-mail:670604984@qq.com. 通讯作者:苗淑彦(1978—),女,副教授;研究方向:水生动物营养与饲料. E-mail:shuyanmiao@126.com.
S968.22
A
1003-1111(2017)02-0202-05
