细胞松弛素B诱导菲律宾蛤仔四倍体的初步研究
2017-12-18李永仁郭永军
李永仁,梁 健,郭永军
( 天津农学院 水产科学系,天津市水产生态及养殖重点实验室,天津 300384 )
细胞松弛素B诱导菲律宾蛤仔四倍体的初步研究
李永仁,梁 健,郭永军
( 天津农学院 水产科学系,天津市水产生态及养殖重点实验室,天津 300384 )
采用不同质量浓度的细胞松弛素B抑制第一极体的释放,诱导菲律宾蛤仔四倍体,观察诱导各组胚胎的早期发育过程,结果表明,0.5、0.7 mg/L及1.0 mg/L的细胞松弛素B均能有效抑制第一极体的释放,获得四倍体诱导率分别为58.2%、55.1%及55.2%,无显著差异;随细胞松弛素B用量的升高,菲律宾蛤仔早期胚胎发育速度略有减慢,各发育阶段胚胎畸形率显著提高,畸形形式增加,孵化率降低。综合分析,0.5 mg/L的细胞松弛素B适于诱导菲律宾蛤仔四倍体。
菲律宾蛤仔; 四倍体; 胚胎发育
菲律宾蛤仔(Ruditapesphilippenarum)俗称花蛤、蚬子,属双壳类、帘蛤科、蛤仔属,为广温、广盐性种类,是我国重要经济贝类,目前已成为世界性养殖贝类[1]。2014年蛤仔产量约占海水贝类产量的1/3,为我国单种养殖产量最高的贝类,产业地位十分重要[2]。目前,蛤仔养殖业主要采用野生苗种,导致个体小型化、抗逆性差、繁殖季节死亡率高、单位产量降低[3]。
三倍体贝类因其不育性而具有生长速度快、成活率高、肉质佳等优良经济性状[4],三倍体菲律宾蛤仔苗种的应用,有望克服其在养殖中出现的问题[5],利用四倍体与二倍体杂交,可培育全三倍体贝类[6],是实现三倍体贝类产业化的关键。
通过物理、化学以及生物等方法抑制第一极体释放是诱导贝类四倍体的基本方法,其中,细胞松弛素B诱导法具有操作流程短、倍化率高的优点,可有效制备贝类多倍体胚胎[5]。目前,已对长牡蛎(Crassostreagigas)、栉孔扇贝(Chlamysferreri)、虾夷扇贝(Patinopectenyessoensis)、马氏珠母贝(Pinctadamartenssi)、紫贻贝(Mytilusgalloprovincialis)等多种贝类开展四倍体育种相关研究[7-11],但尚无对菲律宾蛤仔的四倍体诱导的系统研究。对菲律宾蛤仔三倍体胚胎发育的相关研究表明,三倍体的早期胚胎发育与普通二倍体差异显著[5],而对四倍体蛤仔早期胚胎发育的相关研究未见报道。
采用细胞松弛素B诱导法制备菲律宾蛤仔四倍体胚胎,观察胚胎的早期发育过程,探讨菲律宾蛤仔四倍体的适宜诱导条件,以期为海水双壳类的多倍体育种提供借鉴。
1 材料与方法
1.1 精卵
菲律宾蛤仔亲贝来源于天津大神堂海域的野生群体,性腺自然成熟,于5月底采捕,清洗待用。亲贝阴干4 h,置入经紫外线照射2 h的砂滤海水,充气,约12 min后开始排精产卵。迅速将开始排放配子的亲贝捡出,淡水冲洗,单个置于盛有500 mL砂滤海水的烧杯中继续排放配子。
分别镜检烧杯内的排放物,选择外形浑圆、大小均匀、未被精子污染的卵子合并,得到卵子约400万粒,以100 μm孔径的筛绢滤除组织碎屑,30 μm孔径的筛绢收集,将卵子悬浮于4000 mL砂滤海水中;选择游动迅速、分散度好的一份精液,以30 μm孔径筛绢滤入烧杯待用。
1.2 授精
观察精、卵密度,取约含2500万枚精子的上层精液,加入卵子悬浮液,迅速搅动使受精均匀。受精卵悬浮液均分为4组,各1000 mL,为对照组和3个处理组。受精后13 min,向3个处理组分别加入细胞松弛素B(SIGMA)的二甲基亚矾溶液,迅速混匀,细胞松弛素B终质量浓度分别为0.5、0.75、1.0 mg/L,受精后19 min,以30 μm孔径的筛绢清洗受精卵。
1.3 胚胎发育及倍性测定
洗卵后,4组受精卵分别置入60 L砂滤海水内进行胚胎发育,初始密度20枚/mL,隔1 h搅动水体至胚胎浮游,微充气,约21 h后发育至D形幼虫。整个试验过程,控制海水温度24.8~25 ℃,盐度25。
受精后,观察各组受精卵的极体随时间出现的比例,并分别于4细胞期、原肠期、担轮期和D形期取样,多聚甲醛固定,统计孵化率、各阶段的畸形率及畸形形式。受精率设为卵裂胚胎数与总卵数的百分比;孵化率设为D形幼虫数与受精卵的百分比。
D形幼虫期,各组取样,4′,6-二脒基-2-苯基吲哚工作液固定,震荡3 min,经30 μm孔径的筛绢过滤,得单细胞悬液,紫外流式细胞仪检测,幼虫的四倍体率为四倍体峰面积与总积分面积之比。
试验重复3次平行。
1.4 数据分析
利用单因素方差分析比较各组间4细胞期、原肠期、担轮期以及D形期胚胎的畸形率、孵化率和诱导率。若差异显著,用最小显著性差异法比较组间均值差异。检验显著性水平设为0.05。
2 结 果
2.1 早期胚胎发育进程
受精过程中,统计对照组及处理组第一极体随时间的释放,细胞松弛素B的使用有效抑制了3个处理组的第一极体,随细胞松弛素B使用质量浓度的增加,第一极体抑制率提高(表1);洗卵后,处理组第二极体迅速释放,但释放率低于同期对照组,其中,1.0 mg/L细胞松弛素B处理组的第二极体释放比例显著低于0.5 mg/L和0.75 mg/L细胞松弛素B处理组的第二极体释放比例,说明高质量浓度的细胞松弛素B对受精卵的发育产生了负面影响。
表1细胞松弛素B抑制第一极体的菲律宾蛤仔受精卵极体释放的时间进程 %

在2细胞、4细胞、8细胞期,处理组胚胎发育进程明显慢于对照组;在各处理组,发育速度随细胞松弛素B质量浓度的增加而略减缓;各组于受精后21 h同时发育至D形幼虫阶段。处理组受精率低于对照组,且受精率随细胞松弛素B质量浓度的增加而降低(表2)。

表2 细胞松弛素B抑制第一极体的菲律宾蛤仔受精卵的胚胎发育进程
注:表中时间为受精后50%胚胎达到相应阶段的时间.
2.2 致畸
细胞松弛素B的质量浓度对4~8细胞期、原肠期、担轮期及D形期胚胎的畸形率影响显著(P<0.05),在同一组,胚胎发育后期的畸形率基本高于前期,特别在担轮期及初孵D形幼虫阶段,胚胎畸形率迅速升高(表3)。在相同发育阶段,胚胎畸形率随细胞松弛素B质量浓度的增加而增加,其中,卵裂期与原肠期,0.5 mg/L与0.75 mg/L细胞松弛素B处理组之间的畸形率差异不显著(表4),但1 mg/L 细胞松弛素B处理组胚胎的畸形率迅速升高,D形幼虫期的畸形率高达36%。
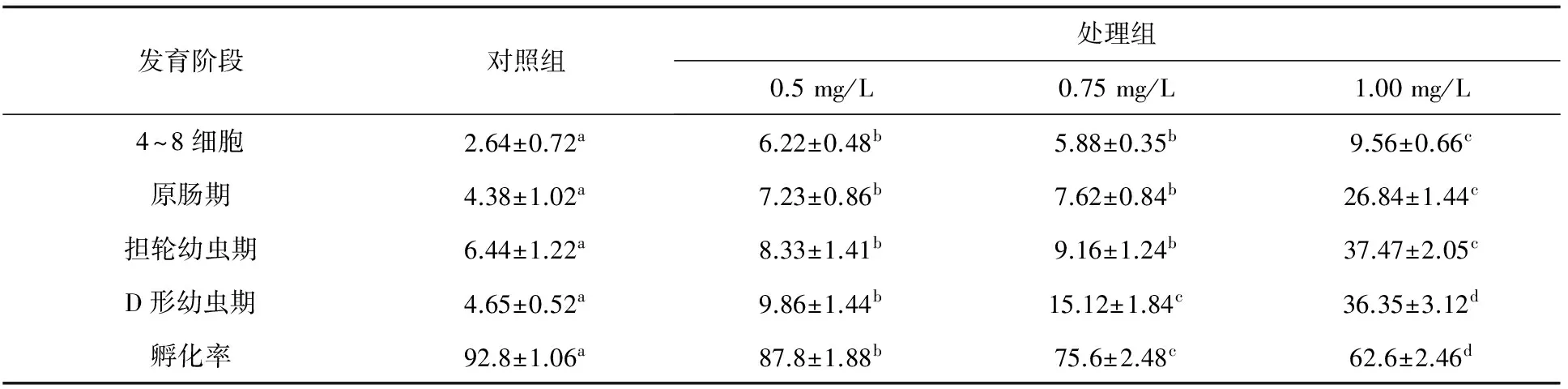
表3 细胞松弛素B抑制第一极体的菲律宾蛤仔受精卵各发育阶段的畸形率 %
注:同一行内,具有相同字母的数值差异不显著(P>0.05).下同.
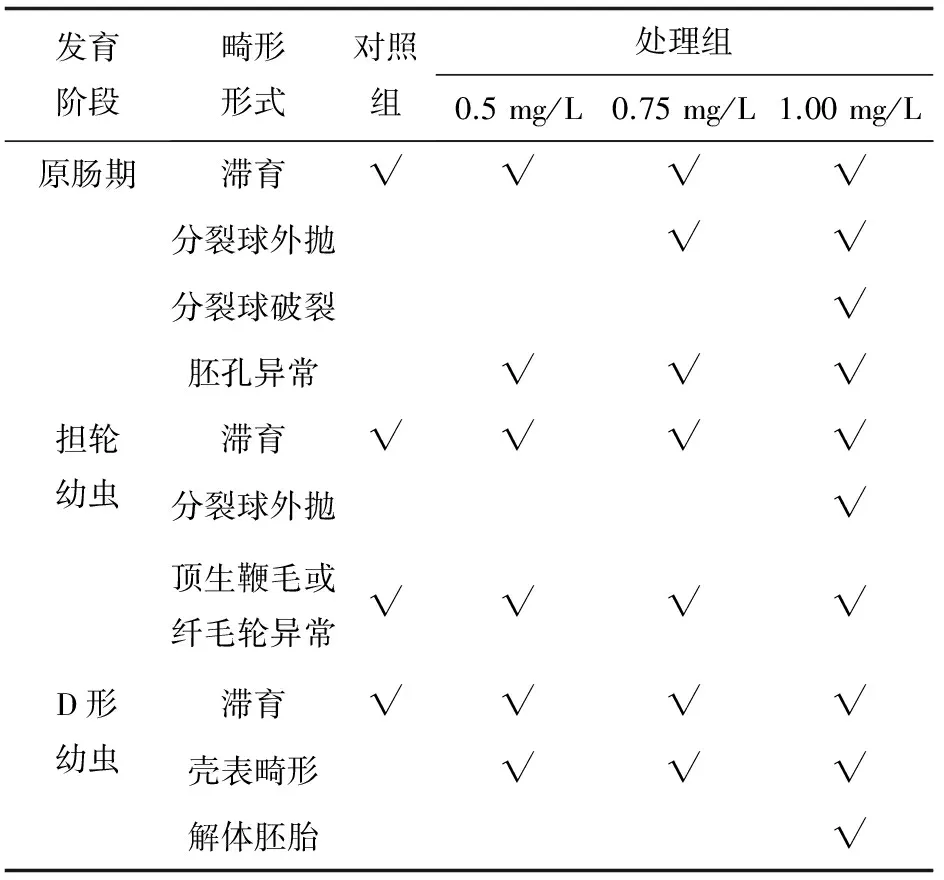
表4 细胞松弛素B抑制第一极体的菲律宾蛤仔受精卵各发育阶段的主要畸形形式
2.3 四倍体诱发
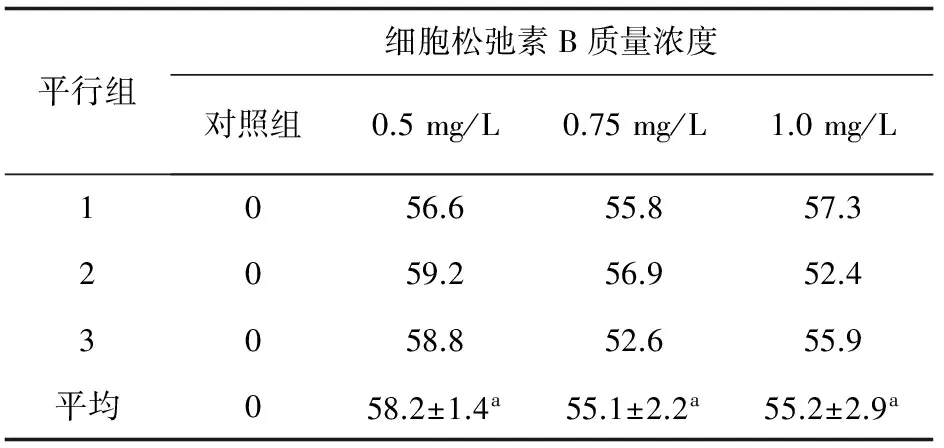
利用流式细胞术检测各处理组及对照组菲律宾蛤仔胚胎细胞的DNA含量(图1),结果表明,细胞松弛素B的使用显著抑制第一极体的释放,获得了四倍体胚胎,细胞松弛素B质量浓度为0.5~1.0 mg/L,四倍体诱导率为55.1%~58.2%(表5),无显著差异,其中,0.5 mg/L细胞松弛素B质量浓度下四倍体诱导率最高。
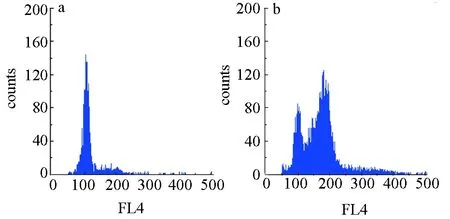
图1 对照组及细胞松弛素B处理组菲律宾蛤仔胚胎细胞的DNA含量分析a:对照组;b:细胞松弛素B处理组
3 讨 论
3.1 四倍体诱导
细胞松弛素B是贝类多倍体的主要诱导剂之一,通过阻遏微丝的形成,抑制受精卵第一次成熟分裂缢缩环的形成,导致第一极体不能释放,染色体加倍[12]。不同双壳类的卵子,因其大小及卵子结构的差异,对细胞松弛素B的敏感性不同,细胞松弛素B处理的适宜质量浓度不同[5]。Scarpa等[10]采用1.0 mg/L的细胞松弛素B抑制第一极体释放得到了17.4%的四倍体紫贻贝稚贝;常亚青等[11]采用0.4~1.0 mg/L的细胞松弛素B抑制第一极体诱发虾夷扇贝四倍体,得到22%~56.5%的诱导率,其中,0.8 mg/L的细胞松弛素B质量浓度下四倍体诱导率最高;王爱民等[9]以0.5~1.0 mg/L的细胞松弛素B抑制第一极体诱导四倍体马氏珠母贝四倍体,在0.7 mg/L的细胞松弛素B质量浓度下获得最高诱导率。本研究中,采用了0.5、0.75、1.0 mg/L 3种细胞松弛素B质量浓度,其诱导效果无显著差异,在同一质量浓度下,不同平行组之间的诱导率存在明显差异,可能由于胚胎发育同步性的差异导致,而卵的成熟度与受精过程是决定胚胎发育同步性的主要因素[13],因此,可通过对卵子的严格选择以及受精过程的精确控制进一步提高四倍体胚胎的诱导率。
3.2 细胞松弛素B的致畸效应
目前,鲜见对双壳类早期胚胎发育的系统研究,李永仁等[5]在高效诱导菲律宾蛤仔三倍体的基础上发现,细胞松弛素B抑制第二极体的释放,显著提高了胚胎的畸形率,且畸形率与处理强度呈正相关。在本研究中,随细胞松弛素B质量浓度的升高,菲律宾蛤仔各发育阶段的畸形率随之升高,同时,孵化率迅速下降。在初孵D形幼虫阶段,0.5 mg/L与0.75 mg/L细胞松弛素B处理组胚胎的畸形率比对照组平稳提高,而1 mg/L细胞松弛素B处理组胚胎的畸形率则大幅度提高,不适于菲律宾蛤仔四倍体诱导。对原肠期、担轮期和D形期胚胎的畸形形式进行统计,对照组主要有4种畸形形式,0.5~0.75 mg/L细胞松弛素B处理组胚胎包括6~7种畸形形式,而1 mg/L细胞松弛素B处理组胚胎涵盖全部10种畸形形式,其中包括分裂球破裂、胚胎解体等极端畸形形式。细胞松弛素B对胚胎的影响可能有两方面原因:细胞松弛素B本身具有毒性,受精卵内残留的细胞松弛素B影响微丝合成,从而影响正常的细胞的分裂过程,导致胚胎畸形;另一方面,第一极体的抑制,导致第二次成熟分裂异常,出现多种染色体分离形式,造成大量的非整倍体胚胎[12],而非整倍体胚胎难以正常发育。
发育进度方面,细胞松弛素B有效抑制了第一极体的释放,且处理组第二极体的释放率低于对照组,在4~8细胞期,处理组的发育速度较对照组慢1~2 min。Argyriou-Tirita等[14]认为,四倍体胚胎的DNA含量较普通二倍体胚胎高一倍,细胞分裂时,DNA复制量显著增加,纺锤体等有丝分裂器的负载增加,导致细胞分裂异常或分裂速度缓慢。
[1] 张国范, 闫喜武. 蛤仔养殖学[M].北京:科学出版社, 2010.
[2] 李永仁, 梁健, 郭永军,等. 天津沿海菲律宾蛤仔适养密度研究[J]. 海洋通报, 2015, 34(4):470-474.
[3] 闫喜武. 菲律宾蛤仔养殖生物学、养殖技术与品种选育[D].青岛:中国科学院海洋研究所, 2005.
[4] 李永仁. 栉孔扇贝四倍体诱导机理的初步研究[D].青岛:中国科学院海洋研究所, 2005.
[5] 李永仁, 邢克智, 郭永军. 细胞松弛素B对菲律宾蛤仔三倍体诱导及早期胚胎发育的影响[J]. 海洋通报, 2013, 32(3):328-332.
[6] 阙华勇, 张国范, 刘晓,等. 雄性四倍体与雌性二倍体杂交培育全三倍体长牡蛎的研究[J]. 海洋与湖沼, 2003, 34(6):656-662.
[7] Guo X, Allen S K. Viable tetraploids in Pacific oysterCrassostreagigas(Thunberg) produced by inhabiting polar body Ⅰ in eggs from triploids[J]. Mal Mar Biol Biotech, 1994, 3(1):42-50.
[8] 杨惠萍, 王如才, 郭希明. 栉孔扇贝四倍体的研究Ⅰ:CB诱导[J]. 青岛海洋大学学报:自然科学版, 1997, 27(2):166-172.
[9] 王爱民, 阎冰, 兰国宝,等. 三种诱导马氏珠母贝四倍体方法的比较[J]. 农业生物技术学报, 2003, 11(1):64-69.
[10] Scarpa J, Wada K, Komaru A. Induction of tetraploidy in mussels by suppression of polar body formation[J]. Nip Sui Gak, 1993, 59(12):2017-2023.
[11] 常亚青, 相建海, 王子臣. 药物诱导虾夷扇贝四倍体的初步研究[J]. 海洋与湖沼,2002,33(1):105-112.
[12] 李永仁, 阙华勇, 张国范. 抑制栉孔扇贝第一极体对受精卵染色体行为及胚胎倍性组成的影响[J]. 海洋科学,2005,29(8):66-70.
[13] 何毛贤, 沈琪, 林岳光,等. 合浦珠母贝三倍体的卵诱导四倍体[J]. 水产学报, 2000, 24(1):22-27.
[14] Argyriou-Tirita A, Romanakis K, Kroisel P. Asynchronous replication patterns of imprinted genes in triploid cells[J]. Acta Genet Med Gemellol, 1996,45(1/2):207-212.
TetraploidInductioninManilaClamRuditapesphilippenarumwithCytochalasinB
LI Yongren, LIANG Jian, GUO Yongjun
( Tianjin Key Laboratory of Aqua-ecology and Aquaculture, Department of Fishery Sciences, Tianjin Agricultural College, Tianjin 300384, China )
An effective chemical treatment, cytochalasin B (CB), was selected to induce tetraploid in fertilized eggs and to observe early embryonic development of Manila clamRuditapesphilippinarumat polar body I (PB1). The results showed that PB1 was inhibited effectively by CB at concentration of 0.5 mg/L,0.7 mg/L and 1.0 mg/L with induction rate as high as 58.2%,55.1% and 55.2%, respectively. In addition, there was no significant difference in the induction rate each other. With the increase in CB concentration, the development of early embryos was slightly slower, the malformation rate and abnormal form were significantly increased, and the hatching rate decreased significantly. As a result, the findings suggested that 0.5 mg/L of CB was the optimal concentration for tetraploid induction of Manila clam.
manila clamRuditapesphilippenarum; tetraploid; embryonic development
10.16378/j.cnki.1003-1111.2017.05.022
2016-07-20;
2016-12-25.
天津市应用基础与前沿技术研究计划(15JCYBJC30400);天津市科技特派员项目(16JCTPJC46200);天津市现代产业技术体系—水产—贝类养殖岗位项目(ITTFRS2017013);天津市农业科技成果转化与推广项目(201602050).
李永仁(1978-),男,副教授;研究方向:海洋生物学. E-mail:lyr1018@163.com.
S968.317
A
1003-1111(2017)05-0666-04
