褶牡蛎金属硫蛋白基因的克隆及组织表达分析
2017-12-18阎光宇孙继鹏易瑞灶苏永全
阎光宇,孙继鹏,易瑞灶,苏永全
( 1.国家海洋局 第三海洋研究所,福建 厦门 361005; 2.厦门大学,福建 厦门 361005;3.国家海洋局 海洋生物资源综合利用工程技术研究中心,福建 厦门 361005 )
褶牡蛎金属硫蛋白基因的克隆及组织表达分析
阎光宇1,2,3,孙继鹏1,3,易瑞灶1,3,苏永全2
( 1.国家海洋局 第三海洋研究所,福建 厦门 361005; 2.厦门大学,福建 厦门 361005;3.国家海洋局 海洋生物资源综合利用工程技术研究中心,福建 厦门 361005 )
金属硫蛋白是一类广泛存在于生物体中的低分子质量、富含半胱氨酸、高度诱导性的内源金属结合蛋白。采用RACE技术,首次获得了褶牡蛎金属硫蛋白基因的全长cDNA序列。该序列全长500 bp,由长54 bp的5′非翻译区,122 bp的3′非翻译区和324 bp的开放阅读框组成,共编码107个氨基酸。该蛋白序列中半胱氨酸含量丰富(28%),不含芳香族氨基酸,富含金属硫蛋白典型的Cys-X(1-3)-Cys结构,存在软体动物等无脊椎动物金属硫蛋白特征序列,是金属硫蛋白家族成员。荧光定量PCR法,测定褶牡蛎体内3种组织(内脏团、鳃、外套膜)中金属硫蛋白mRNA组织特异性表达以及重金属(Cd2+、Zn2+)慢毒胁迫效应。结果表明,金属硫蛋白mRNA在褶牡蛎内脏团中相对表达量最高;褶牡蛎内脏团金属硫蛋白mRNA表达量与重金属胁迫时间呈现出一定时间效应关系,从胁迫开始至7 d表现为正调,而7~10 d开始为负调,Cd2+胁迫和Zn2+联合Cd2+胁迫下金属硫蛋白 mRNA表达量显著增加,最大表达量为对照组的42.5倍(Cd),Zn2+联合Cd2+胁迫表现为拮抗作用。本试验结果为生产实践上在多种重金属污染下应用金属硫蛋白作为生物标志物监测水域污染状况,保护水生生态环境提供了依据。
褶牡蛎;金属硫蛋白;基因;组织表达
近年来,随着经济飞速发展和人类活动的加剧,海洋环境日趋恶化,海洋生态系统的结构和功能受到严重破坏[1]。尤其重金属Cd污染,具有持久性、高危害性和难治理性,并能沿着食物链传递,最终进入人体,直接危害人类健康和安全[2]。而在水环境中,由于 Cd 与 Zn 原子结构、离子、电负性均比较相近,二者往往共同存在。因此,在同一生物体内它们之间可能发生相互作用和干扰。相对于单一污染物的毒性试验,混合污染物的毒性试验则能更好地反映环境的实际污染状况。
金属硫蛋白是一类广泛存在于生物体中的低分子质量、富含半胱氨酸、高度诱导性的内源金属结合蛋白[3-5],主要参与体内微量元素的储存、转运和代谢,拮抗电离辐射,清除自由基以及对重金属具有解毒作用。大量研究证明,在重金属(Cd、Zn、Pb、Hg、Cu、Bi等)诱导下,生物体内金属硫蛋白含量会显著增加,而且这种诱导水平与环境中金属含量有直接相关性,可间接反映出环境中的金属水平。因此,20世纪70年代末就有人提出水生生物金属硫蛋白含量可作为指示环境污染物暴露和毒性效应早期报警的主要生物指示物[6-7]。但目前国内外的研究主要集中在单一重金属胁迫对组织中金属硫蛋白诱导产生的情况等方面[10,12,17],混合重金属胁迫下不同组织中金属硫蛋白的诱导动态变化研究不多。因此需进一步的研究来说明两种或更多种金属同时作用对组织中金属硫蛋白含量的影响。且目前对于混合物联合作用的研究大多进行的是急性试验(96 h),对于慢性和亚急性试验开展较少,这势必会导致评价结果的偏差。
营固着型和附着型生活的底栖双壳类海洋动物由于其分布广、活动性低、对环境中重金属有较强生物累积能力,能反映所在水域的污染状况,被认为是最好的检测金属硫蛋白指示的环境监测生物[8-12]。褶牡蛎(Alectryonellaplicatula)俗名蠔、蚝等,是中国东南沿海重要养殖经济贝类之一,营底栖生活,对环境中的重金属等污染物有较强的累积能力,能够较好地反映栖息地水体和底质的污染状况。目前,对牡蛎金属硫蛋白的研究尚处于起步阶段,对牡蛎金属硫蛋白cDNA序列报道主要集中在美洲牡蛎(Crassostreavirginica)[13]、近江牡蛎(C.ariakensis)[14]葡萄牙牡蛎(C.angulata)[15]和长牡蛎(C.gigas)[16-17],而对褶牡蛎金属硫蛋白 cDNA的序列尚未知。
本研究以底栖双壳类海洋动物——褶牡蛎为试验材料,通过RACE方法获得褶牡蛎金属硫蛋白cDNA序列,进行序列分析,与其他双壳类进行金属硫蛋白氨基酸序列比对,并构建进化树;应用Real-time PCR分析金属硫蛋白mRNA在褶牡蛎3种组织中的表达量;选择水体常见重金属污染离子(Cd2+,Zn2+)共同长时间(慢性试验)胁迫褶牡蛎,检测其内脏团组织中金属硫蛋白mRNA的较长时间的动态变化;以期为评价混合重金属联合对海洋贝类的安全性提出相应的毒理资料,为海洋环境监测指示体系的完善以及为金属硫蛋白金属诱导合成因素和机制的研究提供理论基础。
1 材料和方法
1.1 试验材料
试验用水为经过沉淀、砂滤、净化后的天然海水。
褶牡蛎取自福建省漳州市养殖场,将表面附着物清洗干净,在水箱中(每箱约60只,海水30 L)暂养2 d。选取生长健康、规格一致[壳长(8.50±1.00) cm,壳高(3.50±0.70) cm,总体质量(27.00±5.00) g ]的牡蛎作为试验对象。为避免残饵对金属吸附影响,暂养及试验期间不投喂,试验期间水温(18±1) ℃,盐度26~28,pH 8.0±0.2,溶解氧>8.5 mg/L,及时剔除死亡牡蛎。
1.2 试验方法
1.2.1 牡蛎不同组织取样
取15只褶牡蛎分为3组,分别解剖取褶牡蛎内脏团(肝胰腺等)、鳃、外套膜3种组织,于RNA保存液中-80 ℃保存,用于RNA的提取。
1.2.2 褶牡蛎金属硫蛋白 cDNA克隆
根据NCBI基因库中褶牡蛎相似物种的金属硫蛋白保守片段序列设计5′ 和3′ 端特异性引物 (表1中F1、R1) ,经PCR、产物回收、连接至克隆载体pMD19-T,pMD-19-MT委托深圳华大基因科技有限公司进行序列测定。
为得到褶牡蛎金属硫蛋白 cDNA全序列,采用cDNA末端快速扩增技术扩增褶牡蛎金属硫蛋白 cDNA的5′ 和3′ 末端。根据已得到金属硫蛋白基因序列设计特异性引物(表1中F1、R1)。5′ 和3′ 末端扩增分别使用TaKaRa 3′-Full RACE Core Set Ver.3.0和5′-Full RACE Kit (TaKaRa, Japan)。其中3′ RACE中PCR扩增引物为3′RACE Outer Primer和F1,5′RACE中PCR扩增引物为5′RACE Outer Primer和R1。PCR反应参数:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,30个循环,72 ℃ 1 min; 72 ℃延伸10 min。
受到水电站施工地理位置、地质条件以及经济技术的影响,那么这些因素也会对水轮发电机组运行状态造成影响。由于每个水电站都是专门设计的,使得不同水电站的水轮发电机组振动情况不尽相同,可比性较差,可见其振动故障具有不规则性。
经1.0% 琼脂糖凝胶电泳分离检测扩增产物后,用TaKaRa Purification Kit (TaKaRa, Japan) 回收PCR产物目的片段,连入克隆载体pMD19-T,转入感受态细胞大肠杆菌(Escherichiacoli)DH5α,所获阳性克隆由深圳华大基因科技有限公司进行序列测定。利用Contig软件对3′和5′测序结果进行拼接和重叠序列的去除,最终获得褶牡蛎金属硫蛋白cDNA全基因序列,并设计引物(F2/R2) 进行PCR验证。
1.2.3 褶牡蛎金属硫蛋白 cDNA序列分析
所得褶牡蛎金属硫蛋白 cDNA序列与NCBI Blast程序的BlastN(核酸数据库)、BlastX(蛋白数据库)进行比对分析,寻求与褶牡蛎金属硫蛋白cDNA高度同源序列。利用ORF Finder程序确定开放阅读框及相应的氨基酸序列;利用Conserved Domains网站预测蛋白保守区;利用Expasy中ProtParam和ProtScale进行蛋白理化性质预测分析;运用Motif Scan网站进行蛋白质基序预测分析;运用NCBI网站的BLAST工具进行氨基酸对比分析;运用DNA-MAN软件对其他物种的同源氨基酸进行多重比对;运用Clustal X 1.83和Mega 5.2软件中基于距离的邻接法构建系统进化树,重复验证1000次。
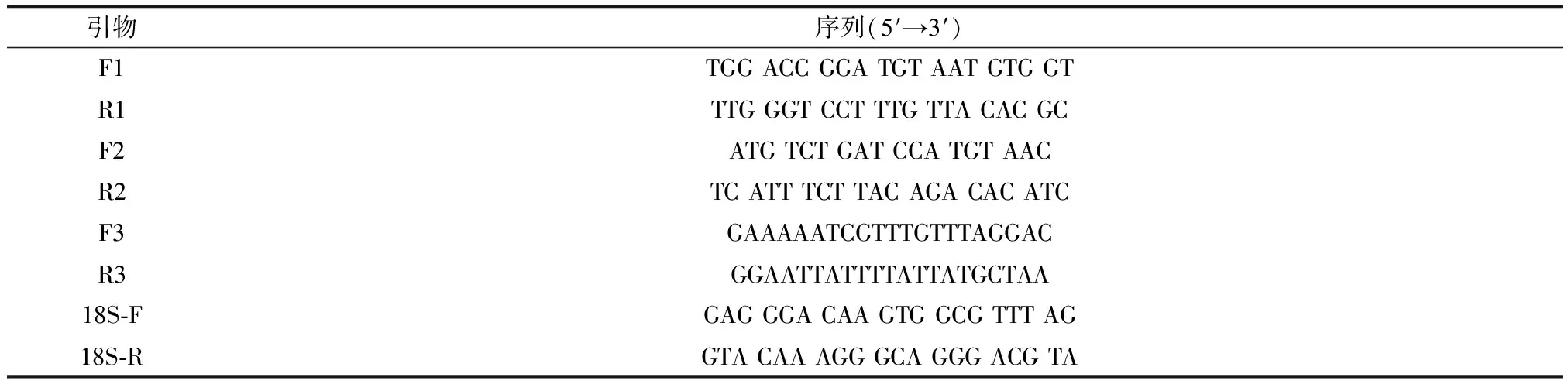
表1 褶牡蛎金属硫蛋白 cDNA克隆测序及Real-time PCR中所用引物
1.2.4 褶牡蛎3种组织金属硫蛋白mRNA表达
分别提取褶牡蛎3种组织(内脏团、鳃和外套膜)总RNA(TRIzol试剂盒),采用Real-time PCR分析褶牡蛎3种组织金属硫蛋白表达量,根据已得褶牡蛎金属硫蛋白cDNA基因序列设计特异性荧光定量引物(F3/R3),所用内参基因为18S(引物为18S-F/18S-R),按TaKaRa Prime-ScriptTMRT Reagent Kit with gDNA Eraser 试剂盒方法(TaKaRa, Japan) 进行反转录,选择SYBR® Premix Ex TaqTMKit(TaKaRa,Japan)进行Real-time PCR,并制作标准曲线,确定目的基因与内参基因的扩增效率相等,再分别对各组织金属硫蛋白的表达量进行相对定量。
1.2.5 不同重金属胁迫对褶牡蛎内脏团金属硫蛋白 mRNA影响
用CdCl2·2.5H2O和ZnSO4·7H2O分别配置成质量浓度为3.00 g/L和66.00 g/L母液,备用。共设置4个试验组,第1组为空白对照组,其余3组为重金属胁迫组:分别暴露于500 μg/L Cd2+、1200 μg/L Zn2+以及500 μg/L Cd2+和1200 μg/L Zn2+混合海水中(根据前期试验结果设置,待发表),每组试验组设置3个平行。采用半静态毒性试验法,每箱放置40个褶牡蛎,试验水体为30 L,不投饵,试验期间连续充氧,每日更新金属试验水体1次。
分别在试验开始后的0、2、4、7 d和10 d进行取样,每箱取5只褶牡蛎,取内脏团装入RNA保存液中,-80 ℃保存,采用Real-time PCR(方法同1.2.4) 对不同重金属诱导下内脏团中金属硫蛋白表达量进行相对定量。
1.2.6 数据处理
采用2-ΔΔCt法对荧光定量 PCR中金属硫蛋白 mRNA 表达量进行相对定量分析。采用 SPSS 13.0软件对褶牡蛎中金属硫蛋白 mRNA的组织分布和不同重金属诱导后的表达特征,用Tukey或者LSD(P<0.05)法进行单因子方差分析。
2 结 果
2.1 褶牡蛎金属硫蛋白 cDNA序列和褶牡蛎金属硫蛋白的理化性质
褶牡蛎金属硫蛋白 cDNA(GeneBank登录号:KP875559) 序列全长500 bp,包含324 bp的开放阅读框,长54 bp的5′非翻译区及122 bp的3′ 非翻译区,可编码107个氨基酸(图1) ,其中半胱氨酸含量28%,无芳香族氨基酸。图1中AATAAA为多聚腺苷酸加尾信号位点。用ProtParam和ProtScale工具对褶牡蛎金属硫蛋白的理化性质和亲水性进行预测,结果显示褶牡蛎金属硫蛋白的相对分子量为10.462 ku,分子式为C391H650N126O147S31,理论等电点为8.17,不稳定指数为30.13,属于稳定蛋白,脂肪指数为16.36,亲水性总平均值-0.239,为亲水性蛋白。 Motif Scan工具对褶牡蛎金属硫蛋白的氨基酸序列进行分析,结果表明,褶牡蛎金属硫蛋白具有典型的金属硫蛋白结构,其中包含了2个磷酸化位点(58~61,90~93),5个肉豆蔻酰基化位点(11~16,29~34,35~40,49~54,81~86),4个糖基化位点(6~9,67~70,78~81,99~102)。通过Conserved Domains分析,该基因编码的蛋白中含有保守的金属硫蛋白基序(图2) 。

图1 褶牡蛎金属硫蛋白基因cDNA全长及氨基酸序列前后方框内分别为起始密码子和终止密码子;*表示终止密码子;下划线标出的是多聚腺苷酸加尾信号位点.
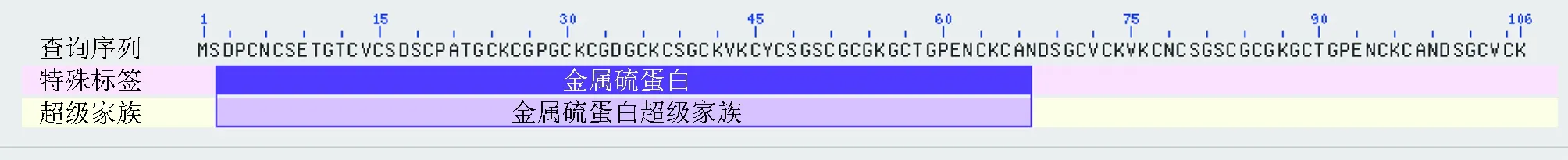
图2 褶牡蛎金属硫蛋白基因保守结构域预测
2.2 褶牡蛎金属硫蛋白氨基酸序列特征及进化树分析
使用Clustal X软件,将褶牡蛎金属硫蛋白氨基酸序列同其他7 种海洋双壳贝类金属硫蛋白氨基酸序列进行比对,分析结果显示,褶牡蛎金属硫蛋白同其他7种海洋贝类金属硫蛋白一致,在Cys的排列上显示出较高的保守性和同源性(图3) 。褶牡蛎金属硫蛋白富含金属硫蛋白典型的Cys-X(1-3)-Cys结构,其中Cys-X-Cys 13个,Cys-X-X-Cys 1个,Cys-X-X-X-Cys 8个,并具有软体动物相同的特征序列CKCXXXCXCX(X为除半胱氨酸以外的其他氨基酸) 。
由金属硫蛋白系统进化树分析显示(图4),褶牡蛎与GenBank中公布的软体动物汇集,其中与长牡蛎、近江牡蛎、三角帆蚌(Hyriopsiscumingii)以及葡萄牙牡蛎等海洋贝类的亲缘关系最近,与斑节对虾(Penaeusmonodon)、锯缘青蟹(Scyllaserrata) 等甲壳类动物,以及小家鼠 (Musmusculus)和人类 (Homosapiens)等高等脊椎动物相距较远,充分体现了物种之间的进化地位,与褶牡蛎的实际生物学分类地位基本一致。

图3 褶牡蛎与其他几种双壳贝类金属硫蛋白氨基酸的多序列比对结果

图4 基于金属硫蛋白蛋白序列构建的邻接系统进化树
2.3 褶牡蛎金属硫蛋白mRNA组织表达
褶牡蛎金属硫蛋白基因表达广泛存在于褶牡蛎各组织中,但表达量存在差异。以褶牡蛎18S为内参基因,通过荧光定量检测金属硫蛋白mRNA在各组织中的表达量(图5),研究结果发现,自然条件下鳃和外套膜组织中金属硫蛋白mRNA的表达量均显著低于内脏团(P<0.001)。由此可见,在自然水体条件下,褶牡蛎内脏团是金属硫蛋白的主要合成和代谢部位。
2.4 不同重金属胁迫下褶牡蛎内脏团金属硫蛋白 mRNA的差异性表达
经过 10 d的重金属胁迫(Zn2+、Cd2+和Zn2++Cd2+联合)试验,以18S为内参标基因,通过荧光定量检测重金属胁迫下褶牡蛎内脏团中金属硫蛋白mRNA在各时间点(0、2、4、7、10 d)的表达量(图6)。
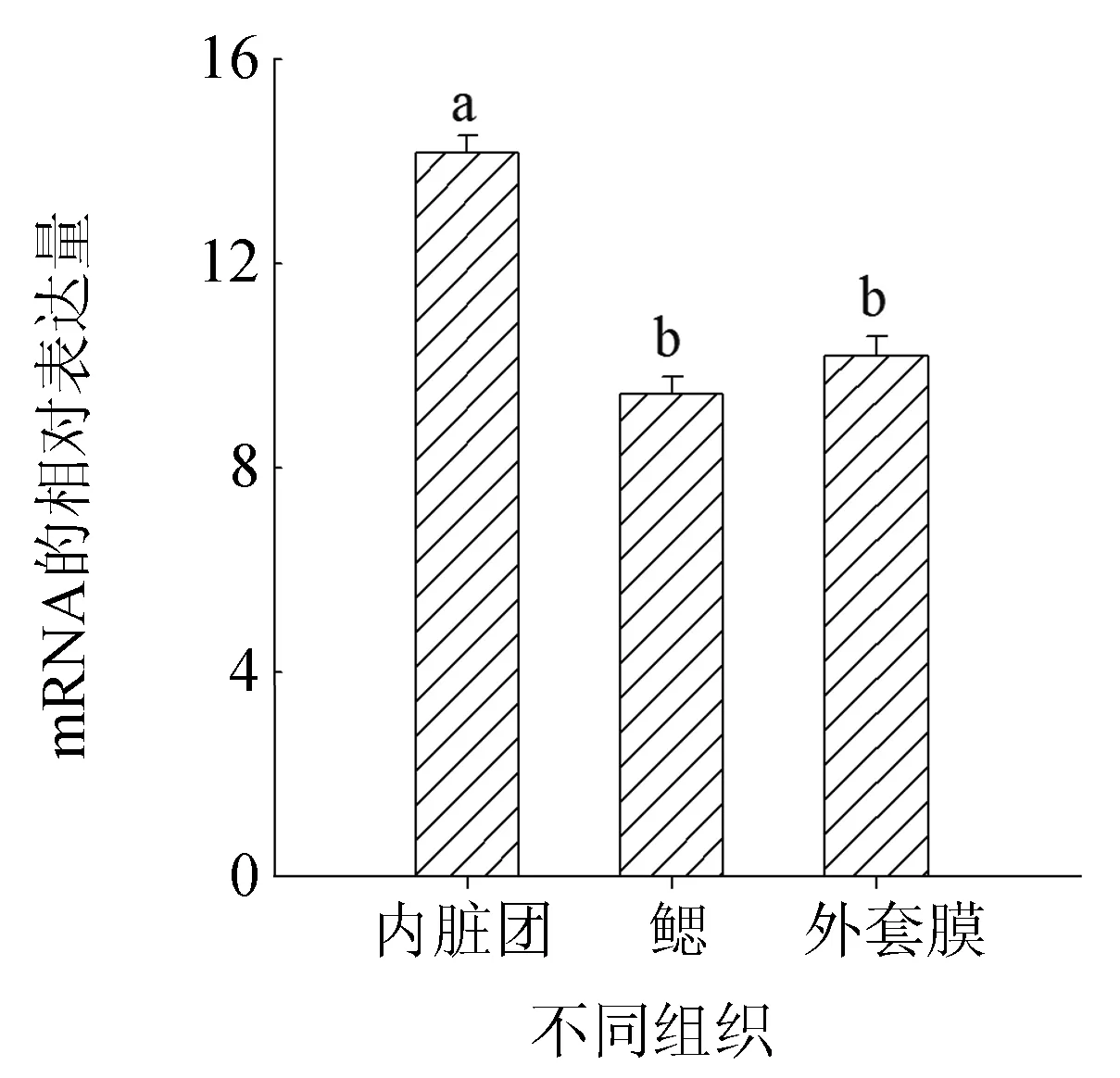
图5 褶牡蛎各组织中金属硫蛋白mRNA的差异性表达
由图 6可知,在整个试验期间(2~10 d) ,空白对照组褶牡蛎内脏团中金属硫蛋白 mRNA的表达量保持稳定;Cd2+和Zn2+联合Cd2+胁迫下,褶牡蛎金属硫蛋白 mRNA表达的动态变化趋势一致,均随胁迫时间延长呈现出时间—效应关系(倒“U”型),从胁迫开始至7 d,褶牡蛎金属硫蛋白 mRNA的表达水平为正调,而自7~10 d开始为负调。单独Zn2+胁迫对褶牡蛎金属硫蛋白 mRNA的转录表达影响相对于对照组均无显著差异,Cd2+胁迫则显著提高了褶牡蛎金属硫蛋白 mRNA的表达量(P<0.001),Cd2+胁迫使内脏团中金属硫蛋白 mRNA 的表达量在第7 d达到高峰,为对照组的42.5倍。Zn2+联合Cd2+胁迫下褶牡蛎金属硫蛋白 mRNA的表达量也显著增加(P<0.001) ,但整个试验期间其表达量均低于单独Cd2+胁迫试验组,第7 d达到高峰,为对照组的28.1倍。
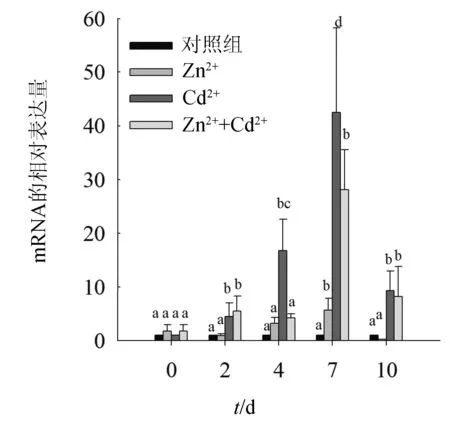
图6 不同金属胁迫下内脏团组织中金属硫蛋白 mRNA表达量的变化
3 讨 论
3.1 褶牡蛎金属硫蛋白 cDNA序列和结构
金属硫蛋白是一个超家族,同一家族的金属硫蛋白共同拥有特有的序列特征并在进化上相关[18]。由系统进化树和海洋软体动物金属硫蛋白氨基酸序列比对可知,本研究所得褶牡蛎金属硫蛋白含有双壳软体动物金属硫蛋白共有的特征序列,与海洋双壳软体动物金属硫蛋白同源性最高。
软体动物金属硫蛋白氨基酸序列中一般有一段为CKCXXXCXCX的保守特征序列[19-22],褶牡蛎中也有1段序列符合此模式,有些软体动物中存在2~3段此模式的序列[21]。一般情况下,软体动物金属硫蛋白 C-末端有一个保守的特征序列C-X-C-X(3)-C-T-G-X(3)-C-X-C-X(3)-C-X-C-K[19-22],褶牡蛎C段的CkCsgCkvkCyCsgsCgCgkgCTGpenCk CandsgCvCK序列与该模式在后半段有所不同,但褶牡蛎却与美洲牡蛎、长牡蛎、葡萄牙牡蛎的金属硫蛋白在C段的序列模式完全相同,这与进化树中显示的结果一致,说明物种越接近,序列模式越相似。
3.2 褶牡蛎金属硫蛋白不同组织表达的差异性
褶牡蛎金属硫蛋白基因表达广泛存在于生物体各组织中,如心脏、血液、大脑、肝脏、鳃等[2,23-26]。本研究结果显示,金属硫蛋白 mRNA存在于褶牡蛎内脏团、鳃和外套膜组织中,且表达量存在组织差异,金属硫蛋白 mRNA基底表达水平在内脏团最高,其次为鳃、外套膜,说明在自然水体中,褶牡蛎体内非必需金属元素的解毒以及金属硫蛋白合成的重要场所都是内脏团,许多双壳贝类体内重金属分布的检测结果也间接证明了这一结论[27-28]。
3.3 褶牡蛎内脏团金属硫蛋白在不同重金属胁迫下的差异性表达
大量研究表明在重金属的胁迫条件下,生物体内金属硫蛋白的表达量与水环境和体内组织中的重金属胁迫呈现出一定的时间/剂量效应关系[26,28-32]。本研究结果显示,随着胁迫时间延长,Cd2+胁迫下褶牡蛎内脏团中金属硫蛋白mRNA的表达量显著增高,而Zn2+胁迫对其影响并不显著,说明褶牡蛎金属硫蛋白主要参与Cd2+平衡,并使牡蛎免受Cd2+的毒性作用。此外,褶牡蛎金属硫蛋白基因表达量随Cd2+胁迫时间变化呈现出时间—效应关系,褶牡蛎金属硫蛋白mRNA表达水平在Cd2+胁迫仅第2 d迅速显著增加,并且在胁迫第7 d达到最大值,最终在胁迫第10 d回归到较低水平。Cd2+胁迫下褶牡蛎金属硫蛋白mRNA表达量的动态变化趋势暗示牡蛎组织一旦接触Cd2+,除了显示出压力信号,立即通过增加金属硫蛋白基因表达和蛋白合成启动解毒过程[33]。通常,在金属胁迫前期 (2~7 d)金属硫蛋白 mRNA表达水平为正调,随着胁迫延长 (至10 d) 开始为负调,这可能因为由于更长时间的金属胁迫,牡蛎体内重金属积累达到毒性阈值,从而损害金属硫蛋白的生物合成[34]。
Zn2+为生物体必需元素,参与金属硫蛋白的合成,但本试验中Zn2+胁迫对褶牡蛎各组织中金属硫蛋白表达量mRNA影响并不显著,表明除重金属胁迫时间和含量外,金属硫蛋白表达水平还与金属类型有关,相对于Zn2+,Cd2+对牡蛎金属硫蛋白具有较强的诱导能力,这与许多文献中报道结果一致[29,35-36],此外,这也可能与牡蛎体内具有较高的Zn2+本底值有关。
本研究结果显示,Zn2+联合Cd2+胁迫时,褶牡蛎内脏团中金属硫蛋白mRNA的表达量相对于对照组显著增加(P<0.001),且褶牡蛎金属硫蛋白mRNA表达量的动态变化趋势与单独Cd2+胁迫下褶牡蛎金属硫蛋白mRNA表达量的动态变化趋势一致,表明水中Cd2+联合Zn2+可诱导褶牡蛎内脏团内金属硫蛋白mRNA的合成和表达,但整个试验期间Cd2+联合Zn2+试验组中金属硫蛋白mRNA表达量均低于单独Cd2+胁迫试验组,联合金属表现明显的拮抗作用,拮抗作用机理认为重金属离子在进入细胞前先与细胞表面的接收点结合[37],在水环境中,Cd2+与Zn2+往往共存,由于原子结构相似,离子半径、电负性都比较相近[38],Zn2+和Cd2+在与细胞表面活性位点结合时存在竞争,结果降低了重金属离子在体内的积累,导致混合重金属离子的毒性下降[39],金属硫蛋白mRNA表达量降低可以灵敏地反映这一现象。对河蚌(Anodontacygnea)[40]、滨螺(Littorinasaxatilis)[37]、摇尾幼虫[41]的研究结果也证实了这一点。然而,侯丽萍等[42]研究发现Cd2+与Zn2+对草鱼(Ctenopharyngodonidella)鱼种的联合毒性24、48 h均为拮抗作用,在96 h表现为协同作用。周彦锋等[43]试验结果也表明Zn2+的存在可以增强Cd2+诱导鲫鱼(Carassiusauratus)组织中金属硫蛋白合成的能力。影响重金属联合毒性作用的因素很多,如环境介质、指示生物的类别和水体中理化指标等[41],这就增加了金属硫蛋白作为检测指标应用的难度,因此进一步深入研究,也是下一步研究的重点。
4 结 论
本研究从褶牡蛎中获得了金属硫蛋白cDNA全序列,褶牡蛎金属硫蛋白cDNA的组织分布情况,以及褶牡蛎内脏团mRNA在不同重金属胁迫下的差异性表达。金属硫蛋白基因表达受金属含量、暴露时间调控,表明金属硫蛋白表达与褶牡蛎抵抗外界环境中重金属胁迫有关,这一结果为阐明金属硫蛋白作用机理和激活途径,探讨其在褶牡蛎应激反应过程中的作用提供了客观证据。此外,该研究结果显示金属硫蛋白基因是一个潜在的镉污染生物标志物,为生产实践上应用金属硫蛋白作为生物标志物监测水域污染状况,保护水生生态环境提供了依据。
[1] 谷河泉, 陈庆强. 中国近海持久性毒害污染物研究进展 [J]. 生态学报, 2008, 28(12):6243-6251.
[2] Guinot D, Urea R, Pastor A, et al. Long-term effect of temperature on bioaccumulation of dietary metals and metallothionein induction inSparusaurata[J]. Chemosphere, 2012, 87(11):1215-1221.
[3] Hamer D H. Metallothionein[J]. Annual Review of Biochemistry, 1986(55):913-951.
[4] Dunn M A, Blalock T L, Cousins R J. Metallothionein[J]. Proceedings of the Society for Experimental Biology & Medicine Society for Experimental Biology & Medicine, 1987, 185(2):107-119.
[5] Kägi J H R. Overview of metallothionein[J]. Methods in Enzymology, 1991(205):613-626.
[6] Livingstone D R. Biotechnology and pollution monitoring:use of molecular biomarkers in the aquatic environment [J]. Journal of Chemical Technology & Biotechnology, 1993, 57(3):195-211.
[7] 叶属峰, 陆健健. 无脊椎动物金属硫蛋白(MTs)多样性及其生态服务功能 [J]. 生物多样性, 2000, 8(3):317-324.
[8] 苏文, 吴惠丰, 廖春阳, 等. 锌铅暴露条件下菲律宾蛤仔消化腺和鳃内金属和金属硫蛋白的变化 [J]. 中国科学院大学学报, 2010, 27(4):456-462.
[9] 刘维青. 海湾扇贝金属硫蛋白 cDNA 序列克隆及其在镉和鳗弧菌诱导下的表达研究[D]. 青岛:中国海洋大学, 2005.
[10] 李春娣, 颜文, 龙爱民, 等. Cu暴露条件下翡翠贻贝(Pernaviridis)消化腺内金属和类金属硫蛋白的变化 [J]. 环境科学, 2007, 28(8):1788-1795.
[11] Roesijadi G. Metallothionein induction as a measure of response to metal exposure in aquatic animals [J]. Environmental Health Perspectives, 1994, 102(s12):91-95.
[12] Bebianno M J, Serafim M A. Comparison of metallothionein induction in response to cadmium in the gills of the bivalve molluscsMytilusgalloprovincialisandRuditapesdecussatus[J]. Science of the Total Environment, 1998, 214(2):83-88.
[13] Ridlington J W, Fowler B A. Isolation and partial characterization of a cadmium-binding protein from the American oyster (Crassostreavirginica) [J]. Chemico-Biological Interactions, 1979, 25(2):127-138.
[14] 张妍. 近江牡蛎(Crassostreahongkongensis)谷胱甘肽 S 转移酶和金属硫蛋白基因 cDNA 克隆及原核表达研究 [D]. 广州:暨南大学, 2012.
[15] Ren F, Jiang H, Sun J, et al. Cloning, characterization, expression, and copper sensitivity of the metallothionein-1 gene in the Chinese mitten crab,Eriocheirsinensis[J]. Molecular Biology Reports, 2011, 38(4):2383-2393.
[16] Tanguy A, Mura C, Moraga D. Cloning of a metallothionein gene and characterization of two other cDNA sequences in the Pacific oysterCrassostreagigas(CgMT1) [J]. Aquatic Toxicology, 2001, 55(1):35-47.
[17] Choi Y K, Jo P G, Choi C Y. Cadmium affects the expression of heat shock protein 90 and metallothionein mRNA in the Pacific oyster,Crassostreagigas[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2008, 147(3):286-292.
[18] Binz P A, Kägi J H R. Metallothionein:molecular evolution and classification[M]. Metallothionein Ⅳ: Birkhäuser Basel,1999:7-13.
[19] 刘维青, 倪多娇, 宋林生, 等. 海湾扇贝 (Argopectenirradians) 金属硫蛋白基因的克隆与分析 [J]. 海洋与湖沼, 2006, 37(5):444-449.
[20] 高祥刚, 赫崇波, 李云峰, 等. 文蛤金属硫蛋白基因的克隆与分析 [J]. 水产学杂志, 2009, 22(4):8-11.
[21] 袁一鸣, 汪桂玲, 李家乐. 三角帆蚌金属硫蛋白基因的克隆及序列分析 [J]. 动物学杂志, 2009, 44(5):98-104.
[22] 唐仁生, 夏建红, 王玉梅, 等. 大珠母贝金属硫蛋白 cDNA 克隆与序列特征分析 [J]. 安徽农业科学, 2009, 37(7):2888-2890,2990.
[23] Cho Y S, Lee S Y, Kim K Y, et al. Two metallothionein genes from mud loachMisgurnusmizolepis(Teleostei; Cypriniformes):gene structure, genomic organization, and mRNA expression analysis [J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2009, 153(4):317-326.
[24] Siscar R, Torreblanca A, del Ramo J, et al. Modulation of metallothionein and metal partitioning in liver and kidney ofSoleasenegalensisafter long-term acclimation to two environmental temperatures [J]. Environmental Research, 2014(132):197-205.
[25] Wu S M, Da Z Y, Kuo C H. Expression of mt2 and smt-B upon cadmium exposure and cold shock in zebrafish (Daniorerio) [J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2008, 148(2):184-193.
[26] Wang C, Zhang F, Cao W, et al. The identification of metallothionein in rare minnow (Gobiocyprisrarus) and its expression following heavy metal exposure [J]. Environmental Toxicology and Pharmacology, 2014, 37(3):1283-1291.
[27] Pennec G L, Pennec M L. Evaluation of the toxicity of chemical compounds using digestive acini of the bivalve molluscPectenmaximusL. maintained alive in vitro [J]. Aquatic Toxicology, 2001, 53(1):1-7.
[28] 霍礼辉, 陈彩芳, 林志华,等. 镉诱导缢蛏(Sinonovaculaconstricta)体内金属硫蛋白基因变化规律研究 [J]. 海洋与湖沼, 2012, 43(4):723-728.
[29] Cheuk W K, Chan P C Y, Chan K M. Cytotoxicities and induction of metallothionein (MT) and metal regulatory element (MRE)-binding transcription factor-1 (MTF-1) messenger RNA levels in the zebrafish (Daniorerio) ZFL and SJD cell lines after exposure to various metal ions [J]. Aquatic Toxicology, 2008, 89(2):103-112.
[30] Huang G Y, Ying G G, Liang Y Q, et al. Expression patterns of metallothionein, cytochrome P450 1A and vitellogenin genes in western mosquitofish (Gambusiaaffinis) in response to heavy metals [J]. Ecotoxicology and Environmental Safety, 2014, 105(7):97-102.
[31] Gao A, Wang L, Yuan H. Expression of metallothionein cDNA in a freshwater crab,Sinopotamonyangtsekiense, exposed to cadmium [J]. Experimental and Toxicologic Pathology, 2012, 64(3):253-258.
[32] Xiang D F, Zhu J Q, Jin S, et al. Expression and function analysis of metallothionein in the testis ofPortunustrituberculatusexposed to cadmium [J]. Aquatic Toxicology, 2013, 140/141(18):1-10.
[33] Migliarini B, Campisi A M, Maradonna F, et al. Effects of cadmium exposure on testis apoptosis in the marine teleostGobiusniger[J]. General & Comparative Endocrinology, 2005, 142(1/2):241-247.
[34] Rhee J S, Raisuddin S, Hwang D S, et al. Differential expression of metallothionein (MT) gene by trace metals and endocrine-disrupting chemicals in the hermaphroditic mangrove killifish,Kryptolebiasmarmoratus[J]. Ecotoxicology & Environmental Safety, 2009, 72(1):206-212.
[35] Klaassen C D, Lehman-McKeeman L D. Regulation of the isoforms of metallothionein [J]. Biological Trace Element Research, 1989, 21(1):119-129.
[36] 吴众望, 潘鲁青. 重金属离子对凡纳滨对虾肝胰脏 MT 含量的影响 [J]. 水产学报, 2005, 29(5):715-718.
[37] Vranken G, Tiré C, Heip C. The toxicity of paired metal mixtures to the nematodeMonhysteradisjuncta(Bastian, 1865)[J]. Marine Environmental Research, 1988, 26(26):161-179.
[38] Daka E R, Hawkins S J. Interactive effects of copper, cadmium and lead on zinc accumulation in the gastropod molluscLittorinasaxatilis[J]. Water, Air & Soil Pollution, 2006, 171(1/4):19-28.
[39] Otitoloju A A. Evaluation of the joint-action toxicity of binary mixtures of heavy metals against the mangrove periwinkleTympanotonusfuscatus, varradula, (L.)[J]. Ecotoxicology & Environmental Safety, 2002, 53(3):404-415.
[40] Hemelraad J, Kleinveld H A, Roos A M, et al. Cadmium kinetics in freshwater clams. Ⅲ. Effects of zinc on uptake and distribution of cadmium inAnodontacygnea[J]. Archives of Environmental Contamination & Toxicology, 1987, 16(1):95-101.
[41] Morley N J, Crane M, Lewis J W. Toxicity of cadmium and zinc toDiplostomumspathaceum(Trematoda:Diplostomidae) cercarial survival[J]. Archives of Environmental Contamination & Toxicology, 2001, 31(11):1211-1217.
[42] 侯丽萍, 马广智. 镉与锌对草鱼种的急性毒性和联合毒性研究[J]. 淡水渔业, 2002, 32(3):44-46.
[43] 周彦锋, 吴伟, 胡庚东, 等. 镉锌联合诱导金属硫蛋白在鲫鱼肝脏和肾脏中的表达[J]. 生态环境学报, 2009, 18(3):811-817.
CloningandExpressionofMetallothioneinGeneinOysterOstreaplicatula
YAN Guangyu1,2,3, SUN Jipeng1, 3, YI Ruizao1, 3, SU Yongquan2
( 1.Third Institute of Oceangraphy, State Oceanic Administration, Xiamen 361005, China; 2.Xiamen University, Xiamen 361005, China; 3.Engineering Research Center for Marine Biological Resource Comprehensive Utilization, State Oceanic Administration, Xiamen 361005, China )
A 500 bp full-length cDNA sequence of metallothionein (named as Op-MT) gene as a kind of low molecular weight, rich cysteine, and highly induced endogenous metal binding protein was obtained from oysterOstreaplicatulausing rapid amplification of cDNA end (RACE) technique, which consists of a 54 bp 5′untranslated region (UTR), a 122 bp 3′UTR and a324 bp open reading frame (ORF). The Op-MT-clone encodes 107 amino acids, and in the encoded protein, no any aromatic amino acid, was found and the cysteines accounted for 28% of the total amino acid, demonstrating the typical structure with Cys-X(1-3)-Cys type. The predicted protein sequence analysis showed that Op-MT as a member of the metallothionein family is characterized by the conserved features of invertebrate′s MTs. Moreover, real-time PCR showed the differential expression of MT mRNA in the oyster, with the maximum in hepatopancreas under the natural state. Additionally, MT mRNA levels demonstrated an up-regulation in a time-dependent manner due to Cd2+and Zn2++ Cd2+exposure during 2—7 day and down-regulated during 7—10 day. MT mRNA had no obvious difference to the control when exposed to zinc and the effect of cadmium and the zinc combining cadmium were significant (P<0.001), and the maximum expression level of MT mRNA appeared when exposed to cadmium (42.5 times for reference). Zinc exerted antagonistic effects on uptake of cadmium. The findings show MT gene is a potential pollution of cadmium in biological markers and provide a basis for the application of MT in the production practice to monitor the water pollution status and protection of the aquatic environment.
Ostreaplicatula; metallothionein; gene; tissue expression
10.16378/j.cnki.1003-1111.2017.05.016
2016-08-02;
2016-10-08.
厦门海洋研究开发院共建项目(K150104);国家海洋局第三海洋研究所基本科研业务费专项资金资助项目(海三科2013014).
阎光宇(1983—),女,助理研究员;研究方向:海洋功能产物.E-mail:guangyu0502@163.com.通讯作者:孙继鹏(1980—),男,助理研究员;研究方向:海洋药物化学.E-mail:jpsun@tio.org.cn.
S917
A
1003-1111(2017)05-0634-08
