脊尾白虾不同发育期线粒体基因组甲基化特征分析
2017-12-18李志辉赖晓芳阎斌伦
薛 蓓,张 培,李志辉,赵 莲,赖晓芳,阎斌伦,高 焕
( 1.淮海工学院 海洋生命与水产学院,江苏省海洋生物技术重点实验室,江苏 连云港 222005;2.江苏省海洋生物产业技术协同创新中心,江苏 连云港 222001;3.江苏省农业种质资源保护与利用平台,江苏 南京 210014 )
脊尾白虾不同发育期线粒体基因组甲基化特征分析
薛 蓓1,2,3,张 培1,2,3,李志辉1,2,3,赵 莲1,2,3,赖晓芳1,2,3,阎斌伦1,2,3,高 焕1,2,3
( 1.淮海工学院 海洋生命与水产学院,江苏省海洋生物技术重点实验室,江苏 连云港 222005;2.江苏省海洋生物产业技术协同创新中心,江苏 连云港 222001;3.江苏省农业种质资源保护与利用平台,江苏 南京 210014 )
为研究不同发育阶段脊尾白虾线粒体基因组表观遗传学特征,本研究在筛选硫化测序引物的基础上,对不同发育期的脊尾白虾线粒体基因组甲基化特征进行了分析。经引物筛选验证,选取了4对引物在脊尾白虾的受精卵、幼体期、仔虾期和成虾期共4个发育期进行甲基化特征的分析,结果表明,除ND5基因3′端序列(21#引物扩增区)无甲基化现象外,COX3基因的起始区序列(13#引物扩增区)、COX3基因的3′端序列(16#引物扩增区)和ND5基因5′端序列(19#引物扩增区)均存在不同程度的甲基化现象。其中,COX3基因的起始区序列仅在受精卵孵化期和幼体期存在甲基化现象,COX3基因3′端序列在除受精卵外的其他3个时期均存在甲基化现象,且以上甲基化率随个体发育阶段的提高呈下降趋势;ND5基因5′端序列在4个不同发育期均存在甲基化现象,但甲基化率无显著差异。甲基化主要发生在COX3基因和ND5基因位点上,推测脊尾白虾在生长发育过程中通过调节线粒体基因组甲基化来调节机体能量代谢过程。本研究首次从整个发育周期角度探讨了线粒体基因组甲基化特征,以期为进一步揭示甲壳类生长发育相关遗传机制提供帮助。
脊尾白虾;线粒体基因组;不同发育期;甲基化
在组蛋白修饰、DNA甲基化和染色质重塑等表观遗传学现象中,DNA甲基化是最为常见并且研究最为深入的[1]。在真核生物的细胞中,除核基因组DNA(nDNA)外,其线粒体细胞器中也含有DNA(mtDNA);mtDNA虽仅占细胞内总DNA的不到1%,但其转录产物对于发挥细胞正常功能是必不可少的[2-3]。以前针对DNA甲基化的研究多集中在nDNA上[4-5],而近年来关于mtDNA甲基化的研究也逐渐增多;但这些研究多集中在衰老[6]、神经退行性疾病[7]及肿瘤[8]等疾病方面,有关不同发育期下mtDNA甲基化的研究鲜见报道,在甲壳动物中更未见报道。
脊尾白虾(Exopalaemoncarinicauda)是我国特有的养殖经济种类,广泛分布于我国沿海区域,尤以黄海、渤海区域最为丰富[9],产量可占我国东部沿海地区池塘混养模式产量的三分之一,且养殖规模有进一步扩大的趋势[10]。因此,近年来为加强其生长发育及免疫等生理生化机制方面的了解,以其为对象的研究也逐渐增多[11-13]。在前期的研究中,已获得脊尾白虾线粒体基因组的全序列[14],并发现该虾在应答饥饿时线粒体基因组会产生甲基化现象[15],但是,在其他情况下线粒体基因组的甲基化特征还不清楚,尤其在不同发育阶段下,而这对于了解线粒体基因组在脊尾白虾等甲壳类生物生长发育过程中的作用及其表达调控机制非常重要。因此,笔者希望通过对脊尾白虾不同发育阶段线粒体基因组甲基化特征的研究,为加深对甲壳类生长发育相关遗传机制的认识提供帮助。
1材料与方法
1.1 试验材料
自养殖池塘中选取性腺发育成熟的脊尾白虾个体,保持温度(27±1) ℃、盐度29±1、pH 8.0±0.5的恒定养殖条件,在实验室中进行养殖并取材。选取受精卵[16]、幼体期[17]、仔虾期和成虾期4个不同发育阶段,每个发育期选取6个样本。
1.2 线粒体基因组DNA提取及处理
利用基因组DNA提取试剂盒(MiniBEST Universal Genomic DNA Extraction Kit, TaKaRa)分别提取各发育期的总DNA(其中含有线粒体基因组DNA),受精卵、幼体期和仔虾期样本采用整体液氮研磨后提取,成虾期样本则取其腹部肌肉进行研磨后提取DNA。利用甲基化检测试剂盒(EpiMarkTM, New England Biolabs Inc.)对提取的基因组进行重亚硫酸盐处理以获得处理后的线粒体基因组DNA,并以处理后的基因组DNA为PCR模板进行BSP引物的验证和后续各不同发育期脊尾白虾的甲基化特征分析。
1.3 硫化测序(BSP)引物的筛选及验证
根据实验室前期设计的引物[14],选取10对(引物3、8、11、12、13、16、19、21、33和48)扩增稳定的硫化测序引物(表1),用于对处理后基因组DNA的扩增,筛选扩增稳定的引物对脊尾白虾线粒体基因组DNA的甲基化情况进行分析。引物名称中的数字为线粒体基因组全序列中对应的序列区间。
采用如下PCR体系进行扩增:总体积25 μL,含10×PCR buffer 2.5 μL,Mg2+(25 mmol/L) 1.5 μL,dNTP (10 mmol/L) 0.5 μL,Taq DNA聚合酶(5 U/μL) 0.5 μL, Forward Primer (10 mmol/L) 1 μL,Reverse Primer (10 mmol/L) 1 μL,ddH2O 15 μL 及处理后的基因组DNA 3 μL。利用Touchdown PCR程序进行扩增:95 ℃ 30 s; 95 ℃ 15 s,55 ℃ 30 s,68 ℃ 45 s(其中退火温度每个循环降低1 ℃,进行10个循环后再以45 ℃固定退火温度进行30个循环);68 ℃ 5 min;4 ℃保存。
PCR产物经1.5%的琼脂糖凝胶电泳验证后,对有扩增条带的片段进行切胶回收,利用pEASY-T3载体进行克隆转化后,送上海生工生物工程有限公司测序,并通过对比测序序列与原序列确认是否为线粒体基因组的扩增产物。
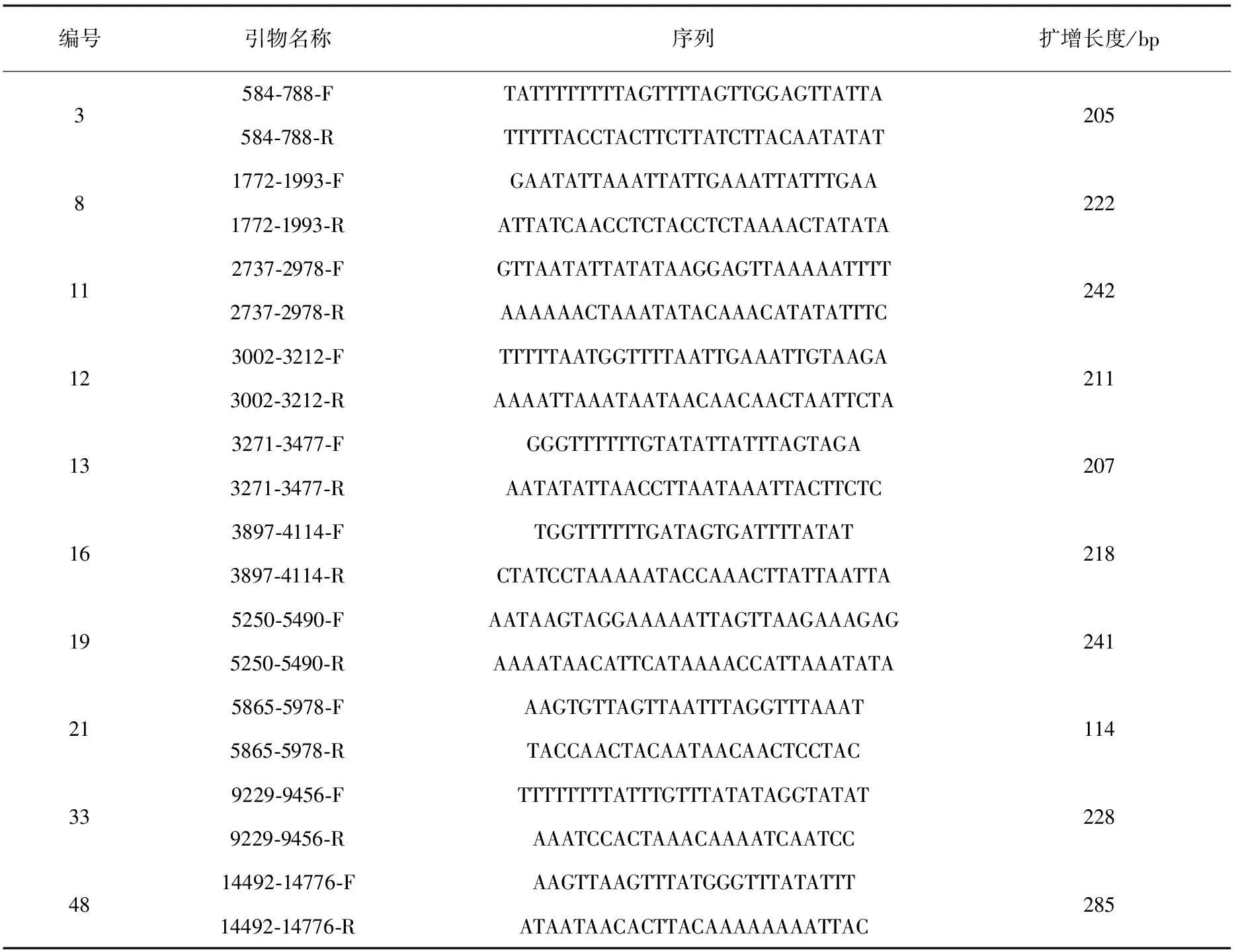
表1 脊尾白虾线粒体基因组BSP引物
1.4 数据分析
将测序获得的处理后线粒体基因组DNA序列与原序列通过在线软件QUMA(http://quma.cdb.riken.jp/)进行比对分析以确认甲基化的有无及其相应特征,并计算相应的甲基化率,其中:
总甲基化率/%=(甲基化胞嘧啶位点个数/总胞嘧啶位点个数)×100%
CpG位点甲基化率/%=(甲基化CpG位点个数/总CpG位点个数)×100%
CpHs位点甲基化率/%=(甲基化CpHs位点个数/总CpHs位点个数)×100%
2 结 果
2.1 硫化测序引物的筛选结果
以各发育期混合DNA为模板的甲基化验证后发现,10对硫化测序引物中,13、16、19和21共4对引物扩增稳定,这4对引物的具体遗传信息特征如下:
引物13(13#)扩增区域位于COX3(细胞色素氧化酶亚基3)基因的起始区序列,序列全长207 bp,其中包含CpG位点4个,CpHs(CpA/CpT/CpC)位点46个;引物16(16#)扩增区域位于COX3基因的3′端序列和ND3基因的起始区序列,序列全长218 bp,其中包含CpG位点5个,CpHs位点46个;引物19(19#)扩增区域位于ND5(还原型辅酶Ⅰ脱氢酶亚基5)基因的5′端序列,序列全长241 bp,其中包含CpG位点5个,CpHs位点60个;引物21(21#)扩增区域位于ND5基因的3′端序列,序列全长114 bp,其中包含CpG位点4个,CpHs位点22个。
通过对不同发育期脊尾白虾基因组DNA的硫化测序结果分析发现,在COX3基因的起始区序列和3′端序列以及ND5基因的5′端序列存在甲基化现象,而在ND5基因的3′端不存在甲基化现象。
2.2 不同发育期脊尾白虾的甲基化特征
对4个不同发育期(受精卵、幼体期、仔虾期和成虾期)脊尾白虾的甲基化特征分析发现,3对硫化测序引物的扩增序列的甲基化不仅发生在CpG位点,也发生在CpHs位点。但3个序列区间在具体的甲基化率等方面存在不同,具体如下:
COX3基因起始区序列(引物13#)仅在受精卵和幼体期各有1个个体存在甲基化,而其他发育期均未发现甲基化现象,受精卵的甲基化率高于幼体期(表2)。

表2 不同发育期脊尾白虾线粒体基因组甲基化特征
COX3基因的3′端序列(引物16#)在受精卵中未发现甲基化现象,在幼体期、仔虾期和成虾期分别有3个、1个和1个个体存在甲基化现象,且随着脊尾白虾的发育,甲基化率呈现下降的趋势(表2);ND3基因的起始序列(引物16#)中未发现甲基化现象。
ND5基因5′端(引物19#)在4个不同发育期脊尾白虾中均存在甲基化现象,只是在受精卵和幼体期取样的6个个体均存在甲基化现象,而在仔虾期和成虾期各有2个个体存在甲基化现象。然而,19#引物的扩增序列在不同发育期的甲基化率不存在明显的差异,单就甲基化位点来看并无明显规律(表2)。
3 讨 论
3.1 不同发育期脊尾白虾线粒体基因组的甲基化水平
在生物体的生长发育过程中,DNA甲基化可以通过直接或间接的方式参与到基因的转录调控作用中,对基因表达具有重要的协同作用[18-19]。生物体内某些核基因在不同发育期的表达量存在差异[20-21],而这种差异与其甲基化水平存在一定的相关性[20]。那么,mtDNA在不同发育期中的甲基化水平是否存在差异?已有的研究表明,疾病[22]、衰老[7,23]、环境因子胁迫[24]和饥饿[15]等因素均可能影响mtDNA甲基化。本研究中通过对脊尾白虾线粒体基因组甲基化水平的研究,发现其在不同发育期的甲基化水平存在差异,且随着个体的发育,在甲基化个体数或总甲基化率水平上呈现降低的趋势,这可能是由于随着生物体的生长发育,其生命活动所需能量增多,而线粒体作为生物体的能量中心,其基因组甲基化水平的降低有利于相关基因的表达。
3.2 不同发育期脊尾白虾COX3基因的甲基化情况
COX3基因的起始区序列(引物13#)及COX3基因的3′端序列(引物16#),在不同发育期的脊尾白虾mtDNA的甲基化情况均表现为随生物体发育甲基化程度降低的整体趋势。细胞色素氧化酶是线粒体内膜呼吸链的重要组成[25],因此这也说明在脊尾白虾的发育过程中,生物体通过调节自身mtDNA甲基化程度来调节能量代谢。但是,这两个序列区间的甲基化情况还略有差异,COX3基因的起始序列在受精卵表现为较高的甲基化率,而COX3基因的3′端序列在该时期则并无甲基化现象;相反COX3基因的3′端序列在仔虾期及成虾期均存在甲基化现象,而COX3基因的起始序列则并无甲基化现象。说明同一基因的不同区间在同一发育阶段的甲基化现象也存在不同,线粒体基因组甲基化的具体机理仍需进一步研究。
3.3 不同发育期脊尾白虾ND5基因的甲基化情况
还原型辅酶Ⅰ脱氢酶是电子进入电子传递链的主要位点,为线粒体内三磷酸腺苷的形成提供约40%的质子,在氧化磷酸化系统中发挥着重要的作用[26-27]。但脊尾白虾在4个不同发育期中ND5基因的5′端序列(引物19#)均表现为较高的甲基化率,且各发育期之间不存在显著差异;而ND5基因的3′端序列(引物21#)在4个发育阶段则均无甲基化现象。这进一步说明同一基因的不同区间在同一发育阶段的甲基化现象存在不同。另外,已有的研究结果显示[15],不同的饥饿期下ND5基因的5′端序列无甲基化现象,而ND5基因的3′端序列存在甲基化现象,这说明ND5基因可能在不同发育阶段甲基化较为稳定,而饥饿胁迫应激后为甲基化现象的高发区。
此外,试验中发现,同一发育期的6个个体在不同区间的甲基化发生情况存在较大的不同,一方面可能是因为取材时并未区分各发育期的具体Ⅰ~Ⅵ期,而同一发育期内的甲基化也存在变化,这仍需要进一步研究;另一方面基因组甲基化具有一定的可遗传性[28],因而不同个体间可能存在遗传上的差异,这需要进一步扩大样品量并进行深入的研究。
[1] Lee T, Zhai J, Meyers B C. Conservation and divergence in eukaryotic DNA methylation[J]. Proceedings of the National Academy of Sciences, 2010, 107(20):9027-9028.
[2] 刘振山, 冯云, 薛志刚, 等. 线粒体DNA与DNA甲基化[J]. 生物学杂志, 2013, 30(5):77-80.
[3] Iacobazzi V, Castegna A, Infantino V, et al. Mitochondrial DNA methylation as a next-generation biomarker and diagnostic tool [J]. Molecular Genetics & Metabolism, 2013, 110(2):25-34.
[4] Laird P W. The power and the promise of DNA methylation markers [J]. Nature Reviews Cancer, 2003, 3(3):253-266.
[5] Dehan P, Kustermans G, Guenin S, et al. DNA methylation and cancer diagnosis:new methods and applications [J]. Expert Review of Molecular Diagnostics, 2009, 9(7):651-657.
[6] Mawlood S K, Dennany L, Watson N, et al. Quantification of global mitochondrial DNA methylation levels and inverse correlation with age at two CpG sites [J]. Aging, 2016, 8(2):1-6.
[7] Wong M, Gertz B, Chestnut B A, et al. Mitochondrial DNMT3A and DNA methylation in skeletal muscle and CNS of transgenic mouse models of ALS[J]. Front Cell Neurosci,2013(7):279.
[8] Feng S, Xiong L, Ji Z, et al. Correlation between increased ND2 expression and demethylated displacement loop of mtDNA in colorectal cancer[J]. Mol Med Rep, 2012, 6(1):125-130.
[9] 王绪峨. 脊尾白虾繁殖生物学的初步观察[J]. 动物学杂志, 1987, 22(1):7-10.
[10] Xu W, Xie J, Shi H, et al. Hematodinium infections in cultured ridgetail white prawns,Exopalaemoncarinicauda, in eastern China [J]. Aquaculture, 2010(300):25-31.
[11] Duan Y F, Jian L, Zhe Z, et al. Characterization of ADP ribosylation factor 1 gene fromExopalaemoncarinicauda, and its immune response to pathogens challenge and ammonia-N stress [J]. Fish & Shellfish Immunology, 2016(55):123-130.
[12] Zhang C S, Li F H, Xiang J H. Effect of salinity on growth and first sexual maturity ofExopalaemoncarinicauda(Holthuis, 1950) [J]. Chinese Journal of Oceanology & Limnology, 2014, 32(1):65-70.
[13] 梁俊平, 李健, 李吉涛, 等. 不同温度对脊尾白虾胚胎发育与幼体变态存活的影响[J]. 生态学报,2013, 33(4):1142-1152.
[14] Shen X, Sun M, Wu Z, et al. The complete mitochondrial genome of the ridgetail white prawnExopalaemoncarinicaudaHolthuis, 1950 (Crustacean:Decapoda:Palaemonidae) revealed a novel rearrangement of tRNA genes[J]. Gene, 2009, 437(1):1-8.
[15] 高焕, 赵莲, 薛蓓, 等. 脊尾白虾线粒体基因组应答饥饿的甲基化特征分析[J].水产学报, 2015, 39(7):953-960.
[16] 王绪峨.脊尾白虾早期胚胎发育以及温、盐度与其孵化的关系[J]. 水产学报,1989,13(1):59-64.
[17] 梁象秋, 李亚娟, 周昭曼. 脊尾白虾的幼体发育[J]. 水产学报, 1988,12(2):157-168.
[18] Grunau C, Renault E, Rosenthal A, et al. MethDB—a public database for DNA methylation data[J]. Nucleic Acids Research, 2001, 29(1):270-274.
[19] Jones P A. Functions of DNA methylation:islands, start sites, gene bodies and beyond[J]. Nature Reviews Genetics, 2012, 13(7):484-492.
[20] Huang Y Z, Zhan Z Y, Sun Y J, et al. Intragenic DNA methylation status down-regulates bovine IGF2, gene expression in different developmental stages[J]. Gene, 2014, 534(2):356-361.
[21] Wang R L, Li J, Staehelin C, et al. Expression analysis of two P450 monooxygenase genes of the tobacco cutworm moth (Spodopteralitura) at different developmental stages and in response to plant allelochemicals[J]. Journal of Chemical Ecology, 2015, 41(1):111-119.
[22] Pirola C J, Gianotti T F, Burgueo A L, et al. Epigenetic modification of liver mitochondrial DNA is associated with histological severity of nonalcoholic fatty liver disease [J]. Gut, 2013, 62(9):1356-1363.
[23] Dzitoyeva S, Hu C, Manev H. Effect of aging on 5-hydroxymethylcytosine in brain mitochondria [J]. Neurobiology of Aging, 2012, 33(12):2881-2891.
[24] Byun H M, Panni T, Motta V, et al. Effects of airborne pollutants on mitochondrial DNA methylation [J]. Particle & Fibre Toxicology, 2013, 10(1):18.
[25] Muntyan M S, Cherepanov D A, Malinen A M, et al. Cytochrome cbb3 of Thioalkalivibrio is a Na+-pumping cytochrome oxidase[J]. Proceedings of the National Academy of Sciences, 2015, 112(25):7695-7700.
[26] Hunte C, Zickermann V, Brandt U. Functional modules and structural basis of conformational coupling in mitochondrial complex I[J]. Science, 2010, 329(5990):448-451.
[27] Braun H P, Binder S, Brennicke A, et al. The life of plant mitochondrial complex I[J]. Mitochondrion, 2014(19):295-313.
[28] Eichten S, Borevitz J. Epigenomics:methylation′s mark on inheritance [J]. Nature, 2013, 495(7440):181-182.
MethylationProfileinMitochondrialGenomeofRidgetailWhitePrawnExopalaemoncarinicaudainResponsetoDifferentDevelopmentalStages
XUE Bei1,2,3, ZHANG Pei1,2,3, LI Zhihui1,2,3, ZHAO Lian1,2,3, LAI Xiaofang1,2,3,YAN Binlun1,2,3, GAO Huan1,2,3
( 1.Jiangsu Key Laboratory of Marine Biotechnology, College of Marine Life and Fisheries, Huaihai Institute of Technology, Lianyungang 222005, China; 2.Co-Innovation Center of Jiangsu Marine Bio-industry Technology, Lianyungang 222001, China; 3.The Jiangsu Provincial Platform for Conservation and Utilization of Agricultural Germplasm, Nanjing 210014, China )
BSP (Bisulfite sequencing PCR) primer pairs were screened in order to analyze the methylation profile of the mitochondria genome in response to different developmental stages in the ridgetail white prawnExopalaemoncarinicauda. Within ten synthesized BSP primer pairs, four primer pairs were selected for further studies because of their repeatable PCR amplification merits, including 13th (located in the 5′ end initiation zone of COX3), 16th (located in the 3′ sequence of COX3), 19th (located in the 5′ sequence of ND5) and 21st (located in the 3′ sequence of ND5). The methylation profile of different individuals at different developmental stages (fertilized eggs, larval, post larval and adult stages) were analyzed, using the above 4 primer pairs. The results showed that the methylation in both CpG sites and non-CpG sites were found in the 5′ and 3′ sequence of COX3 and the 5′ sequence of ND5, but not in the 3′ sequence of ND5. The 5′ sequence of COX3 was methylated at fertilized eggs and larval stage, while the 3′ sequence of COX3 was methylated at larval, post larval and adult stages. Additionally, the methylation ratio was decreased with the increasing of development stage for above two sequences of COX3. The 5′ sequence of ND5 was methylated in the all four developmental stages, and no significant differences for methylation ratio were found among different developmental stages. In view of the biology function of COX and ND genes which expression productions were responsible for maintaining the respiratory electron-transport chain in mitochondria, it is inferred that the function of methylation of mitochondrial genome in ridgetail white prawn is to regulate the energy metabolism during developmental stage.
Exopalaemoncarinicauda; mitochondrial genome; different developmental stage; methylation
10.16378/j.cnki.1003-1111.2017.05.015
2016-09-13;
2016-12-06.
江苏高校优势学科建设工程项目(PAPD);江苏省高等学校自然科学研究重大项目(17KJA240001);江苏省“六大人才高峰”创新人才团队项目(2016-HYGC-CXTD-004);江苏省2015年度普通高校研究生科研创新计划项目(KYLX15_1486);连云港市产学研合作项目(CXY1517).
薛蓓(1992-),女,硕士研究生;研究方向:海洋生物繁殖与遗传育种学.E-mail:malvsy@163.com.通讯作者:高焕(1976-),男,教授;研究方向:甲壳类种质资源开发及利用.E-mail:huanmr@163.com.
S917
A
1003-1111(2017)05-0628-06
