花刺参胚胎和幼体发育的形态观察
2017-12-18王怀洪严俊贤冯永勤方再光王世锋周永灿舒培军
王怀洪,严俊贤,冯永勤,方再光 ,王世锋,周永灿,舒培军
( 1.海南大学 海洋学院,热带生物资源教育部重点实验室,海南省热带水生生物技术重点实验室,海南 海口 570228; 2.南海水产研究所,热带水产研究开发中心,海南 三亚 572018;3.中国水产科学研究院 南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东 广州 510300 )
花刺参胚胎和幼体发育的形态观察
王怀洪1,严俊贤2,3,冯永勤1,方再光1,王世锋1,周永灿1,舒培军1
( 1.海南大学 海洋学院,热带生物资源教育部重点实验室,海南省热带水生生物技术重点实验室,海南 海口 570228; 2.南海水产研究所,热带水产研究开发中心,海南 三亚 572018;3.中国水产科学研究院 南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东 广州 510300 )
为提高花刺参育苗技术,对花刺参自受精卵发育到稚参的形态变化进行了观察研究,详细描述了胚胎发育各个时期的形态特征。通过阴干、流水刺激法对成熟亲参进行人工催产,得到大量的受精卵。在水温27~30 ℃及盐度33.0~35.0室内水泥池进行花刺参幼体培育。花刺参受精卵经5 h发育成囊胚,7 h进入旋转囊胚期,9 h进入原肠期,31 h完成胚胎发育变态为耳状幼体,并经10 d的生长发育进入樽形幼体,第20 d变态为稚参。由结果可知,花刺参的幼体的健康状况与其水体腔和胃部生长发育状况密切相关,水体腔和胃部发育良好,花刺参的健康状况则佳,有利于幼体的变态与存活。
花刺参;胚胎;幼体;发育
花刺参(Stichopusherrmanni,曾用拉丁名为S.variegatus)又名黄肉参、白刺参、猪虫参等,属楯手目、刺参科、刺参属,为南海常见可食用海参。花刺参具有较高的药用价值与食用价值,经研究分析,其体内含有大量能增强人体免疫的成分,包括三萜类物质、多糖类物质等,具有很好的食疗与保健作用[1],国内市场需求量甚大。然而,由于过渡捕捞和栖息地遭人为破坏,花刺参野生资源严重衰减,依靠野外捕捞的花刺参已无法满足市场需求。
国外较早便有花刺参繁育等方面研究的报道,Conand[2]对花刺参的活动行为学进行了研究,分析了花刺参性成熟的相关数据,为花刺参的繁育技术研究打下了基础;Tehranifard等[3]发现花刺参的性成熟与光周期和积温有关;同时,对野生花刺参的资源调查方面也有相关的报道[4-6],对保护该物种天然资源起到积极作用。目前我国南方地区主要以糙海参(Holothuriascabra)为主要养殖开发对象[7-9],而对花刺参的研究主要集中在医药与营养方面[10-11],其养殖方面的报道极少[12]。花刺参作为南方热带海参品种,其营养价值为南海食用海水参中最高[13],却尚未形成规模化人工培育。为有效保护及开发利用花刺参资源,笔者对花刺参胚胎及幼体发育进行了研究,为花刺参全人工繁育与养殖技术的开发提供科学依据。
1 材料与方法
1.1 亲参促排
花刺参亲参为海南省琼海市海域捕捞的天然个体,体长25~32 cm,体质量860~1500 g。亲参采回后置于6 m×2 m×1.2 m的室内养殖水泥池中,水深1.1 m,池水水温27~30 ℃(平均28.3 ℃)。投喂海参亲参配合饲料,对花刺参亲参进行营养强化培养。待性腺发育成熟后,利用阴干、流水刺激法进行人工诱导,即先将亲参阴干处理1 h,接着流水刺激45 min,最后放入池中待产。配子释放并完成受精后,用过滤海水进行洗卵,清除多余精子,将亲参自池中捞出。
1.2 胚胎发育镜检
囊胚期至原肠期阶段每隔15 min取样一次。每次取20个样本进行观察,在光学显微镜下用电子目镜拍摄记录各阶段的形态,并测量样品大小。
1.3 幼体培育与生长发育镜检
小耳幼体的育苗密度为100个/L,24 h连续微充气,投喂球等边金藻(Isochrysisgalbana)、牟氏角毛藻(Chaetocerosmuelleri)、海洋酵母粉及螺旋藻(Spirulinasp.)粉,每日7:30和18:00各投饵一次,鲜活单胞藻投喂量为1500个/L,海洋酵母粉及螺旋藻粉的总投喂量为2 g/m3。观察到有20%~30%的幼体发育至樽形幼体时,投放聚乙烯波纹板附着基。在幼体培育期间,每日于8:00和20:00分别取样1次,观察幼体发育形态、摄食、病变等情况,同时注意观察其他有害水生动物对幼体存活的影响。每次取20个样本进行观察,在光学显微镜下用电子目镜拍摄记录各阶段的形态并测量样品大小。
2 结 果
2.1 花刺参人工诱导与受精
花刺参亲参经过7 d的营养强化培养,通过刺激海参吐脏随机抽样检查其性腺发育情况,镜检得亲参性腺发育成熟,均可用于人工催产。观察发现,成熟雄性个体的精子活动能力强,其性腺腺管饱满,呈乳白色;而成熟雌性个体的卵子饱满且色泽均匀,卵泡清晰,其性腺腺管饱满,呈黄色半透明。确定性腺成熟后,于当日18:00进行人工诱导,直至次日0:00雄参开始排精,30 min后雌参开始产卵,被释放的配子在水中自然受精。镜检发现,个别受精卵出现多精入卵现象,部分出现该现象的受精卵最终将停止发育并死亡。花刺参胚胎和幼体发育过程见表1。
2.2 胚胎发育
生殖细胞:花刺参卵细胞大小为115~165 μm,整体圆润平滑,能够观察到细胞核中的核物质;花刺参的精子活动活跃,精子活动时难以分辨其尾部。
受精卵:受精后约23 min,受精卵的卵膜逐渐变厚(图1a),然后依次出现卵膜举起(图1b)、极体排放(图1c)的现象,其中第一极体和第二极体排放间隔时间为4~7 min。
卵裂期:受精后约41 min,出现第一次细胞分裂,即二分裂,之后的卵裂间隔时间约为40 min,256细胞期则持续了2 h。由图1可见,花刺参的胚胎细胞排列不紧密,细胞之间出现较大的间隙,细胞的形状多变不规则(图1d~k)。
囊胚期:花刺参囊胚直径为160~210 μm(图1l),囊胚期的持续时间约为1.5 h,发育至囊胚后期其形状由正圆形逐渐生长为略呈椭圆形。
旋转囊胚期:花刺参受精卵经过约7 h的发育生长至旋转囊胚期。胚胎利用表面纤毛摆动而旋转,经过3 h的旋转脱膜,囊胚自卵膜中破膜而出,并在水中自由游动。同时,花刺参囊胚形态发生较明显的变化,明显呈椭圆形(图1m)。
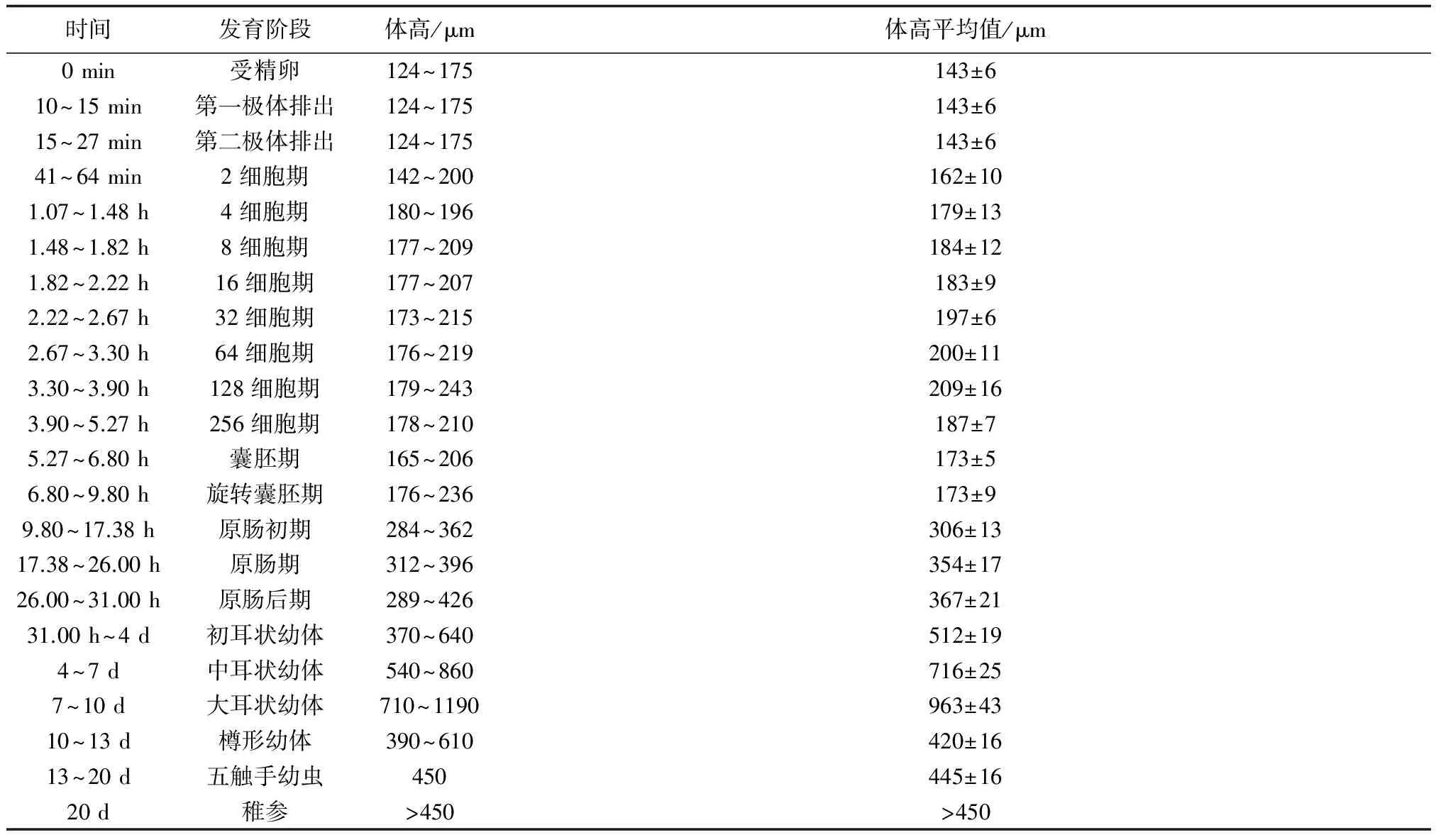
表1 花刺参胚胎和幼体发育过程(28.3 ℃)
原肠期:旋转囊胚经过3 h的发育,花刺参胚胎进入原肠期,其胚胎呈椭圆形,植物极一端细胞增多,出现加厚并内陷逐渐形成胚孔和原肠(图1n),同时出现间质细胞弥散分布在体腔内;原肠继续发育向腹面弯曲并在腹面开口形成了口和食道,原肠中段则分化成为胃和肠,原来的胚孔则变为肛门;体表纤毛逐渐脱落,剩下体侧的纤毛保留而形成纤毛环;间质细胞不断增殖分化,体色加深,从侧面观察其形态逐渐变得与人耳相似。受精卵经过约31 h的生长,完成了胚胎发育而开始进入幼体阶段。
花刺参初耳状幼体:受精后约31 h,花刺参由原肠期进入初耳状幼体期,此期花刺参的消化系统以基本分化完成,胃部变大呈水滴形,咽部壁变厚,进食时可见咽部肌肉收缩。口和肛门附近的前后端纤毛带向中部弯曲生长,分别形成了口前环和口后环,口前环和口后环上的两侧纤毛带则向两侧弯曲,形成肛前臂和口后臂;尾端平,两侧尖角处向外生长突出形成后侧臂,骨片于后侧臂的尖端处形成,颜色变深(图2a)。此期幼体开始摄食,在生产实践中开始需要投入开口饵料以帮助幼体完成生长发育。
中耳状幼体:胚胎发育至第4 d,花刺参进入中耳状幼体。幼体体侧纤毛带不断向两侧生长突起,形成后侧臂和间背臂,口前臂、肛前臂、后背臂和前背壁的轮廓也逐渐清晰。骨片随着幼体生长变大变厚,颜色略加深。胃部明显增大,摄食量也随之增加,此时期的幼体培养需要加大饵料投喂量。左体腔和右体腔出现在胃部的左右两边,在显微镜观察下呈条状。水体腔体积增大,位于食道的左侧。后侧臂不断向后生长延伸,尾部由平坦变为略呈内凹。幼体生长至中耳状后期,体高可达到850 μm(图2b)。
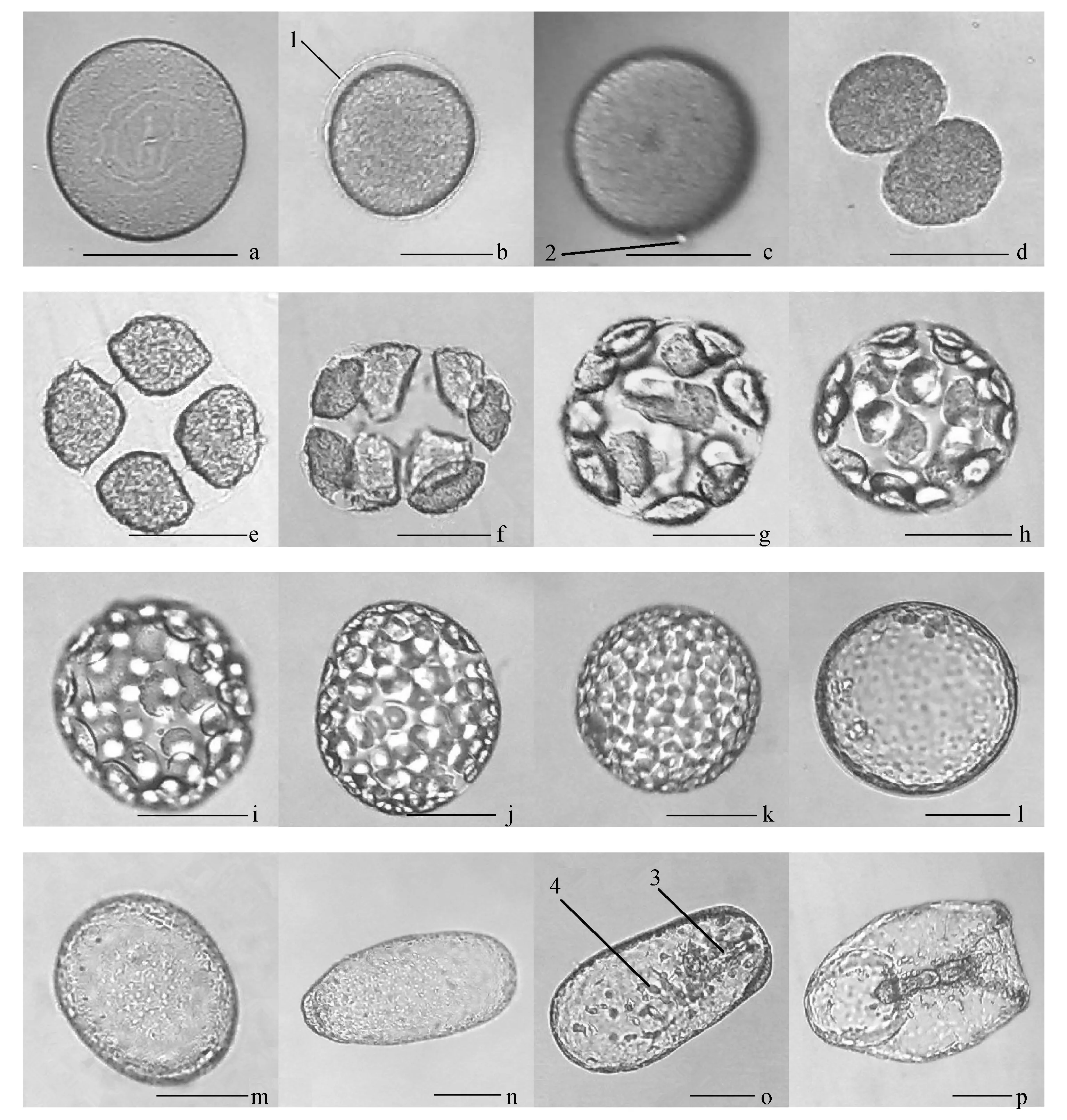
图1 花刺参胚胎发育a.受精卵;b.卵膜举起;c.第一极体排出;d.2细胞期;e.4细胞期;f.8细胞期;g.16细胞期;h.32细胞期;i.64细胞期;j.128细胞期;k.256细胞期;l.囊胚期;m.旋转囊胚期;n.原肠初期;o.原肠期;p.原肠后期.1.卵膜;2.极体;3.原肠;4.间质细胞. 标尺为100 μm.
大耳状幼体:胚胎发育至第7 d变成大耳状幼体,幼体的大小达到最大,体高可达1200 μm。体侧各臂已发育完全,轮廓清晰,各壁尖端处形成半透明的球状体,共有5对。后侧臂尖端处的骨片不断生长加厚,呈类似三角形的块状结构,与球状体挤压于后侧臂狭窄的空间内。左右体腔逐渐变得明显,水体腔则生长形成初级口触手原基和辐水管原基。胃部非常膨大,呈卵圆形,食物在胃腔内不断旋转消化。大耳状幼体后期,幼体体形开始向中心收缩,各臂变短,胃部也明显缩小,表明幼体开始向樽形幼体变态(图2c)。
樽形幼体:10日龄花刺参幼体进入樽形幼体期。幼体的体形不断缩小,各臂逐渐变小直至消失,身体形状呈椭圆形,5对球状体均匀分布于身体两侧,尾端两侧的骨片变大。纤毛部分脱落,纤毛带随身体收缩而形成横向生长的纤毛带,纤毛带颜色略深。口触手原基发育成口触手,和辐水管弯曲团缩体腔内,在显微镜观察下可以看到口触手在体腔内略有蠕动。胃部继续缩小呈圆形,樽形幼体摄食量大幅下降或甚至停食。该时期体高缩小至大耳状幼体的一半左右,为390~610 μm(图2d)。
五触手幼体:幼体发育至第13 d进入五触手幼体时期。纤毛继续脱落,最后纤毛带消失,幼体失去依靠纤毛摆动浮游的能力而下沉。口触手已可完全从口伸出体外,进行附着运动和摄食。体形进一步缩小,体色由半透明明显加深至灰绿色,球状体也完全消失,体表骨片开始形成(图2e)。此期幼体开始从摄食浮游单胞藻转为摄食底栖藻类,摄食量逐渐增大,身体也随之生长加快。
稚参:20日龄开始进入稚参期,稚参表皮长出大量的肉质尤突,体表显得凹凸不平。稚参第一管足从后端发育完全,并与口触手共同完成爬行和摄食运动,摄食量大大提高,体增长加快,此期要注意投喂充足的饵料以供幼虫生长的营养所需(图2f)。

图2 花刺参幼体发育a.小耳状幼体;b.中耳状幼体;c.大耳状幼体d.樽形幼体;e.五触手幼体;f.稚参. 1.胃;2.肛门;3.咽部;4.口;5.口前环;6.口后环;7.食道;8.左体腔;9.右体腔;10.水体腔;11.骨片;12.肛前臂;13.口前臂;14.后侧臂;15.后背臂;16.间背臂;17.前背臂;18.球状体;19.辐水管;20.口触手;21.第一管足.标尺为100 μm.
3 讨 论
3.1 多精入卵对花刺参幼体发育的影响
笔者观察并记录了花刺参胚胎与幼体发育的时间和幼体各个阶段的形态变化,观察发现,亲参释放配子后,精子数量大于卵子数量,在花刺参受精卵细胞受精过程中,精子通过顶体反应进入卵细胞,而卵细胞则会释放某种物质来导致覆盖在卵子表面的多个精子同时发生顶体反应,从而促使多精入卵的出现。已有研究表明,多精入卵可致胚胎停止发育,或导致胚胎出现非整体而产生胚胎的早期死亡[14]。为保证单个精核与卵核的融合,在长期进化过程中,海洋无脊椎动物形成复杂的对应多精入卵机制。棘皮动物中,目前有关棘皮动物阻止多精入卵机制的研究较多,棘皮动物主要通过两个反应阻止多精入卵:①快封闭反应,精子进入卵细胞迅速促发膜电位改变,引起膜外精子与卵细胞识别和融合障碍;②慢封闭反应,通过皮层反应形成厚而硬的受精膜,防止多精入卵[15]。在仿刺参(Apostichopusjaponicus)研究中发现,仿刺参精子钻入卵子之后,卵子也会发生皮层反应,形成受精膜,这表明刺参也有慢封闭反应,以阻止多精入卵发生[16]。在仿刺参受精及早期胚胎发育过程的细胞学研究中观察到多精入卵现象,进入的精子能形成雄原核,然而未发现染色体分离异常现象[17]。其推测仿刺参具有适应多精入卵机制,即进入卵子的精子均能形成雄原核,但雌原核只与其中一个雄原核发生联合,多余的雄原核在卵内被逐渐吸收或崩解。因此,虽然花刺参受精过程中出现部分多精入卵现象,但并未造成大量胚胎发育停止。
3.2 花刺参耳状幼体的健康发育标志
在花刺参幼体发育过程中,大耳幼体辐水管原基、球状体的形成与发育可作为判断其是否能顺利完成变态和幼体能否健康生长的重要标志,与饵料的投喂状况相关。如Dautov[18]指出,没有出现球状体对海参幼体部分结构的形成不利,进一步对参苗的变态和附着产生消极影响;Ramofafia等[19]观察白底辐肛参(Actinopygamauritiana)幼体生长时发现,合理投喂高质量饵料和完善的养殖管理有助于球状体的形成;严俊贤等[8]对糙海参的研究表明,在幼体培育过程中,投喂适量鲜活饵料有助于提高大耳幼体球状体的出现。本试验在幼体人工培育阶段,投喂适量海洋酵母粉、螺旋藻粉,既有助于球状体和辐水管较早形成,同时也能提高幼体发育速率、变态率及成活率。
3.3 花刺参耳状幼体与其他海参幼体的差异
花刺参幼体与糙海参幼体形态上有一定差别,糙海参从小耳幼体开始在幼体后端中线向后长出一个较大的突起物,该结构到中耳幼体已非常清晰,根据其幼体形态将其称呼为“尾突”[8];而花刺参幼体中未发现“尾突”或类似“尾突”结构;同时,糙刺参(S.horrens)[20]、暗色刺参(Isostichopusfuscus)[21]与刺参(Stichopussp.)[22]的幼体中同样也未出现该结构。因此,不同类别的海参幼体存在形态特征上的差异,掌握特定海参的形态发育特点有助于鉴别海参幼体的种类。同时,“尾突”的有无使得不同种类幼体间的骨片生长位置也产生差异,花刺参等刺参科海参的骨片生长于后侧臂尖端,呈不规则形,而糙海参的骨片则位于“尾突”末端,形状为圆块状。
3.4 花刺参幼体的变态附着
相关研究表明,海参幼体培育至樽形幼体容易大量死亡[23]。但笔者通过人工配合饲料与鲜活饵料的混合投喂试验表明,花刺参生长发育过程中,直至出现球状体的大耳幼体后期,花刺参幼体对饵料数量、质量与水环境要求均较高[24]。樽形幼体至五触手幼体期间,是海参由浮游状态转向附着状态、由滤食转向舔舐的关键时期,是苗种培育中的瓶颈,此时若幼体营养尚未得到加强则幼体容易发生大量死亡。因此附着基的投放时间,苗种的营养加强等均为防止花刺参幼体大量死亡的关键因素。
海参催产及苗种培育研究已有悠久历史且较为成功,日本对仿刺参的研究已超过120年[25-26],中国对仿刺参的研究也有较大的进展[27-28]。在印度,James等[29]对白底辐肛参催产及发育做了相关研究。Hamel等[30]研究了Psolusfabricii的配子形成及其产卵机制。Mayurama[31]报道了玉足海参(H.leucospilota)和H.paradis卵母细胞的人工刺激诱导及幼体发育过程,Mercier等[32]于厄瓜多尔饲养暗色刺参取得成功。但目前,对于花刺参幼体育苗尚且处于探索阶段,本研究对于花刺参胚胎发育的观察研究,为花刺参人工繁育研究提供参考资料。
[1] 王晓华. 花刺参活性成分研究[D]. 厦门:第二军医大学,2006.
[2] Conand C. Ecology and reproductive biology ofStichopusvariegatusan Indo-Pacific coral reef sea cucumber (Echinodermata:Holothuroidea) [J]. Bulletin of Marine Science, 1993, 52(3):970-981.
[3] Tehranifard A, Uryan S, Vosoghi G. Reproductive cycle ofStichopusherrmannifrom Kish Island, Iran[J]. SPC Beche-de-Mer Information Bulletin, 2006(24):22-27.
[4] Deepa R P, Bijukumar A. New records of the sea cucumbersHolothuria(Semperothuria)imitansLudwig andStichopusherrmanniSemper (Echinodermata:Holothuroidea) from the southwestern coast of India [J]. Journal of Threatened Taxa, 2010, 2(2):712-715.
[5] Eriksson H, Thorne B V, Byrne M. Population metrics in protected commercial sea cucumber populations (curryfish:Stichopusherrmanni) on One Tree Reef, Great Barrier Reef[J]. Marine Ecology Progress, 2013, 473(1):225-234.
[6] Eriksson H,Fabricius-Dyg J, Lichtenberg M, et al. Biology of a high-density population ofStichopusherrmanniat One Tree Reef, Great Barrier Reef, Australia[J]. SPC Beche-de-mer Information Bulletin, 2010(30):41-45.
[7] 杨学明,张立,李有宁. 南方糙海参的人工催产与育苗初步试验[J]. 南方水产科学,2011,7(1):39-44.
[8] 严俊贤,王世锋,冯永勤,等.糙海参胚胎和幼体发育的形态观察[J]. 水产学报,2012,36(7):1073-1080.
[9] 姜松,范嗣刚,温为庚,等. 微生态制剂对糙海参生长、消化酶活性及水质的影响[J]. 海洋渔业,2014,36(4):335-341.
[10] 王华亭,魏芳,左希宏,等. 复方花刺参黏多糖对血管损伤后再狭窄家兔血管内膜增殖与凋亡的影响[J]. 疑难病杂志,2013,12(3):293-296.
[11] 王远红,于明明,王冬燕,等. 花刺参、梅花参和绿刺参营养成分分析[J]. 营养学报,2010,32(4):397-398.
[12] 陈言峰,胡超群,任春华. 单一或二元的凡纳滨对虾新鲜养殖废物用于花刺参养殖的研究[J]. 南方水产科学,2014,10(1):1-8.
[13] 姚雪梅. 热带海参在我国南方沿海地区的养殖前景[J]. 南方水产科学,2004(4):2-5.
[14] 孙新明,代远玲,孙弋.体外授精过程中多精受精发生机制[J]. 井冈山学院学报:自然科学版,2007,28(6):76-79.
[15] 樊其昶,白书农.发育生物学原理[M]. 北京:高等教育出版社,2002:321-323.
[16] 庞振国.刺参的性腺发育及受精细胞学研究[D]. 青岛:中国海洋大学,2006.
[17] 谭杰,孙慧玲,高菲.刺参受精及早期胚胎发育过程的细胞学观察[J]. 水产学报,2012,36(2):272-277.
[18] Dautov S. Structure and properties of hyaline spheres in holothuroid larvae[J]. Invertebrate Reproduction and Development, 1997, 32(2):155-161.
[19] Ramofafia C, Byrne M, Battaglene S C. Development of three commercial sea cucumbers,Holothuriascabra,H.fuscogilvaandActinopygamauritiana:larval structure and growth[J]. Marine and Freshwater Research, 2003, 54(5):657-667.
[20] Hu C Q, Li H P, Xia J J, et al. Spawning, larval development and juvenile growth of the sea cucumberStichopushorrens[J]. Aquaculture, 2013, 404/405 (10):47-54.
[21] Hamel J F, Hidalgo R Y, Mercierl A. Larval development and juvenile growth of the Galapagos sea cucumberIsostichopusfuscus[J]. SPC Beche-de-mer Information Bulletin, 2003(18):3-8.
[22] Hu C Q ,Xu Y H, Wen J. Larval development and juvenile growth of the sea cucumberStichopussp.(curry fish)[J]. Aquaculture, 2010, 300(1):73-79.
[23] 严俊贤. 六种南海海参的系统发育与糙海参和花刺参的胚胎与幼体发育研究[D]. 海口:海南大学,2012.
[24] Morgan A D. Assessment of egg and larval quality during hatchery production of the temperate sea cumber,Australostichopusmollis(Levin)[J]. Journal of the World Auaculture Sciety, 2009, 40(5):629-642.
[25] Inaba D. Artificial rearing of sea cucumber[J]. Suisen Kenkyushi, 1937, 35(2):241-246.
[26] Imai I,Inaba D I, Sato R, et al. The artificial rearing of the transparent flagellate larvae ofStichopusjaponicus[J]. Tohoku Daigaku Nogakuhu Kenkyo Iho, 1950, 2(2):269-277.
[27] 安振华,董云伟,纪婷婷. 日周期性循环变温对刺参耗氧率和排氨率的影响[J]. 海洋渔业,2013,35(1):59-64.
[28] 吴志宏,刘天红,孙元芹,等. 海星棘皮作为仿刺参饲料添加成分的可行性[J]. 海洋渔业,2015,37(1):45-51.
[29] James D B,Kathirvel M, Ramdoss K, et al. The spawning of the holothurian,Actinopygamauritiana(Quoy and Gaimard) on board FORV Sagar Sampada[J]. Journal of the Marine Biological Association of India, 1993, 35(1/2):220-221.
[30] Hamel J F,Himmelman J H, Dufrense L. Gametogenesis and spawning of sea cucumber,Psolusfabricii(Duben and Koren)[J]. Biological Bulletin, 1993(184):125-143.
[31] Mayurama Y K. Artificial induction of oocyte maturation and development in sea cucumbers,HolothurialeucospilotaandHolothuriaparadis[J]. Biological Bulletin, 1980(158):339-348.
[32] Mercier A, Hidalgo R Y, Hamel J F. Aquaculture of the Galapogos sea cucumber,Isostichopusfuscus[G]∥Lovatelli A,Conand C, Purcell S, et al. Advances in Sea Cucumber Aquaculture and Management, Rome:FAO,2004:347-358.
EmbryonicandLarvalDevelopmentofSeaCucumberStichopusherrmanni
WANG Huaihong1, YAN Junxian2,3, FENG Yongqin1, FANG Zaiguang1, WANG Shifeng1, ZHOU Yongcan1, SHU Peijun1
( 1.Key Laboratory for Tropical Biology Resources, Ministry of Education, Key Laboratory of Tropical Aquatic Biotechnology of Hainan Province, College of Ocean, Hainan University, Haikou 570228, China; 2.Tropical Fishery R & D Center, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Sanya 572018, China; 3.Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China )
In order to enhance the seeding technique of sea cucumberStichopusherrmanni, the embryonic and larval development of the sea cucumber were observed and described. Spawning of sea cucumber was conducted by open-air exposure followed by flow-through filtered seawater stimulation. The results showed that the larvae were bred in indoor cement tanks at water temperature of 27—30 ℃ and a salinity of 33.0—35.0. The embryos developed into blastaea by 5 hours, into the rotating blastaea stage by 7 hours and into the archenteron stage by 9 hours. The embryos were hatched in 31 hours, and the larvae were grew and developed into the doliolaria stage in 10 days, and early juveniles were observed 20 days after fertilization. In the development, if was found that the health of the larvae was involved in the development of axohydrocoel and stomach. In other word, the better development of axohydrocoel and stomach were, the healthier larva was, which was benefit for the metamorphosis and survival.
Stichopusherrmanni(S.variegatus); embryo; larva; development
10.16378/j.cnki.1003-1111.2017.05.011
2016-09-02;
2016-11-28.
农业科技成果转化资金资助项目(2014GB2E200128);国家海洋公益性行业科研专项(201405020-4);海南省应用技术研发与示范推广资助专项(ZDXM2014022);广东省海洋经济创新发展区域示范专项(GD2012-A01-002).
王怀洪(1991-),男,硕士研究生;研究方向:海水苗种繁育. E-mail:whh0419@126.com.通讯作者:严俊贤(1987-),男,助理研究员;研究方向:热带海洋苗种繁育. E-mail:yanjunxianjjj@163.com.
S968.9
A
1003-1111(2017)05-0606-06
