体外沉默二牛龙牛儿基转移酶Ⅰ对舌癌细胞迁移和侵袭的影响
2017-12-14陈正岗王树人李敬华韩金宏王奇民童磊刘文君杨芳郭庆圆郭大伟王莹
陈正岗 王树人 李敬华 韩金宏 王奇民 童磊 刘文君杨芳 郭庆圆 郭大伟 王莹
1.青岛市市立医院口腔科,青岛 266071;2.上海交通大学医学院附属第九人民医院口腔颌面外科,上海 200011;3.胶州市人民医院口腔科,胶州 266300;4.青岛市市立医院中心实验室,青岛 266071;5.烟台市口腔医院,烟台 264008;6.青岛市市立医院耳鼻喉科,青岛 266071;7.济南市第四人民医院口腔科,济南 250031;8.潍坊医学院口腔医学院,潍坊 261021
体外沉默二牛龙牛儿基转移酶Ⅰ对舌癌细胞迁移和侵袭的影响
陈正岗1,2王树人3李敬华4韩金宏5王奇民1童磊1刘文君6杨芳1郭庆圆1郭大伟1王莹7,8
1.青岛市市立医院口腔科,青岛 266071;2.上海交通大学医学院附属第九人民医院口腔颌面外科,上海 200011;3.胶州市人民医院口腔科,胶州 266300;4.青岛市市立医院中心实验室,青岛 266071;5.烟台市口腔医院,烟台 264008;6.青岛市市立医院耳鼻喉科,青岛 266071;7.济南市第四人民医院口腔科,济南 250031;8.潍坊医学院口腔医学院,潍坊 261021
目的 应用RNA干扰技术,体外沉默二牛龙牛儿基转移酶Ⅰ(GGTase-Ⅰ),研究其在舌癌迁移、侵袭中的作用。方法 登录Genebank确定人GGTase-Ⅰ基因序列,针对GGTase-Ⅰ的基因序列设计并构建3条siRNA,分别将RNA干扰组(GGTase-Ⅰ siRNA1、GGTase-Ⅰ siRNA2、GGTase-Ⅰ siRNA3)、阴性对照组(NC-siRNA)和空白对照组转染至舌癌细胞Cal-27,实时定量聚合酶链反应(qRT-PCR)和蛋白质印迹法(Western blot)检测各组细胞转染后GGTase-Ⅰ、RhoA基因的mRNA、蛋白表达;选取沉默效率最高的一组siRNA作为实验组,蛋白质印迹法检测各组细胞基质金属蛋白酶(MMP)-2、MMP-9的表达,GST-pull down实验检测GTP-RhoA蛋白的表达,划痕实验检测细胞迁移能力变化,Transwell小室检测细胞侵袭能力变化。结果 干扰后细胞的GGTase-Ⅰ mRNA、蛋白表达明显下降(Plt;0.05),RhoA mRNA和蛋白表达无明显改变,MMP-2、MMP-9、GTP-RhoA的表达下降,迁移、侵袭能力明显下降(Plt;0.05)。结论 抑制GGTase-Ⅰ表达,可降低舌癌细胞的迁移、侵袭能力,对GGTase-Ⅰ的深入研究可能为舌癌的治疗提供新的有效分子靶点。
二牛龙牛儿基转移酶Ⅰ; RhoA; 舌癌; 迁移; 侵袭; 基质金属蛋白酶-2; 基质金属蛋白酶-9
舌鳞状细胞癌(squamous cell carcinoma of tongue,TSCC)(简称舌癌)是最为常见的口腔恶性肿瘤[1]。舌癌发病率高、发展快、转移早、致死率高,其5年生存率仅50%~60%[2-3]。肿瘤细胞向周围组织浸润及远处侵袭转移尤其是肺部转移是舌癌患者的主要死亡原因,因此了解舌癌细胞侵袭能力和转移机制,抑制癌细胞的迁移、扩散是目前舌癌的研究热点。
二牛龙牛儿基转移酶Ⅰ(geranylgeranyltransferase Ⅰ,GGTase-Ⅰ)是由Fnta编码的α亚单位和Pggtlb编码的β亚单位组成的,对包括Rho族蛋白在内的多种肿瘤迁移、侵袭相关蛋白进行翻译后修饰[4]。Rho家族蛋白是小G蛋白Ras超家族成员,调节细胞二磷酸鸟苷(guanosine diphosphate,GDP)/三磷酸鸟苷(guanosine triphosphate,GTP)的转换,Rho家族蛋白中的RhoA、Rac1、Cdc42被证实在多种肿瘤中高表达,参与细胞黏附、细胞运动、肌动蛋白细胞骨架和细胞极性改变,与肿瘤细胞的迁移、侵袭密切相关[5]。由此推测,GGTase-Ⅰ与舌癌的迁移、侵袭密切相关,通过抑制GGTase-Ⅰ的表达,可阻断相关蛋白活性,从而延缓肿瘤的进展。
为明确GGTase-Ⅰ在舌癌中的表达和功能,本研究应用RNA干扰(RNA interference,RNAi)技术,体外设计合成人舌癌细胞Cal-27GGTase-Ⅰ基因的干扰RNA(small interfering RNA,siRNA)并转染进入细胞,观察其对GGTase-Ⅰ及其相关蛋白的抑制作用,探讨其对舌癌细胞迁移、侵袭调控的可能机制,为今后GGTase-Ⅰ在舌癌的治疗提供实验依据。
1 材料和方法
1.1 主要试剂
胎牛血清(Gibco公司,美国);1640培养基、胰蛋白酶(Hyclone公司,美国);RNA提取试剂盒、逆转录试剂盒、SuperRealPreMix Plus(SYBR Green)FP 205(北京天根生化科技);GGTase-Ⅰ、RhoA实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)引物设计合成(TAKARA公司,日本);内参磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)(上海生工生物工程股份有限公司);siRNA片段设计合成、转染试剂、荧光标记检测试剂(广州锐博生物科技有限公司);鼠抗人GGTase-Ⅰ、RhoA(Santa公司,美国);兔抗人GAPDH、基质金属蛋白酶(matrix metalloproteinase,MMP)-2、MMP-9(武汉伊莱瑞特生物科技股份有限公司)。
1.2 细胞培养
人舌癌细胞株Cal-27(中南大学高等研究中心)置于6 mL 1640培养基(含10%胎牛血清、青霉素100 mg·mL-1和链霉素100 mg·mL-1)中,37 ℃、5%CO2恒温孵育箱中培养。根据细胞生长状况,待细胞铺满瓶底约80%,进行消化,计数,按1∶2比例传代接种在新的培养瓶中。
1.3 方法
1.3.1 GGTase-Ⅰ siRNA的合成 登录Genebank确定人GGTase-Ⅰ的基因序列,序列号为NM_005023.3,针对序列设计3条siRNA载体(表1)。
1.3.2 siRNA转染 转染前1 d,将对数生长期舌癌细胞Cal-27按照每孔5×105个接种于6孔板内,使转染时细胞密度为30%~50%。按照操作说明,120 μL riboFECT™ CP Buffer稀释5 μL 20 μmol·L-1siRNA储存液,混匀后加入12 μL riboFECT™ CP Reagent,吹打混匀并室温孵育0~15 min。弃6孔板内原有培养液,PBS冲洗3遍,每孔加入1 863 μL含血清培养基(不含抗生素),将孵育好的混合液加入6孔板内,使siRNA终浓度为50 nmol·L-1,混匀后将6孔板置于孵育箱中培养。实验设计RNA干扰组(GGTase-Ⅰ siRNA1、GGTase-Ⅰ siRNA2、GGTase-Ⅰ siRNA 3简写为siRNA1、siRNA2、siRNA3组)、荧光对照组(荧光基团Cy3标记siRNA)、阴性对照组(NC-siRNA)和空白对照组(只加入转染试剂,不加入siRNA),分别进行转染。转染24 h后,荧光对照组置于荧光显微镜下明确转染效率。

表 1 针对GGTase-Ⅰ基因序列设计3条GGTase-ⅠsiRNATab1 Three GGTase-ⅠsiRNA sequences designed for GGTase-Ⅰgene
1.3.3 qRT-PCR反应 明确转染效率后,按上述分组,提取空白对照组、阴性对照组和RNA干扰组转染48 h的细胞总RNA,紫外分光光度计判断样品的质量和浓度。将适量RNA反转录为cDNA,取1 μL cDNA进行PCR扩增反应,GAPDH为内参。GGTase-Ⅰ的上游序列:5’-CTCCTGCTGATTTCACTTTGG-3’,下游序列:5’-CCACGACAAAGTTGTGGTTCA-3’,产物大小为102 bp;RhoA的上游引物序列:5’-GCTGGACTCGGATTCGTTG-3’,下游引物序列:5’-TGGGAACTGGTCCTTGCTG-3’,产物大小为120 bp。反应条件:95 ℃预变性15 min,95 ℃变性10 s,60 ℃退火/延伸31 s,共40个循环。使用Stratagene荧光定量PCR仪对荧光信号实时监测和数据分析,结果采用相对定量法,采用2-ΔΔCt公式,计算空白对照组、阴性对照组和RNA干扰组的GGTase-Ⅰ、RhoA mRNA的相对表达水平,其中Ct值为循环阈值。实验重复3次。
1.3.4 蛋白质免疫印迹法(Western blot) 提取各组细胞的蛋白质,二喹啉甲酸(bicinchoninic acid,BCA)法定量蛋白浓度,等量上样,电泳分离后电转膜,5%脱脂奶粉室温摇床封闭2 h后,加入一抗(GAPDH,1∶1 000;GGTase-Ⅰ,1∶200;Rho A,1∶500),4 ℃孵育过夜后用三羟甲基氨基甲烷缓冲盐水(triethanolamine buffered saline,TBST)冲洗3次,加二抗(1∶50 000),37 ℃摇床孵育2 h。TBST冲洗,电化学发光检测,显色曝光,检测条带的灰度值。实验重复3次。根据GGTase-Ⅰ蛋白和mRNA表达结果选取沉默效率最强的一组作为实验组,方法同前,一抗浓度(GAPDH,1∶1 000;MMP-2,1∶500;MMP-9,1∶500)。实验重复3次。
1.3.5 GST-pull down法 分别将已转染好的空白对照组、阴性对照组和实验组细胞用0.5 mL预冷的裂解液冰上裂解细胞后离心10 min,取上清,BCA定量蛋白浓度,使各组蛋白等量。每组取约1 mg总蛋白加入20 μL Rho Assay Reagent 4 ℃孵育45 min,离心弃上清,500 μL Wash Buffer反复冲洗后,分别加入40 μL 2×上样缓冲液,2 μL二硫苏糖醇煮沸10 min,Western blot分别检测各组GTP-RhoA蛋白并与等量总RhoA(Total-RhoA)蛋白比较。实验重复3次。1.3.6 细胞划痕实验 6孔板底部等间距划5条横线,取适量对数生长期的转染48 h细胞接种于6孔板,使细胞密度隔天达到90%。将无菌直尺与孔板底部横线垂直,200 μL枪头保持直立沿直尺在6孔板细胞上划痕。PBS反复冲洗3次后,加入无血清培养基,于0、6、12、24 h观察划痕弥合情况并拍照测定划痕两侧细胞的迁移距离,取均值。实验重复3次。
1.3.7 细胞侵袭实验 将500 mg·L-1的人工基质胶20 μL铺于Transwell侵袭小室聚碳酯微孔膜的上表面,置37 ℃ 30 min使其聚成凝胶。将转染48 h细胞消化、混匀后加入适量无血清培养液,使细胞浓度为每毫升2×105个,Transwell上室加入200 μL含细胞的无血清培养液,下室加入600 μL含10%胎牛血清的培养液,37 ℃、5%CO2孵育48 h后取出,PBS清洗,棉签去除基质胶及孔膜上层细胞,将小室浸入甲醛室温固定30 min,吸干上室固定液,在0.1%的结晶紫中室温染色20 min,PBS冲洗浸泡,显微镜下随机选择5个视野,计数每个视野内穿过微孔的细胞数并取平均值,每组重复3次。
1.4 统计学分析
采用SPSS 19.0软件对各组实验结果进行统计学分析,组间比较采用t检验,以Plt;0.05为差异有统计学意义,每组实验至少重复3次。
2 结果
2.1 细胞转染效率检测
细胞转染结果:红色荧光标记Cy3的荧光标记组细胞siRNA转染24 h后,细胞置于荧光显微镜下观察,80%以上细胞都显示红色荧光,证明多数细胞都已经转染了siRNA(图1)。
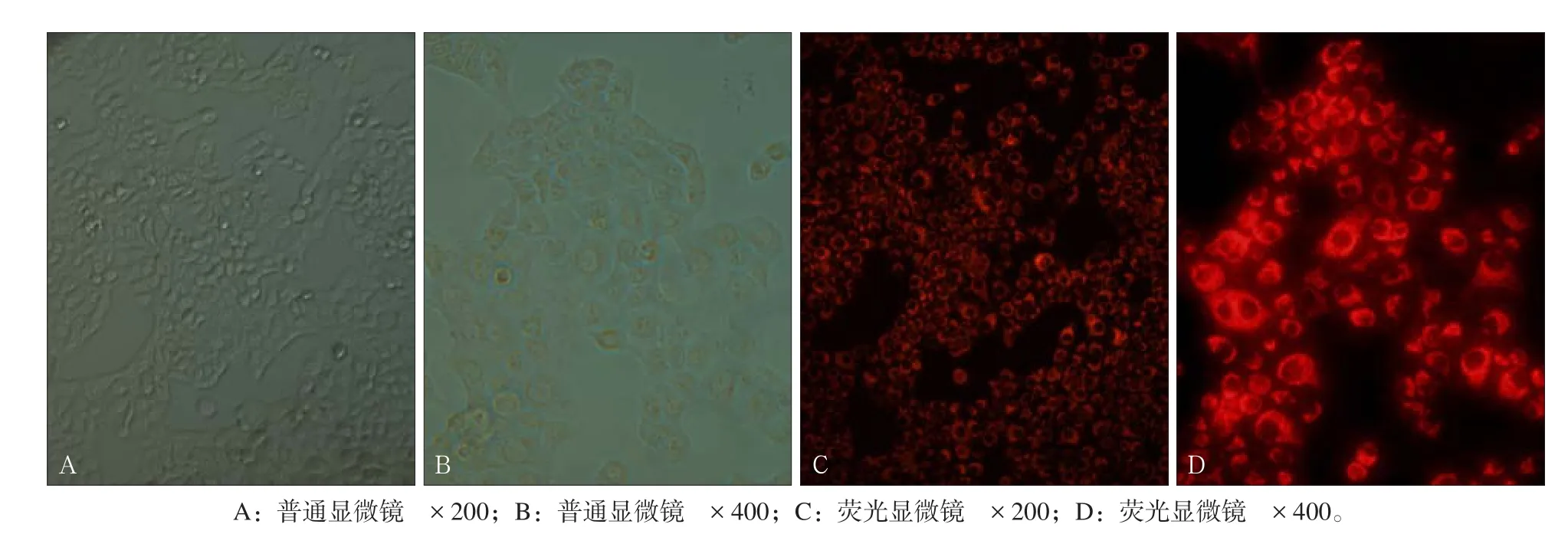
图1 细胞转染Fig 1 Cell transfecfion
2.2 转染后细胞mRNA表达量变化
转染48 h后各组细胞的GGTase-Ⅰ、RhoA的qRTPCR检测结果显示:RNA干扰组与空白对照组和阴性对照组相比,GGTase-Ⅰ的mRNA表达量明显下降(Plt;0.05),RhoA的mRNA变化无统计学差异(Pgt;0.05)(图2)。

图2 转染GGTase-Ⅰ siRNA后GGTase-Ⅰ、RhoA mRNA的表达Fig 2 Expression of GGTase-Ⅰ, RhoA mRNA after GGTase-Ⅰ siRNA transfection
2.3 转染后细胞蛋白表达变化
转染48 h后各组细胞蛋白表达结果显示:RNA干扰组与空白对照组和阴性对照组相比,GGTase-Ⅰ蛋白表达明显下降(Plt;0.05),RhoA蛋白表达无统计学差异(图3),实验组的MMP-2、MMP-9蛋白表达明显下降(Plt;0.05)(图4)。
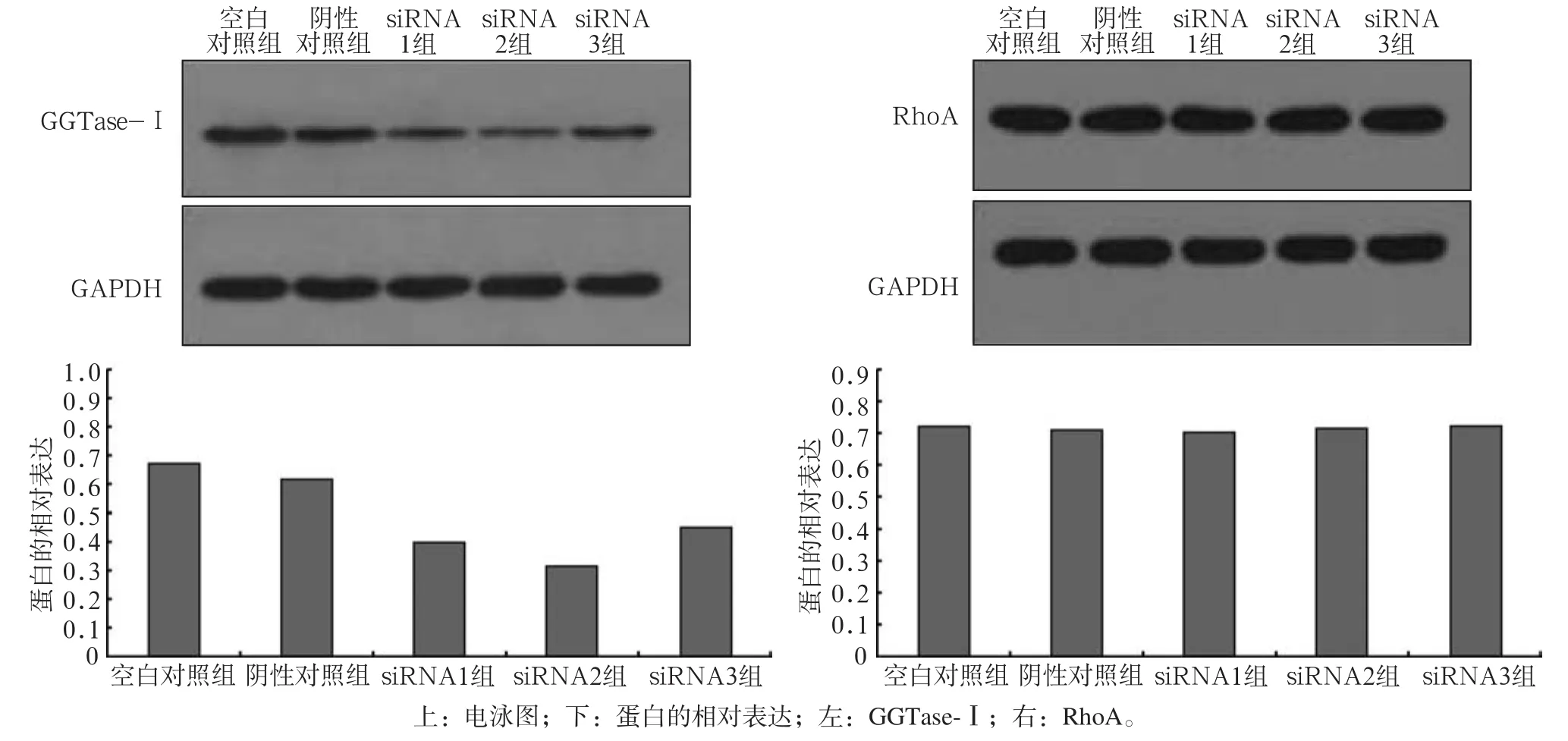
图3 转染GGTase-Ⅰ siRNA后GGTase-Ⅰ、RhoA蛋白的表达Fig 3 Expression of GGTase-Ⅰ, RhoA protein after GGTase-Ⅰ siRNA transfection

图4 转染GGTase-Ⅰ siRNA后MMP-2、MMP-9蛋白的表达Fig 4 Expression of MMP-2, MMP-9 protein after GGTase-Ⅰ siRNA transfection
2.4 转染后细胞RhoA蛋白的活性变化
转染48 h后各组GST-pull down实验结果显示:实验组与空白对照组和阴性对照组相比,GTP-RhoA(RhoA的活性形式)表达明显下降,表明实验组的RhoA蛋白活性下降(Plt;0.05)(图5)。

图5 转染GGTase-Ⅰ siRNA后GTP-RhoA蛋白的表达 Fig 5 Expression of GTP-RhoA protein after GGTase-Ⅰ siRNA transfection
2.5 转染后细胞迁移能力变化
观察各组不同时间段划痕愈合情况,测量划痕宽度,并进行统计分析。结果显示:12、24 h实验组与空白对照组和阴性对照组相比,划痕宽度明显较宽(Plt;0.05)(图6)。
2.6 转染后细胞侵袭能力变化
细胞接种48 h后,计数实验组、阴性对照组、空白对照组穿过人工基底膜的细胞数分别为117.35±28.64、406.22±49.17、427.56±39.28,t检验分析结果显示:实验组与空白对照组和阴性对照组相比,实验组穿膜细胞数量明显下降减少,细胞侵袭能力显著降低(Plt;0.05)(图7)。

图6 转染GGTase-Ⅰ siRNA后细胞划痕宽度比较 Fig 6 Comparison of cell scratch width after GGTase-Ⅰ siRNA transfection

图7 转染GGTase-Ⅰ siRNA后细胞侵袭能力的检测 倒置相差显微镜 × 100Fig 7 Evaluation of cell invasion after GGTase-Ⅰ siRNA transfection inverted phase contrast microscope × 100
3 讨论
舌癌引起死亡的主要原因是细胞内的癌基因发生突变,肿瘤细胞通过细胞黏附、基质分解、远处侵袭过程向周围组织浸润及远处转移。Ras是人类最易发生突变的癌基因,已被证实与多种肿瘤的形成、发展密切相关[6]。1991年Seabra等[7]证实GGTase-Ⅰ参与某些Ras蛋白的翻译后修饰,对Rho族蛋白RhoA、RhoC、Rac1、Cdc42等蛋白进行异戊烯化修饰,是Ras蛋白发挥活性的必需酶[8]。RhoA属于原癌基因,在胰腺癌、大肠癌、乳腺癌、胃癌、黑色素瘤及肝癌等多种恶性肿瘤细胞中表达增高,参与细胞黏附、细胞骨架结构改变和肌动蛋白重组,与肿瘤的浸润、侵袭作用密切相关[9-12]。
本实验以舌癌细胞Cal-27为研究对象,将GGTase-ⅠsiRNA转染入Cal-27中,采用RNA干扰技术沉默GGTase-Ⅰ的表达。结果显示,干扰后的GGTase-Ⅰ蛋白表达明显下降,RhoA蛋白表达没有明显改变,GTP-RhoA蛋白表达下降,舌癌细胞划痕宽度愈合速度明显缓慢,Transwell侵袭小室穿膜细胞数显著减少,推测GGTase-Ⅰ与舌癌细胞的迁移和侵袭密切有关。
研究[13]报道GGTase-Ⅰ抑制剂GGTI298可以刺激神经干细胞再生,促进细胞的迁移。本实验沉默GGTase-Ⅰ后,舌癌细胞的迁移和侵袭能力下降。两种结论相反,分析考虑GGTase-Ⅰ对细胞的迁移作用可能因细胞的种类、分化不同而不同。推测GGTase-Ⅰ可以促进肿瘤细胞发生、发展,并同时抑制正常细胞的增殖迁移。沉默GGTase-Ⅰ的表达,可抑制肿瘤细胞迁移、侵袭,但并不抑制正常细胞的生物学行为,对某些正常细胞特别是神经干细胞反而可以促进其增殖和迁移。本实验中,体外沉默GGTase-Ⅰ后细胞的GGTase-I mRNA和蛋白均显著下降,但RhoA表达无明显改变,表明GGTase-Ⅰ的改变在一定时间内不影响细胞RhoA基因的表达和蛋白合成。细胞RhoA表达无明显改变,但GTP-RhoA蛋白表达下降,RhoA蛋白活性下降,分析认为RhoA蛋白在舌癌细胞中的作用机制与大多数肿瘤细胞相同[14],在细胞核合成后需通过GGTase-Ⅰ引导的异戊烯化翻译后修饰过程才能正确定位于细胞膜上,发挥相应的生物学功能。抑制GGTase-Ⅰ的表达,不影响舌癌细胞RhoA基因的表达和蛋白合成,但能影响RhoA在舌癌细胞内的活性。
MMP是一组高度同源的锌依赖性内肽酶家族,已知在肿瘤细胞和基质细胞都可表达,降解细胞外基质(extracellular matrix,ECM),维持ECM的动态平衡[15]。MMP-2和MMP-9同属于明胶酶类MMP,可以降解包括Ⅳ型胶原、明胶、纤维连接蛋白在内的多种ECM,释放激活相应生长因子,水解ECM和细胞基底膜,促使癌细胞迁移。MMP-2和MMP-9还通过影响血管基底膜的蛋白降解,打开内皮细胞的转移通路从而控制血管新生,使肿瘤细胞向远处侵袭、转移[16-18]。MMP-2在机体各处都可表达,而MMP-9仅特定出现在中性粒细胞中[19],但实验证实MMP-2和MMP-9在结肠癌[20]、乳腺癌[21]、肺癌[22]和头颈部鳞癌均异常活化,与肿瘤迁移、侵袭和淋巴结转移密切相关。研究[23]证实与正常组织相比,口腔鳞癌中MMP-2和MMP-9过表达,表明其与舌癌的侵袭性高度相关。实验组前期证实[24]通过沉默RhoA基因,舌癌细胞的侵袭相关蛋白Galectin-3和MMP-9表达下降,舌癌细胞侵袭力明显降低,推测RhoA通过MMP-9与舌癌细胞的侵袭正相关。本研究中,抑制GGTase-Ⅰ后,舌癌细胞迁移速度降低、侵袭能力下降,MMP-2、MMP-9表达下降,与实验组前期结果符合。且抑制GGTase-Ⅰ后,RhoA的mRNA和蛋白表达量均无明显变化,GTP-RhoA蛋白表达下降,证实GGTase-Ⅰ通过改变RhoA等促癌基因的蛋白活性,抑制其下游蛋白表达,参与细胞形态和骨架调节,影响舌癌细胞的迁移和侵袭;也证实了GGTase-Ⅰ是在RhoA蛋白后期的翻译后修饰过程中发挥作用,不改变细胞内RhoA蛋白的细胞总量。
综上所述,本实验抑制舌癌细胞的GGTase-Ⅰ表达,RhoA的mRNA和蛋白表达量均无明显变化,GTP-RhoA蛋白表达下降,侵袭相关蛋白MMP-2、MMP-9表达下降,舌癌细胞迁移、侵袭能力下降。推测GGTase-Ⅰ通过参与对RhoA等促癌转移基因的翻译后修饰,间接影响舌癌的侵袭,证实对GGTase-Ⅰ沉默可在一定程度上阻止舌癌的黏附、侵袭,干扰舌癌的浸润、转移。但是,其具体作用机制仍需要进一步研究探讨。
[1] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2007[J]. CA Cancer J Clin, 2007, 57(1):43-66.
[2] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005, 55(2):74-108.
[3] 张陈平. 口腔癌临床及基础研究进展: 关于舌癌治疗的几点建议[J]. 中国实用口腔科杂志, 2010, 3(7):385-387.Zhang CP. Consideration of the treatment protocol for oral tongue cancer[J]. Chin J Pract Stomatol, 2010, 3(7):385-387.
[4] Shen M, Pan P, Li Y, et al. Farnesyltransferase and geranyl geranyltransferaseⅠ: structures, mechanism, inhibitors and molecular modeling[J]. Drug Discov Today, 2015, 20(2):267-276.
[5] Berndt N, Hamilton AD, Sebti SM. Targeting protein prenylation for cancer therapy[J]. Nat Rev Cancer, 2011, 11(11):775-791.
[6] Philips MR, Cox AD. GeranylgeranyltransferaseⅠas a target for anti-cancer drugs[J]. J Clin Invest, 2007, 117(5):1223-1225.
[7] Seabra MC, Reiss Y, Casey PJ, et al. Protein farnesyltransferase and geranylgeranyltransferase share a common alpha subunit[J]. Cell, 1991, 65(3):429-434.
[8] Khan OM, Akula MK, Skålen K, et al. Targeting GGTase-Ⅰactivates RHOA, increases macrophage reverse cholesterol transport, and reduces atherosclerosis in mice[J]. Circulation, 2013, 127(7):782-790.
[9] Wang HB, Liu XP, Liang J, et al. Expression of RhoA and RhoC in colorectal carcinoma and its relations with clinicopathological parameters[J]. Clin Chem Lab Med, 2009, 47(7):811-817.
[10] Kasuya K, Nagakawa Y, Hosokawa Y, et al. RhoA activity increases due to hypermethylation of ARHGAP28 in a highly liver-metastatic colon cancer cell line[J]. Biomed Rep, 2016, 4(3):335-339.
[11] Cui J, Cai Y, Hu Y, et al. Epigenetic silencing of TPM2 contributes to colorectal cancer progression upon RhoA activation[J]. Tumour Biol, 2016, 37(9):12477-12483.
[12] Fujimura K, Choi S, Wyse M, et al. Eukaryotic translation initiation factor 5A (EIF5A) regulates pancreatic cancer metastasis by modulating RhoA and Rho-associated kinase (ROCK) protein expression levels[J]. J Biol Chem, 2015, 290(50):29907-29919.
[13] Zhang C, Wu JM, Liao M, et al. The ROCK/GGTase pathway are essential to the proliferation and differentiation of neural stem cells mediated by simvastatin[J]. J Mol Neurosci, 2016, 60(4):474-485.
[14] Leung KF, Baron R, Ali BR, et al. Rab GTPases containing a CAAX motif are processed post-geranylgeranylation by proteolysis and methylation[J]. J Biol Chem, 2007, 282(2): 1487-1497.
[15] Aparna M, Rao L, Kunhikatta V, et al. The role of MMP-2 and MMP-9 as prognostic markers in the early stages of tongue squamous cell carcinoma[J]. J Oral Pathol Med, 2015, 44(5):345-352.
[16] 张明明, 徐玉清. MMP-2和MMP-9在恶性肿瘤中的研究进展[J]. 国际肿瘤学杂志, 2012, 39(11):820-823.Zhang MM, Xu YQ. MMP-2 and MMP-9 in malignant tumor[J]. J Int Oncol, 2012, 39(11):820-823.
[17] Björklund M, Koivunen E. Gelatinase-mediated migration and invasion of cancer cells[J]. Biochim Biophys Acta, 2005, 1755(1):37-69.
[18] Song H, Cheng Y, Bi G, et al. Release of matrix metalloproteinases-2 and 9 by S-nitrosylated caveolin-1 contributes to degradation of extracellular matrix in tPA-treated hypoxic endothelial cells[J]. PLoS One, 2016, 11(2):e0149269.
[19] Chakrabarti S, Patel KD. Matrix metalloproteinase-2 (MMP-2) and MMP-9 in pulmonary pathology[J]. Exp Lung Res, 2005, 31(6):599-621.
[20] Langers AM, Verspaget HW, Hawinkels LJ, et al. MMP-2 and MMP-9 in normal mucosa are independently associated with outcome of colorectal cancer patients[J]. Br J Cancer, 2012, 106(9):1495-1498.
[21] Sullu Y, Demirag GG, Yildirim A, et al. Matrix metalloproteinase-2 (MMP-2) and MMP-9 expression in invasive ductal carcinoma of the breast[J]. Pathol Res Pract, 2011, 207(12):747-753.
[22] González-Arriaga P, Pascual T, García-Alvarez A, et al. Genetic polymorphisms in MMP 2, 9 and 3 genes modify lung cancer risk and survival[J]. BMC Cancer, 2012, 12: 121.
[23] Kato K, Hara A, Kuno T, et al. Matrix metalloproteinases 2 and 9 in oral squamous cell carcinomas: manifestation and localization of their activity[J]. J Cancer Res Clin Oncol, 2005, 131(6):340-346.
[24] 陈正岗, 唐永平, 童磊, 等. 体外RNA干扰RhoA基因对舌癌细胞侵袭的影响[J]. 华西口腔医学杂志, 2016, 34(2):183-188.Chen ZG, Tang YP, Tong L, et al. Effects of RhoA gene silencing by RNA interference on invasion of tongue carcinoma[J]. West Chin J Stomatol, 2016, 34(2):183-188.
Effects of geranylgeranyltransferase Ⅰ gene silencing by RNA interference on the migration and invasion of tongue carcinoma
Chen Zhenggang1,2, Wang Shuren3, Li Jinghua4, Han Jinhong5, Wang Qimin1, Tong Lei1, Liu Wenjun6, Yang Fang1,Guo Qingyuan1, Guo Dawei1, Wang Ying7,8.
(1. Dept. of Stomatology, Qingdao Municipal Hospital, Qingdao 266071, China;2. Dept. of Oral and Maxillofacial Surgery, Shanghai Ninth People’s Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200011, China; 3. Dept. of Stomatology, Jiaozhou People’s Hospital, Jiaozhou 266300, China; 4. Central Laboratory, Qingdao Municipal Hospital, Qingdao 266071, China; 5. Yantai Stomatological Hospital, Yantai 264008, China;6. Dept. of Ear-nose-throat, Qingdao Municipal Hospital, Qingdao 266071, China; 7. Dept. of Stomatology, Fourth People’s Hospital of Jinan, Jinan 250031, China; 8. College of Stomatology, Weifang Medical University, Weifang 261021, China)
Supported by: National Natural Science Foundation of China (81372908); Qingdao Municipal Commission of Health and Family Planning (2014-WJZD009, 2013-WSZD011). Correspondence: Wang Ying, E-mail: 469055264@qq.com.
Objective RNA interference was used to silence geranylgeranyltransferase Ⅰ(GGTase-Ⅰ) in vitro and to study the effect of GGTase-Ⅰ on the migration and invasion of tongue squamous cancer cells. Methods Three small interfering RNAs (siRNA) were designed according to the GGTase-Ⅰ sequence by Genebank and were transfected into tongue squamous cancer cells Cal-27 to knock down GGTase-Ⅰ expression. The tested cells were divided into three groups, as follows: the RNA-interfered groups (GGTase-Ⅰ siRNA1, GGTase-Ⅰ siRNA 2, GGTase-Ⅰ siRNA 3), a negative control group (disrupted by random sequence NC-siRNA), and a blank control group. GGTase-Ⅰ and RhoA gene expressions were examined by quantitative real-time polymerase chain reaction (qRT-PCR) and Western blot. The optimum interference group was screened by qRT-PCR and Western blot and was assigned as the experimental group. Matrix metalloproteinase (MMP)-2 and MMP-9 protein expressions were examined by Western blot. GTP-RhoA expression of protein was examined by GST-pull down. The migration and invasion abilities were analyzed by wound healing assay and Transwell motility assay. Results GGTase-Ⅰ mRNA and protein expression in Cal-27 decreased significantly after transfection of GGTase-I siRNA (Plt;0.05). No significant difference of RhoA gene expression was detected. MMP-2, MMP-9, and GTP-RhoA protein expressions decreased significantly (Plt;0.05). The migration and invasion abilities were inhibited (Plt;0.05). Conclusion To inhibit GGTase-Ⅰ expression, the migration and invasion abilities of tongue squamous cancer cells should also be inhibited. Further studies on GGTase-Ⅰ may provide novel effective molecular targets for tongue squamous cancer cells.
geranylgeranyltransferase Ⅰ; RhoA; tongue squamous cancer; migration; invasion; matrix metalloproteinase-2; matrix metalloproteinase-9
R 78
A
10.7518/hxkq.2017.06.003
2016-12-17;
2017-09-05
国家自然科学基金面上项目(81372908);青岛市卫计委计划项目(2014-WJZD009,2013-WSZD011)
陈正岗,副主任医师,博士,E-mail:chenzhg1973@163.com
王莹,住院医师,硕士,E-mail:469055264@qq.com
(本文采编 石冰)
