脱钙异体冻干骨联合富血小板衍生物治疗牙周骨内缺损疗效的Meta分析
2017-12-14魏雪钟晓波何斌邓彦涵骆书美
魏雪 钟晓波 何斌 邓彦涵 骆书美
1.遵义市正安县人民医院口腔科,遵义 563000;2.重庆医科大学附属口腔医院牙体牙髓科;3.口腔疾病与生物医学重庆市重点实验室;4.重庆市高校市级口腔生物医学工程重点实验室,重庆 401147
脱钙异体冻干骨联合富血小板衍生物治疗牙周骨内缺损疗效的Meta分析
魏雪1钟晓波2何斌2邓彦涵3骆书美4
1.遵义市正安县人民医院口腔科,遵义 563000;2.重庆医科大学附属口腔医院牙体牙髓科;3.口腔疾病与生物医学重庆市重点实验室;4.重庆市高校市级口腔生物医学工程重点实验室,重庆 401147
目的 系统评价脱钙异体冻干骨(DFDBA)联合富血小板衍生物治疗牙周病导致的骨内缺损的有效性。方法 在PubMed、Web of Science、Embase、Cochrane Library、中国学术期刊网全文数据库等数据库中检索2016年5月之前发表的关于DFDBA联合富血小板衍生物治疗牙周病导致的骨内缺损的临床随机对照研究(RCT)。对纳入的文献研究进行质量评价。应用RevMan 5.3软件进行Meta分析。结果 9篇RCT文献纳入Meta分析,共194例患者,303个位点。Meta分析结果显示:DFDBA联合富血小板衍生物试验组较对照组可以降低短期组(6个月)和长期组(12~18个月)的牙周袋探诊深度,均数差(MD)分别为0.75 mm[95%可信区间(CI)(0.31 mm,1.20 mm),P=0.001 0]、0.87 mm[95%CI(0.02 mm,1.72 mm),P=0.04];增加短期组(6个月)和长期组(12~18个月)的临床附着水平,MD分别为0.65 mm[95%CI(0.08 mm,1.22 mm),P=0.03]、1.31 mm[95%CI(0.60 mm,2.01 mm),P=0.000 3];减少长期组(12~18个月)的牙龈退缩[MD为-0.58 mm,95%CI(-0.78 mm,-0.38 mm),P<0.000 01];增加短期组(6个月)和长期组(12~18个月)的骨充填高度,MD分别为0.52 mm[95%CI(0.03 mm,1.00 mm),P=0.04]、1.26 mm[95%CI(0.65 mm,1.86 mm),P=0.000 1]。结论 DFDBA联合富血小板衍生物能有效治疗牙周病导致的骨内缺损,效果优于单用组。但因为此次纳入研究较少,质量不高且样本量较小,所以仍需高质量的、大样本的RCT来进一步验证。
脱钙异体冻干骨; 富血小板血浆; 富血小板纤维蛋白; 骨内缺损
牙周病为口腔慢性炎症性疾病,发病率高。牙周病导致的牙周骨内缺损是牙周治疗的重点与难点,单纯的牙周基础治疗并不能解决该问题。牙周引导组织再生术与植骨术为目前治疗牙周骨内缺损的常用方法。其中,脱钙异体冻干骨(decalcified freezedried bone allograft,DFDBA)和富血小板衍生物已在临床上广泛使用并取得了不错的疗效。
DFDBA属于同种异体骨,经脱钙处理,使骨基质中的骨形成蛋白暴露,具有骨引导和骨诱导作用[1-3]。DFDBA虽然为异体骨,但仍具有良好的生物相容性[4]。富血小板衍生物主要包括富血小板血浆(platelet-rich plasma,PRP)和富血小板纤维蛋白(platelet-rich fibrin,PRF)。PRP是通过自身血提取而成,故生物相容性好。其不仅含有大量的生长因子,可促进骨再生和牙周组织的愈合,还具有抗菌作用[5]。PRF作为第二代材料,具有疏松多孔的网络结构[6],血小板回收率远远高于PRP,具有使生长因子持续释放和抵抗内源性蛋白降解的功能[7-8]。
已有大量文献[5,9]表明,DFDBA和富血小板衍生物可明显减少牙周探诊深度(probing depth,PD),增加临床附着水平(clinical attachment level,CAL)和骨充填高度(bone fill,BF)。但是对于两者联合使用治疗牙周骨内缺损是否优于单独使用,仍存在争议。本研究将对DFDBA联合富血小板衍生物使用和分别单独使用治疗牙周病骨内缺损的随机临床对照试验(randomized controlled trials,RCT)进行Meta分析,为客观评价DFDBA联合富血小板衍生物的临床疗效,以及临床医师合理选择牙周再生材料提供参考。
1 材料和方法
1.1 文献纳入标准
1.1.1 研究类型 所有已发表的DFDBA联合富血小板衍生物(PRP或PRF)治疗牙周骨内缺损的RCT。
1.1.2 研究对象 已满18周岁的成人;临床诊断为慢性牙周炎,并经X线片检查及临床检查确定存在骨内缺损;经牙周基础治疗后3个月复诊,口腔内至少有一个位点PD≥6 mm且CAL≥3 mm。
1.1.3 干预措施 试验组用DFDBA联合PRP或DFDBA联合PRF,对照组为仅用DFDBA或PRP或PRF。
1.1.4 结局指标 按随访时间分为短期组(6个月)和长期组(12~18个月)。结局指标有:PD减少值、CAL增加值、牙龈退缩(gingival recession,REC)变化值和BF。
1.2 文献排除标准
排除标准:1)质量差、重复报道、报道信息太少、结果无平均值和方差的文献;2)无对照组的文献;3)动物实验及体外试验。
1.3 检索策略
1.3.1 检索数据库 检索的数据库包括Web of Science、PubMed、Embase、Cochrane Library、中国学术期刊网全文数据库(CNKI)、万方数据库、维普数据库。按照《Cochrane协作网系统评价手册5.0.1》的要求,针对不同数据库制定不同的检索策略。检索时间段均为从建库至2016年5月。
1.3.2 检索式 英文检索式为“Decalcified freeze-dried bone allograft AND (platelet-rich plasma OR plateletrich fibrin OR platelet-derived) AND periodontal AND intrabony defects OR surgery”。中文检索式为“脱钙异体冻干骨”AND“(富血小板血浆OR富血小板纤维蛋白)”AND“牙周炎”AND“骨内缺损”。并辅以文献追溯的方法,全面搜集。
1.4 文献筛选
整个过程均由2名研究人员按照纳入和排除标准独立进行文献筛选和资料提取,并交叉核对,如遇到分歧则通过讨论或与第三位评价员协商达成一致。
1.5 纳入研究的方法学质量评价
按照《Cochrane协作网系统评价手册》推荐的方法对纳入的RCT进行质量评价,评价内容有:随机序列的产生、盲法(患者、医生、检查人员)的实施、是否进行分配隐藏、随访情况、是否选择性报道结果等。以上均按照“是”(低偏倚风险)、“不清楚”(文献对偏倚评估未提供足够或不确定的信息)及“否”(高偏倚风险)为评价结果。
1.6 统计分析
采用Cochrane协作网提供的RevMan 5.3软件对纳入的文献进行Meta分析。对连续性资料PD减少值、CAL增加值、REC的变化和BF以均数差(MD)及其95%可信区间(confidence intervals,CI)表示,当P<0.05时,差异有统计学意义。通过卡方检验判断是否有异质性,并采用I2判断异质性的大小。当P≥0.10,I2≤50%时,认为各研究结果间的同质性较好,采用固定效应模型进行Meta分析;当P<0.10,I2>50%时,认为各研究结果间异质性明显,采用随机效应模型进行Meta分析,并采用亚组分析和敏感性分析的方法讨论异质性来源。
2 结果
2.1 文献检索结果
初检出文献45篇。通过去除重复文献,阅读题目、摘 要及全文排除36篇,最终纳入9篇文献,均为RCT英文文献。
2.2 纳入文献的一般信息及质量评价
9篇RCT文献,共194例患者,303个位点。其中4篇文献为自身口内对照试验,3篇为平行对照试验,2篇未提及。试验组154个位点,对照组149个位点。所有患者均患有慢性牙周炎,并存在骨内缺损。4篇文献比较DFDBA+PRP组和DFDBA组;2篇文献比较DFDBA+PRF组和DFDBA组,2篇文献比较DFDBA+PRP组和PRP组,1篇文献比较DFDBA+PRP+翻瓣术(open flap debridement,OFD)组和PRP+OFD组。纳入文献的基本特征及质量评价具体见表1、2。
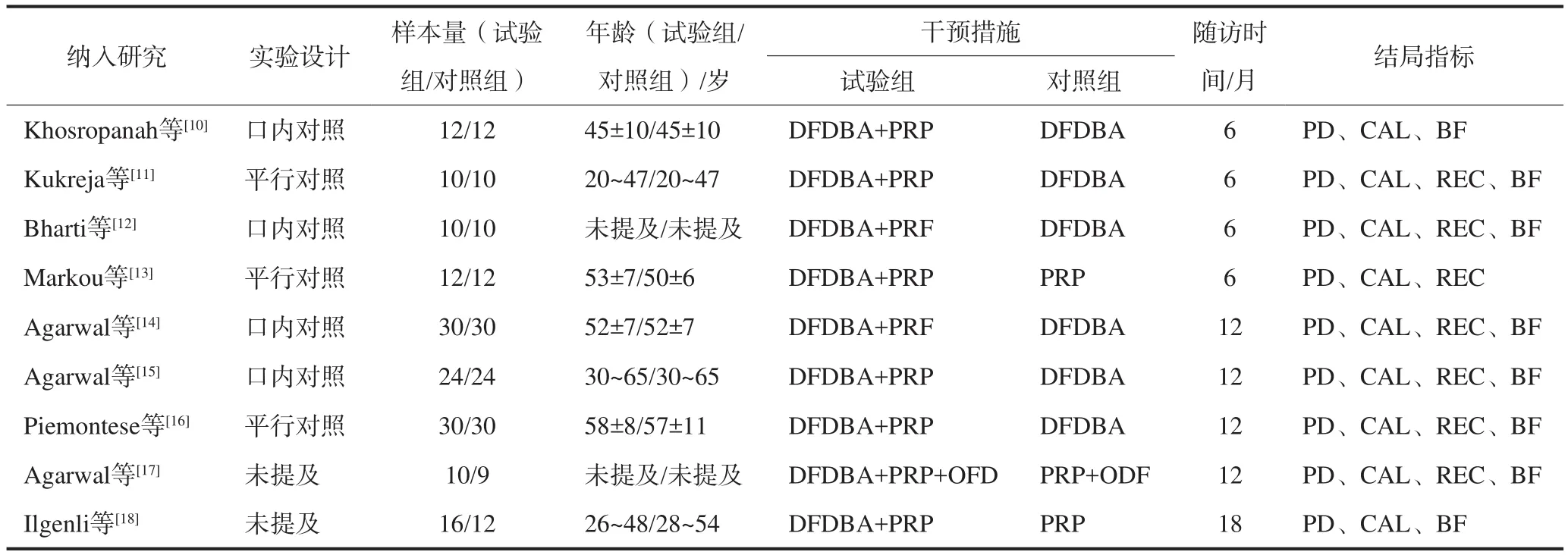
表 1 纳入文献的基本特征Tab1 Characteristic of studies included in Meta-analysis

表 2 纳入研究的方法学质量评价Tab 2 Quality of studies included in Meta-analysis
2.3 Meta分析结果
2.3.1 短期组的Meta分析结果 4个研究[10-13]报道了术后6个月时PD的减少值,共88个受试位点,其中试验组与对照组各44个位点。采用固定效应模型(P=0.12,I2=49%)进行Meta分析,结果显示,试验组术后6个月PD的改善优于对照组,其差异有统计学意义[MD=0.75 mm,95%CI(0.31 mm,1.20 mm),P=0.001 0](图1)。
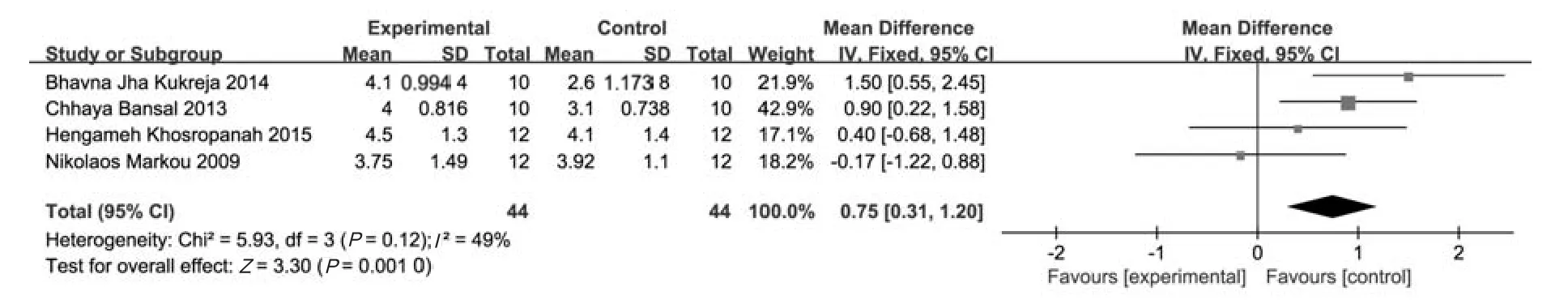
图1 两组短期PD减少值比较的森林图Fig 1 Forest plot comparing mean PD difference between two groups in short-term
4个研究[10-13]报道了6个月时CAL的增加值,共88个受试位点,其中试验组和对照组分别44个位点。采用随机效应模型(P=0.11,I2=50%)进行Meta分析,结果显示,试验组术后6个月CAL的增加值高于对照组,其差异有统计学意义[MD=0.65 mm,95%CI(0.08 mm,1.22 mm),P=0.03] (图2)。
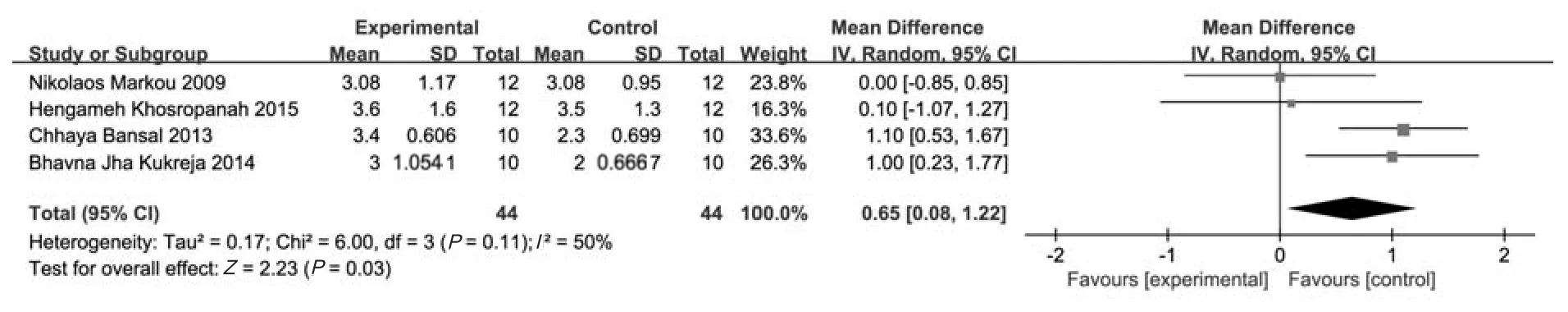
图2 两组短期CAL增加值比较的森林图Fig 2 Forest plot comparing mean CAL gain between two groups in short-term
3个研究[11-13]报道了6个月时REC的变化值,共64个受试位点,其中试验组和对照组各32个位点。采用固定效应模型(P=0.47,I2=0%)进行Meta分析,结果显示,试验组与对照组间REC的变化值差异无统计学意义[MD=-0.07 mm,95%CI(-0.43 mm,0.29 mm),P=0.71](图3)。
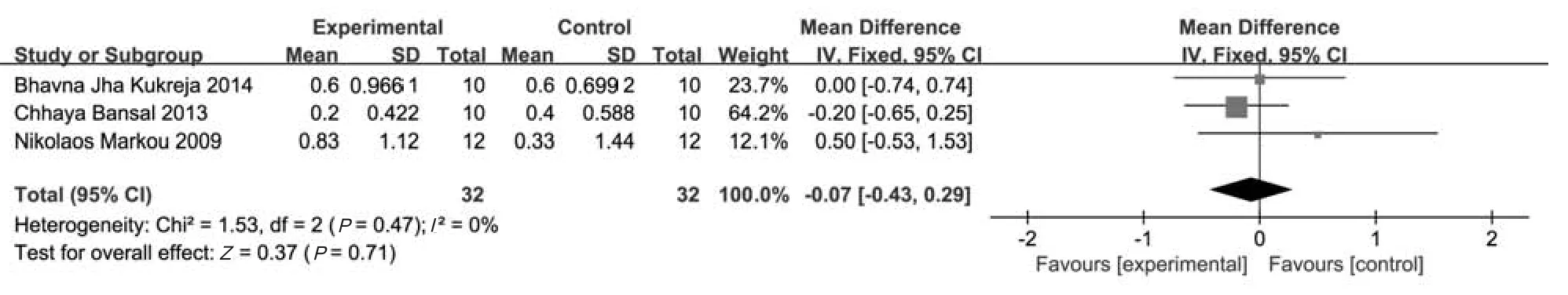
图3 两组短期REC变化值比较的森林图Fig 3 Forest plot comparing mean RCE difference between two groups in short-term
3个研究[10-12]报道了6个月时BF的增加值,共64个受试位点,其中试验组和对照组各32个位点。采用固定效应模型(P=0.72,I2=0%)进行Meta分析,结果显示,试验组BF的增加值优于对照组,差异有统计学意义[MD=0.52 mm,95%CI(0.03 mm,1.00 mm),P=0.04](图4)。

图4 两组短期BF增加值比较的森林图Fig 4 Forest plot comparing mean BF gain between two groups in short-term
2.3.2 长期组Meta分析结果 5个研究[14-18]报道了12~18个月时PD的减少值,共215个受试位点,其中试验组110个位点,对照组105个位点。采用随机效应模型(P<0.05,I2=91%)进行Meta分析,结果显示,试验组PD改善优于对照组,差异有统计学意义[MD=0.87 mm, 95%CI(0.02 mm,1.72 mm),P=0.04] (图5)。

图5 两组长期PD减少值比较的森林图Fig 5 Forest plot comparing mean PD difference between two groups in long-term
5个研究[14-18]报道了12~18个月时CAL的增加值,共215个受试位点,其中试验组110个位点,对照组105个位点。采用随机效应模型(P<0.05,I2=86%)进行Meta分析,结果显示,试验组CAL的增加值高于对照组,其差异有统计学意义[MD=1.31 mm,95%CI(0.60 mm,2.01 mm),P=0.000 3] (图6)。
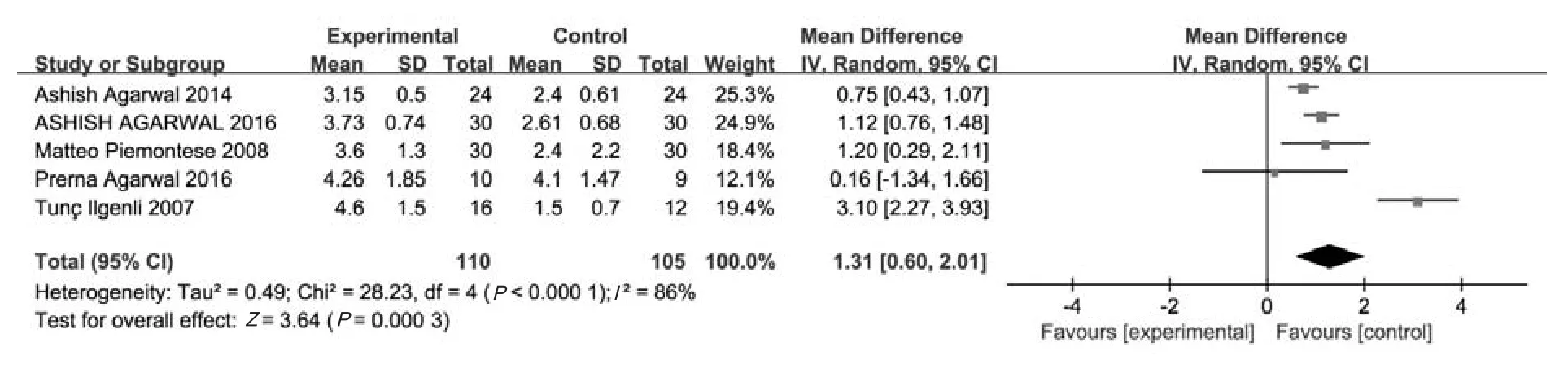
图6 两组长期CAL增加值比较的森林图Fig 6 Forest plot comparing mean CAL gain between two groups in long-term
4个研究[14-17]报道了12~18个月时REC的变化值,共187个受试位点,其中试验组94个位点,对照组93个位点。采用固定效应模型(P=0.63,I2=0%)进行Meta分析,结果显示,试验组RCE的变化值优于对照组,其差异有统计学意义[MD=-0.58 mm,95%CI(-0.78 mm,-0.38 mm),P=0.000 01] (图7)。
图7 两组长期REC变化值比较的森林图Fig 7 Forest plot comparing mean REC difference between two groups in long-term
5个研究[14-18]报道了12~18个月时BF的增加值,共215个受试位点,其中试验组110个位点,对照组105个位点。采用随机效应模型(P<0.05,I2=86%)进行Meta分析,结果显示,试验组BF的增加值优于对照组,差异有统计学意义[MD=1.26 mm,95%CI(0.65 mm,1.86 mm),P=0.000 1] (图8)。
2.3.3 亚组分析 上述研究发现,PD、CAL、BF指标的异质性检验结果均较大。为了讨论异质性来源、研究随访时间对结局指标的影响,采用亚组分析的方法讨论异质性来源。
对于短期组CAL,按照使用材料种类进行亚组分析(亚组A:对照组为DFDBA;亚组B:对照组为PRP)。A组纳入3个RCT[10-12],研究结果异质性降低(I2=14%),采用固定效应模型Meta分析,合并效应量为[MD=0.93 mm,95%CI(0.51 mm,1.36 mm),P<0.000 1]。B组纳入1个RCT。
对于长期组,按照纳入的研究时间进行亚组分析(12个月为亚组C,18个月为亚组D)。C组纳入4个RCT[14-17],CAL和BF指标的异质性降低(I2分别为18%和16%),采用固定效应模型Meta分析,合并效应量MD(95%CI)分别为0.91 mm(0.68 mm,1.14 mm)和0.83 mm(0.61 mm,1.06 mm)。PD减少值指标异质性降低(I2=65%)。D组纳入1个 RCT[18]。

图8 两组长期BF增加值比较的森林图Fig 8 Forest plot comparing mean BF gain between two groups in long-term
2.3.4 敏感性分析 Bharti等[12]和Agarwal等[17]的研究未提及随机分组方法、是否进行分配隐藏和实施盲法,且Agarwal等[17]的研究有2人失访,结果不完整,为高偏倚风险。通过敏感性分析,剔除偏倚风险较高的研究[12,17]后,6月组的PD和CAL与原结论不符,分别为[MD=0.11 mm,95%CI(-0.65 mm,0.86 mm),P=0.78]和[MD=0.46 mm,95%CI(-0.05 mm,0.98 mm),P=0.03]。其余指标仍与原结论相符。
3 讨论
通过文献检索发现许多DFDBA联合富血小板衍生物治疗牙周病骨内缺损的RCT,但不同文献研究结果间存在差异。有学者[19]曾对PRP治疗牙周骨内缺损的疗效进行了评估。但该研究是基于多种植骨材料和PRP进行分析,研究时间只到2012年,且对关于DFDBA植骨材料却只纳入2篇文献,且对于富血小板衍生物第二代PRF材料也未涉及,此外,也没有对随访时间进行分组研究。所以有必要以临床随访时间长短分组来评价DFDBA联合富血小板衍生物治疗牙周骨内缺损的疗效。
本次研究发现,DFDBA联合富血小板衍生物治疗牙周炎引起的骨内缺损,可减少短期和长期组的PD、增加短期和长期组CAL与BF和减少长期组的REC,差异有统计学意义,支持DFDBA联合富血小板衍生物能提高牙周再生治疗疗效这一说法。对PD和CAL改变的影响可能主要是由于富血小板衍生物中不仅含有大量生长因子,如外源性的血小板衍生生长因子和转化生长因子-β1,还含有纤维蛋白、玻连蛋白。这些生长因子和黏附因子可促进牙周组织的愈合和再生[20]。而DFDBA与多数植骨材料不同的是,DFDBA除了有能起到支架材料作用外,还具有骨诱导能力,能促进细胞生长和分化,获得更多的新附着性愈合,提高牙周骨再生性修复的机会。对BF的影响主要可能是因为DFDBA具有异位成骨能力,PRP也可增加牙槽嵴垂直骨增量,减少剩余的骨材料,促进骨愈合并缩短愈合时间。
Meta分析结果表明手术治疗6~18个月后,实验组与对照组REC均有所增加。6个月组中两组变化无统计学差异,表明DFDBA与富血小板衍生物联合使用与单独使用相比并不能有效改善REC。但是12~18个月组中两组变化有统计学差异,说明本次研究中试验组从长期来看能减缓REC的增加量。笔者猜测可能是由于DFDBA与富血小板衍生物联合使用可使牙周组织恢复健康正常的状态,与患牙之间形成新的附着性愈合,减少REC不断加重的发生。
本研究中手术后6个月组的CAL和12~18个月组的PD、CAL、BF的异质性较大。通过亚组分析提示长期组异质性来源可能与纳入研究的时间段不同有关,短期组可能与使用材料种类的差异有关。经敏感性分析剔除风险较高的文献后,6个月组的PD和CAL指标不具有统计学意义,提示这两个结果可靠性不高。其余指标仍与原结论相符,说明结果稳定。
本Meta分析仍具有一定的局限性。在文献纳入中,样本量小,且只纳入了已发表文献,排除了一些研究指标结果中没有差值平均值和均数的文献[1],所以本Meta分析中存在发表偏倚的可能性较大。纳入的文献中,有2篇文献[12,17]在研究设计上均没有具体描述随机化方法,这些都有可能导致一定的选择性偏倚。因此仍有待进行高质量的、大样本的RCT研究以进一步评价DFDBA联合富血小板衍生物治疗牙周骨内缺损的疗效。
综上所述,本研究表明:牙周骨内缺损患牙经DFDBA联合富血小板衍生物治疗后,取得明显的临床疗效,PD、CAL、BF得到了较为显著的改善,优于DFDBA或富血小板衍生物单一治疗组。但仍需高质量的、大样本的RCT研究来进一步评价其疗效。
[1] 康军, 沙月琴, 欧阳翔英. 脱矿冻干骨粉与富血小板血浆联合治疗牙周骨下袋[J]. 北京大学学报(医学版), 2010, 42(1):24-27.Kang J, Sha YQ, Ouyang XY. Combination therapy of periodontal intrabony defects with demineralized freezedried bone powder and platelet-rich plasma[J]. J Peking Univ (Health Sci), 2010, 42(1):24-27.
[2] Miron RJ, Zhang Q, Sculean A, et al. Osteoinductive potential of 4 commonly employed bone grafts[J]. Clin Oral Investig, 2016, 20(8):2259-2265.
[3] Brugnami F, Then PR, Moroi H, et al. GBR in human extraction sockets and ridge defects prior to implant placement: clinical results and histologic evidence of osteoblastic and osteoclastic activities in DFDBA[J]. Int J Periodont Restorat Dent, 1999, 19(3):259-267.
[4] Paknejad M, Rokn A, Rouzmeh N, et al. Histologic evaluation of bone healing capacity following application of inorganic bovine bone and a new allograft material in rabbit calvaria[J]. J Dent (Tehran), 2015, 12(1):31-38.
[5] Katuri KK, Kumar PJ, Swarna C, et al. Evaluation of bioactive glass and demineralized freeze dried bone allograft in the treatment of periodontal intraosseous defects: a comparative clinico-radiographic study[J]. J Indian Soc Periodontol, 2013, 17(3):367-372.
[6] 孙洁, 张剑明, 李彦秋. 富血小板纤维蛋白超微结构的观察与探讨[J]. 口腔医学研究, 2010, 26(1):98-101.Sun J, Zhang JM, Li YQ. Observation and discussion on ultrastructure of platelet-rich fibrin[J]. J Oral Sci Res, 2010, 26(1):98-101.
[7] Dohan DM, Choukroun J, Diss A, et al. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part Ⅱ: platelet-related biologic features[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2006, 101(3):e45-e50.
[8] Lundquist R, Dziegiel MH, Agren MS. Bioactivity and stability of endogenous fibrogenic factors in platelet-rich fibrin[J]. Wound Repair Regen, 2008, 16(3):356-363.
[9] Blaggana V, Gill AS, Blaggana A. A clinical and radiological evaluation of the relative efficacy of demineralized freeze-dried bone allograft versus anorganic bovine bone xenograft in the treatment of human infrabony periodontal defects: a 6 months follow-up study[J]. J Indian Soc Periodontol, 2014, 18(5):601-607.
[10] Khosropanah H, Shahidi S, Basri A, et al. Treatment of intrabony defects by DFDBA alone or in combination with PRP: a split-mouth randomized clinical and three-dimensional radiographic trial[J]. J Dent (Tehran), 2015, 12(10):764-773.
[11] Kukreja B, Dodwad V, Kukreja P, et al. A comparative evaluation of platelet-rich plasma in combination with demineralized freeze-dried bone allograft and DFDBA alone in the treatment of periodontal intrabony defects: a clinicoradiographic study[J]. J Indian Soc Periodontol, 2014, 18(5):618-623.
[12] Bharti V, Bansal C. Evaluation of efficacy of autologous platelet-rich fibrin with demineralized-freeze dried bone allograft in the treatment of periodontal intrabony defects[J]. J Indian Soc Periodontol, 2013, 17(3):361-366.
[13] Markou N, Pepelassi E, Vavouraki H, et al. Treatment of periodontal endosseous defects with platelet-rich plasma alone or in combination with demineralized freeze-dried bone allograft: a comparative clinical trial[J]. J Periodontol, 2009, 80(12):1911-1919.
[14] Agarwal A, Gupta ND, Jain A. Platelet rich fibrin combined with decalcified freeze-dried bone allograft for the treatment of human intrabony periodontal defects: a randomized split mouth clinical trail[J]. Acta Odontol Scand, 2016, 74(1):36-43. [15] Agarwal A, Gupta ND. Platelet-rich plasma combined with decalcified freeze-dried bone allograft for the treatment of noncontained human intrabony periodontal defects: a randomized controlled split-mouth study[J]. Int J Periodontics Restorative Dent, 2014, 34(5):705-711.
[16] Piemontese M, Aspriello SD, Rubini C, et al. Treatment of periodontal intrabony defects with demineralized freezedried bone allograft in combination with platelet-rich plasma: a comparative clinical trial[J]. J Periodontol, 2008, 79(5):802-810.
[17] Agarwal P, Chatterjee A, Gokhale S, et al. Evaluation of platelet-rich plasma alone or in combination with demineralized freeze dried bone allograft in treatment of periodontal infrabony defects: a comparative clinical trial[J]. J Indian Soc Periodontol, 2016, 20(1):42-47.
[18] Ilgenli T, Dündar N, Kal BI. Demineralized freeze-dried bone allograft and platelet-rich plasma vs platelet-rich plasma alone in infrabony defects: a clinical and radiographic evaluation[J]. Clin Oral Investig, 2007, 11(1):51-59.
[19] 高云飞, 郭良微, 周晋, 等. 富血小板血浆联合植骨材料与单用植骨材料比较治疗牙周病骨内缺损疗效的Meta分析[J]. 中国循证医学杂志, 2013, 13(6):741-746. Gao YF, Guo LW, Zhou J, et al. Platelet-rich plasma for the treatment of periodontal intrabony defects: a meta-analysis[J]. Chin J Evid-based Med, 2013, 13(6):741-746.
[20] Marx RE. Platelet-rich plasma: evidence to support its use[J]. J Oral Maxillofac Surg, 2004, 62(4):489-496.
Decalcified freeze-dried bone allograft combined with rich platelet derivatives for the treatment of human periodontal intrabony defects: a Meta-analysis
Wei Xue1, Zhong Xiaobo2, He Bin2, Deng Yanhan3, Luo Shumei4.
(1. Dept. of Stomatology, The People’s Hospital in Zheng’ an County, Zunyi City, Zunyi 563000, China; 2. Dept. of Conservative Dentistry and Endodontics, Stomatological Hospital of Chongqing Medical University, Chongqing 401147, China; 3. Chongqing Key Laboratory of Oral Diseases and Biomedical Sciences, Chongqing 401147, China; 4. Chongqing Municipal Key Laboratory of Oral Biomedical Engineering of Higher Education, Chongqing 401147, China)
Objective This review aims to systematically evaluate the effect of decalcified freeze-dried bone allograft (DFDBA) combined with rich platelet derivatives on the treatment of human periodontal intrabony defects. Methods A search in PubMed, Web of Science, Embase, Cochrane Library, CNKI, and other electronic databases was conducted to identify randomized controlled trials (RCT) of the use of DFDBA combined with rich platelet derivatives in the treatment of human periodontal intrabony defects, performed before May 2016. The quality of the RCTs was assessed. RevMan 5.3 software was applied for Meta-analysis. Results A total of nine RCTs were included. A total of 194 patients and 303 defects were involved. Short-term (6 months) and long-term (12 to 18 months) groups were included. Meta-analysis results revealed that DFDBA combined with rich platelet derivatives was superior to DFDBA or rich platelet derivatives alone for probing depth reduction in the short-term [MD=0.75 mm, 95% confidence intervals (CI) (0.31 mm, 1.20 mm), P=0.001 0] and longterm groups [MD=0.87 mm, 95%CI (0.02 mm, 1.72 mm), P=0.04], clinical attachment level gain in the short-term [MD=0.65 mm, 95%CI (0.08 mm, 1.22 mm), P=0.03] and long-term groups [MD=1.31 mm, 95%CI (0.60 mm, 2.01 mm), P<0.000 3], gingival recession reduction in the long-term group [MD=-0.58 mm, 95%CI (-0.78 mm, -0.38mm), P<0.000 01], bone fill gain in the short-term [MD=0.52 mm, 95%CI (0.03 mm, 1.00 mm), P=0.04] and long-term groups [MD=1.26 mm, 95%CI (0.65 mm, 1.86 mm), P<0.000 1]. Conclusion DFDBA combined with platelet rich derivatives is probably effective in the treatment of human periodontal intrabony defects. It is probably superior to DFDBA or platelet rich derivatives alone. Considering the limitation of the included studies, high-quality and large-sample RCTs are required to evaluate the effect.
decalcified freeze-dried bone allograft; platelet-rich plasma; platelet-rich fibrin; intrabony defects
R 781.4
A
10.7518/hxkq.2017.06.014
Supported by: The Medical Research Key Project of Chongqing Municipal Health Bureau (2012-1-053). Correspondence:Zhong Xiaobo, E-mail: 1448604237@qq.com.
2017-03-22;
2017-09-06
重庆市卫生局医学科研重点项目(2012-1-053)
魏雪,住院医师,硕士,E-mail:358529919@qq.com
钟晓波,教授,学士,E-mail:1448604237@qq.com
(本文编辑 杜冰)
