电解质溶液复习点拨
2017-12-14山东张友伟
山东 张友伟
电解质溶液复习点拨

一、明确考纲
1.了解电解质的概念;了解强电解质和弱电解质的概念。
2.了解电解质在水溶液中的电离,以及电解质溶液的导电性。
3.了解弱电解质在水溶液中的电离平衡。
4.了解水的电离,离子积常数。
5.了解溶液pH的定义;了解测定溶液pH的方法,能进行pH的简单计算。
6.了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
7.了解难溶电解质的溶解平衡及沉淀转化的本质。
二、重点知识整合
(一)弱电解质的电离平衡
1.判断弱电解质的方法
(1)在浓度和温度相同时,与强电解质溶液做导电性对比实验。
(2)在浓度和温度相同时,与强电解质溶液比较反应速率快慢。
(3)配制一定物质的量浓度的HA溶液(如0.01 mol·L-1),测其pH。若pH>2,则说明HA为弱酸。
(4)测定对应的盐溶液的酸碱性,如钠盐(NaA)溶于水,测其pH,若pH>7,则说明HA为弱酸。
(5)稀释前后pH与稀释倍数的变化关系。如将pH=2的酸溶液稀释1 000倍,pH<5,则证明该酸为弱酸。
(6)利用电离平衡证明。如醋酸溶液中滴入石蕊试液变红,再加CH3COONa固体,颜色变浅。
(7)利用较强酸(碱)制取较弱的酸(碱)来判断电解质强弱。
(8)利用元素周期表同周期、同主族的递变性进行判断。
2.一元强酸与一元弱酸的比较

项目相同物质的量浓度、相同体积相同pH、相同体积一元强酸一元弱酸一元强酸一元弱酸c(H+)大小相同中和碱的能力相同小大与金属反应的起始速率大小相同稀释相同倍数后的pH小大大小
(二)水的电离及溶液的酸碱性
1.水电离的c(H+)或c(OH-)的计算方法(25℃)
(1)中性溶液:c(H+)=c(OH-)=1.0×10-7mol·L-1。
(2)溶质为酸的溶液
H+来源于酸电离和水电离,而OH-只来源于水。如计算pH=2的盐酸中水电离出的c(H+):方法是先求出溶液中的c(OH-)=10-12mol·L-1,即水电离出的c(H+)=c(OH-)=10-12mol·L-1。
(3)溶质为碱的溶液
OH-来源于碱电离和水电离,而H+只来源于水。如pH=12的NaOH溶液中,c(H+)=10-12mol·L-1,即水电离产生的c(OH-)=c(H+)=10-12mol·L-1。
(4)水解呈酸性或碱性的正盐溶液
H+和OH-均由水电离产生。如pH=2的NH4Cl溶液中由水电离出的c(H+)=10-2mol·L-1;如pH=12的Na2CO3溶液中由水电离出的c(OH-)=10-2mol·L-1。
2.有关溶液酸碱性及pH的易错易混辨析
(1)一定温度下,无论是稀酸、稀碱或盐溶液中,水的离子积Kw=c(H+)·c(OH-)均不变,水电离出的c(H+)=c(OH-),Kw只与温度有关,只有在25 ℃时,Kw=1×10-14。
(2)pH是溶液酸碱性的量度。pH=6的溶液在常温下呈酸性,其他温度时也可能呈中性或碱性;pH=0的溶液并非没有H+,而是c(H+)=1.0 mol·L-1,同时也并非无OH-,此时c(OH-)=1.0×10-14mol·L-1。
(3)对于强酸(强碱)溶液,每稀释为10倍体积时,pH增大(减小)1个单位;对于弱酸(弱碱)溶液,每稀释为10倍体积,pH增大(减小)不足1个单位;无论稀释多少倍,酸(碱)溶液的pH不能等于或大于(小于)7,只能趋近于7。
(4)强碱溶液的pH计算,应先根据溶液的c(OH-)求出溶液c(H+),从而求出溶液的pH。
(5)强酸、强碱的pH之和与c(H+)、c(OH-)比较:
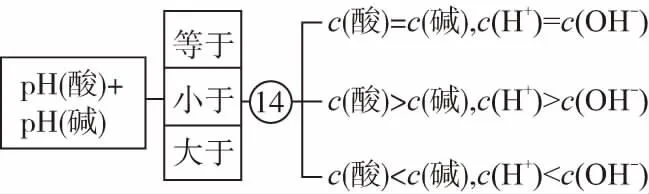
(6)若酸、碱溶液的pH之和为14,酸、碱中有一强一弱,则酸、碱溶液等体积混合后,谁弱显谁性。
(三)电解质溶液中的粒子观
1.两种“微弱”
①弱酸或弱碱的电离
②弱酸阴离子和弱碱阳离子的水解
2.三个守恒
(1)电荷守恒规律

(2)物料守恒规律
电解质溶液中,由于某些离子能水解或电离,粒子种类增多,但某些关键性的原子总是守恒的。

(3)质子守恒规律

3.两种形式
(1)等式
对于等式通常有两个,即电荷守恒、物料守恒,一些复杂的等式往往是对两个守恒关系式经过变形得到的,或代入某些所给已知条件得到的。
(2)不等式
对于不等式,要具体分析溶液中各种电离方程式、水解方程式、溶液的酸碱性。
4.两个注意
(1)不同溶液中同一离子浓度的比较要看溶液中其他离子对该离子的影响。
(2)混合溶液中各离子浓度的比较要综合考虑电离因素、水解因素等。
(四)难溶电解质的沉淀溶解平衡
1.沉淀的生成
(1)条件:离子浓度商(Qc)大于溶度积(Ksp)。
(2)应用:
①分离离子:同一类型的难溶电解质,如AgCl、AgBr、AgI,溶度积小的物质先析出,溶度积大的物质后析出。
②控制溶液的pH来分离物质,如除去CuCl2中的FeCl3就可向溶液中加入CuO或Cu(OH)2等物质,将Fe3+转化为Fe(OH)3而除去。
2.沉淀的溶解
(1)条件:浓度商(Qc)小于溶度积(Ksp)。
(2)方法:酸碱溶解法,即加入酸或碱与溶解平衡体系中的相应离子反应,降低离子浓度,使平衡向溶解的方向移动,如CaCO3可溶于盐酸。
①盐溶解法:加入盐溶液,与沉淀溶解平衡体系中某种离子反应生成弱电解质,从而减小离子浓度使沉淀溶解,如Mg(OH)2溶于NH4Cl溶液。
②配位溶解法:加入适当的配合剂,与沉淀溶解平衡体系中的某种离子生成稳定的配合物,从而减小离子浓度使沉淀溶解,如AgCl溶于氨水。
③氧化还原法:通过发生氧化还原反应使平衡体系中的离子浓度降低,从而使沉淀溶解,如Ag2S溶于硝酸。
3.沉淀的转化
(1)规律:在难溶电解质的饱和溶液中,溶解度小的沉淀易转化生成溶解度更小的沉淀。
(2)实例:

4.溶度积的计算

(2)已知溶度积、溶液中某离子的浓度,求溶液中的另一种离子的浓度,如某温度下AgCl的Ksp=a,在0.1 mol·L-1的NaCl溶液中加入过量的AgCl固体,达到平衡后c(Ag+)=10amol·L-1。
三、热点举例
题型1弱电解质的电离平衡
例1(2015·海南化学,11)下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是
( )

解析:根据甲、乙的电离平衡常数得,这两种物质都是弱电解质,在温度不变、浓度相等时,电离程度CH3COOH 答案:B 题型2弱电解质的判定 例2(2016·上海化学,6)能证明乙酸是弱酸的实验事实是 ( ) A.CH3COOH溶液与Zn反应放出H2 B.0.1 mol/L CH3COONa溶液的pH大于7 C.CH3COOH溶液与Na2CO3反应生成CO2 D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红 解析:A项,只能证明乙酸具有酸性,不能证明其酸性强弱,错误;B项,该盐水溶液显碱性,由于NaOH是强碱,故可以证明乙酸是弱酸,正确;C项,可以证明乙酸的酸性比碳酸强,但是不能证明其为弱酸,错误; D项,可以证明乙酸具有酸性,但是不能证明其酸性强弱,错误。 答案:B 题型3电解质溶液中的粒子浓度大小比较 例3(2016·天津理综,6)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是 ( ) A.三种酸的电离常数关系:KHA>KHB>KHD B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+) 解析:A项,根据图象知,在未滴加NaOH溶液时,0.1 mol·L-1的三种酸(HA、HB和HD)溶液的pH,说明三种酸均为弱酸,且HA的pH最小、酸性最强,HD的pH最大、酸性最弱,因酸性越强,电离常数越大,故KHA>KHB>KHD,正确;B项,滴定至P点时,溶液中未反应的HB与生成的NaB的浓度相等,且溶液呈酸性,说明HB的电离程度大于B-水解程度,故c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),正确;C项,pH=7时,三种阴离子的浓度分别等于c(Na+),然而三种溶液中阴离子水解程度不同,加入的NaOH的体积不同,故三种阴离子的浓度也不同,错误;D项,根据质子守恒即可得出,三种溶液混合后溶液的质子守恒关系:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),正确。 答案:C 题型4难溶电解质的沉淀溶解平衡 例4(2016·海南化学,5)向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是 ( ) C.c(H+) D.Ksp(MgCO3) 答案:A 题型5酸碱中和滴定 例5(2015·广东理综,12)准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1NaOH溶液滴定。下列说法正确的是 ( ) A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 解析:A项,滴定管用蒸馏水洗涤后,还要用待装溶液润洗,否则将会引起误差,错误;B项,在用NaOH溶液滴定盐酸的过程中,锥形瓶内溶液由酸性逐渐变为中性,溶液的pH由小变大,正确;C项,用酚酞作指示剂,锥形瓶中溶液应由无色变为粉红色,且半分钟内不恢复原色时才能停止滴定,错误;D项,滴定达终点时,发现滴定管尖嘴部分有悬滴,则碱液的体积偏大,测定结果偏大,错误。 山东省枣庄二中)


